基于网络药理学和分子对接探讨黄芪-丹参配伍治疗糖尿病肾病作用机制研究
2022-07-04彭文虎吴文明罗新新
彭文虎,刘 玲,吴文明,罗新新
基于网络药理学和分子对接探讨黄芪-丹参配伍治疗糖尿病肾病作用机制研究
彭文虎1,刘 玲2,吴文明2,*罗新新2
(1. 井冈山大学附属医院,江西,吉安 343000;2. 江西省人民医院药学部,江西,南昌 330006)
基于网络药理学和分子对接探讨黄芪-丹参配伍治疗糖尿病肾病作用机制研究。通过中药系统药理学技术平台(TCMSP)获取黄芪、丹参有效成分和作用靶点,运用Cytoscape3.7.1构建成分-靶点-疾病靶点网络图,获取有效成分和DN交集基因,构建PPI网络,运用分子对接对筛选出的有效成分与核心靶基因进行分子对接验证。运用Bioconductor 对靶基因进行GO生物学过程分析和KEGG通路分析。通过分析黄芪、丹参共获得81个有效成分,获取交集基因22个,分子对接预测丹参酮ⅡA与MYC、VCAM1、CASP3有较强的结合活性,槲皮素和山奈酚与ADRB2有较强的结合活性。GO和KEGG富集分析显示,黄芪-丹参治疗DN主要参与糖尿病并发症AGE/RAGE、MAPK、HIF-1等多条信号通路等。黄芪-丹参主要是通过活性成分槲皮素、山奈酚、木犀草素、丹参酮ⅡA等通过靶向ADRB2、CASP3、VCAM1、MYC等相关靶点,参与糖尿病并发症AGE/RAGE、MAPK、HIF-1等多条信号通路发挥治疗DN作用。
黄芪;丹参;糖尿病肾病;网络药理学;分子对接
根据国际糖尿病联盟(International Diabetes Federation, IDF)数据显示,糖尿病已经成为影响全球4.25亿人的健康负担,预测到2045年患病的人数会增加至6.3亿[1]。糖尿病肾病(Diabetic Nephropathy, DN)是糖尿病患者主要并发症之一,DN是引起心血管疾病发病率和致死率的主要因素,临床特征是蛋白尿和/或肾小球滤过率一过性升高,肾小管间质纤维化等,早期DN患者尿蛋白每日30 mg以上,逐渐发展为尿蛋白每日300 mg以上,并使得肾小球滤过率降低,最终发展为终末期肾脏疾病[2]。DN发病机制主要原因是持续性高糖、葡萄糖代谢紊乱、血液动力学异常等[3]。临床上治疗DN的一线药物主要有血管紧张素转化酶抑制剂(ACEI)和血管紧张素受体拮抗剂(ARB)类药物,但其不能有效的阻断DN的发展并且在治疗过程中严重的不良反应发生率也在不断的上升,这使得开发出有效治疗DN并减少不良反应的药物变得非常的重要。
中医药治疗注重人体的整体机能,具有多成分、多靶点、多通路协同作用,毒性分散效应等使得人体不良反应减少及提高机体的耐受性。网络药理学通过对药物信号通路具体过程进行动态分析,从而确定药物的疗效,并被广泛运用于探索复杂性疾病发病机制,如癌症、肾衰、糖尿病等,与中医药治疗及辨证论治的观点相符合。以中医药理论为基础,为DN的防治提供系统的治疗方法。黄芪()为豆科植物膜荚黄芪()或蒙古黄芪()的根,其味甘,微温,具有补气升阳、益气固表、利水消肿的功效。黄芪主要化学活性成分包括黄酮类、皂苷类、多糖类等,具有免疫调节作用、降血糖、双向调控血压、保护心脑血管等药理作用[4]。黄芪用于治疗各类肾脏疾病已有2000多年的历史,始载于汉代《神农本草经》,临床研究表明黄芪治疗DN患者过程中能够有效的降低患者24h尿蛋白量,减轻炎症因子的表达,临床症状明显改善[5]。丹参为唇形科草本植物丹参(干燥的根和根茎,味苦,微寒,具有活血化瘀,凉血清心,除烦安神的功效。主要化学成分包括丹参酮类、丹参酸类、无机元素等,具有抗氧化,抗炎、降糖等药理作用[6]。丹参酮ⅡA磺酸钠治疗DN Meta分析[7]发现其能降低患者尿氮素、血肌酐、降低血糖血脂、改善肾功能,且均未出现明显的副作用。蔺亚东[8]通过对2884篇文献涉及495味中药数据挖掘,分析出中药治疗DN显示黄芪-丹参支持度最高,为46.88%。明确出中医药治疗DN主要为补气滋阴、活血化瘀的药物为主。然而黄芪、丹参包括多种化合物和靶点,其治疗DN作用机制并不是很明确,本研究通过网络药理学和分子对接预测黄芪-丹参配伍治疗DN的作用机制,分析筛选有效成分,活性靶点及疾病治疗靶点和信号通路,为黄芪-丹参配伍治疗DN实验研究及临床运用提供科学依据参考。
1 材料与方法
1.1 GEO分析DN的差异基因
通过NCBI的GEO数据库搜素DN的相关数据,选取含有DN数据的基因芯片GSE30122,芯片信息:Affymetrix Human Genome U133A 2.0 Array,平台:GPL571,该芯片原始数据包括了50个正常人肾样本(26个人正常肾小球样本、24个人正常肾小管样本),19个DN样本(9个DN肾小球样本,10个DN肾小管样本)。运用R语言Limma包分析基因芯片中的差异基因,筛选条件为:< 0.05,logFC<-0.5或logFC > -0.5。
1.2 黄芪-丹参活性成分及潜在靶点的筛选
通过TCMSP平台获取黄芪、丹参的化学成分,根据生物利用度(OB)和类药性(DL)筛选出符合条件的活性成分及相关靶点。筛选的条件为:OB≥30,DL≥0.18[9]。
1.3 黄芪-丹参药对活性成分-靶点-疾病网络构建
筛选出有效化合物对应靶点和DN差异基因,运用Venn图获取交集基因,构建黄芪-丹参药对活性成分-靶点-DN网络图,网络中的度值(Degree)越大明该节点与其它节点关系越紧密,节点的中心性越高。
1.4 黄芪-丹参药对治疗DN关键靶点分析
将筛选出的交集基因输入至Bisogenet中,构建PPI蛋白互作网络和网络拓扑分析。蛋白互作网络构建的数据资源来源于:DIP、BIOGRID、HPR、INTACT、MINT、BID。选取三个参数评估蛋白互作网络中节点的拓扑特征[10]:度值(Degree)、介数(Betweenness)、紧密度(Closeness),这三个参数的高低与节点在网络中的重要性呈正相关,根据这三个参数筛选出核心靶点。
1.5 分子对接
利用ChemBioOffice软件绘制化合物结构并转换为3D立体结构,保存为Mol2格式,从PDB数据库中下载蛋白的3D结构,保存为PDB格式。用PyMOL对原PDB蛋白分子进行蛋白与配体拆分,去氢,加水等操作,并保存PDBQT格式。运用Autodock Vina软件[11]进行化合物和核心靶点的分子对接,用PyMOL对能量最低的结合模式做图。
1.6 黄芪-丹参药对治疗DN生物功能和通路富集分析
运用Bioconductor对PPI网络中筛选出的核心基因进行GO富集分析和通路富集分析(<0.05),对潜在靶点进行GO生物过程分析,KEGG对潜在靶点进行通路富集分析。
2 结果
2.1 DN差异表达基因分析
将芯片GSE30122中50例正常人肾样本设为正常组,19例DN样本设为实验组,通过R语言分析,共得出差异基因638个,其中实验组表达上调基因384个,表达下调基因254个,结果见图1。
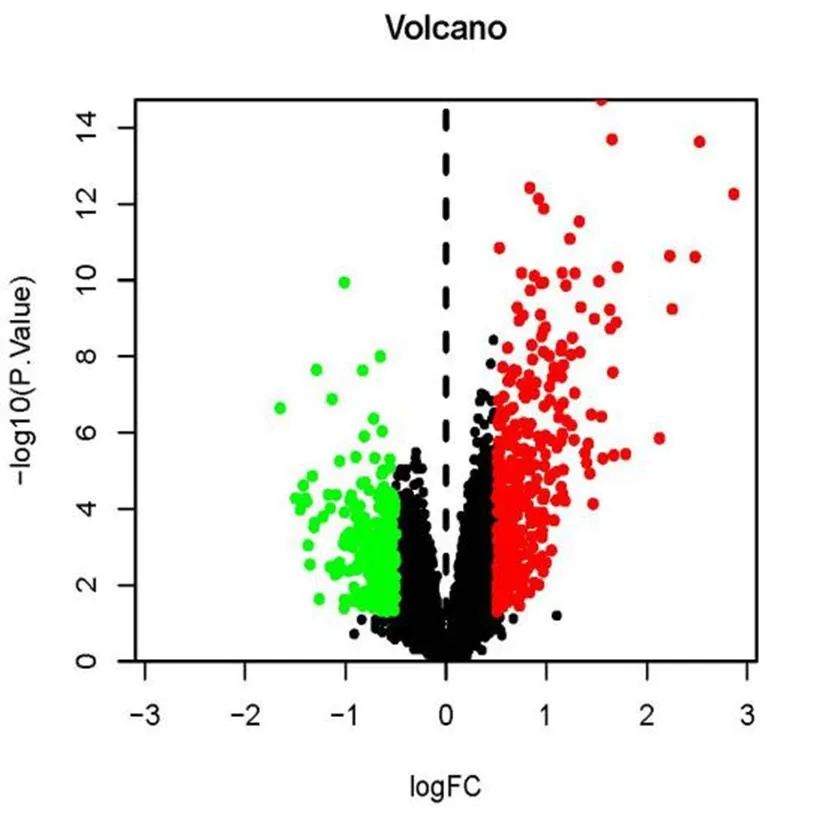
图1 差异基因表达火山图
2.2 活性化合物的筛选
通过TCMSP查询,经OB≥30,DL≥0.18筛选后,黄芪、丹参有效化学成分为20、60个。
2.3 黄芪-丹参治疗DN作用靶点
通过数据库分析,DN、黄芪、丹参作用靶点分别为638个、189个、117个。通过在线韦恩图分析得出,黄芪与DN共有基因21个,丹参与DN共有基因9个,黄芪-丹参药对活性成分作用靶点与DN共有22个交集基因,结果见表1,可能为黄芪-丹参治疗DN的主要作用靶点。
表1 黄芪-丹参药对治疗DN潜在靶点
Table 1 Potential targets from compounds of Radix Astragali and Radix Salviaein treating DN
序号蛋白名称Uniprot ID基因编码中文名称 1Beta-2 adrenergic receptorP07550ADRB2β2肾上腺素受体 2Vascular endothelial growth factor AP15692VEGFA血管内皮生长因子A 3Tumor necrosis factor superfamily 15D9N2U0TNFSF15肿瘤坏死因子超家族成员15 4Caspase-3P42574CASP3半胱氨酸蛋白酶3 5Heme oxygenase 1P09601HMOX1血红素加氧酶1 6G2/mitotic-specific cyclin-B1P14635CCNB1细胞周期蛋白B1 7Calmodulin-1P0DP23CALM1钙调蛋白1 8Alpha-2A adrenergic receptorP08913ADRA2Aα2A肾上腺素能受体 9Myc proto-oncogene proteinP01106MYCMyc原癌基因蛋白 10Alcohol dehydrogenase 1BP00325ADH1B乙醇脱氢酶1B 11Neutrophil cytosol factor 1 P14598NCF1中性粒细胞溶质因子1 12Vascular cell adhesion protein 1P19320VCAM1血管细胞粘附分子 1 13Arachidonate 5-lipoxygenaseP09917ALOX5花生四烯酸5脂加氧酶 14Type I iodothyronine deiodinaseP49895DIO1Ⅰ型脱碘酶 15Secretory leukocyte protease inhibitorP03973SLPI分泌型白细胞蛋白酶抑制因子 16Epidermal growth factor Q6QBS2EGF表皮生长因子 17C-C motif chemokine ligand 2P13500CCL2CC基序趋化因子 18Protein kinase C beta P05771PRKCB蛋白激酶Cβ 19Collagen alpha-1(III)P02461COL3A1Ⅲ型胶原α1链 20Claudin-4 O14493CLDN4紧密连接蛋白4 21Secreted phosphoprotein 1P10451SPP1分泌型磷酸蛋白1 22Cathepsin DP07339CTSD组织蛋白酶D
2.4 黄芪-丹参药对治疗DN活性成分和关键靶点分析
采用Cytoscape3.7.1绘制出黄芪-丹参配伍治疗DN有效成分-作用靶点网络图,黄色、粉色、蓝色节点分别代表交集基因、黄芪化合物、丹参化合物,结果见图2。该图包含了64个节点和87条边,其中42个节点是黄芪-丹参治疗DN的有效成分,22个节点是黄芪-丹参治疗DN作用靶点。因此可以体现出中药单成分多靶点、多成分多靶点及多成分相同靶点之间的协同叠加作用。度值排列靠前的化合物分别为槲皮素(MOL000098,18),山奈酚(MOL000422,8),木犀草素(MOL000006,5),丹参酮ⅡA(MOL007154,3)。
将黄芪-丹参药对治疗DN的22个交集基因输入至Bisogenet中,构建PPI蛋白互作网络和网络拓扑分析。该网络包含了1724个节点和36898条边(如图3),通过三个参数(Degree≥61,Betweenness≥200,Closeness≥0.53)进项评估,筛选出核心靶点,该网络包含148个节点和3768条边(如图4)。根据三项参数分析,在黄芪-丹参药对治疗DN蛋白交互网络中,MYC、VCAM1、ADRB2、CASP3为重要核心靶点(见表2),推测为黄芪-丹参药对治疗DN关键靶点。
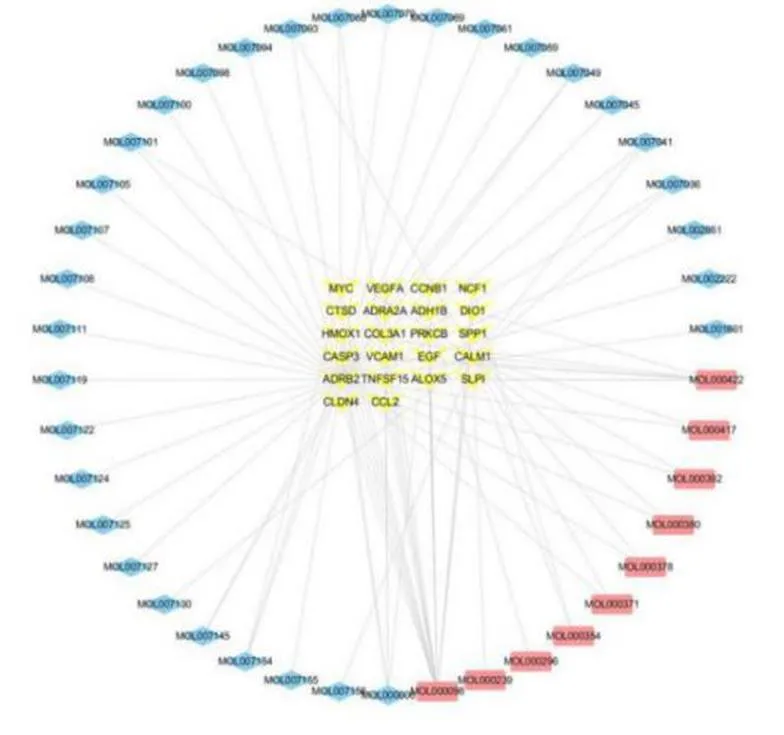
图2 黄芪-丹参治疗DN有效成分-作用靶点网络图

(粉色、黄色、蓝色节点分别代表化合物-靶点-DN靶标、重要靶标、与化合物/DN靶点相互作用的其他Human蛋白)图3 黄芪-丹参治疗DN靶点蛋白相互作用网络图
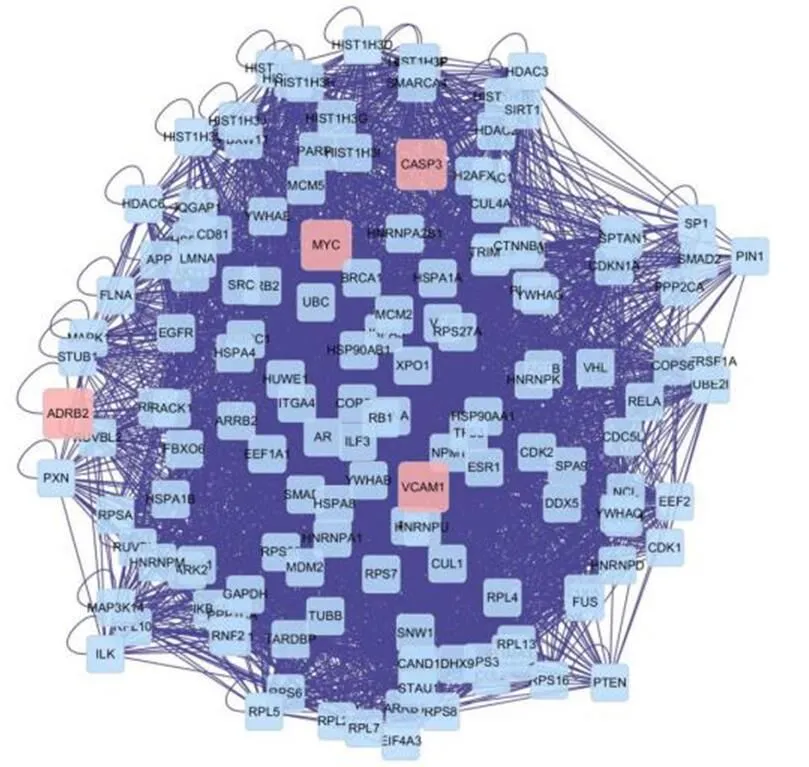
(Degree≥61,Betweenness≥200,Closeness≥0.53;粉色和蓝色节点分别表示化合物与DN靶标,与化合物/DN靶点相互作用的其他Human蛋白)
表2 核心靶点拓扑特征
Table 2 Topological features of major node
Major NodeDegreeNode betweennessCloseness MYC5961806.0730.615063 VCAM14522270.7490.650442 ADRB2259281.86540.550562 CASP3180250.03320.542435
2.5 活性成分与关键靶点分子对接预测
一般认为配体与受体分子的构象稳定时,其能量越低,发生作用的可能性越大,以结合能≤-5 kJ/mol为筛选标准。使用AutoDock Vina软件对关键靶点(MYC、VCAM1、ADRB2、CASP3)与槲皮素、山奈酚、木犀草素、丹参酮ⅡA进行分子对接。研究结果显示MYC与丹参酮ⅡA(结合能:-26.38 kJ/mol)、VCAM1与丹参酮ⅡA(结合能:-36.43 kJ/mol)、ADRB2与槲皮素、山奈酚(结合能均为:-35.17 kJ/mol)、CASP3与丹参酮ⅡA(结合能:-33.49 kJ/mol)结合能均为最低,构象稳定,具有较好的结合活性。将关键靶点与结合能最低的活性化合物进行分子对接,PyMoL作图。结果见图5。

图5 活性化合物与核心靶点最佳结合模式
2.6 靶点通路分析
我们利用Bioconductor中的cluster profiler对黄芪-丹参-DN涉及的22个核心靶点进行GO功能富集分析和KEGG通路富集分析。生物过程富集结果显示(<0.05),正向调控表皮生长因子受体、丝氨酸/苏氨酸激酶活性,氧化应激反应,激活蛋白激酶活性等是重要的生物过程(研究结果如图6)。KEGG富集通路显示(<0.05),糖尿病并发症的AGE/RAGE信号通路、流体剪切应力与动脉粥样硬化、MAPK信号通路、HIF-1信号通路等是主要的代谢通路(如图6),结果显示黄芪-丹参的有效成分靶点存在于不同的通路,主要是通过多通路多靶点协同作用治疗DN。

图6 黄芪-丹参药对治疗DN关键靶点的GO生物过程和KEGG富集分析
3 讨论
本次研究主要是采用网络药理学和分子对接探讨黄芪-丹参配伍治疗DN作用机制。基于黄芪-丹参活性成分-靶点-DN网络分析,最重要的有效成分为槲皮素、山奈酚、木犀草素、丹参酮ⅡA。研究表明,槲皮素可以降低DN小鼠蛋白尿和尿蛋白/肌酐比值,减弱肾脏脂质分布变化和脂滴的堆积,减缓肾小球硬化进程使得肾小球硬化指数和肾重/体重趋于正常化,可以有效的改善糖尿病早期肾脏损害[12-13];山奈酚[14]通过抑制RhoA/Rock通路激活,降低氧化应激和促炎细胞因子(TNF-α、IL-1β)表达从而降低糖尿病或高糖状态下肾脏的损伤;木犀草素是一种天然的肥大细胞稳定剂,Na Xu[15]等研究表明低剂量膳食补充剂木犀草素能降低小鼠附睾脂肪组织中肥大细胞和巨噬细胞的浸润和炎性细胞因子的水平,从而改善IR;Qian Yu[16]通过体外实验发现,木犀草素通过抑制NLRP3炎症小体的激活减轻肾脏足细胞凋亡,为DN治疗提供治疗策略。丹参酮ⅡA磺酸钠用于治疗DN Meta分析结果显示[7],其能有效的降低患者血肌酐、尿素氮水平,改善肾功能,还具有降糖降脂的作用。槲皮素和山奈酚属于葛根成分,木犀草素和丹参酮ⅡA属于丹参成分,这为黄芪-丹参药对治疗DN提供了理论和实践依据。
我们通过PPI网络分析,发现MYC、VCAM1、ADRB2、CASP3为关键靶点,提示这四个靶点可能为黄芪-丹参治疗DN过程中发挥重要作用。将有效成分槲皮素、山奈酚、木犀草素、丹参酮ⅡA与治疗DN的四个关键靶点进行分子对接,结果显示,MYC、VCAM1、CASP3与丹参酮ⅡA,ADRB2与槲皮素、山奈酚结合能最低,表明配体与受体的构象越稳定,其发生的作用性越大。MYC是一种原癌基因,和它的家族成员C-MYC,L-MYC,N-MYC一样是一种转录因子,参与细胞分化、凋亡,能量代谢等生物过程。研究表明当C-MYC在小鼠β细胞中过表达时,就会使得细胞凋亡和高血糖的产生,抑制C-MYC过度表达,可以促进糖尿病足溃疡伤口的愈合[17-18]。ADRB2是β-肾上腺素能受体(ADRB)中的一个亚型,通过多种通路参与肿瘤细胞侵袭和转运、血管生成和凋亡等生理功能[19]。ADRB2可以通过降低DN大鼠肾组织中的TNF-α、MCP-1、NOS2 mRNA表达水平,增加NF-kB p65亚基磷酸化,减轻肾脏炎症和纤维化[20]。CASP3是半胱氨酸蛋白酶3,它是神经元凋亡的执行者,当细胞发出凋亡信号时,该蛋白即被水解激活,研究发现糖尿病大鼠海马中CASP3活性是非糖尿病大鼠的6.7倍[21]。VCAM1是一种细胞粘附分子,它属于免疫球蛋白超家族成员,Guillén-Gómez E等研究[22]发现,与糖尿病患者对比,DN患者尿中VCAM1水平明显升高,可能成为糖尿病患者肾脏病变的标记物。
KEGG通路富集分析表明,黄芪-丹参配伍治疗DN主要涉及AGE/RAGE、流体剪切应力与动脉粥样硬化、MAPK、HIF-1等信号通路。AGEs与其受体RAGE结合后可启动一系列信号转导[23],如增强血管通透性,引起蛋白尿;促进肾脏释放促炎因子、黏附因子等,导致机体的损伤;降低内皮细胞一氧化氮合酶mRNA水平和NO的生物利用度,诱导炎症因子释放,增强细胞毒性作用和机体病变的严重程度[24]。MAPK是一类丝氨酸/苏氨酸蛋白激酶,通过调节能量代谢、细胞增殖和凋亡、炎症反应影响DN的进程,并通过抑制p38MAPK信号通路可以减轻炎症反应,从而减少患者尿蛋白,延缓DN的进展[25]。流体剪切应力是动脉粥样硬化疾病发生发展的独立内在物理因素,正常或稍高的流体剪切应力可以上调内皮细胞的抗氧作用,而低流体剪切应力会使得动脉分支部位脂质堆积和氧化应激的发生,在生理流体剪切力的作用下,可以显著性降低白细胞跨内皮的迁移及降低VCAM1表达[26]。白细胞跨内皮细胞迁移是炎症发生的关键步骤,在炎症和活性氧生成的过程中,白细胞粘附内皮细胞后,会跨膜迁移到血管外,通过抑制ICAM1表达,可以减少外周血多行白细胞的数量,从而减轻炎症反应,对机体起到保护一定的作用[27]。低氧诱导因子-1(Hypoxia-inducible factor-1, HIF-1)是在低氧条件下高度特异性发挥活性参与修复细胞内环境的核转录因子,由α和β两个亚基组成,HIF-1α是氧调节蛋白参与能量代谢、葡萄糖转运、血管生成等生物过程。Gu HF[28]等研究发现,HIF-1α基因pro582Ser多态性通过改善高糖对机体损害作用,影响着DN的发展。
本研究表明,黄芪-丹参中的槲皮素、山奈酚、木犀草素、丹参酮ⅡA等有效成分主要是对MYC、VCAM1、ADRB2、CASP3等关键靶点通过AGE/RAGE、流体剪切应力与动脉粥样硬化、MAPK、HIF-1、白细胞跨内皮迁移等信号通路参与降糖、抗炎、抗氧化、细胞分化和凋亡、能量代谢等方面发挥治疗DN作用。并初步阐明了黄芪-丹参药对主要活性成分、作用靶点及信号通路在DN治疗中的研究价值,为基础研究和实验研究提供了理论依据和参考。
[1] Hird T R, Zomer E, Owen A, et al. The impact of diabetes on productivity in China[J]. Diabetologia,2019,62(7):1195-1203.
[2] Reidy K, Kang H M, Hostetter T, et al. Molecular mechanisms of diabetic kidney disease[J]. J Clin Invest, 2014, 124(6): 2333-2340.
[3] Magee C, Grieve D J, Watson C J, et al. Diabetic Nephropathy: a Tangled Web to Unweave[J]. Cardiovasc Drugs Ther, 2017, 31(5-6): 579-592.
[4] 聂娟,谢丽华,马港圆,等. 中药黄芪的化学成分及药理作用研究进展[J].湖南中医杂志,2018,34(7):228-231.
[5] 陈腾,王之,王丹丽,等.黄芪治疗糖尿病肾病临床疗效及对尿足细胞标志蛋白影响[J].中国中西医结合肾病杂志, 2019,20(8):694-696.
[6]代晓光,苏长兰.丹参化学成分及药理研究进展[J].中医药信息,2018,35(4):126-129.
[7] 许强,文豪,李修身,等.丹参酮ⅡA磺酸钠治疗糖尿病肾病的Meta分析[J].中药新药与临床药理,2020,31(1):113-119.
[8] 蔺亚东,张伏芝,雷蕾,等. 基于数据挖掘的中医治疗糖尿病肾病用药规律分析[J].中国中医药信息杂志,2020,27(5):1-7.
[9] 罗新新,刘玲,吴文明,等.基于网络药理学和分子对接探讨葛根-丹参药对治疗2型糖尿病作用机制研究[J].江西医药, 2020, 55(9): 1157-1162.
[10] 李跃文,刘志强,朱晓芹,等.四磨汤治疗功能性胃肠病机制的网络药理学分析[J].井冈山大学学报:自然科学版, 2020, 41(03): 90-95.
[11] Trott O, Olson A J. AutoDock Vina: improving the speed and accuracy of docking with a new scoring function, efficient optimization, and multithreading[J]. J Comput Chem, 2010, 31(2): 455-461.
[12] Gomes I B, Porto M L, Santos M C, et al. The protective effects of oral low-dose quercetin on diabetic nephropathy in hypercholesterolemic mice[J]. Front Physiol, 2015, 6(247):1-8.
[13] Gomes I B, Porto M L, Santos M C, et al. Renoprotective, anti-oxidative and anti-apoptotic effects of oral low-dose quercetin in the C57BL/6J model of diabetic nephropathy[J].Lipids in Health and Disease,2014, 13(184):1-10.
[14] Sharma D, Gondaliya P, Tiwari V, et al. Kaempferol attenuates diabetic nephropathy by inhibiting RhoA/Rho-kinase mediated inflammatory signalling[J]. Biomedicine and Pharmacotherapy,2019,1(109):1610-1619.
[15] Na Xu, Lei Z, Jing D, et al. Low-dose diet supplement of a natural flavonoid, luteolin, ameliorates diet-induced obesity and insulin resistance in mice[J]. Mol Nutr Food Res, 2014, 58(6): 1258-1268.
[16] Yu Q, Zhang M, Qian L, et al. Luteolin attenuates high glucose-induced podocyte injury via suppressing NLRP3 inflammasome pathway[J]. Life Sci, 2019, 15(225):1-7.
[17] Weir G C, Laybutt D R, Kaneto H, et al. Beta-cell adaptation and decompensation during the progression of diabetes[J]. Diabetes, 2001, 50(1): 151-159.
[18] Sawaya A P, Pastar I, Stojadinovic O, et al. Topical mevastatin promotes wound healing by inhibiting the transcription factor c-Myc via the glucocorticoid receptor and the long non-coding RNA Gas5[J]. J Biol Chem, 2018, 293(4): 1439-1449.
[19] Noh H, Yu M R, Kim HJ, et al. Beta 2-adrenergic receptor agonists are novel regulators of macrophage activation in diabetic renal and cardiovascular complications[J]. Kidney Int, 2017, 92(1): 101-113.
[20] Arif E, Nihalani D, et al. Beta2-adrenergic receptor in kidney biology: A current prospective[J]. Nephrology, 2019, 24(5): 497-503.
[21] Jafari Anarkooli I, Sankian M, Vahedi F, et al. Evaluation of insulin and ascorbic acid effects on expression of Bcl-2 family proteins and caspase-3 activity in hippocampus of STZ-induced diabetic rats[J]. Cell Mol Neurobiol, 2009, 29(1): 133-140.
[22] Guillén-Gómez E, Bardají-de-Quixano B, Ferrer S, et al. Urinary Proteome Analysis Identifid Neprilysin and VCAM as Proteins Involved in Diabetic Nephropathy[J]. J Diabetes Res, 2018, 1-12.
[23] Kay A M, Simpson C L, Stewart J A. The Role of AGE/RAGE Signaling in Diabetes-Mediated Vascular Calcification[J]. J Diabetes Res, 2016, 2016:1-8.
[24] Yamagishi S. Role of advanced glycation end products (AGEs) and receptor for AGEs (RAGE) in vascular damage in diabetes[J]. Exp Gerontol, 2011,46(4):217-224.
[25] 门凌,何日明,杨曙东,等. p38 MAPK介导炎症在糖尿病肾病中作用研究进展[J].陕西医学杂志,2017,46(7): 983-985.
[26] Winkel LC, Hoogendoorn A, Xing R, et al. Animal models of surgically manipulated flow velocities to study shear stress-induced atherosclerosis[J]. Atherosclerosis, 2015, 241(1): 100-110.
[27] 曹妍婷. 缺氧-再氧化条件下血小板对白细胞—肝窦内皮细胞粘附及跨内皮迁移的影响[D].北京:北京协和医学院, 2013: 1-57.
[28] Gu H F, Zheng X, Abu Seman N, et al. Impact of the hypoxia-inducible factor-1 α (HIF1A) Pro582Ser polymorphism on diabetes nephropathy[J]. Diabetes Care, 2013,36(2):415-421.
UTILIZING NETWORK PHARMACOLOGY AND MOLECULAR DOCKING TO EXPLORE THE UNDERLYING MECHANISM OFANDIN DIABETIC NEPHROPATHY
PENG Wen-hu1, LIU Ling2, WU Wen-ming2,*LUO Xin-xin2
(1. The Affiliated Hospital of Jinggangshan University, Ji’an, Jiangxi 343000, China;2. Department of Pharmacy, Jiangxi Provincial People’s Hospital, Nanchang, Jiangxi 330000, China)
To study the molecular mechanism of diabetic nephropathy treated byandbased on network pharmacology and molecular docking.The chemical components and putative targets ofandwere collected based on the TCMSP. Cytoscape3.7.1 software was used to construct the component-target-disease network. Based on the matching targets of related targets inandon DN, protein interaction network analysis was performed. Using the AutoDock Vina software, the candidate compounds were docked with the core targets. Finally GO biological process and KEGG were carried out.In total, 81 active compounds ofandwere identified, of which 22 ones were the targets for the treatment of DN. Molecular docking prediction showed that tanshinone ⅡA had a strong binding activity with MYC, VCAM1 and CASP3, quercetin and kaempferol had a strong binding activity with ADRB2. The main pathway included AGE/RAGE, MAPK, HIF-1signal pathway.Some active compounds ofandsuch as tanshinone ⅡA, luteolin, quercetin and kaempferol, play a role of alleviating DN by affecting AGE/RAGE, MAPK, HIF-1signal pathway. These pathways were primarily associated with the common targets of ADRB2, CASP3, VCAM1 and MYC.
;DN; network pharmacology; molecular docking
1674-8085(2022)04-0084-08
R255.4
A
10.3969/j.issn.1674-8085.2022.04.013
2021-06-17;
2022-01-12
江西省自然科学青年基金项目(20192BAB215056);江西省卫生计生委中医药科研基金项目(2019B059)
彭文虎(1990-),男,江西九江人,主管药师,硕士,主要从事临床药学工作(E-mail:649233001@qq.com);
*罗新新(1990-),女,江西九江人,主管药师,硕士,主要从事医院药学工作(E-mail:719262619@qq.com).
