α-螺旋抗菌肽YHX-1 的从头设计及抑菌活性研究
2022-07-02李剑勋步雨珊刘银雪刘伊索印伯星易华西
李剑勋 步雨珊 刘银雪 刘伊索 印伯星 周 炜 易华西
(1.中国海洋大学 食品科学与工程学院, 山东 青岛 266003;2.扬州市扬大康源乳业有限公司, 江苏 扬州 225000)
食品安全是关乎国计民生的重大问题,其中微生物安全是食品安全中的主要问题。 多年来抗生素在食品产业链不同环节的过度使用和滥用,导致致病菌或食品腐败菌的耐药性不断提高[1]。 因此,寻求安全、高效且不易引起耐药的新型抗生素替代品是目前食品安全和生物替抗领域的研究重点。 抗菌肽(antimicrobial peptides,AMPs),是一类具有抗细菌、抗真菌、抗病毒等多种生物活性的小分子多肽,其凭借独特的膜穿孔机制发挥抗菌作用[2]。 由于具有独特的抗菌机制,不易使致病菌产生耐药性,AMPs 在食品安全和生物替抗领域具有广阔的应用前景;但大部分AMPs 存在抑菌谱窄、抑菌活性低、生物相容性差和生产成本高等问题,限制了其应用。因此,亟需开发抑菌谱广、抗菌活性强、安全性高且成本低廉的AMPs。
尽管AMPs 的作用机制仍存在争议,但普遍认为AMPs 的活性发挥依赖于肽序列中疏水性和阳离子残基排列而成的两亲性结构[3]。 研究表明,提高疏水性和疏水力矩可以同时提高抗菌肽对细菌细胞膜的穿透力和溶血活性[4]。 因此,通过改变AMPs的疏水性和两亲性分布,使抑菌活性和生物相容性达到理想的平衡状态是AMPs 理性设计的关键。Jiang 等[5]在α-螺旋肽的非极性表面引入带有正电荷的赖氨酸,改造后的肽在保留了抑菌活性的同时溶血活性降低,细胞选择性提高。 Misawa 等[6]将赖氨酸残基设计在螺旋结构的一侧,将亮氨酸和丙氨酸残基置于螺旋的另一侧,得到的肽抑菌活性良好且细胞毒性较低。 由于α-螺旋在序列排列上具有周期性,因此易于对其两亲性特征进行设计。 随着生物信息学的迅速发展,使得基于生物信息学数据库、预测及分析工具获得新型AMPs 的方法越来越具有可行性和科学性[7]。 本研究结合Database filtering 方法[8]、合理设计思路以及生物信息学工具进行新型AMPs 的从头设计,设计方法便捷高效,避免了传统序列优化方法的盲目性和不确定性,得到了一条具有广谱、高效抑菌活性,高细胞选择性的YHX-1,旨在为解决AMPs 的应用瓶颈提供理论依据和技术支撑,为开发新一代高效、安全的AMPs 提供新思路。
1 材料与方法
1.1 材料与试剂
大肠杆菌(Escherichia coliATCC 25922)、鼠伤寒沙门氏菌(Salmonella typhimuriumATCC 14028)、铜绿假单胞菌(Pseudomonas aeruginosaATCC 27853)、金黄色葡萄球菌(Staphylococcus aureusATCC 8095)、单核细胞增生李斯特氏菌(Listeria monocytogenesATCC 19115)、变异链球菌(Streptococcus mutansATCC 25175),中国海洋大学功能性乳品与益生菌工程研究室。 小鼠单核巨噬细胞白血病细胞RAW 264.7 细胞,中国科学院细胞库;LB 肉汤培养基、BHI 肉汤培养基、DMEM 培养基、琼脂粉,青岛海博生物技术有限公司;三氟乙醇TFE、十二烷基硫酸钠SDS、MTT 噻唑蓝、TritonX-100,北京索莱宝科技有限公司。
1.2 仪器与设备
Multiskan FC 型酶标仪,美国赛默飞世尔科技公司;TGL-16M 型台式高速冷冻离心机,湖南湘仪实验室仪器开发有限公司;SHP-250 型生化培养箱,上海精宏实验设备有限公司;THZ-98A 型恒温振荡器,上海一恒科技有限公司;BHC-1300IIA 型二级生物安全柜,苏州净化设备有限公司;LCI-270型二氧化碳细胞培养箱,上海龙跃仪器设备有限公司;J-815 型圆二色(CD)光谱仪,日本分光株式会社。
1.3 实验方法
1.3.1 AMPs 的从头设计
从抗菌肽数据库APD[9]中筛选出对革兰氏阳性菌和革兰氏阴性菌有抑菌活性的AMPs 序列组成序列子集,对序列长度、带电荷数、疏水氨基酸比例和氨基酸组成等序列参数进行统计分析,按照优势参数的选取原则确定新设计AMPs 的序列特征参数。 采用生物信息学预测及分析工具,使用数据库CAMPR3、DRAMP 及DBAASP[10-12]对不同氨基酸排列顺序的肽序列成为AMPs 的概率进行预测,使用软件Heliquest、Expasy[13-14]对序列相对分子质量、平均疏水值、平均疏水力矩、不稳定性指数、脂肪族指数、半衰期、螺旋轮图等性质进行预测分析,使用I-TASSER、Pep-fold[15-16]对二级结构进行预测,并利用PyMOL 软件可视化,进而筛选出最优的AMPs序列。
1.3.2 琼脂扩散法测定抑菌活性
抗菌肽由强耀生物科技(上海)有限公司合成,单次制备量为10 mg,纯度高于95%,冷冻干燥后分装规格为1 mg/管。 抗菌肽冻干粉保存于-20 ℃环境中,现用现配,溶液可短期保存至4 ℃冰箱中。 将金黄色葡萄球菌、大肠杆菌、铜绿假单胞菌和鼠伤寒沙门氏菌接种于LB 肉汤培养基,单增李斯特菌和变异链球菌接种于BHI 肉汤培养基,37 ℃恒温培养箱培养18 h。配置LB 和BHI 半固体培养基(琼脂质量分数0.6%),待培养基冷却至50 ℃后以每皿20 mL 的体积量,加入7 μL 菌液振荡混匀后倒入摆放好牛津杯的培养皿中,待培养基凝固后拔除牛津杯完成打孔。 每孔中加入160 μL AMPs 溶液(配置使用1 mg 抗菌肽溶于3 mL 超纯水),置于37 ℃恒温培养箱培养24 h 后测量抑菌圈直径[17],测量3 次取平均值。
1.3.3 最小抑菌浓度及最小杀菌浓度测定
参考Tang 等[18]的方法,向96 孔板中加入培养至对数生长期稀释至1 × 106CFU/mL 的菌液50 μL,同时采用二倍稀释法在孔中加入各浓度梯度AMPs 溶液(4 ~512 μg/mL)50 μL,并以未加AMPs的菌液作为阴性对照组,空白培养基作为空白对照组。 在37 ℃恒温培养箱培养18 h 后测量各孔的OD600nm,取菌株生长被完全抑制的最低浓度作为AMPs 的最小抑菌浓度(minimal inhibitory concentration,MIC)。 从所有菌株生长被完全抑制的孔中吸取50 μL 样液,涂布于相应的固体培养基表面,37 ℃恒温培养24 h 后计算菌落数,以杀死99.9%细菌的最低药物浓度作为AMPs 的最小杀菌浓度(minimum bactericidal concentration,MBC)。
1.3.4 杀菌动力学曲线测定
以单增李斯特菌为指示菌,将其培养至对数生长期并调整菌落数至1 ×105CFU/mL,同最小杀菌浓度的AMPs 溶液混合后,分别于0、5、10、20、30、60、120、240、300 min 取样,用生理盐水(质量浓度为0.009 g/mL 的NaCl 溶液)稀释至合适倍数后涂布于BHI 固体培养基,37 ℃恒温培养24 h 后统计细菌存活情况。
1.3.5 AMPs 稳定性测定
参考Mishra 等[8]的方法,以单增李斯特菌作为指示菌,探究不同环境条件对AMPs 抗菌活性的影响。 将培养至对数生长期的单增李斯特菌分别在含有200 mmol/L NaCl、2 mmol/L CaCl2、10% ~25%人血浆,以及微酸性(pH 值5.4、6.8、7.4)培养环境中与AMPs 共孵育,按照1.3.3 节的方法测定MIC 的变化。
1.3.6 溶血活性测定
在签订知情同意书的前提下,用采血针抽取1 mL 来自健康志愿者的新鲜血液置于肝素钠抗凝管中,4000 r/min 离心10 min 后取沉淀,将红细胞用PBS 缓冲液冲洗3 次并重悬。 在96 孔板中加入终浓度为4 ~512 μg/mL AMPs 溶液与红细胞悬液共孵育,以PBS 缓冲液作为阴性对照,以TritonX-100(质量浓度为0.001 g/mL)作为阳性对照。 在37 ℃恒温孵育1 h 后,离心取上清液并使用酶标仪测定OD570nm[19]。 溶血活性计算如式(1)。
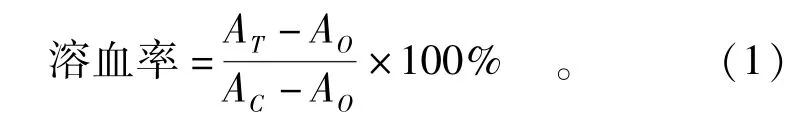
式(1)中,AT为实验组的吸光度;AC为阳性对照组的吸光度;AO为阴性对照组的吸光度。
1.3.7 细胞毒性测定
参考Khara 等[20]的方法,测定了YHX-1 对小鼠单核巨噬细胞白血病细胞RAW264.7 的细胞毒性。 将冻存于液氮中的RAW264.7 细胞复苏后在含有胎牛血清(体积分数为10%)和双抗(质量浓度为0.01 g/mL)的DMEM 培养基中,37 ℃、体积分数5% CO2条件下传代培养。 以1 ×104细胞/mL 的密度将细胞接种于96 孔板中,继续培养24 h。 待细胞贴壁后,吸去旧培养基,加入200 μL 使用二倍稀释法得到的不同质量浓度 YHX - 1 溶液(4 ~512 μg/mL)处理24 h。 随后,用200 μL 新鲜DMEM和40 μL MTT(5 mg/mL)溶液取代培养基,并在37 ℃下再孵育4 h。使用150 μL 的DMSO 溶解得到的甲瓒晶体,并在595 nm 下测量吸光度。 以未经处理的细胞作为对照组并计算细胞存活率。
1.3.8 圆二色光谱分析
使用CD 光谱法测定YHX-1 的二级结构[21]。将YHX-1 分别溶于10 mmol/L PBS(pH =7.4)溶液、体积分数50% 的三氟乙醇(TFE) 溶液和30 mmol/L十二烷基硫酸钠(SDS)溶液中,使肽的终浓度为200 μmol/mL。 配置好的多肽溶液加入光径为1 mm 的比色皿中,在室温条件下用CD 光谱仪测定YHX-1 在190 ~250 nm 的椭圆率,扫描速度为100 nm/min,重复3 次取平均值,并根据式(2)计算多肽的平均残基椭圆率。

式(2)中,θM为平均残基椭圆率,deg·cm2·dmol-1;θobs为实测椭圆率,mdeg;c为多肽浓度,mmol/L;l为光径,mm;n为多肽中的氨基酸残基个数。
1.4 数据处理
实验结果以平均值±标准偏差表示,方差分析采用SPSS 23.0 软件中One-way ANOVA 分析,P<0.05代表差异具有统计学意义。 实验独立重复3 次。
2 结果与分析
2.1 AMPs 的设计结果
将从AMPs 数据库APD 中筛选得到的843 条AMPs 序列组成序列子集,该序列子集包括了已被证实对革兰氏阴性菌和革兰氏阳性菌有抗菌活性的天然及人工合成AMPs。 对AMPs 序列参数进行分析,包括序列长度、带电荷数、疏水氨基酸比例和氨基酸组成等。 依据Database filtering 方法中的优势参数选取原则同时结合合理设计思路,确定了新型AMPs 的各项序列参数(见表1)。
为降低合成成本,同时降低细胞毒性,序列长度选择参数频率第一位的13。 选取在数据库中出现频率最高的甘氨酸Gly、赖氨酸Lys、丝氨酸Ser、亮氨酸Leu 组成AMPs 序列,其中带正电氨基酸Lys 和极性不带电荷氨基酸Ser 组成抗菌肽的极性面,选取疏水性氨基酸Leu 形成疏水面,来保证AMPs 的两亲性结构。 电荷数确定为+ 5,保证AMPs 对细菌细胞膜的亲和力。 在此基础上使用Expasy 和Heliquest 对不同氨基酸排列顺序肽序列的螺旋轮图及物化性质进行分析,使用I-TASSER等对二级结构进行预测,筛选得到的最优肽序列YHX-1 及物化性质如表1,螺旋轮图及二级结构预测结果如图1。

表1 YHX-1 的序列参数及物化性质Tab.1 Sequence parameters and physicochemical properties of YHX-1

图1 YHX-1 的螺旋轮图及二级结构预测Fig.1 Helical wheel and predicted secondary structure of YHX-1
通过GRAVY(总平均疏水值)和疏水力矩可以看出预测的肽序列具有适中的疏水性和较好的两亲性,在对细菌细胞膜具有较好亲和力的同时有利于深入细胞膜的磷脂双分子层,进而破坏细胞膜的完整性。 脂肪族指数(aliphatic index)和不稳定性指数(instability index)均被认为与肽的稳定性相关,其中不稳定性指数低于40 表明了序列较好的稳定性,通过预测结果可知YHX-1 具有较好的稳定性。 基于3 种不同算法(SVM、Random Forest、ANN) 使用CAMPR3 对AMPs 的成肽可能性进行预测,肽序列YHX-1 的成肽可能性均在0.94 以上。
2.2 YHX-1 的抑菌活性分析
通过琼脂扩散法、最小抑菌浓度、最小杀菌浓度的测定以及杀菌动力学曲线对YHX-1 的体外抑菌活性进行了评价,见表2。 结果表明,YHX-1 对革兰氏阳性菌(单增李斯特菌、金黄色葡萄球菌、变异链球菌)和革兰氏阴性菌(铜绿假单胞菌、大肠杆菌、鼠伤寒沙门氏菌)均有明显的抑菌活性。 其中,对单增李斯特菌的抑菌圈直径最大,达到了20.56 mm。最小抑菌浓度及最小杀菌浓度测定结果表明, YHX - 1 对不同致病菌的 MIC 在4 ~128 μg/mL,其中对单增李斯特菌和鼠伤寒沙门氏菌的抑菌效果最好,MIC 均为4 μg/mL。 YHX-1 对各株致病菌的MBC 为MIC 的1 ~4 倍,与朱洁[22]的结果一致。 YHX-1 在1 ×MBC(8 μg/mL)对单增李斯特菌的杀菌动力学曲线如图2。 由图2 可知,YHX-1 在2 h 内可杀死99.99%以上的菌体,具有很高的杀菌效率。

图2 YHX-1 对单增李斯特菌的杀菌动力曲线Fig.2 Time-killing curve of L. monocytogenes treated with YHX-1

表2 YHX-1 对致病菌的抑菌活性Tab.2 Antimicrobial activity of YHX-1 against pathogenic bacteria
2.3 YHX-1 的稳定性分析
在盐离子和血浆环境中的活性降低一直是AMPs 开发中不可忽视的问题。 血浆中的高密度脂蛋白和清蛋白与LL-37 结合后可使其失活[23],盐离子可能通过降低阳离子AMPs 对细胞膜表面的静电吸附力或降低AMPs 与细菌外膜的相互作用降低抗菌肽的抑菌活性[24]。 本研究探究了在不同体积分数血浆、不同盐离子浓度以及不同pH 值下YHX-1 的MIC 变化情况(表3)。 结果表明,随着培养环境中血浆体积分数的增大, YHX-1 对单增李斯特菌的抑菌活性不断降低。 在体积分数25%的血浆环境下,MIC 增大到32 μg/mL,为原来的8 倍。 在Na+和Ca2+环境中YHX-1 对单增李斯特菌的MIC 会提高2 ~4 倍,说明YHX-1 对盐离子具有一定的敏感性,但仍然会保持良好的抗菌活性。 比较研究了5.4、6.8 和7.4 这3 个pH 梯度对肽抑菌活性的影响,结果表明,不同的微酸性环境对YHX-1 的MIC不会产生显著影响。

表3 不同环境条件下YHX-1 对 单 增 李斯特菌的MICTab.3 MIC of YHX-1 against L. monocytogenes at different environmental conditions
2.4 YHX-1 的溶血活性分析
由于AMPs 通过与膜直接作用发挥抗菌活性,当多肽中各项序列参数失衡时,AMPs 不仅可以杀灭致病微生物,对哺乳动物细胞同样会存在裂解毒性。 天然及人工合成的AMPs 往往具有溶血活性,如天然线性阳离子肽蜂毒肽(melittin) 在2.219 μg/mL时即会引起10%以上的人血红细胞溶血[25]。 因此缺乏足够的细胞选择性是当前AMPs广泛应用的主要瓶颈之一。 本研究测定了YHX-1对人血红细胞的溶血活性(图3)。 结果表明,在测试质量浓度下(2 ~256 μg/mL),YHX-1 的溶血率均低于10%;256 μg/mL 的溶血率为4.71%,8 μg/mL 仅会引起0.57%的人红细胞溶血。 Zhang 等[26]以蜂毒肽为模板进行设计优化,发现当将疏水表面的丙氨酸和异亮氨酸替换为带正电荷的极性氨基酸赖氨酸或精氨酸后,肽A(A1R、A8R、I17R)的最小溶血浓度增至200 μmol/L,同时抗菌活性与原肽相似。 因此,本研究设计的YHX-1 细胞选择性高,具有很好的生物相容性。
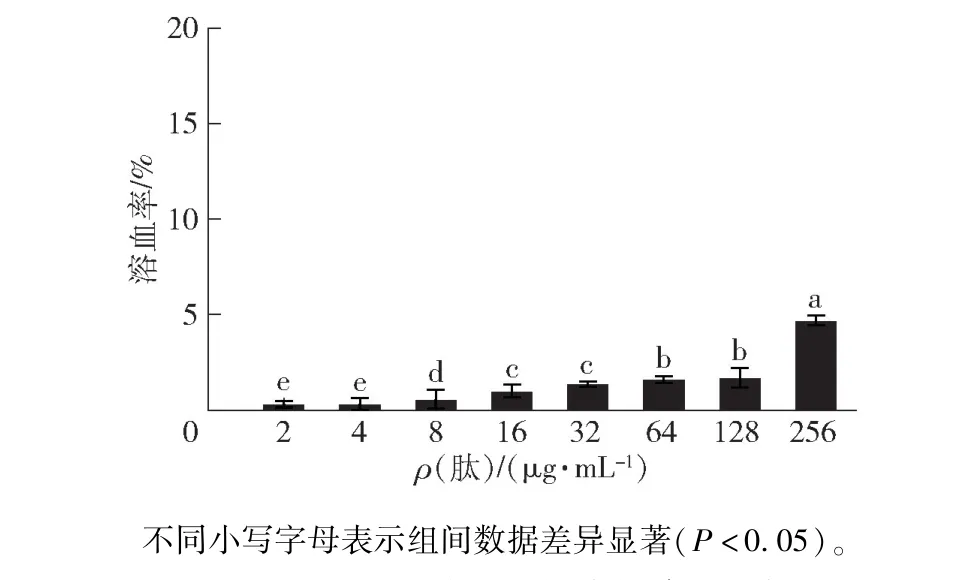
图3 YHX-1 对人红细胞的溶血活性Fig.3 Hemolytic activity of YHX-1 on human erythrocytes
2.5 YHX-1 的细胞毒性分析
使用MTT 法测定了不同质量浓度的YHX-1 对RAW264.7 细胞的细胞毒性,结果如图4。 YHX-1对RAW264.7 细胞的毒性作用呈现出明显的浓度依赖性,且与溶血活性表现出相同的作用趋势。 在低于16 μg/mL 时,YHX-1 作用24 h 后的细胞存活率均在90.00% 以上;而当肽质量浓度增大到256 μg/mL时,YHX-1 对RAW 264.7 的细胞毒性较明显,细胞存活率降低至66.55%。 因此,YHX-1质量浓度在MIC 时表现出了较好的生物相容性。
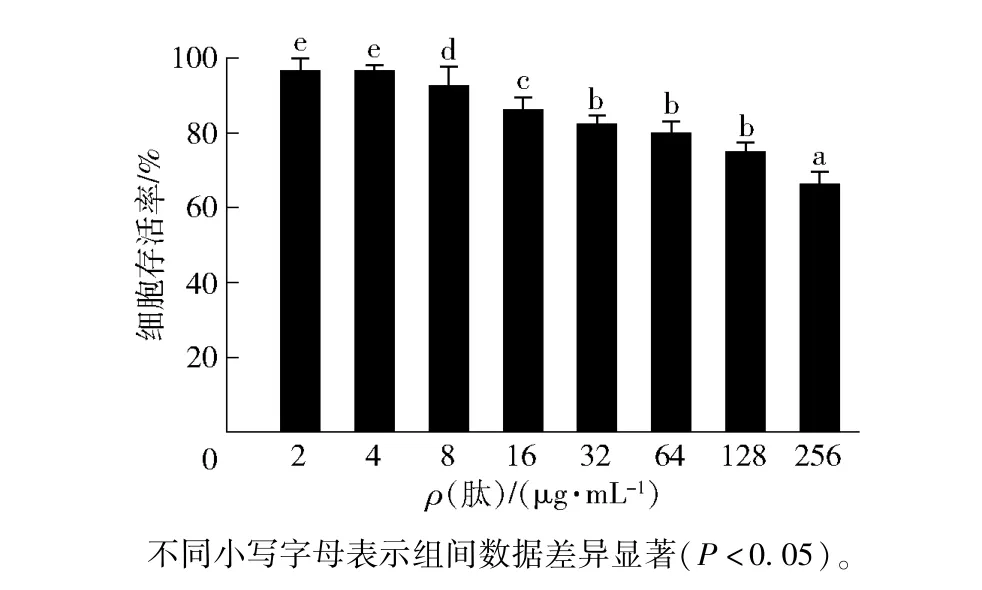
图4 YHX-1 对RAW 264.7 细胞的细胞毒性Fig.4 Cytotoxicity of YHX-1 on RAW 264.7 cells
2.6 YHX-1 的二级结构测定
CD 光谱用于研究各种环境中多肽的二级结构。本研究使用50% TFE 模拟疏水性环境,用于评估多肽的固有螺旋倾向,30 mmol/L SDS 模拟磷脂双分子层的阴离子环境,10 mmol/L PBS(pH=7.4)模拟亲水环境,结果如图5。 YHX-1 在30 mmol/L SDS和50% TFE 环境中,在192 nm 附近出现正峰,在208、222 nm 附近出现2 个特征性的负峰,说明在细胞膜模拟环境中均呈现α-螺旋构象。 而YHX-1 在PBS 模拟的水相环境中呈现无规卷曲的状态。
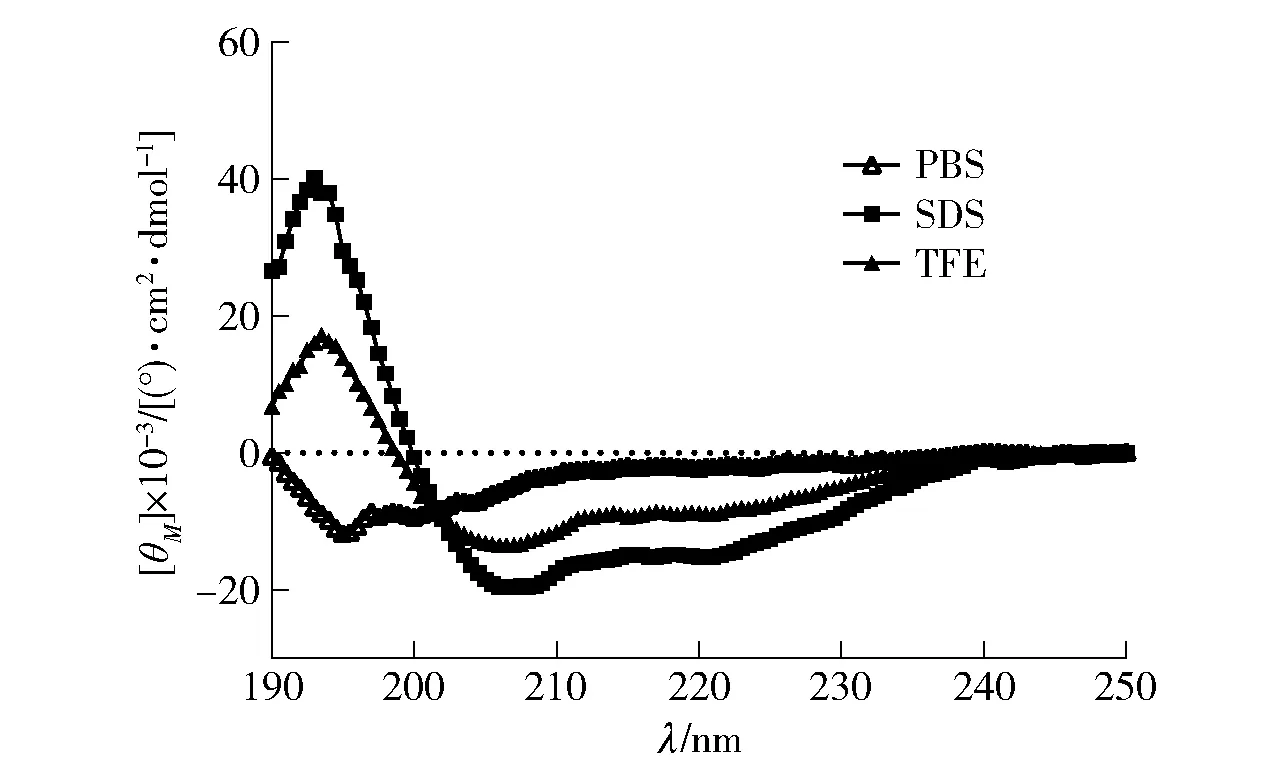
图5 YHX-1 在不同环境中的圆二色光谱Fig.5 CD spectra of YHX-1 in different environments
3 结论
结合Database filtering 方法、合理设计及生物信息学预测及分析工具设计得到了对革兰氏阳性菌和革兰氏阴性菌均有良好抑菌活性的肽YHX-1。YHX-1 对单增李斯特菌和鼠伤寒沙门氏菌的MIC为4 μg/mL,在2 h 内可杀死99.99%以上的菌体,256 μg/mL 时的溶血率为4.71%,同时具有良好的盐离子及血浆稳定性和生物相容性。 圆二色光谱分析表明,YHX-1 在细胞膜模拟环境中呈现典型的α-螺旋构象。 YHX-1 具有抑菌谱广、抑菌活性高、细胞选择性好、序列短及合成成本低等优点,有望作为一种生物抗菌剂应用于食品防腐保鲜和生物替抗领域。 同时,本研究应用的AMPs 从头设计方法较为便捷高效,可为开发新一代高效、安全的AMPs 提供参考。
