燕麦β-葡聚糖-槲皮素复合物的制备及其对秀丽隐杆线虫寿命的影响
2022-07-02赵娇娇司茜媛张琨霖刘欢欢郭庆彬王昌禄梁宏和蒋爱民李贞景
赵娇娇 司茜媛 张琨霖 刘欢欢 郭庆彬 王昌禄 梁宏和 蒋爱民 李贞景
(1.天津科技大学 食品科学与工程学院, 天津 300457;2.天津科技大学 食品营养与安全国家重点实验室, 天津 300457;3.广西壮族自治区亚热带作物研究所, 广西 南宁 530001;4.桂林原心达生物科技有限公司, 广西 桂林 541000)
燕麦β-葡聚糖(oats β- glucan,OG)是一种葡萄糖的同聚物,具有抗氧化、降胆固醇、降血脂、抗病毒等多种生物活性[1-3]。 近年来,有关OG 延缓衰老的研究逐渐引起人们的关注。 研究表明,OG 可通过抑制脂质过氧化、提高机体的抗氧化能力达到延缓衰老的作用[4]。 此外,OG 因具有较简单的糖单元结构,呈线性并具有亲水基团,因此易与多酚交联从而加强其抗氧化活性[5-6]。
槲皮素(quercetin,QE)是最丰富的黄酮类化合物之一,作为天然抗氧化剂在食品、医药、化妆品等行业有广泛的用途[7]。 研究表明,QE 具有促进细胞自我更新和分化的特性,可减轻人骨髓间充质干细胞的衰老[8],被认为是一种抗早衰的药物。 尽管大量文献报道QE 抗氧化活性显著,但因溶解度低、提取过程中易流失,从而导致其生物利用度较低,因此在临床应用上受到限制。
天然糖酚复合物存在于多种植物中,目前已有从小球藻、马尾藻、紫菜、冷杉藻、迷迭香、百里香和马鞭草等植物中提取出高抗氧化活性糖酚物质的报道[9-11]。 在糖酚的制备方面,壳聚糖和原花青素可通过自由基诱导制备出稳定性高、抗氧化活性好的糖酚复合物[12];在应用方面,利用浆果多酚-黑木耳多糖复合物开发出的复合果汁饮料具有良好的抗氧化功能[13]。
此外,糖、酚作为人类食物的主要成分之一,在肠胃的消化过程中,两者极易形成复合物,但有关糖酚复合物的研究相对较少,导致对糖酚复合物的形成机制、消化特性和生物活性知之甚少。 多酚在胃的酸性环境中是稳定的,但在小肠的中性和弱碱性环境下会被降解。 多糖可包裹多酚,有效保护多酚在碱性条件下不被降解,并在肠液中缓慢而持久地释放。 研究表明,糖酚交联为复合物后,可减少多酚在肠道环境中的降解,提高多酚在小肠中的渗透,甚至增加多酚在血液中的含量[14]。 因此,亟需加强糖酚复合物的有关基础研究。
秀丽隐杆线虫Caenorhabditis elegans(C. elegans)结构简单、培养方便,是进行抗氧化、抗衰老研究最理想的模式生物之一。 目前尚未见到有利用秀丽隐杆线虫研究糖酚互作的报道。
本研究以OG 和QE 为原料,通过自由基催化、氢键吸附的方法分别制备燕麦β-葡聚糖-槲皮素共价复合物(COGQ)与非共价复合物(NOGQ),研究其结构性质及对秀丽隐杆线虫寿命的影响,以期为糖酚复合物的制备及新型食品抗氧化剂的开发提供参考和借鉴。
1 材料与方法
1.1 材料与试剂
燕麦 β-葡 聚 糖(AR 80%), 分 子 质 量 为350 kDa,购于山东佰兴生物科技有限公司,经实验室醇沉纯化至AR 92%;槲皮素(AR 98%),购于上海生工生物有限公司;N2 野生型秀丽隐杆线虫与OP50 型大肠杆菌,天津科技大学保藏;无水乙醇、苯酚、透析袋、H2SO4、NaNO3、CH3OH、二甲基亚砜、NaCl、MgSO4、CaCl2,天津江天化工技术股份有限公司;胆固醇、抗坏血酸、蛋白胨,生工生物工程(上海)股份有限公司;5-氟尿嘧啶(5-FU),阿拉丁试剂(上海)有限公司。 实验所用试剂均为分析纯。
1.2 仪器与设备
PIVC 2-25 plus 型真空浓缩仪,德国Christ 公司;ITC 200 型等温滴定量热仪、IS 50 型傅里叶红外光谱仪,日本尼高利公司;Infinite 200 PRO 型酶标仪,瑞士TECAN 公司;Bruker Avance NEO 型核磁共振波谱仪,布鲁克(北京)科技有限公司;Q 50 型热重分析仪,美国TA 仪器公司;SU 1510 型扫描电子显微镜,天美(中国)科学仪器有限公司;HN-150Y 型超声波破碎细胞仪,济南童鑫生物科技有限公司。
1.3 实验方法
1.3.1 OG 的纯化与总糖含量测定
取1.0 g OG 溶于10.0 mL 蒸馏水,浓缩至1.0 mL,缓慢加入1.5 mL 无水乙醇,4 ℃冷藏24 h,6000 r/min离心,收集上清液,旋蒸回收乙醇,冻干后4 ℃保存。 按苯酚-硫酸法[15]测定OG 总糖含量。
1.3.2 NOGQ 的制备
OG 可通过氢键、疏水作用、范德华力等与QE结合,形成具有特异性强、可逆的NOGQ。 QE 酚羟基上的氢和葡聚糖醚键上的氧原子之间形成氢键,苯环作为交联葡聚糖凝胶羟基的电子供体[16],使OG 形成包封QE 的结构从而形成NOGQ。
配制25 mg/mL OG 溶液,60 ℃磁力搅拌4 h 后,置于超声破碎细胞仪(18 kHz,600 W,每循环处理3 s,间歇2 s,共20 个循环)降分子质量。 利用DMSO助溶配制0.5 mg/mL QE 溶液。 将配好的OG 与QE 溶液置于超滤管,6000 r/min,20 ℃离心10 min,内管中沉淀即为NOGQ,冻干后,4 ℃保藏备用。
1.3.3 COGQ 的制备
OG 可通过自由基诱导、酶促和碳二亚胺交联等方法与QE 发生共价相互作用[17]。 QE 通过氧化作用生成醌,进而与OG 分子间发生希夫碱反应或迈克尔加成反应[18],最终生成COGQ。
称取1.0 g OG 溶于100.0 mL 超纯水,加入4.0 mL 25 μg/mL 抗坏血酸溶液,磁力搅拌30 min,加入物质的量比为0.1∶1.0 的QE(nQE∶nOG=1.0∶0.1),磁力搅拌24 h,8000 r/min离心10 min,保留沉淀,蒸馏水透析72 h,去除多余的QE,得到COGQ,冻干后,4 ℃保藏备用。
1.3.4 复合物相对分子质量的测定
采用高效排阻色谱(high performance size exclusion chromatography,HPSEC) 法测 定OG、NOGQ、COGQ 的相对分子质量,条件为:流动相为0.15 mol/L NaNO3溶液,流速为0.6 mL/min,检测温度为40 ℃,并根据标准曲线计算出相对分子质量[19]。
1.3.5 复合物特殊官能团的分析
准确称量样品1.0 mg 和干燥的150.0 mg KBr,均匀混合后充分研磨,使用压片机在30 MPa 下保持30 s,得到透明状薄片后,进行背景扫描去除干扰,在400 ~4000 cm-1进行32 次扫描得到红外光谱图[20]。
1.3.6 复合物糖苷键的分析
准确称量样品40.0 mg 溶于1 mL 重水(D2O),反复冻融3 次溶解于核磁管,利用500 MHz 核磁共振波谱仪,在25 ℃记录1H-NMR[21]。
1.3.7 复合物结合比的测定
配制OG 溶液1 mg/mL,QE 溶液10 mg/mL,使用等温滴定量热仪测定热量变化曲线[22]。
1.3.8 复合物热降解特性的分析
准确称量样品5.0 mg,置于氧化铝样品盘,氮气作为载气,30 mL/min,25 ~600 ℃,10 ℃/min,根据时间和温度的函数,跟踪加热后剩余固体的质量,得到失重曲线[23]。
1.3.9 样品微观结构的观察
取少量样品均匀分散于粘有导电双面胶的样品台上,洗耳球吹走多余样品后,放入离子溅射镀膜仪中,在真空环境中做喷金处理后,放入样品室观察不同放大倍数下样品的微观结构。
1.3.10 线虫寿命实验
用N2 野生型秀丽隐杆线虫研究寿命,以尿嘧啶缺陷型大肠杆菌(E. coliOP50)作为线虫食物,培养于线虫生长培养基(nematode growth medium,NGM)上。 将同期化至L4 期线虫挑至含有OP50 的NGM 上(含12.5 mg/L 5-FU),随机分为4 组,分别为OG 组、QE 组、COGQ 组、NOGQ 组,每组3 板,每板40 条。 每日将活线虫转移至新培养基,记录寿命,直到线虫全部死亡。 若挑针触动线虫无反应,则认为死亡,若线虫爬到培养皿壁干死,则从总数中剔除。 实验重复3 次并做寿命曲线。
1.3.11 线虫氧化应激实验
将同期化至L4 期线虫挑至含有质量分数为0.1%过氧化氢的NGM 平板,每隔0.5 h 统计一次寿命,直到线虫全部死亡。 其他条件同寿命实验。
1.3.12 线虫抗氧化酶活性的测定
收集同期化至L4 期的线虫,培养方法同寿命实验,5 d 后用PBS 冲洗线虫至EP 管,每管约2000 条,反复洗涤3 次后,再次加入200 μL PBS,于冰上匀浆,离心后取上清液。 根据试剂盒方法测定超氧化物歧化酶(SOD)和过氧化氢酶(CAT)活性,实验重复3 次。
1.4 数据处理
采用Excel 2010 软件进行数据处理,采用SPSS 26软件做差异显著性分析。 所有实验均重复3 次,结果以平均值±标准差表示,采用Origin 2019 软件绘图。
2 结果与分析
2.1 COGQ、NOGQ 的结构与理化特性分析
2.1.1 共价、非共价交联对复合物相对分子质量分布的影响
按照1.3.4 方法测定复合物相对分子质量分布情况。 以葡聚糖相对分子质量1 万、4 万、7 万、50 万Da 作为标准品,得到葡萄糖标准曲线回归方程y= -0.4616x+11.522,R2=0.979。 以保留时间为横坐标,信号值为纵坐标,得到复合物的高效排阻色谱,见图1。 由图1 可知,OG 组、NOGQ 组、COGQ 组的保留时间分别为17.264、 17.282、17.394 min,计算出相对分子质量分别为355、354、349 kDa。 复合物形成后,其表面的羟基与水形成刚性结构,内部只是形成疏水空腔或间隙[24],并未改变其他结构,因而其相对分子质量变化不大。
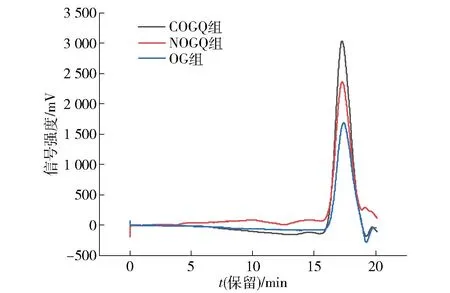
图1 复合物的高效排阻色谱Fig.1 HPSEC of composites
2.1.2 共价、非共价交联对复合物特殊官能团的影响
利用红外光谱技术,将已知官能团出现的吸收峰与未知化合物的吸收峰作比较。 复合物的红外光谱(FI-IR)分析结果见图2。 由图2 可知,OG 和QE的FT-IR 谱图有典型特征峰,这些峰在COGQ 和NOGQ 的光谱中也存在。 OG 中1660 cm-1处的吸收峰为 ==C O 的伸缩振动,在1243 cm-1处的吸收峰为C—O—C 的伸缩振动。 QE 中1562 cm-1处的吸收峰为苯环骨架的 ==C C 伸缩振动。 COGQ 与NOGQ 在1660 cm-1处具有属于OG 的 ==C O 的伸缩振动,在1243 cm-1处具有属于OG 的C—O—C的伸缩振动,在1562 cm-1处具有属于QE 的苯环骨架的 ==C C 伸缩振动。 另外,NOGQ 与COGQ 相比,在3000 cm-1处具有不饱和C—H 伸缩振动。 QE 在1000 ~1700 cm-1处存在强烈的吸收峰,而OG、COGQ、NOGQ 没有明显的峰,表明这3 种物质此时是无定型状态。 复合物中具有属于OG 的羰基和醚键,也具有属于QE 的苯环骨架,且QE 中强烈的吸收峰在COGQ、NOGQ 包封QE 后信号减弱,可能由于部分相关基团消失,表明OG 与QE 存在化学键交联。

图2 复合物的红外光谱Fig.2 FT-IR spectra of composites
2.1.3 共价、非共价交联对复合物糖苷键的影响
1H-NMR 可识别多糖结构中的糖苷键构型,由于OG 中的质子和复合物中的芳香氢、活泼的—OH基团质子在溶剂中易受到去屏蔽影响和各向异性效应的影响[25],因此通过重水交换,可去除其他氢信号的干扰。 复合物的核磁共振波谱见图3。 由图3(a)可知,OG 的异头氢信号集中在化学位移4.5 ~5.5 处,QE 在化学位移6.5 ~8.5 处有明显的3 个芳香基质子信号[图3(d)];而共价、非共价复合物在化学位移4.5 ~5.5 处出现了α 型异头氢质子的信号峰,且在化学位移6.5 ~8.5 处产生了3 个属于QE 的芳香基的新质子信号,与红外光谱的结果相符,进一步验证了QE 被成功连接到OG 的糖苷键上。

图3 各组样品的一维核磁波谱Fig.3 1H-NMR spectra of samples
2.1.4 共价、非共价交联对复合物结合比例的影响
利用等温滴定量热技术测定糖酚结合情况,实验结果见图4。 由图4 可知,随着滴定的进行,加热丝补偿给样品池和参比池的热量存在变化且逐渐减少并逐渐达到饱和状态,说明OG 与QE 可结合,每1 mol OG 可结合4.5 mol QE。 滴定过程是通过QE酚羟基上的氢和OG 醚键上的氧原子之间形成氢键,苯环作为交联葡聚糖凝胶羟基的电子供体,通过氢键与范德华力的吸引形成复合物进而封装QE[26]。 另外,复合物的热量变化随QE 浓度的变化而变化,浓度过低,补偿热量高;而过量的QE 可能会结合相邻的纳米颗粒,促进架桥絮凝和结构变形,从而进一步降低复合物的稳定性;当浓度适宜时,结合的复合物具有良好的稳定性。

图4 复合物的结合比例Fig.4 Binding ratio of composites
2.1.5 共价、非共价交联对复合物热降解特性的影响
利用热重技术可研究复合物的热降解特征,实验结果见图5。 由5(a)可知,随着温度的升高,各物质的质量都呈现下降的趋势。 由图5(b)可知,COGQ 与NOGQ 在100 ℃左右出现第一个明显的失重峰,可能是由于样品失去表层水分,同时失去结合水,造成质量略有下降;第二降解阶段集中在200 ~300 ℃,这一时期失重加快,由于原料中的化学结构发生降解,羰基和C—H 键断裂,发生高分子降解,析出挥发物而导致质量下降[27];第三个热降解阶段是300 ℃,这一阶段是由于原料发生了碳化而导致质量下降[28],因此COGQ 与NOGQ 在300 ℃以下不易降解。
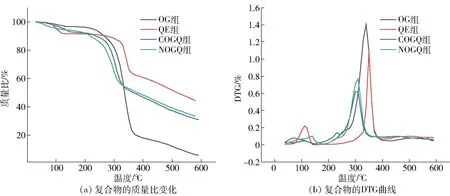
图5 复合物的热降解特性曲线Fig.5 Thermal degradation characteristic curve of composites
2.1.6 共价、非共价交联对复合物微观结构的影响
扫描电子显微镜是观察物体微观结构最直接的手段,通过放大300、500、900 倍,可以清楚地观察到样品呈现出的表面结构(图6)。 由图6 可见:OG 组物质较为分散,菱角锋利,大小不一,呈分散的颗粒状;QE 组物质结合疏松,呈丝状或线条状;COGQ 组物质结构较为致密,呈光滑卷曲状;NOGQ 组物质较为平整,连接紧密,呈凹凸状。 COGQ、NOGQ 在包埋QE 之后,与可溶性OG 相比,复合物结构更为致密,推测可能是因为复合物经过化学键的连接,分子间作用力增强而呈现。复合物组表面不规则的形状和粗糙度可能是因为样品在冻干时用极少量的水溶解后,没有被很好地水化而直接吸附在样品台,导致呈聚集状。

图6 各组样品的微观结构Fig.6 Microstructure of each group of samples
2.2 COGQ、NOGQ 对线虫衰老的影响
2.2.1 复合物对线虫寿命与氧化应激的影响
为研究复合物对线虫寿命的影响,将OG、QE、COGQ、NOGQ 喂食线虫后,观察线虫存活时间,实验结果见表1。 由表1 可知,COGQ 组与NOGQ 组较空白组寿命有所延长。 NOGQ 组线虫平均寿命为(17.70 ±1.63)d(P<0.05),最长寿命为(27.33 ±0.85)d(P<0.01),其中最长寿命比空白组延长17.95%,表明复合物能有效延长线虫寿命。

表1 复合物对线虫寿命的影响Tab.1 Effect of composites on lifespan of C. elegans
氧化应激可反映线虫清除氧化自由基,维持自由基和氧化应激系统动态平衡的能力,实验结果见表2。 由表2 可知,COGQ 组与NOGQ 组的线虫较空白组寿命有所延长。 NOGQ 组线虫平均寿命为(3.76 ±0.35)h(P<0.05), 最 长 寿 命 为(4.72 ±0.40)h(P<0.01),其中最长寿命比空白组延长12.23%,表明复合物在氧化应激方面有良好的效果。 由于多糖与多酚交联后,多糖包埋多酚,可能会降低多酚的抗氧化潜能,因此表2 中出现复合物延长寿命效果低于多酚的现象。

表2 复合物对线虫氧化应激的影响Tab.2 Effects of composites on oxidative stress of C. elegans
复合物延长线虫寿命还可能与胰岛素-1 信号通路有关[29],此信号通路是调节生物个体衰老最重要的信号通路之一。daf-16 基因在线虫中属于胰岛素信号通路中的关键基因,在人类身上可以找到其所在信号通路的同源基因。 目前已有大量文献报道,通过提供特定的营养素可调控daf-16 基因,延缓寿命[30-32]。
2.2.2 复合物对线虫体内SOD 和CAT 酶活性的影响
机体内自由基的过多积累会破坏细胞结构进而导致细胞衰老甚至死亡。 SOD 是目前已知的唯一能直接清除超氧自由基的专一酶,CAT 也是分解H2O2的专用酶。 提高SOD 和CAT 的活性可以清除体内多余的自由基,并可潜在地延长寿命[33-34]。图7 显示了复合物对线虫体内SOD 和CAT 酶活的影响,由图7 可知,与空白组相比,NOGQ 组SOD 酶活极显著提高(P<0.01),COGQ 组CAT 酶活极显著提高(P<0.01)。 由于多糖与多酚的相互作用对多酚清除自由基、提高SOD 与CAT 酶活有掩蔽作用,因此会降低多酚的抗氧化潜能,出现复合物抗氧化效果低于多酚的现象[35]。 研究结果表明,复合物可提高机体抗氧化酶活性,同时也就具有抑制及清除自由基的作用,这与氧化应激实验的结果一致。

图7 复合物对线虫体内SOD 和CAT 活性的影响Fig.7 Effect of composites on SOD and CAT activity of C. elegans
3 结论与展望
本研究采用氢键、范德华力吸附制备NOGQ,利用自由基移植催化反应制备COGQ,表征复合物的化学性质并利用秀丽隐杆线虫评价复合物延缓衰老的作用。 实验发现,复合物经过交联后相对分子质量较OG 变化不大,呈非晶无定型状态,在300 ℃以下稳定,微观结构致密。 复合物能提高线虫的平均寿命和最长寿命,能有效提高机体抗氧化应激能力及抗氧化酶的活性。 研究结果旨在为糖酚复合物制备及新型食品抗氧化剂的开发提供参考。 本研究初步探索了糖酚复合物的抗衰老活性,今后可研究不同结合度、不同侧链、不同类型的糖苷键复合物,进一步探索其结构与活性的关系。
