北京地区酱香型白酒第六轮次堆积发酵中细菌群落多样性分析
2022-07-02李微微李秀婷王红安华孙宝国张成楠
王 源 李微微 李秀婷 王红安 朱 华孙宝国 张成楠 许 狂
(1.北京工商大学 食品营养与人类健康高精尖创新中心, 北京 100048;2.北京工商大学 食品与健康学院, 北京 100048;3.北京华都酿酒食品有限责任公司, 北京 102212)
中国传统酱香型白酒的生产为典型的多菌种、开放式固态发酵过程,由于酿造环境的影响,酱酒产品呈现出显著的地域特点[1-2]。 酱香型白酒产区主要包括贵州、四川、山东、辽宁、北京等省市,其中贵州省是酱香型白酒的聚集产区,产品风格主体为“酱香、窖底香、醇甜香”[3]。 研究发现,相较于贵州、四川等南方产区的酱香型白酒,在山东、辽宁等北方产区生产的酱香型白酒的风味物质有所不同。韩兴林等[4]在北方地区采用相同的酿造工艺生产酱香型白酒,与南方产区酱酒相比,酒中的正丙醇、异戊醇、己酸乙酯等风味物质含量较高,而四甲基吡嗪等物质显著减少。 许多研究已证实,酱香型白酒的风味物质主要是在酿造过程中由微生物代谢产生,而环境微生物菌群种类及其丰度的差异显著影响酱香型白酒的风味[1]。 贵州省等南方酱酒产区属亚热带湿润季风气候,雨量充沛、全年气温变化小,环境微生物较丰富,而北京、山东等地气候属暖温带季风气候,雨量集中,全年气温变化大,环境微生物相对单一[5]。 分析不同地区酱香型白酒酿造过程中环境微生物的功能差异,对了解其不同产区酒的品质特征差异具有重要的意义。
高温堆积发酵是酱香型白酒酿造过程的核心工艺,也是富集环境微生物的重要步骤之一[1,4]。 高温堆积发酵是使经过蒸煮、摊晾、拌曲后的酒醅堆积在酿酒场地中4 ~5 d,待堆子温度、香味等理化感官指标适宜后,便可将堆积后的酒醅移入窖池中,进行密闭的入窖发酵[5]。 在高温堆积发酵过程中,由于堆子各位点的温度、水分和氧气含量等理化条件的不同,导致堆子各位点的微生物群落结构存在明显差异,从而对酒的产量和质量产生一定影响。 在实际生产中,常常采用“倒堆”的方法,即翻倒、移动堆子,减少堆子各位点的理化条件的差异,提高堆底、堆心等部位的氧气含量,促使堆子温度等条件快速达标[6]。 高温堆积发酵的主要目的是富集环境中的微生物,同时筛选、培养优势微生物,使其产生大量的风味物质或风味前体物质,为随后的入窖发酵奠定基础[7]。
目前,较多研究发现,不同地区的酱香型白酒高温堆积发酵过程中微生物的结构存在明显差异,由于细菌群落结构的变化与演替对于酱酒生产品质十分关键,引起许多研究者的高度关注。 针对酱酒聚集产区高温堆积发酵细菌的相关报道较多:王琳等[8]对茅台镇一带多个酱香型白酒厂房的各个轮次酿造环境进行实验分析,发现其优势细菌门为变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)和放线菌门(Actinobacteria);胡小霞等[9]对赤水河畔酱香型白酒第一轮次堆积中的细菌群落结构进行研究,发现其优势细菌门为Firmicutes;而Dai 等[10]对贵州某酒企不同轮次堆积过程进行探讨,确定其优势细菌门为Firmicutes 和Proteobacteria。 对于北方地区酱香型白酒高温堆积微生物的研究报道较少,仅有韩兴林等[11]研究了山东青州地区酱香白酒堆积中的原核微生物,优势菌属包括Proteobacteria 菌门的不动杆菌属(Acinetobacter)、Firmicutes 菌门的魏斯氏菌属(Weissella)等12 种。
北京地区酱香型白酒的高温堆积相关研究鲜有报道,不仅发酵过程中不同阶段微生物的群落结构变化不清楚,微生物间的相互作用关系亦不明晰。基于此,本研究拟采用高通量测序技术[12-13],对北京地区酱香型白酒第六轮次高温堆积发酵过程中细菌群落结构、演替规律和相互作用关系进行动态分析,希望通过探讨北京地区酱香型白酒第六轮次堆积生产过程中微生物变化的特点,为科学揭示北京地区酱香型白酒酿造过程微生物特征提供基础数据,也为进一步研究酱香型白酒风味地域性差异的内在机制提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 样品来源
酒醅样品采自北京华都酿酒食品有限公司。 对第六轮次堆积发酵的酒醅进行采样,从堆子成型开始记为0 h,堆积发酵总计持续84 h,在64 ~66 h 对堆积的酒醅进行“倒堆”操作。 分别在堆积发酵的不同时间点(0、24、48、66、72、78、84 h)的堆子上、中、下三层进行取样,每层的取样位置固定,取样后储存于-80 ℃待用。
1.1.2 实验试剂
E.Z. N. A®Soil DNA Kit,美国Omega Bio-Tek公司;rTaq DNA 聚合酶试剂盒,北京全式金生物技术有限公司;DNA Marker,宝生物工程(大连)有限公司;引物合成,上海生物工程股份有限公司; Gengreen 染料,上海赛百盛有限公司。
1.2 仪器与设备
Thermal Cycler 型梯度PCR 仪,美国Bio-Rad 公司;Zealway G154DW 型高压蒸汽灭菌锅,致徽(厦门)仪器有限公司;台式高速冷冻离心机,德国Sigma 公司;DYY-8C 型电泳仪,北京六一仪器厂;JS-680C 型凝胶成像仪,上海培清科技有限公司。
1.3 实验方法
1.3.1 样品总DNA 提取
取酒醅样品10 g 于50 mL 离心管中,加入30 mL灭菌后的0.1 mol/L 磷酸缓冲盐溶液(PBS)悬浮,加入5 ~7 颗玻璃珠,充分振荡7 min,400 r/min 离心5 min,吸取上清液。 将沉淀用PBS 洗涤,漩涡振荡4 min,400 r/min 离心5 min,收集上清液,重复用PBS 洗涤,直至得到40 ~50 mL 上清液。 将所得液体进行12000 r/min 离心5 min,弃上清液,收集沉淀。 总DNA 提取步骤参照E.Z.N.A®Soil DNA Kit操作说明。
1.3.2 PCR 扩增
采用16S rRNA 通用引物338F (5′-ACTCCTACGGGAGGCAGCAG-3′) 和806R (5′-GGACTA CHVGGGTWTCTAAT-3′)扩增细菌16S rRNA 高变区V3 -V4。
PCR 条件为:95 ℃预变性3 min;95 ℃变性30 s;55 ℃退火30 s;72 ℃延伸45 s;30 次循环;72 ℃终延伸10 min,之后降至4 ℃。
PCR 扩增体系包括:5 ×TransStart FastPfu buffer 4 μL,2.5 mmol/L dNTPs 2 μL,正向引物(5 μmol/L)0.8 μL,反向引物(5 μmol/L) 0.8 μL,TransStart FastPfu DNA 聚合酶0.4 μL,模板DNA 10 ng,用ddH2O 补至20 μL。
1.3.3 Illumina Miseq 测序
用质量分数为2%的琼脂糖凝胶回收PCR 产物,利用AxyPrepDNA Gel Extraction Kit 进行纯化,Tris-HCl 洗脱,再用质量分数为2%的琼脂糖凝胶进行电泳检测。 利用QuantiFluorTM-ST 进行检测定量。将纯化后的扩增片段在Illumina MiSeq 平台上构建文库,并进行测序,分别对细菌V3 -V4 高变区序列进行测序分析。
1.4 数据处理
应用Fastp 软件对原始测序序列进行质控,使用Usearch 软件,在97%的相似性阈值水平下,对基因序列进行OTU 聚类分析。 利用RDP Classifer 进行分类学注释分析。 Alpha 多样性指数、优势细菌属的相对丰度均采用单因素方差分析(one way analysis of variance,one way ANOVA)结合最小显著性差异法(least-significant difference,LSD),分析不同堆积发酵时长样品间的差异显著性(P<0.05)。通过Unweighted Unifrac 算法计算不同样品间的距离,形成Beta 多样性计算矩阵,并利用主坐标分析(principal co-ordinates analysis,PCoA)进行可视化展示。 利用Origin 2019b 软件进行图形绘制。
2 结果与分析
2.1 Alpha 多样性分析
为探究北京地区酱香型白酒第六轮次堆积发酵过程中细菌群落结构的动态变化,对21 个酒醅样品中原核微生物16S rRNA 基因的V3 -V4 可变区进行序列分析[14-15],获得了1821920 个有效基因序列。 OTU 聚类分析结果表明,堆积发酵样品的基因序列聚类成730 个OTU。 基于OTU 聚类分析结果,对不同堆积时间的样品进行Alpha 多样性分析,计算Chao 1 指数和Shannon 指数,用以反映酒醅样品中细菌群落的丰富度和多样性[16]。 Chao1 指数反映酒醅样品中细菌群落的丰富度,Chao1 数值越大代表样品中的物种数量越多;Shannon 指数反映酒醅样品中细菌群落的多样性,Shannon 指数的数值越小代表样品中的细菌群落丰度的均匀性越差。Alpha 多样性分析结果见图1。
图1(a)和图1(c)表明,所有酒醅样品基于Chao1 指数和Shannon 指数的稀释曲线均逐渐趋向平缓,说明对酒醅中微生物的多样性分析已覆盖样品中的主要细菌种类[17]。 由图1(b)可知,随第六轮次堆积发酵时间的延长,酒醅样品的Chao1 指数除66 h 外均无显著性差异,表明第六轮次堆积发酵过程中酒醅样品中细菌种类的数量总体上无明显差异;堆积发酵时间达到66 h 时,酒醅样品的Chao1指数显著升高,这主要归因于在64 ~66 h 进行的“倒堆”操作,富集酿造环境中的微生物,从而增加了酒醅中细菌种类的数量。 由图1(d)可知,第六轮次堆积发酵0 h 时,酒醅样品中细菌的Shannon 指数最高,说明此时细菌群落丰度的均匀性最好;随堆积发酵时间的增加,Shannon 指数逐渐缓慢下降,在堆积结束的84 h 处显著降低,说明细菌群落丰度的均匀性在堆积过程中呈下降趋势。 在第六轮次堆积发酵过程中,细菌物种数量相对稳定,然而群落丰度出现了不均匀的发展趋势。 胡小霞等[9]研究了贵州产区酱香型白酒第一轮次堆积发酵过程中的细菌群落结构,发现Shannon 指数随时间呈下降趋势,与本研究结果相似。 这显示出随着发酵的进行,较高的堆积温度促使酒醅中的微生物进一步自然筛选,推动优势微生物群落的生长,为随后入窖发酵提供特有的微生物基础。 戴奕杰等[18]研究发现,贵州产区的酱香型白酒第六轮次堆积发酵结束时,酒醅样品中细菌群落的Shannon 指数为3.41,高于本研究的2.56(84 h);Chao1 指数为348.91,高于本研究的326.49(84 h)。 这表明了相较于贵州产区,北京地区酱香型白酒第六轮次堆积发酵结束时细菌群落的种类数量较少且均匀性较差。

图1 北京地区酱香型白酒第六轮次堆积发酵过程中细菌群落的Alpha 多样性分析Fig.1 Alpha diversity analysis of bacterial community in the sixth heap fermentation process of sauce-flavor Baijiu produced in Beijing
2.2 细菌群落组成分析
为了探寻第六轮次堆积发酵过程中细菌多样性变化的原因,本研究进一步分析了第六轮次堆积发酵过程中不同堆积发酵时长的酒醅样品在门水平上的细菌群落结构差异,分析结果如图2。
第六轮次堆积发酵样品中所检出的细菌群落归属于8 个门。 将相对丰度大于1%的细菌门定义为优势细菌门,由图2 可知,样品中的Firmicutes、Actinobacteria 和Proteobacteria 为优势菌门。 其中,Firmicutes 相对丰度最高,为89.34%(24 h) ~96.15%(72 h)。 王欢等[19]分析了贵州省产区酱香型白酒第六轮次堆积发酵中细菌群落组成,发现第六轮次的优势菌门为Firmicutes、 Actinobacteria 和Proteobacteria,其中Firmicutes 相对丰度为75%左右。戴奕杰等[18]研究了同样来源于贵州省产区的酱香型白酒,发现在第六轮次堆积发酵中优势细菌门包括Firmicutes、Actinobacteria、Proteobacteria 和Bacteroidetes 等,其中Firmicutes 相对丰度约42%,Proteobacteria 相对丰度约46%。 由此可见,北京地区酱香型白酒第六轮次堆积发酵过程中相对丰度占优势的菌门与其他产区相同,但Firmicutes 的相对丰度较高,而Proteobacteria 的相对丰度较少。
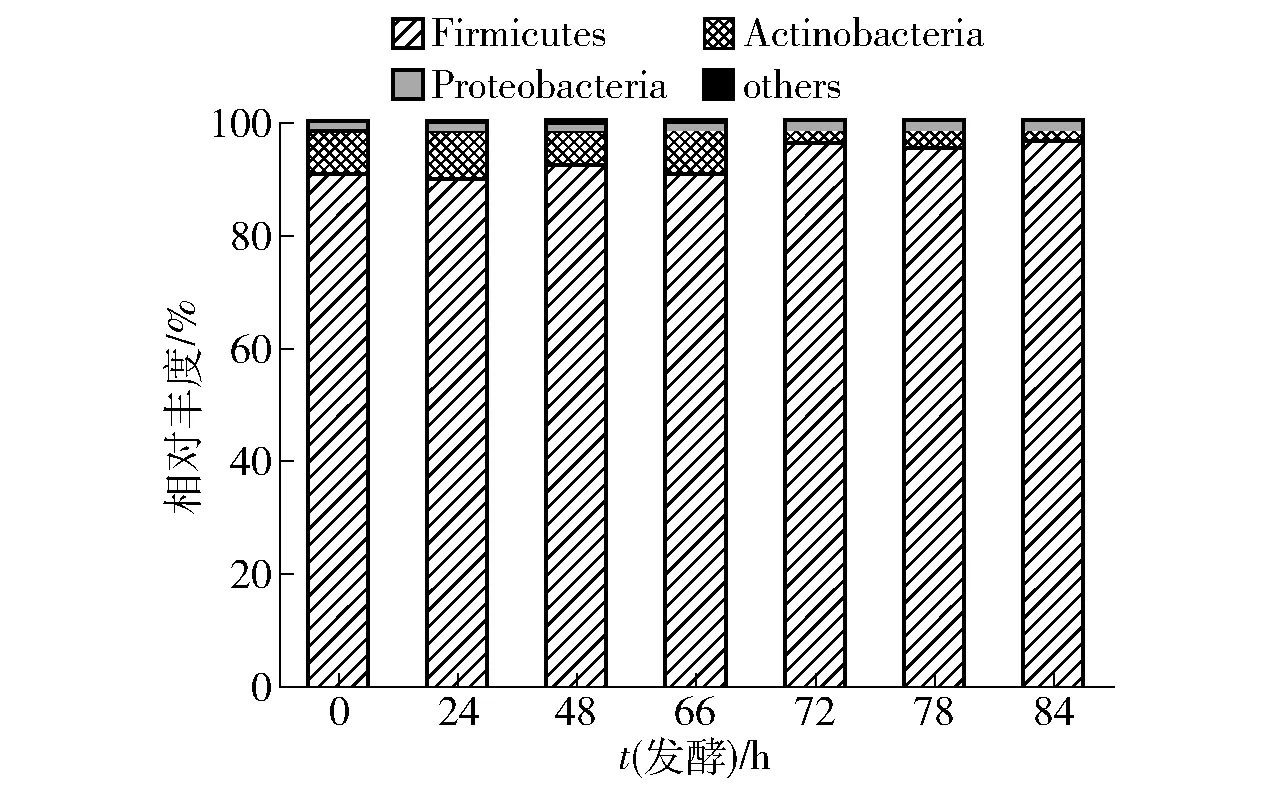
图2 北京地区酱香型白酒第六轮次堆积发酵过程中细菌在门水平上的群落组成Fig.2 Bacterial community structure at phylum level in the sixth heap fermentation process of sauce-flavor Baijiu produced in Beijing
在属水平上,第六轮次堆积发酵样品中所检出的细菌群落归属于362 个属(图3)。 各个堆积发酵时间共有及各自独有的菌属数量如图3(a),堆积发酵过程中细菌在属水平上的群落组成如图3(b)。
由图3(a)可知,7 个堆积发酵时间点的酒醅样品中共有的细菌属为106 个。 将相对丰度大于1%的细菌属定义为优势菌属,由图3(b)可知,样品中优势菌属共有14 个:乳酸杆菌属(Lactobacillus)、慢生芽孢杆菌属(Lentibacillus)、克罗彭斯特菌属(Kroppenstedtia)、海洋芽孢杆菌属(Oceanobacillus)、芽孢杆菌属(Bacillus)、葡萄球菌属(Staphylococcus)、片球菌属(Pediococcus)、糖多孢菌属(Saccharopolyspora)、高温放线菌属(Thermoactinomyces)、norank_f_Sporolactobacillaceae、魏斯氏菌属(Weissella)、norank_f_Actinopolysporaceae、 unclassified_f_Bacillaceae、棒状杆菌属(Corynebacterium_1)。 这些细菌属也是其他产区酱香型白酒堆积发酵过程中的优势菌属[19-25]。
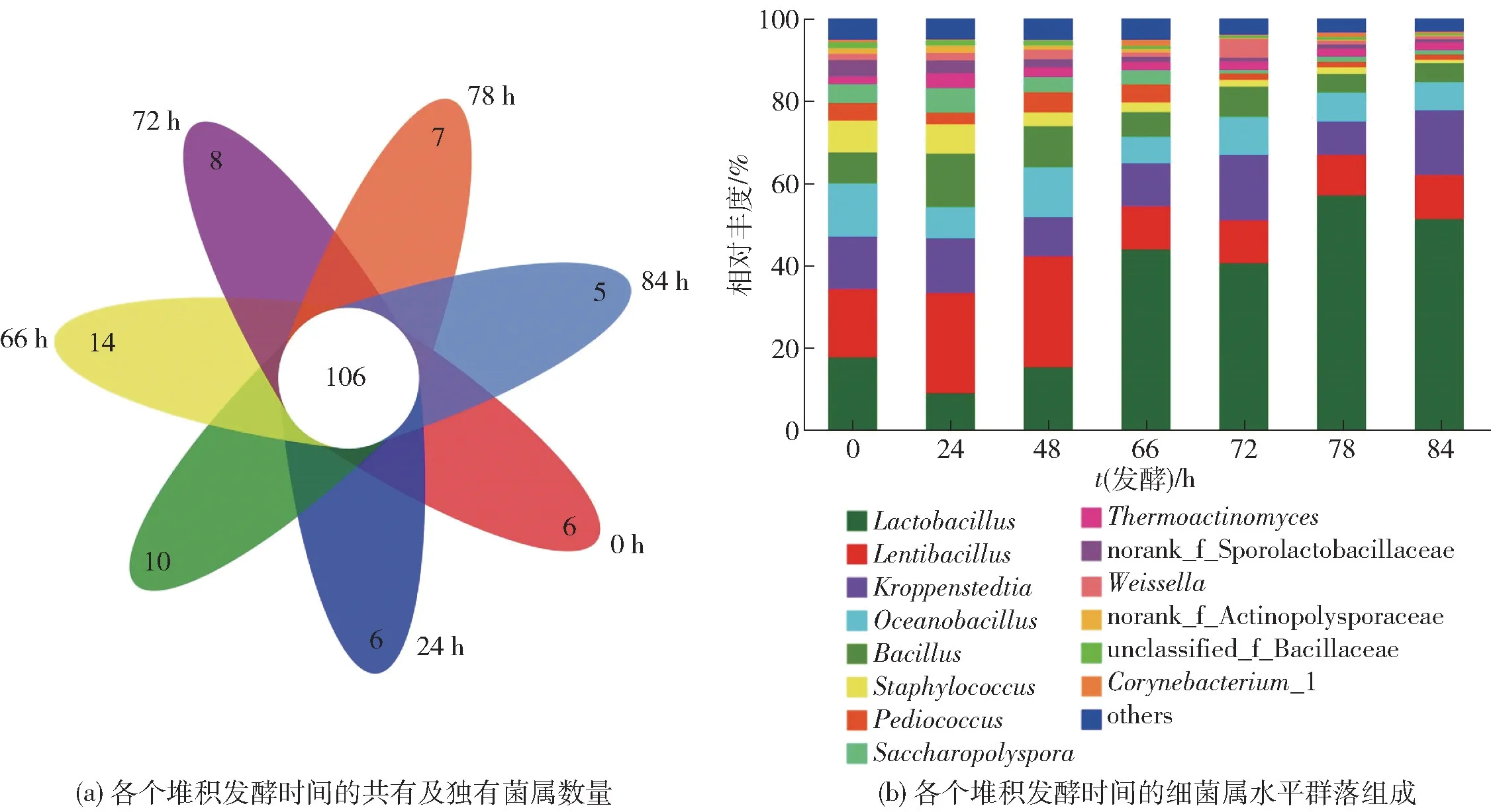
图3 北京地区酱香型白酒第六轮次堆积发酵过程中细菌在属水平上的共有菌属及群落组成Fig.3 Common bacterial genera and community structure at genus level in the sixth heap fermentation process of sauce-flavor Baijiu produced in Beijing
相较于其他产区,北京地区酱香型白酒堆积发酵过程中优势细菌属虽然与其他产区的菌属组成相似,但是相对丰度存在明显差异。 王欢等[19]研究发现,贵州省酱香型白酒第六轮次堆积发酵过程中相对丰度最高的细菌属是Acinetobacter,占全部细菌属的60%;而在北京地区酱香型白酒第六轮次堆积发酵过程中,Acinetobacter的相对丰度不足1%[图3(b)]。研究表明,Acinetobacter在贵州省产区的酿酒环境和大曲中较丰富,在堆积发酵过程中从环境进入酒醅参与酱香型白酒的酿造[20]。戴奕杰等[18]研究发现,贵州省产区酱香型白酒第六轮次堆积发酵过程中埃希氏菌属(Escherichia-Shigella)相对丰度较高,而在北京地区第六轮次堆积发酵中其相对丰度小于1%。Escherichia-Shigella是一种典型的环境微生物,贵州省产区较高的环境温度与空气湿度为其生长提供了良好的生长条件,而北京地区较低的环境温度和湿度可能造成其生长缓慢[21]。
大量文献已报道,酱香型白酒堆积发酵过程中部分优势细菌属的动态变化有明显差异[11,22-23]。对比分析7 个堆积发酵时间点的酒醅样品中细菌群落组成,可以发现,优势细菌属Lentibacillus、Lactobacillus的相对丰度变化趋势存在明显差异,将两菌属单独进行显著性差异分析,结果如图4。 由图4(a)可知,Lentibacillus相对丰度先升高后降低,在堆积发酵开始时(0 h)为16.58%,在发酵48 h 时达到最高值26.99%;“倒堆”操作后,其相对丰度显著下降,在堆积发酵结束时(84 h)为10.70%。Lentibacillus主要来源于大曲,其在酱香型白酒发酵过程中的作用尚不清楚[20]。 由图4(b)可知,Lactobacillus相对丰度总体呈上升趋势,在“倒堆”操作前(0 ~48 h),其相对丰度占比为8.99% ~17.75%;在“倒堆”操作后(66 ~84 h),其相对丰度显著升高,为40.58%(72 h) ~57.04%(78 h)。 Zhang 等[24]研究发现,堆积发酵过程中酒醅的温度不同可以影响Lactobacillus的生长代谢,进而影响整体的细菌群落结构及演替规律。Lentibacillus、Lactobacillus相对丰度的变化直接导致了酒醅样品中细菌群落丰度均匀性的变化,而这可能主要归因于堆积发酵过程中温度等环境条件的改变。 在贵州省等酱香型白酒的主要产区,遇到环境气温较低的月份,堆子容易出现升温不正常或不升温的现象,因此常采用“倒堆”操作,从而有效平衡堆子内温度、酸度、氧气浓度等环境条件,改善堆积发酵状况[6];北京地区酱香型白酒第六轮次堆积发酵在10月份,此时环境气温较低,堆子升温缓慢,因此同样采用“倒堆”操作以起到促使堆子升温和均衡位点的作用。
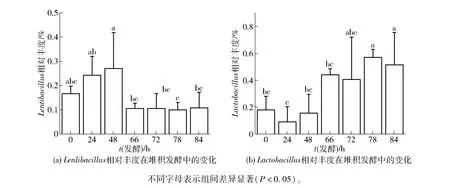
图4 北京地区酱香型白酒第六轮次堆积发酵过程中Lentibacillus 和Lactobacillus 的相对丰度变化Fig.4 Changes in relative abundance of Lentibacillus and Lactobacillus in the sixth heap fermentation process of sauce-flavor Baijiu produced in Beijing
北京地区与其他酱香型白酒产区酿酒环境条件和堆积发酵工艺的不同,共同造成了各地堆积发酵过程中优势细菌属演替变化的差异。
2.3 相关性网络分析
为进一步探究北京地区酱香型白酒第六轮次堆积发酵过程中细菌群落结构的动态变化规律,聚焦堆积发酵过程中相对丰度较高的细菌属,分别计算两两细菌属间的Spearman 相关系数,绘制相关性网络图,见图5。 由图5 可知,第六轮次堆积发酵的相关性网络图包含44 个细菌属间的正相关关系,17个负相关关系。 相关性分析表明,大多数细菌属之间呈正相关调节机制。
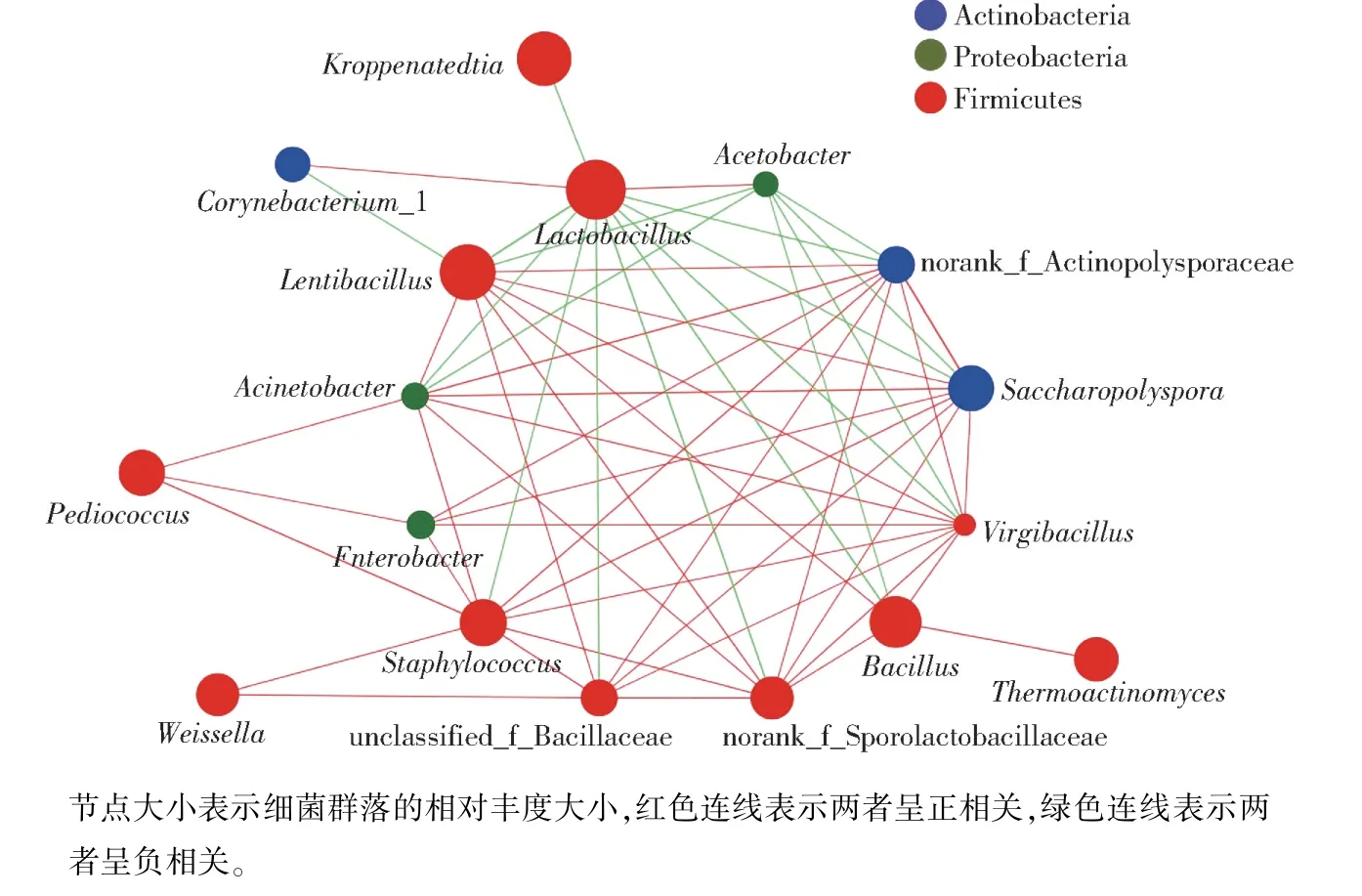
图5 北京地区酱香型白酒第六轮次堆积发酵过程中细菌群落相关性网络Fig.5 Correlation network of bacterial communities in the sixth heap fermentation process of sauce-flavor Baijiu produced in Beijing
相关性网络图中的高相关性关键节点是指与一定数量的其他微生物均有相关性的微生物[9],又称hubs,其数量和种类可在一定程度上反映微环境中微生物群落结构的稳定性[25]。 在图5 中,共发现17个hubs,其中,相对丰度较高的Lactobacillus和Lentibacillus菌属(图4),在相关性网络图中与多个菌属存在负相关性关系;Lactobacillus作为核心负相关性hubs 之一,与10 个细菌属间存在负相关关系,表明Lactobacillus对部分细菌属有显著的抑制作用,这一结果与胡小霞等[9]、Wang 等[23]和Wang 等[26]的研究结果相似。 在堆积发酵过程中,Lactobacillus通过代谢可发酵性糖产生大量乳酸、乙酸等酸性物质,显著降低酒醅的pH 值,进而抑制不耐酸微生物的生长[23]。 这可能是Lactobacillus在“倒堆”操作后相对丰度显著升高的原因之一。 由图5 还可发现,Lentibacillus作为核心正相关性hubs 之一,与7 个细菌属呈正相关关系,这可能是Lentibacillus在“倒堆”操作前相对丰度较高的原因之一,其内在机理有待进一步研究。 另外,Staphylococcus与Saccharopolyspora作为核心正相关性hubs,分别与9 个、8 个细菌属间存在正相关关系。 这些微生物间的相互作用关系构成了发酵过程中的生物学调控机制,维持了整个发酵体系的自然稳态发展和动态平衡[9]。
2.4 Beta 多样性分析
北京地区酱香型白酒第六轮次堆积发酵过程中,样品细菌群落的Beta 多样性分析结果如图6。

图6 北京地区酱香型白酒第六轮次堆积发酵过程中细菌群落的Beta 多样性分析Fig.6 Beta diversity analysis of bacterial community in the sixth heap fermentation process of sauce-flavor Baijiu produced in Beijing
由图6 发现,“倒堆”操作后(66、72、78、84 h)相较于“倒堆”操作前(0、24、48 h)细菌群落结构具有显著的差异。 优势菌属Lentibacillus和Lactobacillus在倒堆前后的变化最为明显[图4(a)和图4(b)],Lentibacillus从“倒堆”前的26.99%(48 h)下降到19.51%(66 h);Lactobacillus从“倒堆”前的15.31%(48 h)上升到了43.91%(66 h);。 随着堆积发酵时间的延长,堆子不同位置的温度、酸度和氧气浓度等出现明显差异,通过“倒堆”操作可以有效平衡这些环境条件的差异,促进优势菌群的演替[6]。 袁再顺[27]研究发现,贵州省产区酱香型白酒在“倒堆”前后细菌群落结构无明显变化,与本研究结论相反,这可能与具体操作工艺差异有关,具体原因有待进一步比较研究。
3 结论
本研究利用高通量测序方法分析了北京地区酱香型白酒第六轮次堆积发酵过程中细菌群落结构及动态变化。 研究结果表明:
1)在细菌菌群种类数量上,堆积发酵前后无明显变化,相较于其他产区,北京地区酱香型白酒第六轮次堆积发酵结束时细菌菌群种类数量较少;
2)堆积发酵过程中的优势细菌门按相对丰度从 高 到 低 排 序 为Firmicutes、 Actinobacteria、 Proteobacteria,相较于其他产区,北京地区酱香型白酒第六轮次堆积发酵过程中Firmicutes 相对丰度较高,占绝对优势,而Proteobacteria 的相对丰度较少;
3)堆积发酵过程中共有14 个优势菌属,其中,优势菌属Lactobacillus相对丰度从17.75%(0 h)上升至51.31% (84 h),Lentibacillus相对丰度从16.58%(0 h)下降至10.70%(84 h),相较于其他产区,北京地区酱香型白酒第六轮次堆积发酵过程中Acinetobacter等相对丰度较低。
希望本研究可为了解北京地区酱香型白酒酿造过程中细菌群落演替提供数据支撑,为探究不同产区白酒酿造的特征差异提供科学基础。
