不同摄入量小米对小鼠肠道菌群和短链脂肪酸的影响
2022-07-02陈博睿付永霞侯殿志王显瑞
陈博睿 付永霞 侯殿志 王 晗 薛 勇 王显瑞 沈 群
(1.中国农业大学 食品科学与营养工程学院/国家粮食产业(青稞深加工)技术创新中心/植物蛋白与谷物加工北京市重点实验室/国家果蔬加工工程技术研究中心, 北京 100083;2.赤峰市农牧业科学院, 内蒙古 赤峰 024029)
近年来,杂粮因其良好的健康功效受到广泛关注。 目前关于杂粮的研究多集中在对肥胖、糖尿病等慢性疾病的缓解作用方面,如许阳等[1]用不同添加量的燕麦饲料喂养肥胖小鼠,发现20%摄入量的燕麦降血脂效果最好;陈新宇等[2]用不同添加量的小米饲料干预高血脂小鼠,发现40%摄入量的小米降体重的效果最好。 尽管《中国居民膳食指南(2021)》中推荐每日摄入一定量谷薯类食物,但针对杂粮摄入量还未有统一的标准。 小米是我国产量最高的杂粮之一,许多研究已经表明小米有良好的健康功效[3],但小米存在蛋白质消化率低、抗营养因子含量高等问题[4],高摄入量的小米可能会对正常小鼠的健康产生负面作用,所以有必要评价不同小米摄入量对机体的影响。
肠道菌群被称为人类的“第二基因组”,影响着宿主的营养吸收和能量平衡,是目前研究人类健康的热点。 饮食是影响肠道菌群的关键因素,不同的饮食模式对应着不同的肠道菌群结构[5]。 不同杂粮摄入量与肠道菌群之间的关系尚缺乏研究,尤其是高摄入量下肠道菌群的变化。 此外,小米中富含抗性淀粉等膳食纤维[6],能够被肠道菌群利用产生短链脂肪酸[7](short-chain fatty acids, SCFAs),而目前小米摄入量与肠道短链脂肪酸水平之间的关系还不明确。 本研究拟用小米添加量为20%、40%、60%、80%的饲料喂养3 周龄初断乳的C57BL/6J小鼠,采用自动血生化分析仪、16S rRNA 高通量基因测序和气相色谱-质谱联用技术,探究饲喂不同添加量的小米对小鼠生长发育、肠道菌群和短链脂肪酸的影响,希望为阐明杂粮摄入量与肠道菌群以及机体健康之间的关系提供一定理论依据。
1 材料与方法
1.1 实验动物、材料及试剂
3 周龄雄性C57BL/6J 小鼠60 只(初始体重11 ~15 g),购于北京斯贝福实验动物科技有限公司;小米(“东方亮”),购于山西东方物华农业科技有限责任公司;AIN-93G 纯化饲料及小米特种饲料,购于北京译成科技有限公司。 硫酸(优级纯),西陇科学股份有限公司;无水乙醚(分析纯),天津富宇精细化工有限公司;环己酮(分析纯),上海国药化学试剂有限公司;甲醇、乙腈、甲酸、丙醇(色谱纯),德国Fisher 公司。 乙酸、丙酸、丁酸、异丁酸、戊酸、异戊酸和己酸标准品(质量分数>99%),德国Dr. Ehrenstorfer 公司。
1.2 仪器与设备
Miseq PE300 型DNA 测序分析仪,美国Illumina公司;QP2010-Ultra 型气相色谱质谱联用仪,日本岛津有限公司;3100 型自动血生化分析仪,日本日立公司;Centrifuge 5430R 型高速冷冻离心机,德国Eppendorf 公司;Eclipse E100 型显微镜,日本Nikon公司;Wonbio-96c 型高通量组织破碎仪,上海万柏生物科技有限公司;SBL-10TD 型超声波清洗机,宁波新芝生物科技股份有限公司;XH-C 型旋涡混合器,常州越新仪器制造有限公司;JXDC-20 型氮气吹扫仪,上海净信实业发展有限公司;LNG-T88 型快速离心浓缩干燥器,江苏太仓华美生化仪器厂。
1.3 实验方法
1.3.1 动物实验设计及分组
小米经碾米后用磨粉机打粉(不过筛)得到小米粉,将小米粉与超纯水按质量比1∶1混合蒸熟,在40 ℃烘箱烘干后再磨粉得到熟化小米粉,其基本营养成分见表1。 蛋白质根据GB 5009.5—2016 测定,脂肪根据GB 5009.6—2016 测定,膳食纤维根据GB 5009.88—2014 测定,灰分根据GB 5009.4—2016 测定,水分根据GB 5009.3—2016 测定,碳水化合物利用差减法计算。

表1 小米的基本营养成分Tab.1 Basic nutrients of foxtail millet %
小米干预组的饲料与对照组的纯化饲料营养素保持一致。 为了保证营养素的平衡,添加20%、40%、60%、80%小米粉后,相应减少纯化饲料中玉米淀粉、酪蛋白、麦芽糊精、大豆油、蔗糖的含量,进行配比加工,得到不同添加量的小米组:M20、M40、M60 和M80,饲料配方和能量密度见表2。

表2 饲料配方Tab.2 Feed formula
动物在SPF 级动物房中饲养,饲养条件严格按照《实验动物管理条件》进行,实验方案得到中国农业大学实验动物福利与动物实验伦理审查委员会的批准,批准编号为AW71302202-5-2。 所有小鼠用纯化饲料适应性饲养1 周后,按体重随机分成5 组,每组12 只。 对照组(NC)继续用纯化饲料喂养,其余4 组分别用小米质量分数为20% (M20)、40%(M40)、60%(M60)、80%(M80)的饲料喂养。 饲养期间小鼠自由进食和饮水,每周称重、记录摄食量一次,共饲养12 周。 饲养结束后,对所有小鼠实施安乐死,解剖后收集小鼠的血液、肝脏、回肠、结肠等组织进行后续分析检测。
1.3.2 生化指标检测
语言是教师提问活动的主要交流载体,因此,教师应善于组织自己的提问用语,尽量做到语句简洁明确,明确问题的中心,为学生指出清晰的关注点,强调问题的核心内容。同时,教师的表达还要做到通俗易懂,且具有趣味性。诙谐幽默的课堂提问方式可以有效提高教师的亲和力,激发学生对问题的回答欲望,通俗易懂的语言也便于学生理解。在教学中,要将学生视为教学主体去进行提问,一方面缓解了学生对问题的思考难度,另一方面也将枯燥的语文课堂变得轻松快乐起来。
将采集的小鼠血液离心(3000 r/min、15 min、4 ℃)后获得上清液即血清,使用自动血生化分析仪测定小鼠血清中的总甘油三酯(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、天冬氨酸转氨酶(AST)含量,上样量100 μL。
1.3.3 病理切片分析
将回肠、结肠用质量分数为4%的多聚甲醛固定48 h 后,清洗组织中的残留固定液,用体积分数为75% ~100%的酒精梯度脱去组织水分,放入二甲苯透明,而后在石蜡中包埋。 将包埋好的组织在切片机上制成5 μm 的切片,再用二甲苯脱蜡,100%、95%、85%酒精清洗,蒸馏水复水。 将得到的切片用显微镜镜检,采集图像进行分析。
1.3.4 肠道菌群分析
将小鼠饲养至第12 周,采用无菌操作收集其粪便,置液氮中冷冻,转移至-80 ℃冰箱保存待用。每组选取8 只小鼠(共40 只)粪便样本进行16S rRNA 高通量基因测序,利用Illumina 公司的NovaSeq PE250 平台进行分析。 对样本进行物种注释与评估,在OTU 水平上计算Shannon、Simpson、Shannoneven、Simpsoneven 指数,评估α-多样性,利用PCoA 分析和NMDS 分析评估β-多样性,距离算法为bray-curtis、组间差异检验方法为ANOSIM。 用Kruskal-Wallis 秩和检验分析各组在门、科、属水平上的显著性差异,用fdr 多重检验对检验结果进行校正。
1.3.5 SCFAs 分析
收集小鼠盲肠内容物,迅速用液氮冻存,转移至-80 ℃冰箱保存。 称取10 mg 样品,加入提取液(1 mL水和200 μL 质量分数为50% 的硫酸)、100 μL 1 mg/mL 环己酮和2 mL 乙醚超声萃取20 min,随后在4000 r/min 转速下离心10 min,取上清液用气相色谱-质谱联用仪分析。 色谱条件:Agilent DB - WAX 毛 细 管 柱(30 m × 0.25 mm,0.25 μm);升温程序为40 ℃保持3 min,以30 ℃/min升至210 ℃,保持5 min;载气(He)流速1.0 mL/min,进样量1 μL,不分流进样,溶剂延迟时间3.5 min。 质谱条件:电子轰击(EI)离子源,离子源温度230 ℃,接口温度220 ℃,乙酸、丙酸、丁酸、异丁酸、戊酸、异戊酸和己酸的目标离子m/z设置为60、74、88、73、87、60,以SIM 模式采集数据,采集间隔为0.3 s。
1.4 数据处理
数值以平均值±标准偏差(mean ± SD)表示。用SPSS 22.0 软件进行统计分析,One-way ANOVA分析组间差异显著性(P<0.05 为差异显著),用Graphpad Prism 8.0.1 软件绘图。
2 结果与分析
2.1 不同摄入量小米对小鼠生理指标的影响
以不同添加量小米饲料喂养3 周龄初断乳小鼠12 周,记录了5 组小鼠的体重、进食量、体长、尾长、肝脏质量,实验结果见图1。 如图1(a)至图1(d)所示,不同摄入量小米对小鼠体重、进食量、体长、尾长均没有显著影响。 如图1(e)所示,M20、M40、M60 组的肝脏质量与NC 组相比没有显著差异,但是M80 组小鼠的肝脏质量显著增加(P<0.05)。总体来说,不同摄入量的小米对小鼠的表型没有影响。

图1 不同摄入量小米对小鼠生理指标的影响Fig.1 Effects of different foxtail millet intake on physiological indexes of mice
2.2 不同摄入量小米对小鼠血脂水平的影响
不同摄入量小米对小鼠血脂水平影响的实验结果见图2。 由图2 可知,NC、M20、M40、M60 组的TC、TG、HDL-C、LDL-C 之间没有显著性差异,而M80 组与其余4 组相比,小鼠血清中的TG 没有变化,TC、HDL-C、LDL-C 显著增加(P<0.05),这说明小鼠的胆固醇水平较高,可能出现了脂代谢紊乱。

图2 不同摄入量小米对小鼠血脂水平的影响Fig.2 Effect of different foxtail millet intake on blood lipid level of mice
2.3 不同摄入量小米对小鼠肠道组织结构的影响
在不同添加量小米饲料干预下,对小鼠的结肠、回肠的组织切片进行了H&E 染色病理分析,结果见图3。由图3 可知,各组小鼠的回肠、结肠组织结构致密,黏膜层形态完整,肠绒毛清晰可见,没有受损迹象,说明不同摄入量的小米对小鼠肠道组织形态和黏膜屏障的健康没有影响。
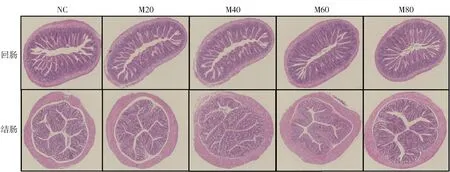
图3 小鼠回肠、结肠组织的H&E 染色结果Fig.3 H&E staining results of mice ileum and colon tissues
2.4 不同摄入量小米对小鼠肠道菌群的影响
2.4.1 肠道菌群多样性分析
对40 只小鼠粪便DNA 的16S rRNA 基因的V3 -V4 可变区测序,共得到了2132967 个有效序列,平均序列读数为53324,按最小样本序列(34185)抽平后的OTU 表进行后续分析。 稀释曲线是以随机抽取的序列数为横坐标,以α-多样性指数值为纵坐标,根据曲线的平缓程度判断测序量是否足够。 以Sobs 指数和Shannon 指数两个α-多样性指数绘制了稀释曲线,结果如图4。 由图4(a)和图4(b)可知,Shannon 指数值和Sobs 指数值随抽取的序列数的增加逐渐趋于平缓,说明本次测序数据量合理,足以代表所有样本的生物学信息。

图4 肠道菌群的稀释性曲线Fig.4 Rarefaction curve of gut microbiota
进一步对小鼠肠道菌群的α-多样性进行分析,结果见图5。 α-多样性是指一个特定区域或者生态系统内的多样性,与Shannon 指数值成正比,与Simpson 指数值成反比。 由图5(a)和图5(b)可知,相比于NC、M20 和M40 组,M80 组的Shannon 指数显著降低(P<0.05),Simpson 指数显著增大(P<0.05),说明80%摄入量的小米使小鼠肠道菌群α-多样性下降,而M60 组的Shannon 指数有下降的趋势,与M80 组之间没有显著性差异。总体来说,过量(80%)的小米摄入导致小鼠肠道菌群多样性下降,而60%摄入量可能是下降的拐点。 肠道菌群的均匀度与Shannoneven 指数和Simpsoneven 指数成正比,由图5(c)和5(d)可知,M60 组和M80 组的Shannoneven 指数和Simpsoneven 指 数 相比 于NC、M20、M40 组 皆 显 著 降 低(P<0.05),这说明60%和80%的摄入量使小鼠肠道菌群均匀度下降。

图5 不同摄入量小米对小鼠肠道菌群α-多样性的影响Fig.5 Effect of different foxtail millet intake on α-diversity of gut microbiota in mice
利用PCoA 分析和NMDS 分析评价肠道菌群OTU 水平上的β-多样性,来探究小鼠在不同摄入量的小米干预下,微生物群落组成之间的差异程度,坐标图上样本点的距离越远,表明样本物种组成结构差异越大,结果如图6。 由图6 可知,与NC 组相比,不同摄入量的小米皆引起了分组椭圆的偏移,说明小米的干预改变了肠道菌群的组成,且摄入量越大,偏移程度越大,尤其是PCoA 分析中的M80,以及NMDS 分析中M60、M80 与NC 组完全分离,没有任何重叠,说明小米对肠道菌群的影响程度随摄入量的增大而增大。
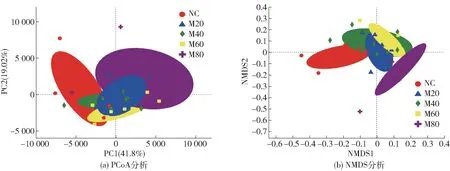
图6 不同摄入量小米对小鼠肠道菌群β-多样性的影响Fig.6 Effect of different foxtail millet intake on β-diversity of gut microbiota in mice
2.4.2 肠道菌群的门、科、属水平分析
2.4.2.1 肠道菌群门水平分析
进一步比较了肠道菌群组成在门、科、属水平上的差异,门水平组成结果见图7。 图7(a)显示了门水平上相对丰度大于1%的菌群,拟杆菌门(Bacteroidota)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteriota)共占据相对丰度的92% 以上。由图7(b)可知,与NC 组相比,M20、M40、M60、M80 组拟杆菌门丰度皆显著升高(P<0.05),厚壁菌门和放线菌门丰度皆显著下降(P<0.05),而且随着小米摄入量的增加,变化趋势越明显,说明小米干预有利于拟杆菌门的生长,不利于厚壁菌门和放线菌门生长。 此外,相比于NC 组的拟杆菌门(29.25%)、 厚 壁 菌 门(46.76%)、 放 线 菌 门(18.64%),M80 组的3 个优势菌门((67.81%、26.82%、1.83%)之间的相对丰度比例出现了明显的失调,这与M80 组肠道菌群多样性和均匀度的下降结果是一致的。

图7 不同摄入量小米对肠道菌群门水平组成的影响Fig.7 Effect of different foxtail millet intake on gut microbiota at phylum level
2.4.2.2 肠道菌群科水平分析
小鼠肠道菌群科水平组成的实验结果见图8。由图8(a)可得,Muribaculaceae 的相对丰度随小米摄入量的增加而提高,尤其是在M80 组出现了极显著的上升(P<0.05),这与拟杆菌门的变化趋势一致。 由图8(c)可得,相比于对照组(NC),乳杆菌科(Lactobacillaceae)和双歧杆菌科(Bifidobacteriaceae)在M20、M40、M60、M80 组都出现了显著下降(P<0.05),颤螺旋菌科(Oscillospiraceae)在M60、M80 组出现了显著下降(P<0.05)。 由图8(b)可得,理研菌科(Rikenellaceae)在M80 组出现了显著下降(P<0.05),拟杆菌科(Bacteroidaceae)在M40、M60、M80组出现了显著下降(P<0.05)。 小鼠肠道菌群科水平上的变化表明了过量(60%、80%)摄入小米不利于小鼠肠道内乳杆菌科、双歧杆菌科、颤螺旋菌科、拟杆菌科和理研菌科的定殖。

图8 不同摄入量小米对小鼠肠道菌群科水平组成的影响Fig.8 Effect of different foxtail millet intake on gut microbiota at famliy level in mice
2.4.2.3 肠道菌群属水平分析
小鼠肠道菌群属水平组成的分析结果见图9。由图9(a)的热图分析可知,norank_f_Muribaculaceae、Ileibacterium、乳酸菌属(Lactobacillus)、双歧杆菌属(Bifidobacterium)和粪杆菌属(Faecalibaculum)是属水平上的优势菌属,且不同小米摄入量对菌群的影响不同。 由图9(b)的组间差异判别分析可知,与NC 组相比,M20 组显著增加了norank_f_Muribaculaceae、另枝菌属(Alistipes)、肠杆菌属(Enterorhabdus)、副拟杆菌属(Parabacteroides)、Romboutsia的相对丰度(P<0.05)。 由图9(c)的组间差异判别分析可知,与M20 组相比,M80 组显著降低了双歧杆菌属、粪杆菌属、另枝菌属、布劳特氏菌属(Blautia)、Colidextribacter、肠杆菌属、副拟杆菌属的相对丰度(P<0.05)。 由图9(d)的组间差异判别分析可知,与M40 组相比,M80 组显著降低了粪杆菌属、Colidextribacter、肠杆菌属、布劳特氏菌属、Parvibacter、副拟杆菌属、罗氏菌属(Roseburia)的相对丰度(P<0.05)。 总体来说,相比于低摄入量(M20、M40)组,过量(M80)小米的摄入不利于小鼠肠道中粪杆菌属、布劳特氏菌属、Colidextribacter、肠杆菌属、副拟杆菌属、罗氏菌属的生长。

图9 不同摄入量小米对小鼠肠道菌群属水平组成的影响Fig.9 Effect of different foxtail millet intake on gut microbiota at genus level
2.5 高低摄入量小米对小鼠SCFAs 的影响
小鼠肠道SCFAs 的分析结果见图10。 由2.4分析结果可知,摄入20%、40% 小米与高摄入量(80%)的小米,小鼠肠道菌群组成结构差异显著,故仅选取M20、M40、M80 组的小鼠肠道短链脂肪酸含量进行分析。 由图10 可知,各组的乙酸、异戊酸、己酸、总短链脂肪酸含量之间无显著性差异,这说明不同摄入量的小米对小鼠肠道中乙酸、异戊酸和己酸3 种短链脂肪酸含量均没有显著影响。 NC、M20、M40 之间的丙酸、丁酸、异丁酸和戊酸含量没有差异,但M80 组的丙酸、丁酸、异丁酸和戊酸含量显著升高(P<0.05),这说明了20%、40%摄入量的小米对小鼠的SCFAs 含量没有显著影响,只有80%摄入量的小米能够升高小鼠肠道中丙酸、丁酸、异丁酸和戊酸的含量。

图10 高低摄入量小米对小鼠肠道SCFAs 的影响Fig.10 Effect of high and low foxtail millet intake on SCFAs of mice
2.6 肠道菌群与SCFAs 相关性分析
短链脂肪酸是肠道菌群的主要代谢物,为了探究M80 组短链脂肪酸升高的原因,明确与短链脂肪酸相关的菌群,对丙酸、丁酸、异丁酸和戊酸4 种显著增加的SCFAs 与肠道菌群丰度属水平前50 名的菌属进行了斯皮尔曼相关性分析,结果如图11。由图11 可知,丙酸的增加与norank_f_Muribaculaceae、普雷沃氏菌科_UCG-001、Romboutsia、瘤胃球菌(Ruminococcus)显著正相关,丁酸的增加与norank_f_Muribaculaceae显著正相关,异丁酸的增加与norank_f_Muribaculaceae、普雷沃氏菌科_UCG-001 显著正相关,戊酸的增加与norank_f_Muribaculaceae、普雷沃氏菌科_UCG-001、Romboutsia、瘤胃球菌呈显著正相关,这表明norank_f_Muribaculaceae、普雷沃氏菌科_UCG-001、Romboutsia和瘤胃球菌可能参与了代谢小米产生短链脂肪酸的过程。
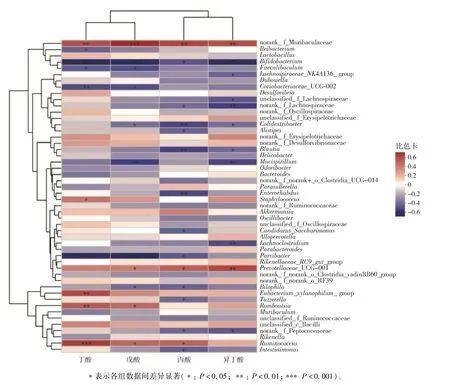
图11 SCFAs 与肠道菌群属水平的相关性分析Fig.11 Correlationship of SCFAs and gut microbiota at genus level
3 讨 论
3.1 不同摄入量的小米对小鼠生长状态的影响
通过对3 周龄初断乳小鼠进行12 周的小米饲料干预,发现不同小米摄入量对小鼠的正常生理状态以及肠道组织病理状态均没有明显的影响;然而,80%小米摄入量使小鼠肝脏质量、血清TC、HDLC、LDL-C 水平显著升高,这可能是因为小米相比于其他谷物油脂、脂肪酸、甾醇含量较高[8],先前的研究发现高脂饮食喂养会使小鼠TC、LDL-C、HDL-C同时升高[9]。 本研究表明,过量(80%)摄入小米可能会使小鼠的血液胆固醇循环水平处于较高的状态,造成脂代谢紊乱。
3.2 不同摄入量的小米对小鼠肠道菌群结构和组成的影响
不同摄入量小米对小鼠肠道菌群组成的影响差别显著。 维持肠道菌群多样性对于宿主健康起着重要作用[10],多样性下降是肠道菌群失调的重要标志。 80%小米摄入量使小鼠肠道菌群多样性和均匀度显著下降,群落组成结构趋于单一化,这与高脂饮食、素食饮食和生酮饮食的极端饮食模式导致菌群多样性降低的结果是一致的[11-13],而菌群多样性和均匀度的下降可能是导致脂代谢紊乱的原因之一[9]。 从门水平组成上看,80%摄入量的小米使小鼠肠道中拟杆菌门、厚壁菌门和放线菌门3 个优势菌门的相对比例显著失调,这可能是因为过量(80%)摄入小米使某些营养素摄入过量导致特定菌群损失以及菌群间的相对丰度失衡。
在科水平上,80% 摄入量的小米使Muribaculaceae 在小鼠肠道菌群过度定殖,而乳酸杆菌科、双歧杆菌科、颤螺旋菌科、理研菌科和拟杆菌科皆显著下降。 黏液层的黏液蛋白是肠道微生物重要的附着点和营养来源,微生物与黏液蛋白的结合能力,决定了其在黏液层中的定殖能力[14]。 有研究表明,Muribaculaceae 是结肠壁上高度活跃的黏蛋白聚糖降解菌[15],毛螺菌科、理研菌科和拟杆菌科也具备利用黏蛋白聚糖的能力[16],而双歧杆菌科与颤螺旋菌科在黏液层中显著富集[17-18],因此我们推测Muribaculaceae 与黏液蛋白的结合能力更强,在生态位点的竞争中处于优势,导致了其他菌科丰度的下降。 此外,降解黏蛋白聚糖的细菌包括肠道共生菌和致病菌[14],共生菌如著名的嗜黏蛋白阿克曼菌(Akkermansia muciniphila),该菌被认为参与了肥胖、糖尿病的缓解[19],而致病菌会降解黏液层而引发炎症[14],所以80%摄入量小米组中Muribaculaceae 的过度定殖对机体是否会产生不利影响,尚需进一步的评价和研究。
在属水平上,80%摄入量的小米使双歧杆菌属、粪杆菌属、布劳特氏菌属和罗氏菌属等潜在益生菌下降。 双歧杆菌属是肠道重要的益生菌,它的定殖能够增强肠道屏障,抑制致病细菌的定殖并降低毒素水平[20]。 双歧杆菌丰度的降低可能与小米饲料中酪蛋白的减少有关[21]。 此外,布劳特氏菌属具有调节宿主健康和缓解代谢综合征的能力[22],罗氏菌属能够为宿主提供氨基酸和B 族维生素,有利于机体健康[23]。 本研究还发现肠道重要的共生菌另枝菌属、副拟杆菌属、肠杆菌属在20%小米摄入量时显著上升,在80%摄入量时显著下降,其中副拟杆菌属被发现能够减少炎症细胞浸润发挥抗炎作用[24],这表明20%摄入量的小米有利于肠道菌群多样性增加和益生菌富集,而80%摄入量的小米喂养使小鼠肠道微生物的群落多样性和均匀度下降,有益菌属丰度下降,引起菌群失调。
3.3 不同摄入量的小米对小鼠短链脂肪酸的影响
20%、40%摄入量小米对SCFAs 的含量没有影响,只有高摄入量(80%)小米增加了小鼠肠道中丙酸、丁酸、异丁酸和戊酸的含量,这可能是因为小米中的抗性淀粉含量较高[6],不能被小肠的淀粉酶分解,进入结肠后被微生物发酵利用,产生次级代谢物短链脂肪酸。 通过相关性分析发现,Muribaculaceae、普雷沃氏菌科_UCG-001、瘤胃球菌属与SCFAs的升高呈正相关。 Muribaculaceae 能够产生乙酸、丙酸和琥珀酸[25],普雷沃氏菌是一种高效的丙酸产生菌[26],而瘤胃球菌能够分解抗性淀粉产生丁酸[27],本研究的实验结果与先前的结论是一致的,这表明Muribaculaceae、普雷沃氏菌科_UCG-001 和瘤胃球菌属很可能是80%小米摄入量干预下产生短链脂肪酸的主要菌群。
4 结论
本研究系统分析了不同小米摄入量对小鼠生长状态、肠道菌群组成和短链脂肪酸水平的影响,发现20%小米摄入量就能有效调节肠道菌群,增加有益菌的定殖,而过高的小米摄入量(80%)则会使肠道菌群多样性和均匀度降低,引起Muribaculaceae 的过度定殖,有益菌丰度下降。 研究结果表明,需要理性看待杂粮的营养与健康价值,避免过量摄入。 目前关于过量摄入杂粮与机体健康的研究仍较少,需要更多后续的研究,尤其针对老人、幼儿等有特殊营养需求的人群。 本研究尚存在许多科学问题需要进一步研究,如80%摄入量小米引起血脂水平上升的原因,以及高摄入量小米是否会导致血糖、血蛋白的异常,小米中的何种成分引起肠道菌群和短链脂肪酸的变化等。
