破囊壶菌属微生物中超长链多不饱和脂肪酸的生物合成及其代谢工程应用
2022-06-29谢曦陈碧翰罗俊锴郭梓蔚王琴肖更生刘东杰林蠡刘袆帆
谢曦,陈碧翰,罗俊锴,郭梓蔚,王琴,肖更生,刘东杰,林蠡,刘袆帆*
(1.仲恺农业工程学院轻工食品学院,广东省岭南特色食品科学与技术重点实验室,广东广州 510631)
(2.仲恺农业工程学院动物科学学院,广东广州 510631)
超长链多不饱和脂肪酸(very long chain polyunsaturated fatty acids,VLCPUFAs),是指含有超过18个碳原子,2个以上双键的一类脂肪酸。目前VLCPUFAs根据其双键位置有两种命名系统,第一种是“ω”命名法,该系统根据甲基端第一个双键碳原子的位置命名,这种命名系统多用于划分结构相似的一类脂肪酸。如二十碳五烯酸(eicosapentaenoic acid,EPA)和二十二碳六烯酸(docosahexaenoic acid,DHA),因其甲基端第一个双键落在第三个碳原子上,因此这类脂肪酸统称为“ω3”脂肪酸。而花生四烯酸(arachidonic acid,ARA),因其第一个碳-碳双键落在第六个碳原子上,因此称其为“ω6”脂肪酸。第二种为“Δ”命名法,多用于描述双键合成的过程,它是从羧基端开始计算,以“Δ”引导符号用数字标注每一个双键的位置。以ARA(C20:4ω6 Δ5,8,11,14)为例,“20”表示主链由20个碳原子组成;“4”表示主链中含4个双键;“Δ”右上角的数字表示从主链羧基端开始计数,第5、8、11、14个碳原子位置各连着一个双键[1]。大量研究表明,VLCPUFAs(包括EPA和DHA)在维护生物膜结构和功能、提高机体免疫能力、促进生长发育、调节脂类代谢以及相关基因表达等方面作用非凡[2]。VLCPUFAs还对降低血栓形成、减少心血管疾病发病率、抵抗癌症等有积极的预防和辅助治疗作用[3]。同时,多项临床研究表明EPA和DHA是构成调节机体机能的最高中枢-大脑皮层灰质的主要脂肪酸之一,它可参与信号转导、视紫红质激活等,它对于运动能力、注意力和记忆功能有正面效应[4]。DHA是神经保护素D1(Neuroprotectin D1,NPD1)的前体,可响应氧化应激和激活神经营养素,以维持神经稳态。也可通过调节抗炎信号级联来保护神经元和感光细胞,从而防止大脑和视网膜损伤[5]。另外一些研究发现二十碳类VLCPUFAs可在哺乳动物组织和细胞内经过不同的途径合成几类重要的信号分子,如通过花生四烯酸在环加氧酶作用下先转化为环内过氧化物,之后在不同异构酶的作用下转化为前列腺素、血栓素、前列环素等;花生四烯酸也可在脂加氧酶作用下合成白三烯及其他羟二十四碳四烯酸[6]。因此,适当地摄入VLCPUFAs对维持人体健康、保持人类正常机体功能上起到重要的作用(图1)。
目前,EPA、DHA等常见VLCPUFAs产品主要是通过捕捞深海鱼类提取所得,深海鱼类是人类获得VLCPUFAs的重要天然来源,随着全球气候变暖、过度捕捞、环境污染等因素,使得海洋鱼类资源日趋减少,制约了利用海洋鱼类提取VLCPUFAs产业的发展。同时鱼油中VLCPUFAs的构成和含量随着深海鱼类的种类、季节、地理环境的不同而变化,使得提取的鱼油中VLCPUFAs的含量和组成会产生较大的差别,生产出的鱼油产品质量不稳定,难以满足市场对鱼油产品高质量的要求[7]。如何研究开发出新的稳定、可控、高产、可持续、低成本的VLCPUFAs来源从而摆脱VLCPUFAs产业对海洋鱼类的高度依赖,已经摆在从事VLCPUFAs类产品加工、销售者的面前。
研究表明,海洋微藻、原始真菌和原生生物等能在细胞膜或储存性脂质中积累ARA、EPA、二十二碳五烯酸(docosapentaenoic acid,DPA)和DHA等多种具有营养价值的VLCPUFAs[8,9]。相比于深海鱼油等常规的VLCPUFAs来源,微生物源的VLCPUFAs具有无鱼腥味、低胆固醇、低杂质、受环境影响少、产量质量稳定、脂肪酸组分简单和提取容易等诸多优势,极具开发价值。如澳大利亚等一些国家的生物技术公司已开始尝试培养海洋微藻或破囊壶菌等海洋微生物以替代深海鱼类作为VLCPUFAs原料进行EPA和DHA的生产,取得一定的进展,已经有成批量的产品投放市场。
1 破囊壶菌属微生物
破囊壶菌(Thraustochytrids)、属于Stramenopila界、Heterokonta门、Labyrinthulomycetes纲、Thraustochytriales目、Thraustochytriaceae科的异养型原生生物。破囊壶菌广泛分布于海洋、盐水湖以及红树林地区,因其外观形态像“破囊菌”,而释放孢子的形式像“壶菌”,因此命名为破囊壶菌[10]。科学家前期对这些微生物的脂质代谢产物进行分析后发现Thraustochytriaceae科中的一部分微生物,包括Thraustochytriumsp.(又称破囊壶菌)、Schizochytriumsp.(又称裂殖壶菌)、Ulkeniasp.、Aurantiochytriumsp.(又称橙黄壶菌)和Hondaeasp.能积累大量EPA、DPA和DHA等多不饱和脂肪酸[11](图2)。更有研究指出这些破囊壶菌属微生物能够广泛地利用碳源和氮源作为营养来源,生长快速、培养简单、能积累大量VLCPUFAs,具有大规模工业化生产的潜力[12](表1)。
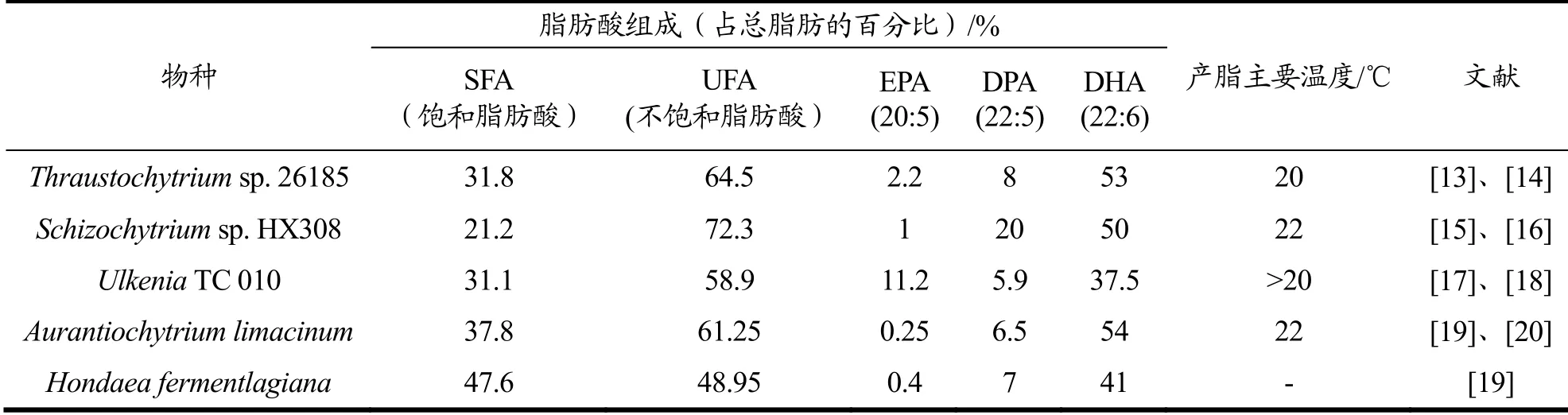
表1 破囊壶菌属微生物中多不饱和脂肪酸的组成及含量 Table 1 Composition and content of polyunsaturated fatty acids from Thraustochytrids
2 破囊壶菌属微生物的VLCPUFAs的生物合成途径
自1989年澳大利亚科学家首次发现破囊壶菌能积累DHA以来,科学家们对破囊壶菌中多不饱和脂肪酸的生物合成途径开展了研究[21]。目前基本探明了在自然界中,破囊壶菌属微生物能通过有氧合成途径和无氧合成途径来合成VLCPUFAs。
2.1 有氧合成途径及其关键酶
有氧合成途径普遍存在于动物、植物和真核微生物体内,这些生物体内的VLCPUFAs主要是以长链脂肪酸为前体,通过一系列的延长酶(添加两个碳原子)和去饱和酶(导入一个双键)的交替作用合成的。
2.1.1 脂肪酸延长酶
脂肪酸的延长过程发生在真核细胞的内质网中,其经由脂肪酸延长酶催化,向酯酰链添加两个碳原子来延长多不饱和脂肪酸的链长。脂肪酸延长酶是一个复合酶,由四个复合体共同催化完成一次延伸反应:由β-酮酰基辅酶A合成酶(β-ketoacyl-CoA synthase,KCS)催化两个碳链的延伸;由酮酰基辅酶A还原酶催化酮酰基辅酶A的酮基还原为羟基;由β-羟酰辅酶A脱水酶催化脱除一个水分子;由酮酰基辅酶A还原酶催化还原烯酰辅酶A。在脂肪酸延长酶复合体的四种单体酶中,KCS主要参与脂肪酸延伸过程的缩合反应,与其他三种酶相比,它具有很强的底物特异性,被认为是超长链脂肪酸合成的限速酶[22,23]。根据序列相似性和底物特异性,真核生物KCS可分为两类。一类是FAE型KCS,它最早是通过转座子标记在拟南芥中被发现[24]。这种延长酶主要存在于植物和藻类中,以饱和及单不饱和脂酰链为底物进行延长。另一类是ELO型KCS,最先是在酿酒酵母中被发现的[25]。该类型的KCS主要存在于酵母、真菌和动物中,主要以多不饱和脂酰链为底物,每次向酰基链添加两个碳原子进行延伸[26,27]。例如,在酿酒酵母中,三种具有不同底物偏好性的ELO型KCS能催化长链、超长链不饱和脂酰链延伸[28]。在微藻Nannochloropsissp.中,细胞质ELO型KCS能将16:3延长到18:3,然后进入EPA的生物合成阶段[29]。在高等植物中,除了在Eranthis hyemalis等少量植物中存在ELO型KCS外,大部分植物中只含有FAE型KCS[30]。但在海洋微藻、真核生物中ELO型KCS的存在较为广泛[31-37](表2)。

表2 已鉴别出的不同破囊壶菌属微生物的延长酶汇总表 Table 2 Summary of elongases from different Thraustochytrids
2.1.2 脂肪酸去饱和酶
脂肪酸去饱和酶是VLCPUFA上双键形成的关键酶,它能利用氧分子作为辅助因子,催化脱除脂酰链上两个氢原子从而引入碳-碳双键[42]。去饱和酶的氨基酸序列上通常含有3个组氨酸保守区,常以H-X[3,4]H、H-X[2,3]H-H和H/Q-X[2,3]H-H的形式存在。脂肪酸去饱和酶能依据其在酰基链上的作用位置,分为前端去饱和酶(front-end desaturase)和甲基末端去饱和酶(methyl-end desaturase)。甲基末端去饱和酶主要作用于已存在的双键和甲基端之间,如ω3和ω6去饱和酶能分别催化从甲基端开始第三个碳和第六个碳上的双键合成。前端去饱和酶主要作用于已存在的双键和多不饱和脂肪酸的羧基端之间的碳原子上,如Δ4、Δ5和Δ6去饱和酶[43-47]。脂肪酸去饱和酶亦能根据底物酰基载体的不同,分为酰基载体蛋白(acyl carrier protein,ACP)去饱和酶、酰基辅酶A(coenzyme A,CoA)去饱和酶与酰基脂类去饱和酶。酰基ACP去饱和酶是以脂酰基ACP作为底物;酰基CoA去饱和酶主要催化酰基CoA的去饱和反应;而酰基脂类去饱和酶将双键引入由各种复杂脂质分子(如糖脂磷脂和鞘脂等)组成的酰基链中[48]。虽然最近研究揭示了两种膜结合的酰基CoA去饱和酶的晶体结构,为深入了解酰基辅酶A去饱和酶在内质网中的催化机制提供了新思路[47,49],但是,微生物中大多数去饱和酶的底物特异性仍需要进行一系列的研究去验证明确[50]。
目前,来自于不同破囊壶菌属微生物的去饱和酶(Δ4,Δ5,Δ6,Δ9,Δ12和ω-3)和延长酶等都先后被分离出来并进行了功能鉴定,因此,VLCPUFAs的有氧合成途径已经研究得较为清晰(表3)。其中最典型的EPA和DHA的有氧合成途径可分为Δ6和Δ4两个途径[13,27,34,38,45,51-55]。Δ6途径的研究最为详细,该途径以α-亚麻酸(α-linolenic acid,ALA)和亚油酸(linoleic acid,LA)为底物,当以LA为底物时在Δ6-饱和酶的去饱和作用下生成γ-亚麻酸(γ-linolenic acid,GLA),随后在Δ6-延长酶的延长作用下合成二高γ-亚麻酸(dohomo-γ-linolenic acid,DGLA),最后经Δ5-饱和酶的作用生成ARA。而以ALA为底物时,在Δ6-饱和酶的去饱和作用下生成十八碳四烯酸(stearidonic acid,SDA),再经Δ6-延长酶的延长作用合成二十碳四烯酸(eicosatetraenoic acid,ETA),最后在Δ5-饱和酶的作用下生成二十碳五烯酸(EPA)。另一种是Δ4途径,主要是以EPA作为底物,在Δ5-延长酶的作用下合成DPA,随后在Δ4去饱和酶的作用下合成DHA,如破囊壶菌、裂殖壶菌便能以该途径合成DHA(图3)。

表3 已鉴别出的不同破囊壶菌属微生物的去饱和酶汇总表 Table 3 Summary of desaturases from different Thraustochytrids
2.2 VLCPUFAs的无氧合成途径及其关键酶
无氧合成途径是VLCPUFAs的另一种合成途径,它不存在于任何高等植物和动物中,只存在于微生物中。之所以被称为无氧合成途径,是因为该途径不需要去饱和酶和氧气参与反应,而是在酰基链延伸过程中导入双键。该途径由一个聚酮合成酶(polyketide synthase,PKS)结构相似的多不饱和脂肪酸合成酶(polyunsaturated fatty acid synthase,PUFA合成酶)催化,以丙酮酸为前体经过多个迭代循环反应从头合成VLCPUFAs[60]。破囊壶菌属微生物的PUFA合成酶与Shewanellasp.、Moriteollasp.和裂殖壶菌属(Schizochytriumsp.)等微生物的类似,由多个亚单位组成,每个亚基可能含有一个以上的催化结构域,如酮酰基载体蛋白合成酶(ketoacyl carrier protein synthetase,KS)、酮酰基载体蛋白还原酶(ketoacyl carrier protein reductase,KR)、去饱和酶(desaturase,DH)、烯酰基载体蛋白还原酶(enoyl carrier protein reductase,ER)、丙酰辅酶A:载体蛋白转酰基酶(propionyl-CoA:carrier protein transacylase,MAT)和酰基载体蛋白(ACP)。这些结构域协同工作,通过四个重复的循环反应来合成VLCPUFAs。然而,与通过脂肪酸合成酶合成长链脂肪酸过程不同,在PUFA合成酶催化的无氧途径中,PUFA合成酶可以周期性的跳过脂酰链的烯酰还原步骤,保留上面的顺式双键,依次合成VLCPUFA上的顺式双键(图4)。
2.2.1 PUFA合酶
PUFA合成酶的发现可以追溯到1996年,当时Yazawa[61]从鱼肠中分离得到约40 kbShewanella pneumatophoriSCRC-2738的基因组DNA大片段,在大肠杆菌中表达,能催化EPA的合成。1997年,Takeyama[62]将8个开放阅读框(open reading frames,ORFs)组成的DNA片段亚克隆到一个广泛宿主范围的质粒载体中,并在Synechococcussp.中表达,发现重组菌也能合成EPA。随后的序列分析表明,该DNA序列编码的蛋白质与聚酮合成酶(polyketide,PKS)和脂肪酸合成酶有较高相似性,这使得Metz等人[63]认为该基因簇序列参与EPA的生物合成可能遵循类似于PKS的催化机制,称该类能催化VLCPUFAs合成的大型合成酶为PUFA合成酶。基于此,科学家们进一步尝试将破囊壶菌和裂殖壶菌的PKS相似基因进行体内和体外的功能验证,研究表明这种与PKS相类似的基因能催化VLCPUFAs合成。随后,科学家在包括细菌、真菌、藻类和破囊壶菌微生物在内的大量海洋微生物中均发现PUFA合成酶[64-72]。由PUFA合成酶催化的合成过程可以有效地生产多种VLCPUFAs,包括ARA、EPA、DPA和DHA等,由于其催化合成过程较简单,因此被认为是比有氧合成途径更有效的VLCPUFA生产系统[73-75],是天然生产DHA等VLCPUFA的重要途径。
虽然,PUFA合成酶广泛存在于海洋微生物中,但这些合成酶的结构却是多种多样的。如除陆地分枝杆菌外的原核生物的PUFA合成酶大多包含超过四个亚单位PfaA[76]、PfaB[77]、PfaC[78]和PfaD[79],且每一个亚单位中催化结构域的数量和种类亦有所不同。而真核生物的PUFA合成酶结构相对保守,如破囊壶菌属微生物的PUFA合成酶只含有3个亚单位称为Subunit A、Subunit B和Subunit C,其中每个亚单位的结构域种类相似,除了ACP数量略有差异以外其他结构域排列顺序和种类都一样(图5),因此,这些微生物的产物VLCPUFA是相同的,分别是DPA和DHA。
2.2.2 PUFA合酶的重要催化结构
尽管VLCPUFAs是由PUFA合酶的多个催化结构域协同作用合成,但VLCPUFAs上多个不饱和双键的合成和酰基链上的顺序排布与PUFA合酶的两个特殊区域-KS结构域和DH结构域息息相关。
KS结构域是PUFA合成酶的关键催化区域,能催化酰基-S-KS与延伸单元丙乙酸-S-ACP之间的缩合,形成酮酰基-ACP,起到向酰基链添加2个碳原子的作用。与脂肪酸合成酶不同,PUFA合成酶上含有1~3个KS区域,这些区域具有底物偏好性,决定这最终产物的链长[80],部分KS区域还能与缺失活性位点但结构与KS相似的链长因子(chain length factor,CLF)区域形成二聚体结构,催化不饱和酰基链的延伸。如破囊壶菌PUFA合成酶中的两个KS区域皆能互补大肠杆菌酮酰基-ACP合成酶突变体(fabB)的表型,使突变体恢复不饱和脂肪酸的合成。而在大肠杆菌中表达两个KS区域发现,在Subunit A上的KS区域能提高长链脂肪酸的合成,而Subunit B上的KS区域能提高大肠杆菌脂肪酸的不饱和度,该结果指出PUFA合成酶的KS区域底物具有特异性。随后,日本课题组将Photobacterium profundum(产EPA菌)PUFA合成酶的KS区域与Moritella marina(产DHA菌)的KS结构域进行互换,发现替换了Moritella marinaKS结构域的Photobacterium profundumPUFA合成酶也能合成DHA,进一步说明KS对PUFA合成酶的最终产物的碳链长度起决定性作用。
DH结构域是合成VLCPUFAs上顺式双键的关键区域。根据序列分析,DH区域分为两类,一种是PKS型DH结构域,另一种是FabA型DH结构域[81,82]。大肠杆菌互补实验表明,前者类似于PKS的DH区域,催化羟酰基进行脱水反应,从而在ɑ和β-碳之间引入反式双键;后者类似于大肠杆菌羟酰基-ACP脱水酶(FabA),催化底物脱水形成反式双键后,还可以将构型从反式转换为顺式,形成VLCPUFA的双键结构[83]。体外实验更指出,PKS型DH结构域对短链酰基链具有选择性,从而决定最终脂肪酸的类型。如,产ω-6脂肪酸的Aureispira marinaPKS型DH结构域与FabA型DH结构域竞争C6-Enoyl-ACP结合,而Moritella marinaPKS型 DH 结构域优先与C3-Enoyl-ACP反应,从而合成ω-3脂肪酸。两类DH结构域轮流作用于碳链的延伸和双键的导入合成,之后ER将Enoyl-ACP上的反式双键还原为饱和ACP,完成一次碳链的延长,如此循环往复多个反应使得多个顺式双键能形成在延伸的酰基链上。
除了这些关键域外,PUFA合成酶中还要其他一些区域,包括MAT域和AT域。MAT结构域催化丙二酰CoA向丙二酰ACP转移,并作为缩合反应的扩展单元[84]。通过切割最终的酰基ACP的硫酯键,释放游离脂肪酸。AT结构域可以参与脂肪酸产生的最后步骤[85]。
3 破囊壶菌属微生物中TAG的生物合成途径
VLCPUFAs在破囊壶菌属微生物中的生物合成不仅涉及脂肪酸的催化合成,而且还涉及这些脂肪酸如何整合组装到存储性脂质三酰基甘油(triacylglycerol,TAG)中。由PUFA合成酶合成的超长链多不饱和脂肪酸是以游离脂肪酸的形式从酶中释放出来[60],然后通过酰基CoA合成酶将新合成的脂肪酸活化为相应的硫酯,才能进行细胞代谢和脂质储存装配[86]。
现有的研究表明,大量结合了VLCPUFAs的甘油脂积累在破囊壶菌属微生物(如Thraustochytriumsp.)体内。这类甘油脂主要有:磷脂酰胆碱(phosphatidylcholine,PC)、磷脂酰乙醇胺(phosphatidylethanolamine,PE)、磷脂酰丝氨酸(phosphatidylserine,PS)、磷脂酰甘油(phosphatidylglycerol,PG)和磷脂酰肌醇(phosphatidylinositol,PI)等极性脂类以及二酰甘油(diacylglycerol,DAG)和三酰甘油等非极性脂类。极性脂是构成各种细胞器膜及细胞质膜的主要成分,而非极性脂类是以VLCPUFAs为最终储存形式储存在生物体内。
3.1 破囊壶菌属微生物的甘油脂生物合成途径
3.1.1 酰基CoA依赖途径(Kennedy途径)
目前,动植物合成甘油酯的途径可根据其是否利用酰基CoA分为酰基CoA依赖途径和非依赖酰基CoA途径。利用酰基CoA作为反应底物的途径,又称为依赖酰基CoA途径(即Kennedy途径)。Kennedy途径主要存在于酵母和植物中,是以3-磷酸甘油(glycerol-3-phosphate,G3P)为底物,在甘油-3-磷酸酰基转移酶(glycerol-3-phosphate acyltransferase,GPAT)和溶血磷酸酯酰转移酶(hemolyticacyltransferase,LPAT)的催化下,以酰基CoA为酰基供体,将G3P酰基化成磷脂酸(phosphatidic acid,PA)在磷脂酸磷酸酯酶(phosphatidic acid phosphatase,PAP)的催化作用下,将PA去磷酸化得到DAG,然后通过二酰基甘油酰基转移酶(diacylglycerol acyltransferase,DGAT)在sn-3位与另一个酰基CoA酰基化得到TAG[87-89]。
3.1.2 非依赖酰基CoA途径
除了Kennedy途径外,还有一个不依赖酰基CoA的独立途径,通常以DAG作为底物,PC作为酰基供体,在磷脂:二酰基甘油酰基转移酶(phospholipid:diacylglycerol acyltransferase,PDAT)的作用下将磷脂(主要是PC)sn-2位上的酰基链转移到DAG的sn-3位置,从而合成TAG[90,91]。
3.1.3 破囊壶菌属微生物的甘油脂生物合成机理研究进展
到目前为止,在破囊壶菌中几乎所有参与磷脂和TAG生物合成的基因都通过基因组测序被鉴定出来[92,93]。但大部分参与合成的基因仍未被功能验证,只有Aurantiochytrium limacinumF26-b中参与PC合成的PC酰基转移酶(LPCAT)的功能得到了验证。最近的一些同位素标记实验表明[87,88],真核生物TAG中VLCPUFAs积累主要是由PC的合成水平决定的。加拿大萨省大学Xiao Qiu课题组[92]首次通过C14同位素示踪实验对VLCPUFAs在破囊壶菌Thraustochytriumsp. 26185的甘油酯合成机理进行探索。研究发现,该菌产生的VLCPUFAs首先积累到PC上,随后以DAG作为媒介合成作为储存性脂质的TAG。脂质的组分和结构分析表明,PC上的脂肪酸组成与PC衍生而成的DAG(即PC-DAG)和TAG上的组成和结构非常相似,VLCPUFAs大多结合在甘油骨架sn-2的位置上。同时,实验指出PC和DAG上的多不饱和脂肪酸含量随着时间推移逐步减少,而TAG上的多不饱和脂肪酸含量却逐渐上升。随后,武汉油料所万霞等[93],对裂殖壶菌不同生长阶段各类脂质含量、成分和结构进行组学分析,其结果亦印证了这个观点。由此可以推断,在破囊壶菌属微生物中VLCPUFAs可能是由PC通过DAG作为媒介转移到TAG上,或直接由PC作为前体直接合成TAG,积累在体内。PC上的多不饱和脂肪酸水平直接决定了储存性脂质TAG上的不饱和脂肪酸含量。但是,至今为止,仍没有具体的实验能够解释破囊壶菌属微生物上的VLCPUFAs是如何组装到TAG上的,需要对一系列参与该途径的基因进行克隆、表达和功能验证才能阐明这些VLCPUFAs脂质的合成机理。(图6)
4 破囊壶菌属微生物开发与利用的探讨
破囊壶菌属微生物作为VLCPUFAs的主要生产者,油脂含量相对较高,可以作为EPA、DHA等功能油脂的潜在来源。但由于这些海洋微生物长期生活于海洋环境,对培养条件要求较高。因此,通过培养破囊壶菌属微生物提取VLCPUFAs方法来进行大批量功能油脂的生产,不仅比用鱼油提取的成本更高而且产量也难以满足市场需求。如何利用破囊壶菌属微生物富含VLCPUFAs的特性来大量获取EPA、DHA等功能油脂为人类健康服务,是值得我们深入研究探索的一个课题。随着现代生物科技的高速发展,通过基因工程、酶工程、代谢工程和发酵技术等现代科技手段实现利用破囊壶菌属微生物高效获取VLCPUFAs指日可待。
4.1 通过转基因工程菌生产DHA
目前来说,利用破囊壶菌进行商业化生产还需要克服一系列的挑战。首先,破囊壶菌属微生物需要成本较高的培养基。此外,海洋微生物的繁殖会受到其他物种和病原体的污染,从而影响生长。其三,环境温度对破囊壶菌属微生物中DHA的生产也有很大的影响,如裂殖壶菌在较低温度下DHA产量明显高于正常生长温度,因为裂殖壶菌中涉及糖代谢和中长链脂肪酸代谢的关键基因受到低温抑制,而合成DHA的关键酶却没有受到温度调控,低温更适合DHA在裂殖壶菌中积累,因此,培养破囊壶菌属微生物需要特定控温设施[94]。利用天然海洋微生物生产DHA的效率和商业价值都不高。如今,利用工程菌结合代谢工程生产DHA具有常规微生物培养不可比拟的优势:包括能高密度发酵生产、培养基成本低和不需要特定的控温设施。因此,通过代谢工程将破囊壶菌中参与VLCPUFAs合成的关键酶基因转入能高密度、低能耗发酵的工程菌中将会是生产VLCPUFA新的来源[95]。
除此以外,向工程菌转入PUFA合成酶,构建无氧合成途径,也能使工程菌合成功能油脂。Orikasa等[74]将Moritella marinaMP-1中DHA生物合成基因簇(pDHA3)包括基因:pfaA、pfaB、pfaC、pfaD和pfaE在大肠杆菌中共表达,在15 ℃下培养能生产占总脂肪酸产量5%的DHA[97]。四年后,另一项研究指出[95],将Shewanella balticaMAC1的PUFA合成酶在大肠杆菌中异源表达能够在体内产生EPA和DHA。尽管可以通过将编码PUFA合成酶的基因在大肠杆菌中表达,合成EPA和DHA,但大肠杆菌作为未被确定为食品级(Food grade,FG)微生物,不能直接用于食品工业中。乳酸菌属于FG微生物并且能表达PUFA合成酶基因,因此,通过PUFA合成酶在乳酸菌表达而合成EPA和DHA的方法,将有可能成为获得VLCPUFAs新的规模化生产途径。为此,Amiri-Jami[96]将来自Shewanella balticaMAC1的基因簇引入乳酸菌Lactococcus lactissubsp.cremoris MG1363中,该重组菌能产生1.35±0.5 mg/g的DHA和0.12±0.04 mg/g的EPA[98]。该实验为后期开发产EPA/DHA的乳酸菌作为乳品发酵剂、青贮饲料添加剂和动物饲料添加剂提供了前期研究基础。
4.2 转基因油料作物生产VLCPUFAs
油料作物,如油菜、大豆具有包括油酸、亚油酸等的多不饱和脂肪酸。近年来,将微生物基因应用到植物中,经代谢工程合成VLCPUFAs在作物的改良生产方面具有一定的突破。Wu等[99]尝试通过在油菜中异源表达9个来源于破囊壶菌Thraustochytriumsp. 26185等微生物的基因(包括:Δ4、Δ5、Δ6和ω3去饱和酶、延长酶和酰基转移酶)构建DHA生物合成途径。实验结果表示,转基因油菜籽油中含有2%的DHA,证明在植物中表达有氧合成途径的关键基因具有实现DHA等功能油脂在油料作物中的大规模生产的可能性[99]。随后,科学家对转基因植物中的关键基因进行优化、尝试在Brassica napus和Camelina sativa等油料作物中合成EPA、DHA,获得了一系列能生产功能油脂的转基因油料作物,并不断提高其产量[99-103]。虽然现在利用有氧合成途径在转基因油菜籽作物中合成的DHA水平能达到总脂的12%,但由于去饱和酶和延长酶对脂酰基底物的特异性,造成转基因油料作物还会产生一些中间体脂肪酸,如硬脂酸、GLA和ETA等[101,102],需要后期通过纯化等方法去除,造成生产成本增加。除外,可能由于两种类型酶的蛋白不相容性或者表达水平不一致,导致最终产物产量降低,不能最大限度地生产目的功能油脂。

表6 基因改造破囊壶菌属微生物基因改造汇总表 Table 6 Summary table of genetic modification of Thraustochytrids microorganisms
近年来,科学家尝试在植物中构建无氧合成途径,以期获得较为纯净的功能油脂产物。Walsh等[103]将裂殖壶菌SchizochytriumATCC PTA 9695中编码PUFA合酶的三个开放阅读框基因通过农杆菌转入甘蓝型油菜Brassica napus(Canola)中,构建无氧合成途径,在转基因油菜中成功生产占总脂0.7%的EPA和3.7%的DHA。虽然PUFA合酶能成功在油料作物中合成EPA和DHA,但是其产量远远不足以用于功能油脂的大规模生产,DHA产量低可能是由于转基因植物中异源PUFA合酶的活性低。因此,后续可能需要通过提高油料种子中PUFA合酶的活性来进一步优化DHA的催化途径(表4)。

表4 利用破囊壶菌基因在工程菌中合成VLCPUFAs Table 4 Production of VLCPUFAs in microbes through introducing genes from Thraustochytrids
4.3 利用基因工程技术改造破囊壶菌属微生物提高VLCPUFAs的产量
遗传修饰策略常用于发酵领域,旨在通过代谢工程方法提高天然菌株中目标产物的产量。该策略已广泛应用于转基因微生物和植物中,通过生物合成途径相关基因的过表达或诱变,以及敲除参与竞争途径的基因来增强某些特定产物。
近年来,科学家也陆续尝试通过遗传修饰策略改造破囊壶菌属微生物,提高其VLCPUFAs的产量。如,Wang等[104]将微藻Crypthecodinium cohnii的苹果酸酶在裂殖壶菌Schizochytriumsp. S31中进行超表达,提高NADPH的供应,同时超表达土壤真菌Mortierella alpina延长酶(Δ3-DES)来抑制脂肪酸合成酶中乙酰CoA羧化酶的活性,进而提升DHA的产量。结果表明,转基因裂殖壶菌中DHA的产量相对于野生菌株提升了1.39倍,达到了3.54 g/L,大大提高了DHA的生产效率。Ling等[105]尝试把裂殖壶菌Schizochytriumsp.SR21中PUFA合成酶Subunit C上的ER敲除,发现裂殖壶菌突变体的总不饱和脂肪酸,尤其是EPA和DHA的产量提高了50%以上,明显高于野生菌,证明改造PUFA合成酶的催化结构域能改变VLCPUFAs的产量。Wang等[106]在破囊壶菌Aurantiochytriumsp.中超表达PUFA 合成酶型磷酸泛酰巯基乙胺基转移酶(phosphopantetheinyl transferase,PPTase),成功提高53.9%的DHA产量。此外,还有很多成功超表达VLCPUFA相关合成途径提高关键脂肪酸的产量的案例[107,108](表5)。

表5 转基因植物合成VLCPUFAs Table 5 VLCPUFAs produced in plants
5 总结与展望
5.1 随着对VLCPUFAs(特别是ARA、EPA和DHA)等在维护生物膜结构和功能、提高机体免疫力、促进生长发育、调节脂类代谢、减少心血管疾病发病率等作用的逐渐深入了解,全球市场对这些脂肪酸的需求量也日益增加,因此,开发富含ARA、EPA和DHA的油脂来源迫在眉睫。海洋鱼类如鲑鱼、鳟鱼、鲭鱼等是VLCPUFAs的传统来源,然而,由于全球气候变暖、海洋环境污染和过度捕捞等因素的影响,海洋鱼类资源日渐减少,通过捕捞海洋鱼类获得VLCPUFAs的传统生产方式不仅大量消耗海洋鱼类资源,影响海洋生态,而且也难以满足日益增长的市场需求。因此,筛选富含ARA、EPA和DHA的海洋微生物资源并发掘其合成这些脂质的关键基因,并利用现代生物科技,构建转基因微生物和油料作物,通过定向表达特定基因,实现EPA和DHA等制品的高效合成,具有一定的应用前景。
5.2 破囊壶菌是一种广泛分布于全球海域的海洋原生生物,其具有生长周期较短、培养简单且能合成EPA、DPA和DHA的特点。自1989年澳大利亚科学家首次发现破囊壶菌能积累DHA以来,科学家们对破囊壶菌中VLCPUFAs的生物合成途径开展了研究,对该壶菌EPA、DPA和DHA的生物合成及其甘油酯的组装途径已有一定了解,部分参与VLCPUFAs合成和组装途径的关键基因已被分析、克隆和功能鉴定,为后续利用现代生物科技,定向表达该类基因,实现EPA和DHA等制品的高效合成奠定了基础。
5.3 尽管破囊壶菌以及其他海洋微生物具有生产VLCPUFAs的能力,但它们的生长速度和产量相对较低,且需要昂贵的培养条件,难以应用于工业大规模生产。因此,近年来,通过在工程微生物或油料作物中重构异源VLCPUFA有氧/无氧生物合成途径或对天然微生物进行基因改造,已取得一定进展。然而,在应用天然或异源宿主来生产VLCPUFAs时,其产量可能会受到一些代谢瓶颈的限制。第一,酰基-PC库与酰基-CoA库之间的酰基转换效率是影响EPA、DHA最终产量的关键。在有氧合成途径中,饱和酶和延长酶的底物并不兼容,延长酶需要利用酰基-CoA作为底物而去饱和酶则是利用酰基-PC,因此,在VLCPUFAs合成过程中PC和CoA库之间的酰基转换非常频繁。但很多工程菌和油料作物中的多不饱和酰基转移酶工作效率远低于海洋微生物,导致多不饱和酰基无法高效地在两种底物之间转换,从而影响最终产物的合成效率。一些研究也指出,VLCPUFAs的有氧合成途径和储存脂质合成途径与VLCPUFA-CoA存在竞争关系,也会导致最终产物的合成水平。同时,一些利用PUFA合成酶在植物中构建无氧合成途径的研究指出,由于PUFA合成酶与脂肪酸合成酶竞争丙酮酸、NADPH等底物,导致PUFA合成酶底物不足,影响DHA的产量。有些研究也指出由于PUFA合成酶是一个巨型合成酶,编码其表达的基因超过20万个碱基,导致其编码基因在异源微生物和植物中表达水平低,从而影响其对DHA的合成效率。
5.4 因此,针对当下VLCPUFAs代谢工程合成过程中的瓶颈问题,一些潜在的策略可能适用于VLCPUFA的合成工程:(1)增加合成前体的生成;(2)抑制VLCPUFA合成的竞争途径;(3)通过更换启动子或增加目的基因的拷贝数增加相关合成酶的表达水平;(4)减少编码PUFA合成酶基因的长度,只保留关键功能区域,增加合成酶的表达水平;(5)选择适合VLCPUFAs合成和组装的关键基因进行表达。通过不断挖掘、优化VLCPUFAs的替代来源,符合国家对“大健康”产业的发展方向,对摆脱该产业对海洋鱼类的高度依赖,推动产业向生态、环保、优质方向发展,促进海洋生物资源的保护和利用,具有重要意义(图7)。
