硅碳双键化合物的合成及反应活性研究进展
2015-03-20董召文李志芳
董召文,李志芳
(杭州师范大学有机硅化学及材料技术教育部重点实验室,浙江 杭州311121)
0 引言
有机硅反应活性中间体的合成及其反应活性研究是有机化学领域的一个研究热点.其中,由于硅碳双键不饱和化合物(硅碳烯)反应活性高且容易二聚,因此,该类化合物合成与分离一直是有机合成中的一个难点.1967年,Flowers[1]等人首次通过热解硅杂环丁烷1得到二硅杂环丁烷3.理论计算推测3是硅碳双键中间体2的二聚物(Eq.1).1981年,Brook等人[2-4]分离出第一个在室温下稳定的硅碳双键化合物5a,其稳定性主要是由于引入大位阻取代基阻碍其进行二聚反应.虽然这种硅碳双键化合物具有动力学稳定性,但仍具有较高的反应活性.硅碳烯5a在惰性气体保护下能稳定存在几年的时间,但暴露在空气中就立刻分解(Eq.2).
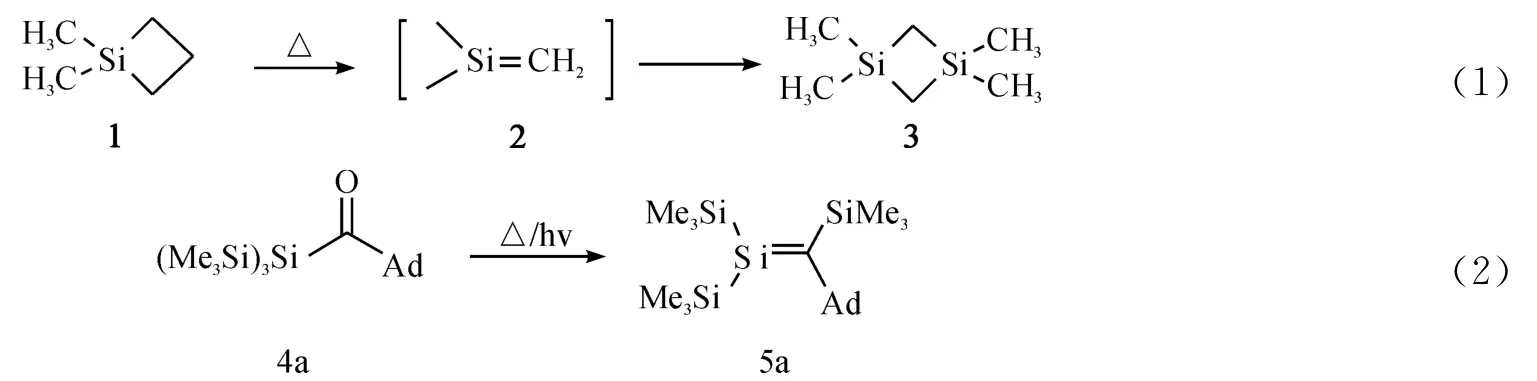
最近,利用大位阻取代基稳定硅碳双键化合物的方法已分离出许多稳定的硅碳烯化合物(6和7)[5-6](Chart 1).随着对硅碳烯研究的深入,利用N 原子上的孤对电子与硅碳烯中心硅原子空的p轨道的共轭作用来稳定的硅碳双键化合物8[7-8]和9[9]也被分离出来.近年来,这方面的研究工作逐渐扩展到多硅碳烯化合物的合成.Apeloig等人[10]通过Peterson反应合成出一个分子内含有两个硅碳双键的化合物10,并且对其结构和性质进行了详细的研究.在此工作的基础上,化合物11-14也先后将被分离出来[11-15].

随着对硅碳双键化合物结构和性质的深入研究,其在有机合成中的应用也越来越被广泛关注.目前有关硅碳双键化合物的综述还鲜有报道[9][16-20].为了更加全面、深入地了解硅碳双键化合物的研究,本文对近几十年来硅碳化合物的合成方法及其反应活性研究进行了综述.
1 硅碳双键化合物的合成研究
自1981年,Brook等人[2]分离出第一个稳定的硅碳双键化合物,在随后的几十年中越来越多的硅碳双键化合物被合成出来.同时,合成方法也越来越丰富,主要有热解法,光解法,盐消除法和Peterson反应等.
1.1 热解法和光解法制备硅碳双键化合物
最初,主要利用热解或光解法来制备这种非稳定的硅碳双键化合物活性中体.Conlin等人[21]通过热解(E)-和(Z)-1,1,2,3-四甲基-硅杂环丁烷15 发现其生成硅碳双键化合物2,以及Z-16(Eq.3)和E-16(Eq.4),从而证明了硅杂环丁烷在热裂解过程中立体构型保持专一性.将1,1-二甲基-硅杂环丁环1中的甲基分别替换为乙烯基和苯基,用紫外光照射得到裂解产物2a[22]和2b(Eq.5)[23].利用该方法生成的硅碳双键化合物反应活性高,容易二聚,无法分离.因此在很长的一段时间内,仅仅是对这种活性中间体进行一些简单的性质分析,无法研究其结构、物理和化学性质.
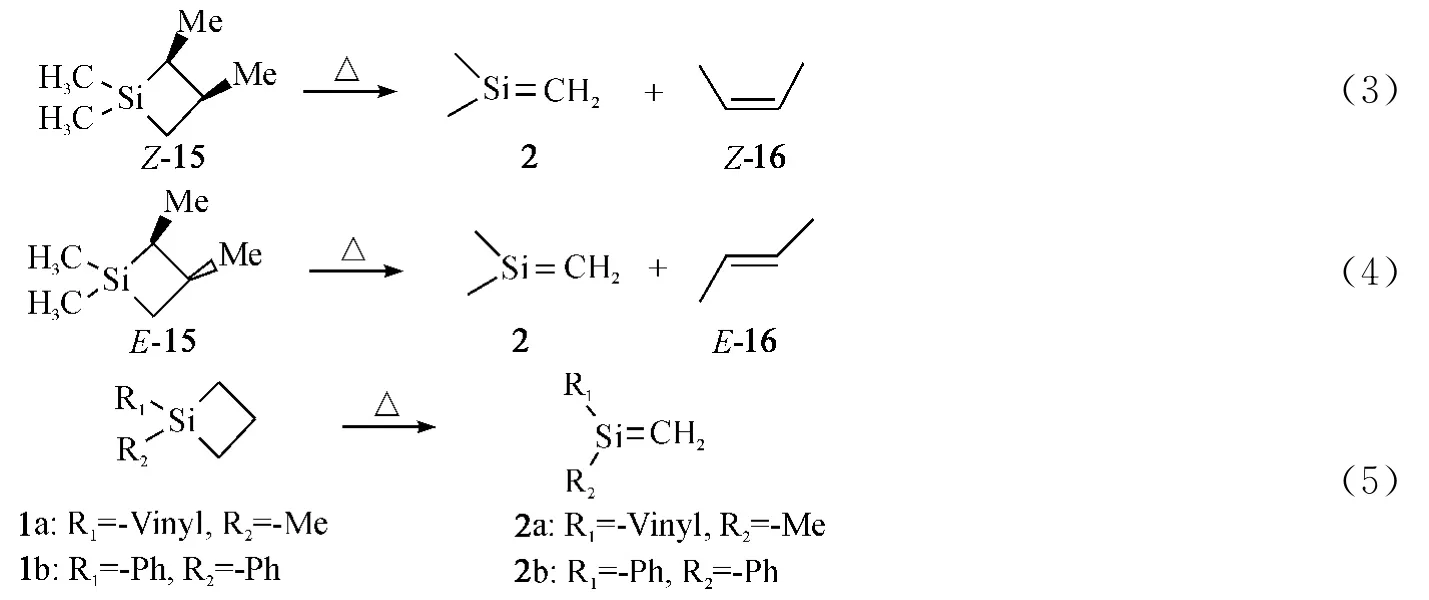
1981年,Brook等[2]利用光解酰基硅烷化合物分离出一个稳定的硅碳双键化合物5a.该法利用三甲基硅基的1,3-迁移生成稳定的硅碳双键化合物(Eq.6),其稳定性主要来源于中心硅原子上大取代基团的空间位阻效应.这类硅碳双键化合物被称为‘Brook'型硅碳烯(Tab.1).


表1 ‘Brook'型硅碳双键化合物的合成Tab.1 The Synthesis of‘Brook'Stytle Silenes
1991年,Kira等人[31]通过光解硅杂环戊烷17 制备了化合物18(Eq.7).18 能与亲核试剂(H2O,EtOH 等)进行加成反应.
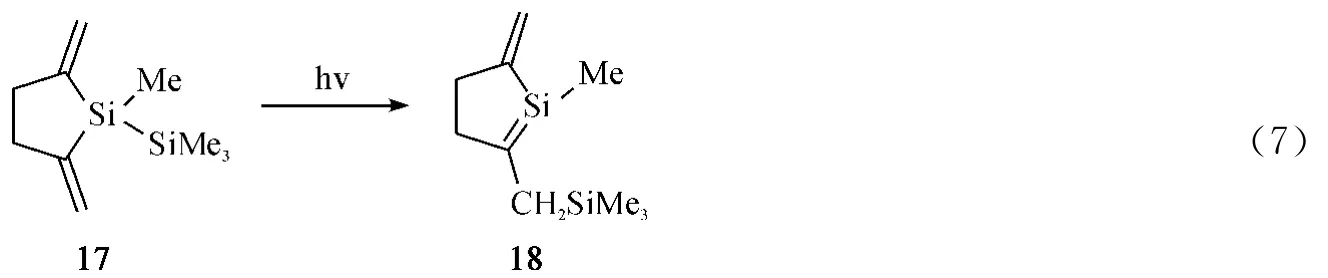
1987年,Sekiguchi等人[32]通过光解重氮化合物19,21等,发现反应首先形成相应的卡宾中间体,然后三甲基硅基进行1,2-迁移形成硅碳双键化合物20(Eq.8)或22(Eq.9).

1.2 盐消除法制备硅碳双键化合物
1981年,Wiberg等人[33-38]利用盐消除法制备出一系列硅碳双键化合物25(Eq.10).该法通过二卤代化合物与锂试剂反应制备反应中间体24,加热消除一分子卤化锂生成硅碳双键化合物25.通过改变中心硅原子或碳原子上的取代基可以制备出多种硅碳烯(Eq.11).该法与加热和光解法相比,原料简单,反应条件温和.

利用盐消除法既可以制备上述‘Wiberg'类型硅碳双键化合物外,也可以制备‘Auner/Jones'类型的硅碳双键化合物.该法利用乙烯基氯硅烷28与叔丁基锂反应,消除LiCl生成硅碳双键化合物29.1988年Auner课题组[39]用这种方法合成出化合物29a(Eq.12),但是由于取代基团为两个甲基,空间位阻较小,生成的双键化合物反应活性比较高,无法分离出来.1994年,Couret等人[40]通过引入大位阻取代基-Mes,分离出稳定的硅碳双键化合物29b(Eq.12).
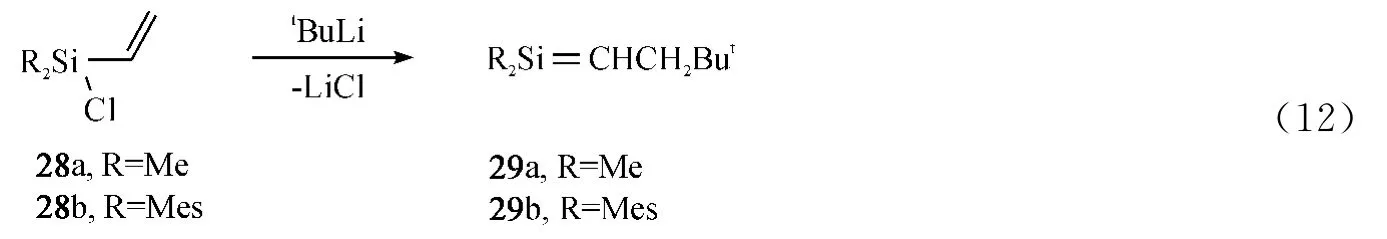
1.3 Sila-Peterson反应法制备硅碳双键化合物
Sila-Peterson法对底物中的官能团兼容性好.通过醛、酮、醇、烯醇醚与相应的金属试剂反应生成中间体30,经Peterson消除反应生成硅碳双键化合物31(Scheme 1).

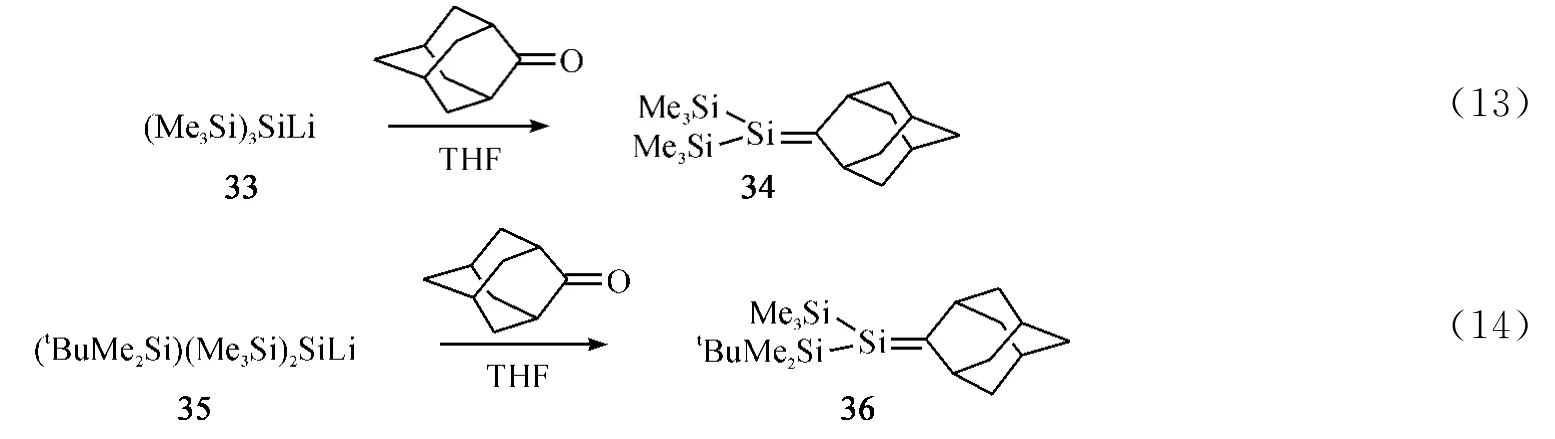
1992年,Apeloig课题组[41]用硅基锂试剂33与金刚烷酮反应制得硅碳双键化合物34,但34容易二聚成相应的二聚产物(Eq.13).在此基础上,Apeloig课题组通过增加中心硅原子上的位阻效应成功分离出相对稳定的硅碳双键化合物36(Eq.14)和38(Eq.15),并给出了它们的单晶数据.
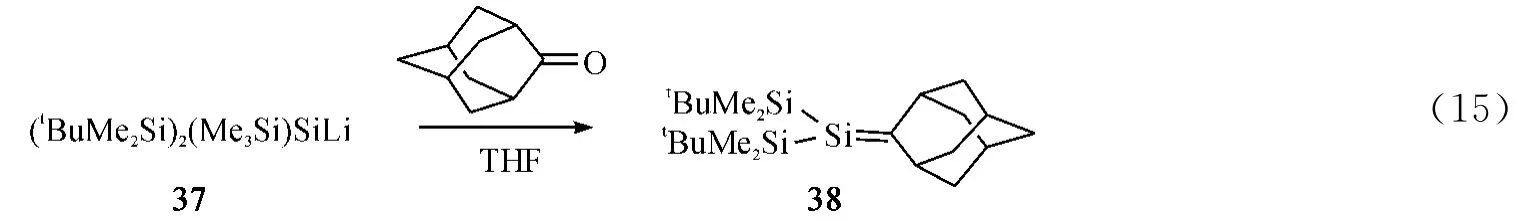
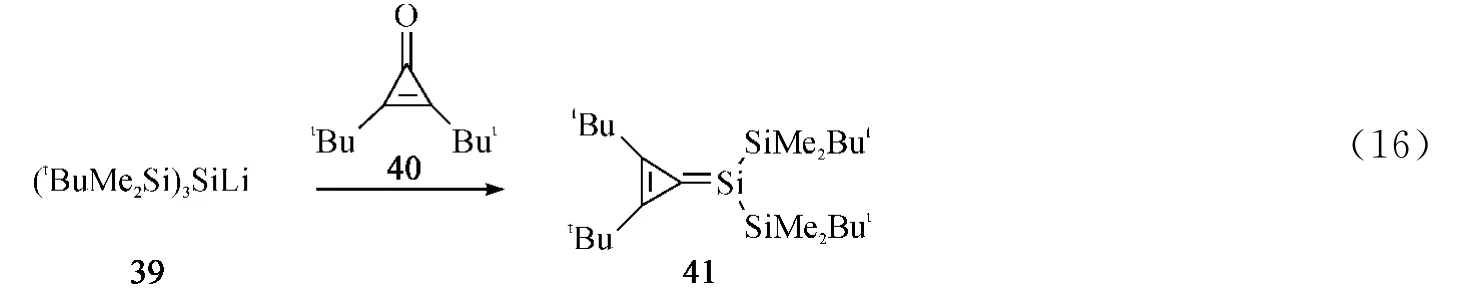
2002年,Kira课题组[42]通过硅基锂试剂39与环丙烯酮40反应分离得到稳定的硅碳双键化合物41(Eq.16).
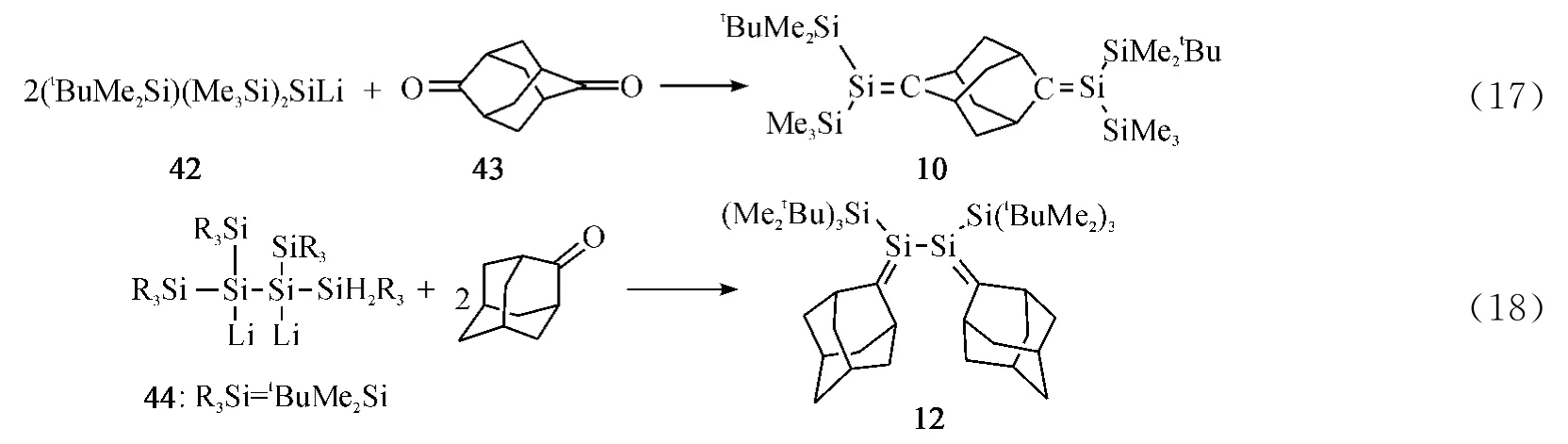
近年研究的重点从分子内含有单个硅碳双键的化合物逐渐集中于分子内含两个或多个硅碳双键的化合物.2003 年,Apeloig课题组[10]利 用Sila-Peterson 反应制备出分子内含两个硅碳双键化合物10(Eq.17).2014年Iwamoto课题组[12]利用双金属锂试剂与金刚烷酮反应合成出共轭1,3-丁二硅碳烯12(Eq.18),并且对其结构和反应活性进行了详细的研究.
2 硅碳双键化合物反应活性的研究
硅碳双键化合物的反应活性较高,自身既能进行二聚反应,也可以与一些亲核试剂、烯烃、炔烃等化合物进行亲核反应或加成反应.
2.1 硅碳双键化合物自身的二聚反应
在早期的工作中,由于合成手段有限,无法分离出稳定的硅碳双键化合物,其中最主要的一个原因是该类化合物极易进行头-头、头-尾的二聚反应(Eq.19).

Brook课题组对硅碳双键化合物的二聚进行了详细的研究,发现R 取代基团的大小对硅碳双键化合物的稳定性影响很大(Eq.20).当R 是金刚烷基a或者b等大位阻基团时,能分离到稳定的硅碳双键化合物5a[24]和5b[29],二者不进行二聚反应.当R 是叔丁基c时,由于取代基的位阻较大,因此能够检测到硅碳双键化合物5c,但不足以阻止其进行二聚反应,反应得到硅碳烯5c与二聚产物45c的混合物[25].当R=d,e,f时,无论是取代基的空间位阻效应,还是共轭效应都无法稳定硅碳烯5d-5f,反应只得到二聚产物45d,45e和46f[29-30]

1995年,Oehme课题组[43-46]对硅碳双键化合物47的二聚反应的动力学过程进行了研究.该二聚反应可能经历[2+2]和[4+2]加成两个过程.研究发现,硅碳双键首先进行二聚反应生成中间体48,然后重排形成化合物49,49经加热分解成二聚产物50.因此,他们得出了硅碳双键化合物47是通过[4+2]环加成两级动力学反应形成二聚产物50的结论(Scheme 2).

2.2 硅碳双键化合物与亲核试剂的反应
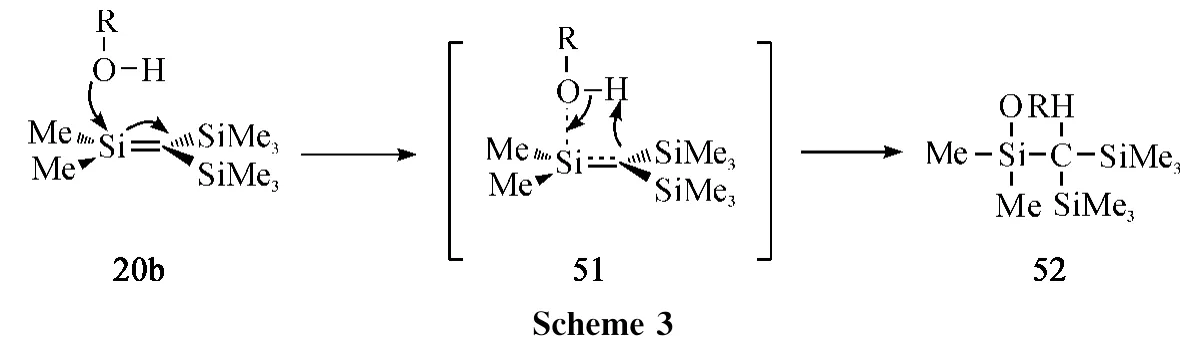
硅碳双键化合物由于硅碳双键可逆的极化作用导致中心硅原子显正电性,具有很强的亲电能力,能与一些亲核试剂发生反应(如:水、醇、胺、以及其它亲核试剂).Wiberg课题组[47]发现硅碳双键化合物与醇进行O-H 键插入反应生成相应的加成产物(Scheme 3).
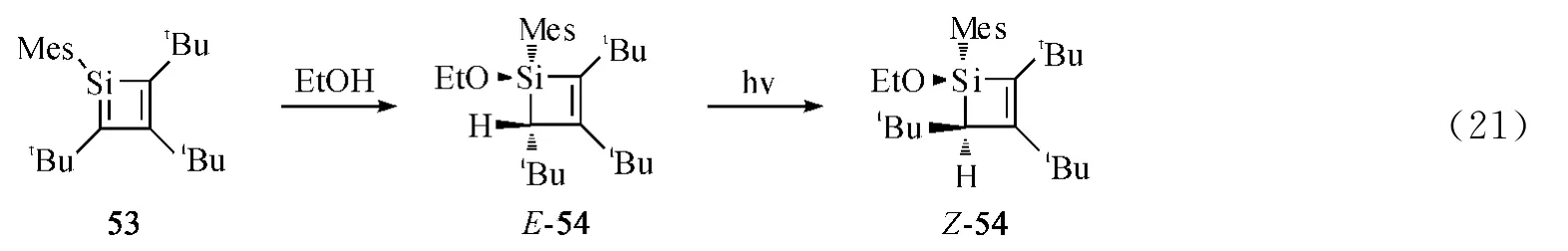
1991年,Fink课题组[48]研究了硅碳双键化合物与乙醇反应的立体选择性.53与乙醇反应生成具有立体专一性的顺式加成产物E-54,在光照下E-54从反式结构转变成顺式结构(Eq.21).

同年,Kira课题组[31]提出了硅碳双键化合物与醇反应的机理.硅碳双键化合物18与醇反应,生成的加成产物Z-56和E-56,二者的比例与醇的浓度和酸性有关.在高浓度醇的环境下,反应主要是通过双分子醇反应的a过程;在低酸性环境下,或者是与质子化比较强的醇作用,则主要经历分子内质子迁移的b过程.因此Z-56和E-56的比例按MeOH <n-Pr OH<i-Pr OH<t-Bu OH 依次增加.当与叔丁醇反应时,则基本上只有顺式加成产物Z-56(Scheme 4).
1997年,Kira课题组[49-52]第一次分析了Si=C 双键极性的改变对其与水和醇反应的影响.与常规的硅碳双键化合物相比,41的活性较低,几乎不与t-BuOH 反应.他们认为取代基空间位阻效应和可逆的极化共振结构,降低了Si=C的极性,从而导致其反应活性低.41与MeOH 反应生成非常规的加成产物57(Eq.22)[42],即甲氧基-OMe加成到三元环上,而不是中心硅原子上.

2011年,Sekiguchi课题组[53]发现碳双键化合物14与一分子甲醇反应生产加成产物58(Eq.23).
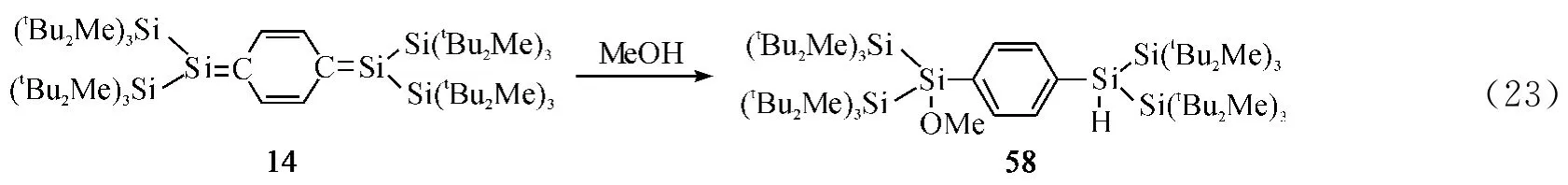
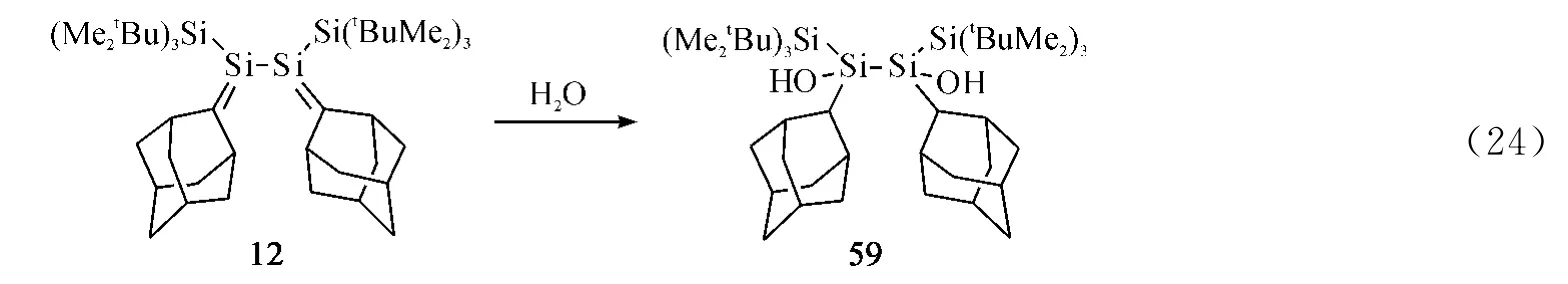
Iwamoto课题组[12]发现12 的两个硅碳双键分别与一分子的H2O 反应生产二羟基化合物59(Eq.24).
2.3 硅碳双键化合物与不饱和化合物的环加成反应
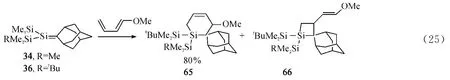
硅碳双键化合物易与烯烃、炔烃、羰基化合物等进行[2+2]或[2+4]环加成反应[54-55].Brook课题组对(Me3Si)2Si=C(OSiMe3)R 类型的硅碳双键化合物与不饱和烯烃的反应也做了大量的研究工作(Scheme 5).由于这种类型的硅碳烯中存在σ-π共轭效应,导致其能够产生可逆的极化作用.化合物5a,5f与2,3-二甲基-1,3-丁二烯反应得到[2+4]环加成产物62,同时分离到硅碳双键化合物的还原产物63,二者的比例为1.5∶1[56].化合物5a,5f与苯乙烯或甲基苯基乙炔反应生成相应的[2+2]环加成产物64和61[57];与二苯甲酮反应则经历了[2+4]环加成反应生成相应的产物60[59].
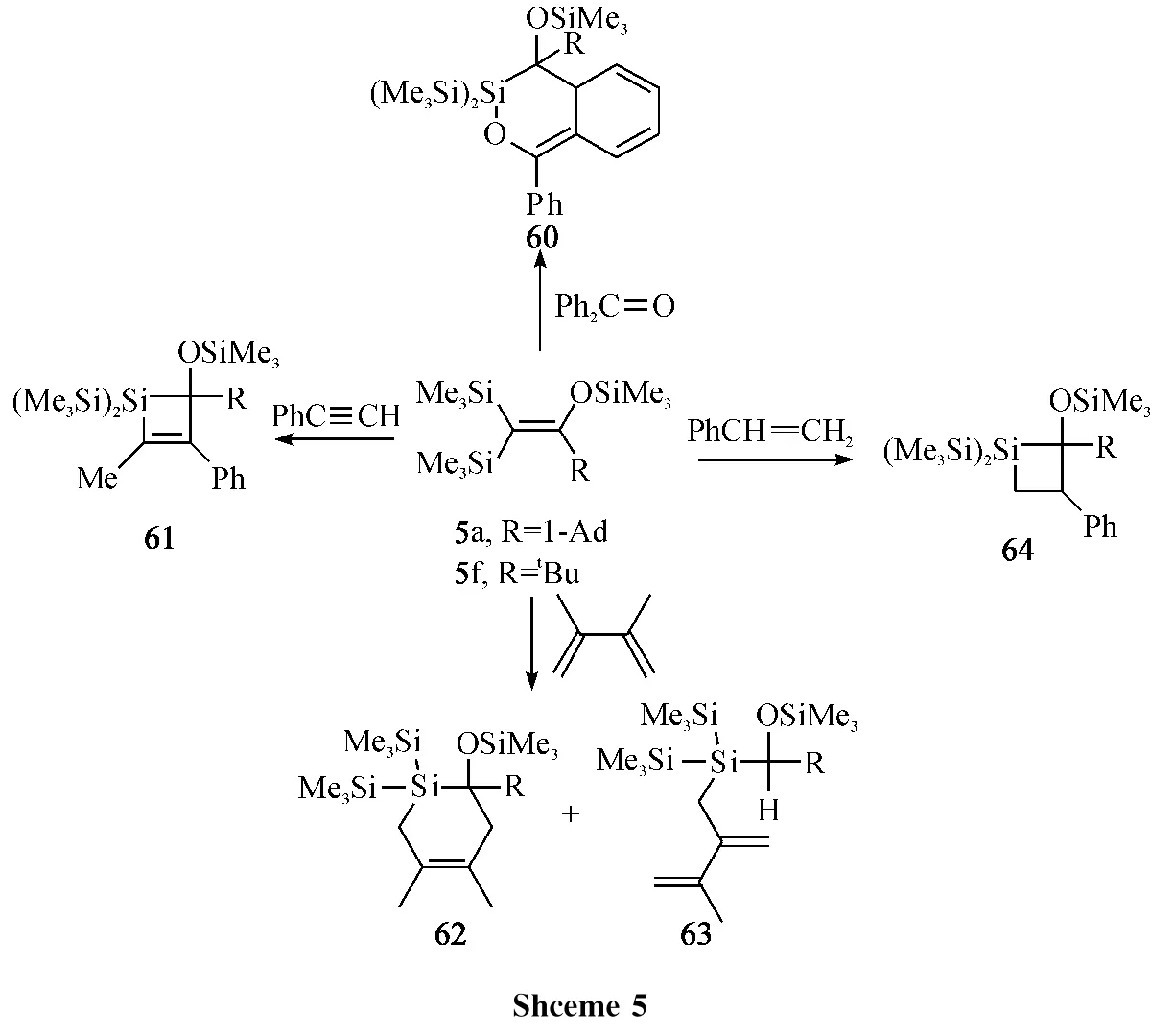
由于硅碳双键化合物34,36的Si=C 双键的极性比较低,与1-甲氧基-1,3丁二烯反应主要是通过[2+4]环加成反应生成65,同时分离到少量的[2+2]环加成产物66(Eq.25).这与此前Auner,Wiberg,and Couret[18],[59]报道的Si=C双键极性比较大的硅碳双键化合物的反应结果正好相反.
2014年,Iwamoto课题组[12]发现1,3-丁二硅碳烯12与两分子的酮67进行[2+4]环加反应生产加成产物68(Eq.26).

3 结论与展望
经过40多年的研究,不饱和硅碳双键化合物的合成与反应活性研究已经成为有机化学中的一个研究热点.随着合成手段的提高,越来越多的新型硅碳双键化合物被合成出来.通过这些工作,人们无论是对其物理和化学性质,还是对其反应机理都有了更深入的认识,丰富了不饱和含硅化学的内容.但是,由于现有的合成方法还比较有限,硅碳双键化合物的合成还是一项富有挑战性的工作.因此,寻找更为便捷的合成方法将成为今后一段时间内的研究重点.同时硅碳双键化合物反应活性的研究,及其在有机合成中的应用也将引起人们的极大关注.
[1]Gusel'nikov L E,Flower M C.The Thermal Decomposition of 1,l-Dimethyl-1-silacyclobutane and Some Reactions of an Unstable Intermediate containing a Silicon-Carbon Double Bond[J].J Chem Soc Chem Commun,1967,741(17):864-865.
[2]Brook A G,Abdesaken F,Gutekunst B,etal.A Solid Silaethene:Isolation and Characterization[J].J Chem Soc Chem Commun,1981,1213(4):191-192.
[3]Brook A G,Nyburg S,Abdesaken F,etal.Stable solid silaethylenes[J].J Am Chem Soc,1982,104:5667-5672.
[4]Nyburg S C,Brook,A G,Abdesaken F,etal.Structure of 2-(1-adamantyl)-2-trimethylsiloxy-1,1-bis(trimethylsily)-1-silaethylene[J].Acta Cryst C,1985,41(11):1632-1635.
[5]Apeloig Y,Bendikov M,Yuzefovich M,etal.Novel stable silenes via a Sila-Peterson-type reaction.Molecular structure and reactivity[J].J Am Chem Soc,1996,118(48):12228-12229.
[6]Wiberg N,Wagner G.Auf dem Wege zu einem stabilen Silaethen:Sterischüberladene Trisilylmethane tBu2SiX=CY(Si Me3)2(X,Y,H,Hal,Li)[J].Chem Ber,1986,119(5):1455-1466.
[7]Driess M.Silicon-phosphorus and silicon-arsenic multiple bonds[J].Adv Organomet Chem,1996,39:193-231.
[8]Rappoport Z,Apeloig Y.The Chemistry of Organic Silicon Compounds[M].New York:Wiley,1998:857-1062.
[9]EscudiéJ,Couret C,Ranaivonjatovo H.Silenes>Si=C<,germenes>Ge=C<and stannenes>Sn=C<:The French contribution[J].Coord Chem Rev,1998,178:565-592.
[10]Bravo-Zhivotovskii D,Korogodsky G,Apeloig Y.Synthesis of the first long-lived bis-silene[J].J Organomet Chem,2003,686(1):58-65.
[11]Bravo-Zhivotovskii D,Dobrovetsky R,Nemirovsky D,etal.The Synthesis and Isolation of a Metal-Substituted Bis-silene[J].Angew Chem Int Ed,2008,120(23):4415-4417.
[12]Motomatsu D,Ishida S,Ohno K,etal.Isolable 2,3-Disila-1,3-butadiene from a Double Sila-Peterson Reaction[J].Chem Eur J,2014,20(30):9424-9430.
[13]Kinjo R,Ichinohe M,Sekiguchi A,etal.Reactivity of a Disilyne RSiSiR(R=Si i-Pr[CH (SiMe3)2]2)towardπ-Bonds:Ste-reospecific Addition and a New Route to an Isolable 1,2-Disilabenzene[J].J Am Chem Soc,2007,129(25):7766-7767.
[14]Han J S,Sasamori T,Mizuhata Y,etal.Reactivity of an aryl-substituted silicon–silicon triple bond:1,2-disilabenzenes from the reactions of a 1,2-diaryldisilyne with alkynes[J].Dalton Trans,2010,39(39):9238-9240.
[15]Nozawa T,Nagata M,Ichinohe M,etal.Isolable p-and m-[((t)Bu2MeSi)2Si]2C6H4:disilaquinodimethane vs triplet bis(silylradical)[J].J Am Chem Soc.2011,133(15):5773-5775.
[16]EscudiéJ,Ranaivonjatovo H,Rigon L.Heavy Allenes and Cumulenes ECE'and ECCE'(E=P,As,Si,Ge,Sn;E'=C,N,P,As,O,S)[J].Chem Rev,2000,100(10):3639-3696.
[17]Morkin T L,Leigh W J.Substituent effects on the reactivity of the silicon-carbon double bond[J].Acc Chem Res,2001,34(2):129-136.
[18]Gusel'nikov L E.Hetero-π-systems from 2+2 cycloreversions.Part 1.Gusel'nikov–Flowers route to silenes and origination of the chemistry of doubly bonded silicon[J].Coord Chem Rev,2003,244(1-2):149-240.
[19]Ottosson H,Eklöf A M.Silenes:Connectors between classical alkenes and nonclassical heavy alkenes[J].Coord Chem Rev,2008,252(12-14):1287-1314.
[20]Ottosson H,Steel P G.Silylenes,Silenes,and Disilenes:Novel Silicon-Based Reagents for Organic Synthesis[J].Chem Eur J,2006,12(6):1576-1585.
[21]Conlin R T,Namavari M,Chickos J S,etal.Kinetics and mechanism of the thermal decomposition of(E)-and(Z)-1,1,2,3-tetramethylsiletane[J].Organome,tallics,1989,8(1):168-175.
[22]Pola J,Volnina E A,Gusel nikov L E.Production of poly(silaisoprene)by laser-induced decomposition of 1-methyl-1-vinyl-1-silacyclobutane[J].J Organomet Chem,1990,391(3):275-282.
[23]Leigh W J,Bradaric C J,Kerst C,etal.Mechanistic Studies of the Reactions of Silicon-Carbon Double Bonds.Addition of Alcohols to 1,1-Diphenylsilene[J].Organometallics,1996,15(9):2246-2253.
[24]Brook A G,Nyburg S C,Abdesaken F,etal.Stable solid silaethylenes[J].J Am Chem Soc,1982,104(21):5667-5672.
[25]Brook A G,Harris J W,Lennon J,etal.Relatively stable silaethylenes.Photolysis of acylpolysilanes[J].J Am Chem Soc,1979,101(1):83-95.
[26]Zhang S,Conlin R T,McGarry P F,etal.Reaction kinetics,quantum yields,and product studies for the dimerization of a stabilized silene[J].Organometallics,1992,11(6):2317-2319.
[27]Baines K M,Brook A G.Photolysis of acylpolysilanes containing.alpha.-hydrogens.Formation of linear head-to-head silene dimers[J].Organometallics,1987,6(4):692-696.
[28]Baines K M,Brook A G,Ford R R,etal.Photochemical rearrangements of stable silenes[J].Organometallics,1989,8(3):693-709.
[29]Brook A G,Abdesaken F,Gutekunst G,etal.Carbon-13 and silicon-29 chemical shifts and coupling constants involving tris(trimethylsilyl)silyl systems[J].Organometallics,1982,1(7):994-998.
[30]Brook,A G,Krishna R,Kallury M.Attempted stabilization of silaethylenes with aryl or trifluoromethyl groups[J].Organometallics,1982,1(7):987-994.
[31]Kira M,Maruyama T,Sakurai H.Stereochemistry and Mechanism for the Addition of Alcohols to a Cyclic Silene[J].J Am Chem Soc,1991,113(10):3986-3987.
[32]Sekiguchi A,Ando W.Decompositions of polysilylated diazomethanes.Silene formations by selective silyl migration[J].Organometallics,1987,6(9):1857-1860.
[33]Wiberg N,Preiner G,Schieda O,etal.Erzeugung und Nachweis des Silaethens Me2Si=C(SiMe3)2:Thermischer Zerfall von(Me3Si)2(Me2XSi)Cli(Xz.B.Hal,OR,SR)[J].Chem Ber,1981,114(11):3505-3517.
[34]Wiberg N,Preiner G,Schieda O.Reaktivität des Silaethens Me2Si=C(Si Me3)2:Thermolyse von(Me3Si)2(Me2XSi)CLi(Xz.B.(Ph O)2PO2)in Anwesenheit von Silaethen-Fängern[J].Chem Ber,1981,114(11):3518-3532.
[35]Wiberg N,Link M,Fischer G.Erzeugung und Nachweis des Silaethen Ph2Si=C(Si Me3)2[J].Chem Ber,1989,122(3):409-418.
[36]Wiberg N,Fischer G,Schurz K.Notiz zur Reaktivität des Silaethens Me2Si=C(SiMe3)2:Konformative Effekte bei Diels-Alder-Reaktionen mit trans-und cis-Piperylenl)[J].Chem Ber,1987,120(9):1605-1606.
[37]Wiberg N,Schurz K,Fischer G.Notiz zur Reaktivität des Silaethens Me2Si=C(Si Me3)2:Regiospezifität der Diels-Alder-Reaktionen mit Isopren und Piperylen[J].Chem Ber,1986,119(11):3498-3501.
[38]Wiberg N,Passler T,Polborn K.Erzeugung Stabilisierung und Reaktivität des Silaethens[J].J Organomet Chem,1997,531(1):47-59.
[39]Auner N.Silaheterocyklen.III.Erzeugung und Reaktivität von Di-tbutyl-Neopentylsilaethen,tBu2Si=CHCH2tBu[J].Anorg Allg Chem,1988,558(1):87-106.
[40]Delpon-Lacaze G,Couret C.Organometallic alkenes:the first stable silene in the neopentyl series[J].J Organomet Chem.1994,480(1):c14-c15.
[41]Bravo-Zhivotovskii D,Braude V,Stanger A,etal.Novel route to carbon-silicon double bonds via a Peterson-type reaction[J].Organometallics,1992,11(7):2326-2328.
[42]Sakamoto K,Ogasawara J,Kon Y,etal.The First Isolable 4-Silatriafulvene[J].Angew Chem Int Ed,2002,114(8):1460-1462.
[43]Krempner C,Reinke H,Oehme H.Synthesis of Transient Silenes by a Modified Peterson Reaction[J].Chem Ber,1995,128(2):143-149.
[44]Krempner C,Reinke H,Oehme H.Controlled Conversion of the Transient 2-Mesityl-1,1-bis(trimethylsilyl)silene into a Tetrahydro-2,3-disilanaphthalene,a 1,2-Disilacyclobutane,or a 1,3-Disilacyclobutane[J].Chem Ber,1995,128(11):1083-1088.
[45]Luderer F,Reinke H,Oehme H.2-(2,4-Di-tert-butylphenyl)-1,1-bis(trimethylsilyl)silene and 2-(2,4,6-Tri-tert-butylphenyl)-1,1-bis(trimethylsilyl)silene–Two New Sterically Protected but Still Unstable Silaethenes[J].Chem Ber,1996,129(1):15-20.
[46]Hoffmann D,Reinke H,Oehme H.Head-to-head versus head-to-tail dimerizations of transient silenes—the synthesis and reactivity of 2-(8-dimethylamino-1-naphthyl)-and 2-(4-dimethylamino-1-naphthyl)-1,1-bis(trimethylsilyl)silene[J].J Organomet Chem,1999,585(1):189-197.
[47]Auner N,Grobe J,Müller T,etal.Transient Silenes and Their Dimethyl-d 6 Ether Donor Complexes from the Gas-Phase Pyrolysis of Siletanes[J].Organometallics,2000,19(18):3476-3485.
[48]Tamao K,Hayashi T,Ito Y,etal.Frontiers of Organosilicon Chemistry[M].Cambridge:Royal Society of Chemistry,1991:285.
[49]Sakamoto K,Ogasawara J,Sakurai H,etal.The First Silatriafulvene Derivative:Generation,Unusually Low Reactivity toward Alcohols,and Isomerization to Silacyclobutadiene[J].J Am Chem Soc,1997,119(14):3405-3406.
[50]Veszprémi T,Takahashi M,Ogasawara J,etal.An ab initio MO study of structure and reactivity of 4-silatriafulvene[J].J Am Chem Soc,1998,120(10):2408-2414.
[51]Takahashi M,Sakamoto K.Two geminal delocalizations affect the structural preference of disilyne and its derivatives[J].J Phy Chem,2004,108(26):5710-5714.
[52]Takahashi M,Sakamoto K,Kira M.Substituent effects on inversion motion of 4-silatriafulvene derivatives:An ab initio MO study[J].Int J Quant Chem,2001,84(2):198-207.
[53]Nozawa T,Nagata M,Ichinohe M,etal.Isolable p-and m-[(t-Bu2MeSi)2Si]2C6H4:Disilaquinodimethane vs Triplet Bis(silyl radical)[J].J Am Chem Soc,2011,133(15):5773-5775.
[54]Raabe G,Michl J G,Patai S,etal.The Chemistry of Organic Silicon Compounds[M]//Pataiand S,Rappoport Z.New York:Wiley Chichester,1989:1015-1142.
[55]Conlin R T,Namavari M.Reactions of 1,1-dimethylsilabutadiene.Stereospecific 4+2 and nonstereospecific 2+2 cycloadditions[J].J Am Chem Soc,1988,110(11):3689-3690.
[56]Brook A G,Vorspohl K,Ford R R,etal.Reactions of stable silenes with dienes and alkenes:[2+2],[2+4]and ene reactions[J].Organometallics,1987,6(10):2128-2137.
[57]Brook A G,Baumegger A,Lough A J.Stable silene geometric isomers[J].Organometallics 1992,11(9):3088-3093.
[58]Brook A G,Chatterton W J,Sawyer J F,etal.1,2-Siloxetanes:formation,structure,and rearrangements[J].Organometallics,1987,6(6):1246-1256.
[59]Brook A G,Brook M A.The chemistry of silenes[J].Adv Organomet Chem,1996,39:71-158.
