浒苔多糖的结构、制备与降解研究进展
2022-06-29宁利敏姚忠朱本伟孙芸
宁利敏,姚忠,朱本伟*,孙芸
(1.南京中医药大学医学院·整合医学院,江苏南京 210023)(2.南京工业大学食品与轻工学院,江苏南京 211816)
近年来,我国黄海海域经常爆发由漂浮浒苔导致的绿潮,严重危害海洋生态环境。浒苔(Enteromorphasp.)属于绿藻门石莼科浒苔属,大约有40个种,而我国约有9个种,常见的有浒苔(Enteromorpha prolifera)、肠浒苔(Enteromorpha intestinalis)、缘管浒苔(Enteromorpha linza)等(图1)[1]。浒苔具有丰富的营养价值,其中蛋白占细胞干重的22%,还含有亚油酸、亚麻酸、棕榈酸和花生四烯酸等十余种多不饱和脂肪酸,经常被加工为海苔条等健康食品。浒苔细胞壁的主要成分是具有复杂结构的浒苔多糖[2]。研究发现,浒苔多糖由鼠李糖、阿拉伯糖、木糖、半乳糖、岩藻糖和葡萄糖醛酸等单糖或单糖醛酸组成,而且组成的单糖种类和含量还随着浒苔种类、采收季节、生长条件等因素的不同而不同[3]。浒苔多糖作为浒苔的主要活性成分,具有多种生物活性,如抗氧化、抗肿瘤、免疫调剂和降血脂等[4-7]。浒苔多糖主要是通过热水浸提法、微波或超声辅助提取等方法获得,但是由于其分子量较大,浒苔多糖具有溶解性差、生物利用率低等缺陷,这极大地限制了浒苔多糖资源的高值化开发和利用。
浒苔多糖经降解后得到的降解产物不仅保持了多糖所具有的多种生物活性,而且还在溶解性、生物利用度等方面有了较大的提升,使得浒苔多糖降解产物的制备与活性研究成为海洋生物资源开发研究领域的热点[8]。目前,关于浒苔多糖的研究报道正日益增多,尚未有相关论文对目前的研究进展进行完善地总结和讨论。本文对浒苔多糖的化学组成、提取方法、分离与结构分析等研究报道进行了系统总结,并综述和分析了浒苔多糖降解产物的制备方法,以及浒苔多糖降解产物活性方面的研究进展。在论文的最后,分析了当前浒苔多糖研究存在的主要问题和技术瓶颈,为推动浒苔多糖的高值化利用和促进绿潮生态灾害的无害化处理提供理论基础和借鉴。
1 浒苔多糖的化学组成
浒苔多糖的化学组成较为复杂,而且会根据来源的浒苔种类、浒苔的生长条件、采收季节以及多糖的纯化方法等的不同而有所差异[9,10],浒苔多糖中的单糖组成如图2所示。齐晓辉等[11,12]研究了来源于缘管浒苔、青岛绿潮浒苔和厦门条浒苔的浒苔多糖的化学组成。研究发现缘管浒苔多糖主要由鼠李糖构成,还含有少量的半乳糖、木糖和葡萄糖醛酸;厦门条浒苔多糖则主要由阿拉伯糖和半乳糖组成,此外还含有少量的鼠李糖和微量的岩藻糖、木糖、甘露糖和葡萄糖等成分;青岛绿潮浒苔多糖则主要由鼠李糖组成,此外还含有少量的葡萄糖醛酸、氨基葡萄糖和甘露糖,表明不同种类的浒苔所含的多糖组成差异较大。石学连等[10]研究了不同时间采集的条浒苔多糖的单糖组成,发现这些样品中的单糖种类基本一致,但各种单糖的含量有所差异。例如,6月份和11月份采集的浒苔中,多糖中的甘露糖、鼠李糖、葡萄糖、半乳糖和木糖的组成比例分别为6.74:65.56:5.54:2.83:19.33和2.81:67.55:2.31:2.71:24.61[10]。此外,嵇国利等[13]分析了处于爆发期的条浒苔多糖的化学组成,结果发现除了除鼠李糖和葡萄糖醛酸外,浒苔多糖中还含有艾杜糖醛酸,但是不含甘露糖,而之前并未有条浒苔多糖含有艾杜糖醛酸的报道,这表明处于爆发期的浒苔与正常生长条件下的条浒苔多糖成分存在明显差异。由此可见,浒苔的生长或采收时间不同,浒苔多糖的组分也有所差异,这在其他藻类多糖的成分分析中也有发现[14]。
2 浒苔多糖的结构
由于浒苔多糖中的单糖组成比较复杂,单糖间的连接方式以及基团修饰等的复杂多样,存在分枝结构等原因,浒苔多糖结构的复杂性远超过其他藻类多糖(如褐藻胶、卡拉胶和琼胶多糖等)[3,15]。齐晓辉等[12]对不同来源的浒苔多糖的结构进行研究,发现青岛缘管浒苔(Enteromorpha linza)的多糖由5种多糖组分(MCS、MHS、SCS、SH1S和SH2S),和[→4)-β-D-Xylp-(1→]组 成,并 含 有 少 量 的[→2)-α-L-Rhap-(1→] 、 [→3)-α-L-Rhap-(1→] 、[→3,4)-α-L-Rhap-(1→]、[→2,3)-α-L-Rhap-(1→]和[→2,4)-α-L-Rhap-(1→],硫 酸 基 则 主 要 位 于[→4)-α-L-Rhap-(1→]的C3位。5种多糖组分的化学组成详见表1[12]。而从青岛绿潮浒苔(Enteromorpha prolifera)中可分离得到四种多糖组分QC1S、QCQ2、QCQ3和QHS[12]。如表1所示,该多糖主要含有两种二 糖 结 构 单 元;[→4)-β-D-ClcUAp-(1→4)-α-L -Rhap3S-(1→]和[→4)-β-D-Xylp-(1→4)-α-L-Rhap3S- (1→]。其中,QC1S组分主要由[→4)-α-L-Rhap-(1→]和[→4)-β-D-Xylp-(1→]组 成,含 有 少 量 的[→2)-α-L-Rhap4S-(1→]、[→3)-α-L-Rha4S-(1→]、[→4)-α-L-Rhap2S-(1→]和[→3,4)-α-L-Rhap-(1→];而QHS组分主要由[→4)-α-L-Rhap-(1→]、[→4)-β-D- Xylp-(1→]和[→4)-β-D-GlcUAp-(1→]组成,含有少量的[→3)-α-L-Rhap-(1→]和[→2,4)-α-L-Rhap-(1→],硫酸基位于[→4)-α-L-Rhap-(1→]的C3位。最后从厦门条浒苔(Enteromorpha clathrata)中分离得到了3个多糖组分(XCS、XH1S和XH2S),如表1所示,XCS主要由[→2)-β-D-Galp-(1→]、[→3)-β-D-Galp-(1→]、[→4)-β-D-Galp-(1→]和[→6)-β-D-Galp-(1→]组成,含有少量的[→4)-β-L-Arap-(1→]、[→2)-α-L-Rhap-(1→]、[→3)-α-L-Rhap-(1→]和[→2)-α-L-Rhap-(1→],硫酸基主要位于[→4)-β-D-Galp-(1→]的C6位或者C2位、[→6)-β-D-Galp-(1→]的C4位或者C2位。XH1S主要由[→4)-β-L-Arap-(1→]组成,含有少量的[→3)-β-D-Galp- (1→]、[→4)-β-D-Galp-(1→]和[→6)-β-D-Galp-(1→],硫酸基主要位于[→4)-β-L-Arap-(1→]的C3位;XH2S主 要 由[→4)-β-L-Arap3S-(1→]组 成,含 有 微 量[→4)-β-L-Arap-(1→]和[→3)-α-L-Rhap4S-(1→][12]。

表1 不同种类浒苔的多糖化学组成[12] Table 1 The chemical composition of different Enteromorpha polysaccharide [12]
焦丽丽等[16]从肠浒苔(Enteromorpha intestinalis)中提取得到两个多糖组分(WEB和DAEB),通过结构分析发现WEB中Rha以(1→4)键型为主,还有(1→2),(1→2,4)、(1→4)、和(1→3)连接键型;Xyl和Gal之间的连接键型均为(1→),同时含有(1→4)-GlcA及少量的(1→)-GlcA;该糖中每5个(1→4)-Rha中就有一个分支,分支点在O-2。WEB和WEBD的13C-NMR分析表明,WEB中硫酸根位于鼠李糖的O-3。DAEB甲基化研究表明DAEB由(1→)-Rha、(1→4)-Rha、(1→2,4)-Rha、(1→)-Xyl、(1→2,3)-Xyl、(1→3)-Xyl、(1→4)-Glc及(1→3)-Gal组成;每6个(1→4)-Rha中就有一个分支,分支点在O-2。另外,通过研究DAEB和DAEB-D的甲基化修饰发现,大部分硫酸根位于(1→4)-Rha的O-3,还有一少部分硫酸根位于(1→3)-Xyl的O-2位。石学连等[10]利用红外光谱和核磁共振波谱等分析缘管浒苔多糖组成,发现缘管浒苔多糖主要包括(1→2,4)-和(1→4)-连接的鼠李糖残基,(1→4)-连接的木糖残基,其中硫酸根主要连接在鼠李糖基3位。从以上研究不难看出,不同种类浒苔多糖的结构差异很大,这种差异性不仅体现在多糖的化学组成上,还体现在糖苷键的连接方式、硫酸基团的位置以及分支点的位置及数量上。由此可见,浒苔多糖是含有多种结构单元、连接方式复杂多样且含有支链的杂多糖,因而研究其精细结构具有非常大的难度和挑战性。
3 浒苔多糖的提取与纯化
目前关于浒苔多糖提取和纯化方法的报道很多,但是按照提取和纯化的工艺,可以将提取方法归结为三大类,即溶液浸提法、物理提取法和酶辅助提取法[17],浒苔多糖的纯化方法也可归结为三大类,即离子交换色谱法和凝胶过滤色谱法,以及这两分离种方法的联用[18]。
3.1 浒苔多糖的提取方法
浒苔多糖的提取方法与其他植物多糖的提取方法类似,主要包括热水提取法、酸碱提取法等溶液提取法、酶法辅助和物理辅助提取法[19]。
3.1.1 溶液提取法
溶液提取法主要包括热水浸提法和酸碱浸提法。许福超等[20]以料液比1:60,在90 ℃条件下提取4 h,多糖提取率可达21.96%。李霞等[21]按照料液比1:20(m/V,g/mL)加入80%的乙醇加热回流提取3次,每次回流2 h,干燥后按照料液比1:16加入蒸馏水浸泡过夜后在100 ℃提取3 h,重复两次,回收水提液蒸发浓缩后采用75%的乙醇进行醇沉。齐晓辉等[12]按照料液比1:75的比例混匀后在室温搅拌4 h,过滤得到多糖的冷水提取液。然后将滤渣也按照1:75的料液比在90 ℃水浴中搅拌4 h后过滤得到多糖的热水提取液。将冷水提取液与热水提取液合并后进行浓缩,采用95%的乙醇进行沉淀,多糖提取率在7.3%~22.6%之间。吴明江等[22]先用95%的乙醇在80 ℃条件下提取2 h除去小分子,然后按照1:15的料液比在90 ℃提取2 h,粗多糖的提取率约为15%。同样地,嵇国利[13]和Cho等[23]在水提的工艺前先用乙醇浸提,然后再按照料液比1:20,65 ℃或者90 ℃热水提取2 h,多糖提取率为34.87%。热水浸提法提取多糖所需的时间较长,且提取的多糖含有较多水溶性杂质,而在水提前增加醇提工艺,可去除一部分既溶于水又溶于乙醇的物质,多糖的纯度可以得到大大提高。
此外,在热水浸提法的基础上,还可以通过改变提取液的pH值来改进浒苔多糖的提取工艺。林威等[24]采用碱法提取浒苔多糖,通过单因素多水平实验优化料液比、提取温度、提取时间和碱溶液浓度等因素,获得了提取的最佳工艺条件,即提取温度90 ℃、提取时间2.5 h、料液比1:4、NaOH溶液浓度0.3 mol/L,浒苔多糖的提取率可达3.1%。宋雪原等按照料液比1:50加入0.05 mol/L的HCl进行回流提取2 h,滤渣重复提取三次,合并滤液后浓缩加入3倍体积的无水乙醇沉淀。孙士红等[25,26]采用0.5 mol/L的NaOH对浒苔滤渣进行提取,合并滤液后加入3倍体积的95%乙醇进行沉淀,多糖的收率可达33.3%。张智芳等[27]将浸提液的pH和料液比分别调整为5和1:90,在80 ℃条件下提取4 h,多糖的提取率为8.73%。Ray[3]调整料液比为1:150,采用1 mol/L KOH溶液4~8 ℃提取16 h,然后30~35 ℃提取6 h,提取率可达4.32%;将上述剩余残渣按料液比1:150加入4 mol/L KOH后,30~35 ℃提取6 h,然后4~8 ℃提取16 h,仍可得到3.78%的浒苔多糖。嵇国利[13]先采用85%乙醇浸提,然后按照料液比1:20,再90 ℃条件下提取2 h,提取率为17.56%,将10倍2%的NaOH溶液再加入到剩余残渣中,90 ℃提取1 h,仍然可得到10.45%的浒苔多糖。与热水浸提法相比,酸液或碱液提取法可提高对提取物的选择性,但由于酸碱溶液对设备要求较高且会污染环境,因此不利于绿色化和工业化生产。
3.1.2 酶辅助提取法
酶辅助提取法在水提法的基础上,结合酶技术提取多糖。酶可以降解浒苔细胞壁中的纤维素、半纤维素及果胶,而细胞壁结构的破坏则可提高多糖的溶出速度和效率[28]。潘晓慧等[29]在浒苔的水提物中加入了中性蛋白酶和风味蛋白酶,酶解后采用70%的乙醇进行醇沉得到两种浒苔多糖的粗品,提取率分别为22.90%和21.50%。吕海涛等[30]在浒苔的水提液中加入木瓜蛋白酶进行酶解,3 h后过滤浓缩并加入4倍体积的无水乙醇进行沉淀,多糖的提取率可达27.75%。肖宝石等[31]比较了热水提取法和酶辅助提取法的提取率,热水浸提法的浒苔多糖提取率为10.43%,而加入木瓜蛋白酶,60 ℃酶解2 h后浒苔多糖的提取率可达13.88%。徐大伦等[32]引入纤维素酶提取浒苔多糖,40 ℃提取2.5 h,提取率可达20.22%。因而,酶辅助提取法中,酶的加入有利于破坏细胞结构和多糖的溶出,而且对于提取温度的要求较低,因此,酶法是浒苔多糖提取最有优势和应用前景的方法。
3.1.3 物理辅助提取法
3.1.3.1 超声波辅助提取法
超声波辅助提取法采用超声波辅助溶剂提取多糖,超声波通过破坏浒苔细胞结构促进多糖的溶出,缩短提取所需的时间,从而提高多糖的提取效率。郭雷等[33]通过响应面设计优化了超声波辅助浒苔多糖提取的工艺条件,得到了提取的最佳工艺,在即温度80 ℃、料液比1:63的条件下超声28 min,提取率仅为25.84 mg/g。唐志红等[34]在超声功率531.17 W的条件下提取4.8 min,获得的提取率为17.42%。该方法具有提取时间短、多糖的提取率较高的优点。但同时,也由于该方法的提取时间过短,需要大量的实验来对提取条件进行优化来提高提取率。
3.1.3.2 微波辅助提取法
除了在多糖的提取中将超声作为辅助手段外,微波由于能加速溶液对浒苔多糖的提取过程和多糖从细胞中的溶出而受到了研究者的重视。陈小梅等[35]调整料液比为1:62,使用610 W作用微波11 min提取浒苔多糖,提取率为7.58%。郭雷等[33]按照料液比1:78,在微波功率800 W,95 ℃的条件下作用32 min提取浒苔多糖,得到的提取率仅为4.04%。由此可见,微波辅助提取法可大大节约提取时间,并提高多糖的提取效率,但却无法提高多糖得率和纯度。目前,浒苔多糖的提取方法均以水提法为基础,结合多种辅助提取技术衍生出了各种提取方法,但每种方法都有其特定的优点和缺陷,而将多种方法结合使用,就可达到取长补短的效果,从而快速高效地提取浒苔多糖[36]。
3.2 浒苔多糖的纯化方法
在通过热水浸提等方法获得浒苔多糖的粗品后,需要经过进一步的纯化才能得到可用于结构和活性研究的多糖样品。首先,多糖的纯化需要去除蛋白质和其他小分子等非多糖杂质。浒苔多糖去蛋白常用Savage法、三氯乙酸法和蛋白酶法[18]。王明莹[37]利用链酶蛋白酶结合Savage试剂和透析处理,可将2种多糖中的蛋白质和核酸除尽。林叶等[38]采用三氯乙酸脱法对粗浒苔多糖脱蛋白,脱蛋白率可达51.69%。目前,小分子杂质的去除则可以采用乙醇重沉淀法、透析法、凝胶过滤法和离子交换树脂法等。除此之外,纯化后的浒苔多糖还需通过离子交换柱层析法和凝胶柱层析法等方法进行进一步地分级和精制。
离子交换色谱(Ion Exchange Chromatography,IEC)是以离子交换剂为固定相,依据流动相中的组分离子与交换剂上的平衡离子进行可逆交换时的结合力大小的差别而进行分离的一种层析方法。浒苔多糖在一定pH值条件下所带电荷不同,因此可以根据各多糖上电荷的差异而对多糖组分进行纯化和分离。齐晓辉等[11]使用例子交换色谱Q Sepharose Fast Flow,以 NaCl为流动相对来源于青岛缘管浒苔(Enteromorpha linza)、青岛绿潮浒苔(Enteromorpha prolifera)和厦门沿海条浒苔(Enteromorpha clathrata)的浒苔多糖进行梯度洗脱和纯化,分别得到了5个、4个和3个多糖组分。潘晓慧等[29]采用DEAE Sepharose Fast Flow离子交换层析对江苏浒苔多糖进行纯化,分别以0.5、0.6和1 mol/L NaCl作为流动相,分离得到了4个多糖组分。焦丽丽等[16]采用DEAE Sepharose CL-6B作为分离介质纯化肠浒苔多糖,以0.9% NaCl作为流动相,分离得到了2个多糖组分。许晶晶等[39]以阴离子交换柱为分离介质纯化浒苔多糖,以0.2~0.8 mol/L NaCl作为流动相得到了1个多糖组分。
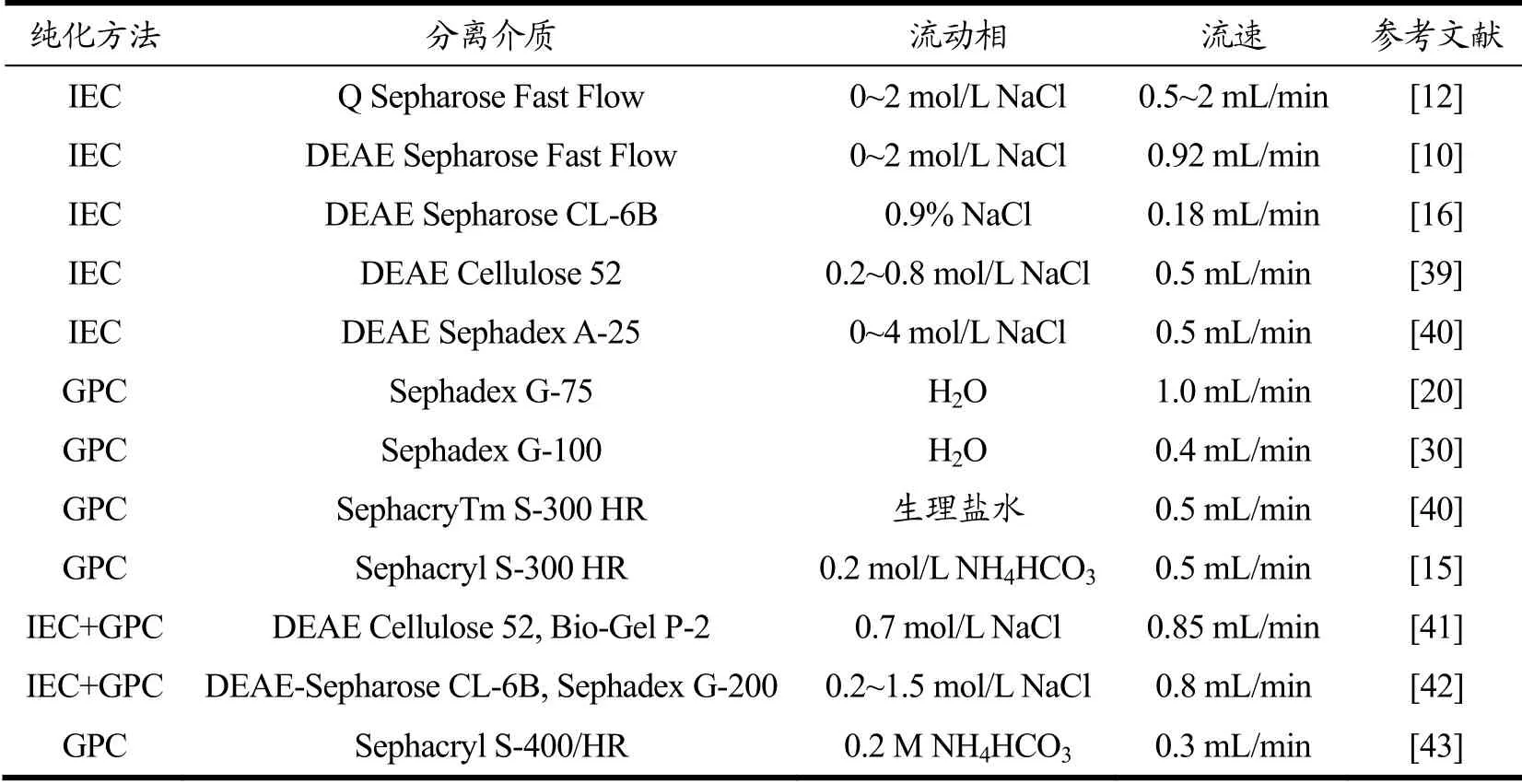
表2 纯化浒苔多糖所用的分离方法汇总 Table 2 The summary of methods for purification of Enteromorpha polysaccharide
除此以外,凝胶渗透色谱(Gel Permeation Chromatography、GPC)也常用于浒苔多糖的分离和纯化。许福超等[20]以Sephadex G-75凝胶柱作为分离介质,用1.0 mL/min水作为流动相洗脱,得到一个浒苔多糖的组分。吕海涛等[30]利用Sephadex G-100凝胶,以水作为流动相得到了2个多糖组分。此外,徐大伦等[40]利用凝胶柱SephacryTm S-300 HR分离得到2个浒苔多糖的组分。综上,离子交换法是基于多糖所带电荷不同来实现对浒苔多糖的不同组分进行分离的,而凝胶渗透色谱是利用多糖的分子大小的差异来实现不同组分的分离。因此,对于分子量相差不大但是所带电荷不同的多糖组分可以优先选用离子交换色谱进行分离,而对于所带电荷情况类似但分子量有较大差异的组分则可优先选用凝胶渗透色谱进行区分。在浒苔多糖的分离中往往先用离子交换柱层析得到几个不同组分,再用凝胶柱层析获得更加均一的不同分子量大小多糖组分。Lin等[41]先以0.7 mol/L NaCl溶液为洗脱液,采用 0.85 mL/min流速,利用DEAE-Cellulose 52进行离子交换层析,再用以水为洗脱液,按照0.85 mL/min流速,采用Bio-Gel P-2凝胶过滤层析,进一步纯化多糖组分。Tang等[42]先利用DEAE-Sepharose CL-6B离子交换层析,以0.2~1.5 mol/L NaCl溶液为洗脱液,流速0.8 mL/min,再用Sephadex G-200凝胶可得到纯化的多糖组分。
4 浒苔多糖的降解方法
目前关于降解浒苔多糖的报道较少,但是按照降解所用的方法进行分类,可以将浒苔多糖降解的方法总结为三大类,即物理降解法、化学降解法和酶法降解。
4.1 化学法降解浒苔多糖
化学法降解浒苔多糖的报道较少,仅有高玉杰等[44]利用三氟乙酸(TFA)对浒苔多糖进行降解,用于制备低分子量的浒苔多糖。另外,段科等[45]采用自由基降解浒苔多糖,并获得浒苔多糖最佳降解工艺条件为H2O2联合维生素C浓度15 mmol/L、温度50 ℃、反应时间2 h和料液比1:50(g/mL),浒苔寡糖的得率为58.33%。吕海涛等[5]利用TFA和硝酸对浒苔多糖进行降解,并对降解的工艺条件进行了优化。
4.2 物理法降解浒苔多糖
物理法降解浒苔多糖的报道同样比较少,可能是由于物理法降解多糖的条件较为剧烈,会对寡糖的结构造成破坏。Li等[46]利用微波辅助的方法降解浒苔多糖,但是由于微波作用的非特异性,降解得到的产物分子量分布差异较大,从3.1 ku到446.5 ku均有分布。段科等[47]采用微波辅助盐酸/过氧化氢降解浒苔多糖,发现在1 mol/L的盐酸溶液中加入30%过氧化氢(加入量5%),在900 W微波,50 ℃条件下反应10 min,制备的寡糖得率可达77.88%。
4.3 酶法降解浒苔多糖
与化学法和物理法降解法相比,酶解法降解浒苔多糖反应条件温和,而且产物特异性好,因而受到了研究者的关注报道较多。目前,用于降解浒苔多糖的酶多为纤维素酶、果胶酶和糖化酶等商业化酶制剂(如表3所示)。张高丽等[48]采用Alteromonassp. A321产生的浒苔多糖降解酶降解浒苔多糖,发现在14 mg/mL底物溶液中加入1.5%的酶,并控制反应条件使pH=6.5、温度33 ℃,反应6 h后,对多糖的降解率可达61.21%,酶解产物包括酸性寡糖片段和中性寡糖片段。Zhou等[49]加入48.5 U/mL果胶酶和糖化酶,45.2 ℃下反应3 h降解浒苔多糖。徐杰等[50]添加9.60 U/mL果胶酶,在56 ℃和pH 4.45条件下,反应3 h降解浒苔多糖。此外,还有利用糖化酶和α-淀粉酶对浒苔多糖进行降解的报道[51,52]。

表3 酶法降解浒苔多糖方法汇总 Table 3 The summary of methods for enzymatic degradation of Enteromorpha polysaccharide
李银平等[53,54]筛选出一株高产浒苔多糖降解酶的菌株Alteromonassp. A321。对该菌株产生的浒苔多糖降解酶组分进行硫酸铵沉淀、DEAE-CL-6B离子交换层析等纯化步骤后,获得了两个电泳纯的浒苔多糖降解酶,分别命名为酶L1和L2,由于没有获得这两个酶的基因序列,因此无法判断L1和L2属于是新型的多糖裂解酶或者糖苷水解酶。此外,除了这一个关于浒苔降解酶的报道,目前尚无专一性降解浒苔多糖的酶的报道,所以到底有没有专门降解浒苔多糖的酶,也是一个值得进一步确定的问题。
5 浒苔多糖降解产物的活性
目前,关于浒苔多糖降解产物活性的研究和报道正在急剧增长,但是目前的文献报道较为零散,而且由于浒苔多糖降解产物结构的复杂性,相关活性的机制及浒苔降解产物的构效关系未得到阐明。Lv等[5]采用酸法制备了浒苔多糖降解产物及其硒化衍生物,并对其抗菌活性进行了评价,结果表明硒化的浒苔多糖降解产物对大肠杆菌(Eschetichia coli)和植物病原真菌的抑制活性较强,而对金黄色葡萄球菌(Staphylococcus aureus)的抑制活性则稍弱。Liu等[7]在快速老化小鼠(SAMP8 mice)模型上对浒苔多糖降解产物的抗衰老和抗氧化作用进行了研究,结果发现浒苔多糖降解产物可以显著降低炎症因子如IFN-γ、TNF-α和IL-6的水平,提高了重组人脑源性神经营养因子(BDNF)的水平,起到了保护海马神经元的作用。Liu等[6]评价了浒苔多糖降解产物对于环磷酰胺致免疫抑制小鼠模型的免疫调节作用,研究结果表明浒苔多糖降解产物可以促进NO的分泌,上调IL-1β、IL-6和TNF-α等细胞因子的表达水平,激活iNOS、COX2和NLRP3炎症小体,从而起到免疫激活的作用。Xu等[50]对三种浒苔多糖降解产物组分的抗氧化活性进行了研究,结果表明浒苔多糖降解产物可以有效地清楚OH·、超氧阴离子及DPPH自由基,从而起到了抗氧化的作用。Li等[46]以维生素C作为阳性对照,考察了低分子量的浒苔多糖降解产物的抗氧化活性,研究结果表明浒苔多糖降解产物对于超氧阴离子和羟基自由基显示出了很强的抑制和清除能力,IC50达到了0.39 mg/mL,而且结果还显示浒苔多糖降解产物的抗氧化能力与分子量具有密切关系。Zhang等[4]考察了H2O2氧化法制备的浒苔多糖降解产物的抗氧化活性,发现浓度为2.28 mg/mL的寡糖对于羟基自由基的清除率达到了92.2%,高于同等浓度的浒苔多糖,这是由于在多糖降解产物结构中存在较多的羟基,显示出了很好的自由基清除能力。Cui等[57]利用浒苔多糖降解产物制备了铁离子和多糖降解产物的络合物,研究结果发现该络合物对于缺铁性贫血的小鼠显示出了很好的治疗效果,可进一步开发为补充铁元素的营养助剂。此外,Wang等[58]考察了浒苔多糖降解产物的抗凝血活性,研究结果发现多糖降解产物的抗凝血活性与其结构中的硫酸集团的数量和分布具有密切关系。Jin等[59]从浒苔多糖中制备得到了葡萄糖醛酸-木糖-鼠李糖组分EP-3-H,并考察了该组分对于人肺癌细胞增殖的抑制活性,研究结果发现EP-3-H能够与成纤维生长因子FGF1和FGF2作用而发挥其抗肿瘤活性。目前对于浒苔多糖降解产物活性的研究较为粗浅,这也是由于浒苔多糖的结构过于复杂,而且尚未有适当的方法获取精细结构确定的多糖降解产物来研究其构效关系。
6 结论与展望
浒苔多糖作为浒苔的主要活性成分,可用于开发新型食品、药品和保健品等,具有广阔的开发前景。目前,浒苔多糖的规模化提取工艺已日渐成熟,但由于纯度太低,无法满足高值化利用的要求,因而高纯度浒苔多糖的制备是目前研究的热点之一。另一方面,浒苔多糖的分子量通常在400 ku以上,溶解性和生物利用度等受其分子量的影响,其生物活性和应用受到了极大的限制,因此如何开发能够高效降解浒苔多糖的工具酶,实现浒苔多糖降解产物的高效定向地制备也是未来浒苔多糖生物资源开发和利用的热点。此外,由于浒苔多糖的单糖组成以及糖苷键连接方式复杂多样,再加之分枝结构的存在,使得浒苔多糖和浒苔多糖降解产物的结构分析异常困难,因此如何精确分析浒苔多糖和寡糖的精细结构对于研究浒苔多糖及其降解产物的构效关系、促进浒苔多糖的高值化开发和利用具有重要的推动作用。
