地衣芽孢杆菌的双位点荧光原位杂交检测
2022-06-29吴
吴
茗花1,朱小颖1,邓锐杰1,罗爱民1*,王西2,王鼎3
(1.四川大学轻工科学与工程学院,四川成都 610065)(2.四川郎酒股份有限公司,四川泸州 646500) (3.四川宜府春酒厂有限责任公司,四川成都 610065)
地衣芽孢杆菌(Bacillus licheniformis)是一种公 认安全的细菌菌株,为革兰氏阳性嗜热细菌,其具有合成2,3-丁二醇的巨大潜力,从而促进四甲基吡嗪的生成[1]。地衣芽孢杆菌在大曲制备过程中具有水解原料中淀粉以及分解蛋白质的能力,有利于原料的分解利用,能够产生独特的大曲风味,提高大曲香气的饱满度,生成酒体的芳香类物质,对白酒的风味提供香味物质[2-4]。目前,地衣芽孢杆菌的检测方法主要为传统计数法、聚合酶链式反应(polymerase chain reaction,PCR)和高通量检测等[5,6]。传统计数法,操作繁琐,检测周期长,容易受到环境杂菌的污染;PCR扩增与高通量检测具有效率高、成本低等特点,但是需要提取细菌DNA,且无法直接观察其细菌形态。
荧光原位杂交技术(fluorescence in situ hybridization,FISH)是指利用荧光标记已知序列的核酸碱基,根据碱基互补配对原则,特异性探针会识别目标核酸并进行杂交,通过荧光激发产生荧光信号[7]。FISH广泛应用于遗传学分析[8-10]、临床医学[11-14]、微生物群落[15,16]等领域,在微生物学领域的应用主要是在复杂环境中微生物种群的鉴定、定量和表征[17]。荧光原位杂交常用的探针主要分为肽核酸探针(PNA)和寡核苷酸探针[18]。肽核酸探针具有优异的特异序列识别能力,不带电荷,因此可以与DNA和RNA特异性结合,具有很高的杂交稳定性,但是其水溶性较差,细胞通透性不强,设计复杂且价格昂贵[19],因此主要用于致病菌的检测[20,21]。寡核苷酸探针虽然特异性和灵敏度较低,杂交条件复杂,但是也可以与靶标序列特异性结合,操作简单且价格便宜,因此,大部分研究都使用寡核苷酸探针进行非致病微生物的检测[22-25]。Posada等[22]利用FISH对许多作物的植物生长促进细菌枯草芽孢杆菌(PGPB)进行鉴定,根据16S rRNA设计的探针可以特异性识别枯草芽孢杆菌,与其他近缘杆菌无法杂交产生荧光。Geneviève等[23]首次建立了快速有效的FISH检测芽孢杆菌孢子的方法,可应用于1 h内原位标记的芽孢杆菌研究,并且可以有效检测在混合细胞群。Zhang等[24]将分子信标与荧光原位杂交结合快速和直接检测阳性血液培养中的金黄色葡萄球菌,该方法具有较强的特异性和高灵敏度,可用于阳性血培养中的金黄色葡萄球菌;吴冬梅等[7,25]先后利用FISH对窖泥微生物群落和纯培养的微生物进行检测,该方法可视化定量表征了窖泥中细菌和古菌的特征,且在优化杂交体系后提高FISH计数的准确性,为其在今后的微生物检测奠定基础。因此,荧光原位杂交与传统微生物计数方法和PCR相比,其操作简单,检测周期短,不需要进行扩增以及核酸提取,可以观察到完整的细菌形态,从而避免了外界污染造成的假阳性和假阴性的结果[26]。但是在大量的研究中发现,FISH虽然可以实现可视化检测,但是不同的检测对象可视化程度差异较大,其特异性探针杂交情况容易受到溶菌酶浓度、杂交时间、去离子甲酰胺浓度等影响,导致荧光信号不稳定[27,28]。
因此本实验以纯培养地衣芽孢杆菌为研究对象,探究纯培养微生物FISH检测的荧光探针的选择、菌体分散方式、细胞通透性、杂交条件等影响因素,对探针特异性进行检验,以期为白酒生产过程中不同发酵过程中微生物的荧光原位杂交检测奠定基础。
1 材料与方法
1.1 微生物菌株
七株芽孢杆菌,其中包括地衣芽孢杆菌、解淀粉芽孢杆菌、枯草芽孢杆菌、蜡样芽孢杆菌、沙式类芽孢杆菌、嗜气芽孢杆菌、甲基营养型芽孢杆菌,三株酵母菌,其中包括热带假丝酵母、毕赤酵母、埃切假丝酵母;三株其他菌株,其中包括嗜盐四联球菌、根霉属、肠沙门氏菌肠炎亚种,其中肠沙门氏菌肠炎亚种购买自中国工业微生物菌种保藏管理中心,菌种编号CICC 22956,其余菌株均保藏于四川大学纺工楼513实验室,-20 ℃磁珠法保藏。
1.2 主要试剂及仪器
试剂:多聚赖氨酸溶液(L型)(分子质量>15000 u)、PBS缓冲液、PBS-T缓冲液、曲拉通X-100、盖玻片(24×60 mm,厚度0.13~0.17 mm)、抗荧光猝灭封片剂、溶菌酶(>20000 U/mg)、4%多聚甲醛、去离子甲酰胺溶液均购自生工生物工程(上海)股份有限公司;荧光探针,序列如表1所示,5’端分别修饰CY3和FAM,HPLC纯化,由生工生物工程(上海)股份有限公司合成;无水乙醇,购自成都金山化学试剂厂;4',6-二脒基-2-苯基吲哚(4',6-diamidino-2- phenylindole,DAPI)(分析纯),购自海门碧云天生物技术有限公司;20X SSC溶液购自北京索莱宝科技有限公司;DTT(0.1 mol/L)、RiboLockRnase Inhibitor、Yeast tRNA均购自赛默飞世尔科技(中国)有限公司;所有溶液采用分子生物级水配制,购自美国康宁(纽约)有限公司。

表1 探针序列 Table 1 Sequences of probes
仪器:Ti2-U倒置荧光显微镜,日本Nikon公司;分析软件NIS-Elements Analysis;D3024R台式高速冷冻型微量离心机,美国SCILOGEX(赛洛捷克);THZ-98AB恒温振荡器,上海一恒科学仪器有限公司;分光光度计,上海佑科仪器仪表有限公司;DSX-30L-I手提式高压蒸汽灭菌器,上海申安医疗器械厂;数显超声波清洗机,广州繁花科技有限公司等。
1.3 培养基
所需的培养基包括:LB培养基、MRS培养基、BHI培养基、PDA培养基、YPD培养基,高温高压灭菌后使用。
1.4 探针的设计与验证
FISH探针的设计是在NCBI的网站上(https://www.ncbi.nlm.nih.gov/)搜索地衣芽孢杆菌的的16S rRNA的基因,用Primer Premier5软件进行探针的设计,如表1所示。根据探针设计原则,选出四个长度合适、二级结构较少、GC含量在40%~60%的探针用于实验。为了验证探针的敏感度和特异性,用BLAST(https://blast.ncbi.nlm.nih.gov/Blast.cgi)对探针进行了验证。BLAST搜索发现,所设计的探针具有较高的特异性。
1.5 实验方法
1.5.1 地衣芽孢杆菌生长曲线的测定
将保存于斜面固态培养基的地衣芽孢杆菌接一环于液态LB培养基中,37 ℃,140 r/min,振荡培养。对其不同生长时期的吸光度值(即OD值)进行测定,以无菌的液体培养基作为空白对照,在600 nm波长下用光程1 cm的比色皿通过比浊法测定地衣芽孢杆菌不同生长时期的培养液的OD值。分别于0、4、8、12、16、20、24、28、32、36、40、44、48、52 h取出3 mL菌液,测定其在600 nm波长下的OD值,每个时间点重复三次取平均值。
1.5.2 样品的处理
取在37 ℃、140 r/min活化24 h的地衣芽孢杆菌菌液1 mL,2000 r/min离心5 min,去掉上清液。加入1 mL的PBS溶液,混匀,5000 r/min离心10 min,去掉上清液,收集菌体。最后再加入0.5 mL的PBS溶液,混匀,放置4 ℃冰箱中待用。
取20 μL菌液滴在多聚赖氨酸涂层载玻片上,0.5 h,加入100 μL PBS和300 μL 4%多聚甲醛固定0.5~1 h,结束后用PBS洗涤两次。加入10 mg/mL溶菌酶在37 ℃下反应20 min,使细胞膜通透,再加入5‰的曲拉通X-100,反应5 min。用70%、90%、100%乙醇进行梯度脱水,每次反应2 min,自然风干即可进行荧光原位杂交。
加入20 μL的杂交液,其中包括2 μL荧光探针(10 μmol/L),2 μL 20 x SSC缓冲液,1 μL DTT(100 nmol/L),0.5 μL RibolockRnase Inhibitor (40 U/μL),2 μL yeast tRNA(10 mg/mL),4 μL去离子甲酰胺溶液,10.5 μL RNase-free H2O。加入杂交液之后盖膜,避光杂交过夜,该过程保持湿润的反应环境,避免因为过于干燥而引起的非特异性杂交。
杂交反应结束,用PBS-T在室温下清洗两次,加入20 μL的3% DAPI溶液进行非特异性染色,盖膜,避光染色10 min。反应结束用PBS-T在室温下清洗两次,避光空气干燥,加入抗荧光猝灭剂封片。选择绿光激发(WG 534~558 nm)、蓝光激发(WB 420~485 nm)及紫外激发(WU 330~400 nm)滤光片,随机拍摄5个视野,对照样品拍摄2个视野,对视野进行荧光光点计数。
1.5.3 条件优化
1.5.2.1 特异性探针的选择
将已经处理好的处于稳定期的菌液进行避光原位荧光杂交,加入20 μL的杂交液,其中,荧光探针分别加入EUB338、P1、P2、P3、P4和随机探针,在37 ℃下进行原位杂交,通过观察其FISH检测结果分析其特异性。
1.5.2.2 菌体分散形式的优化
稳定期的菌体用4%多聚甲醛固定,探讨在不同超声时间对菌体分散的影响,涡旋振荡后超声波处理,超声功率为100 W,温度为20 ℃,超声时间分别为:0 s、30 s、60 s、90 s、120 s、150 s,间隔30 s超停一次,取20 μL的菌液进行原位杂交,观察FISH检测效果。
1.5.2.3 细胞通透性对FISH检测的影响
以地衣芽孢杆菌为研究对象,加入20 μL的溶菌酶(10 mg/mL),在37 ℃条件下分别对稳定期菌体处理0 min、20 min、40 min、60 min,然后进行原位杂交,观察FISH检测效果,计算其菌体检出率[1]:
式中:
R——待测样品的菌体检出率;
FISHC——蓝光激发下绿色荧光光点数目;
DMC——显微镜直接计数菌液菌体数目。
1.5.2.4 杂交条件的优化
针对杂交条件(杂交时间及甲酰胺浓度)固定某一个因素,改变另外一个因素进行实验,然后进行原位杂交后FISH计数(FISHC)。杂交时间分别为0、2、4、6、8 h,去离子甲酰胺浓度分别为0%、10%、20%、30%、40%,同时计算菌体检出率。
1.5.2.5 特异性检测
使用特异性探针、EUB338细菌通用探针和DAPI染料对七株芽孢杆菌、三株酵母菌、三株其他菌株共13株菌株进行检测,观察FISH检测效果。
1.6 数据处理
利用NIS-Elements Analysis、ImageJ、OriginPro 8.5分析软件进行数据处理。
2 结果与讨论
2.1 地衣芽孢杆菌生长曲线
由图1可知,地衣芽孢杆菌的OD600nm值随发酵时间增加呈逐步上升的趋势,OD600nm值由0增加至2左右。当发酵时间为0~4 h时,OD600nm值几乎没有变化,处于地衣芽孢杆菌的延滞期,主要是由于菌株接种到新的培养基中需要缓慢适应生长环境,吸收培养基中的营养物质从而开始生长繁殖。当发酵时间为4~24 h时,OD600nm值急剧增加,处于地衣芽孢杆菌的对数生长期,主要是因为菌株已经适应了培养基的环境,开始指数增长,不断的吸收周围的营养物质生长繁殖。当发酵时间为24~40 h时,OD600nm值增加缓慢,趋于平稳,处于地衣芽孢杆菌的稳定期,主要原因可能是因为菌株的大量生长繁殖大量消耗培养基中的营养物质,导致营养物质的缺乏,产生大量的代谢产物,因此培养基不适宜繁殖生长。当发酵时间为40~52 h时,OD600nm值开始缓慢下降,处于地衣芽孢杆菌的衰亡期,菌株不再生长,开始衰亡。综上所述,地衣芽孢杆菌在0~4 h处于生长迟缓期,4~24 h处于对数生长期,24~40 h处于稳定期,40~52 h处于衰亡期。
2.2 探针的选择
如图2所示,由2a~2e可知,通用探针可对所有的细菌进行染色[23],P1、P2可对地衣芽孢杆菌进行特异性染色,P3、P4无法染色,原因可能是因为探针序列长度较长,且二级结构比较复杂,因此无法与目标序列特异性杂交。从2f的染色情况可知,设计的随机探针其无法与地衣芽孢杆菌杂交,且对其修饰的FAM荧光基团不可以附着在细菌表面,从而造成假阳性结果。由图2g可知,在DAPI染料处理下,所有具有细胞核的真核细胞都能被DAPI穿透细胞膜与细胞核中的双链DNA结合而发出荧光[30]。由2h可知,当体系中只含有地衣芽孢杆菌时是无法产生任何荧光,说明菌体本身不自带荧光,以及实验中使用的其他化学试剂是不含荧光。因此,该方法设计的探针P1、P2针对地衣芽孢杆菌具有一定的特异性。
由图2可知,P1和P2可以与地衣芽孢杆菌特异性杂交发出荧光,因此,我们尝试用两个位点不同的P1和P2探针按1:1的比例加入到杂交体系中,进行双位点杂交。结果如图3所示,通过合并通道的图a1和b1来看,双位点杂交染色情况优于单位点;通过合并通道的图a3和b3来看,b3的菌体检出率高于a3。通过随机选取20个菌的荧光进行灰度计算,结果如图3c所示,发现单探针灰度值为21.54,多探针的灰度值为33.16,增加1.54倍,进一步说明了双探针的杂交效果更优于单探针。采用双位点进行杂交,用两个探针对地衣芽孢杆菌进行染色,其染色效果和检出率均优于单一位点。因此,选择使用两个探针进行双位点杂交可以提高检测的特异性。
2.3 菌体分散形式的选择
采用超声波处理待杂交菌体分散液,菌体分散状况见图4。由图4a可知,未经过超声处理的菌体分布不均匀,荧光信号时强时弱,并且部分菌体容易聚集,不便于观察计数;由图4b~4f可知,在一定的超声处理内,有利于菌体的均匀分散,时间过短无法有效的破坏细菌细胞壁,荧光信号较弱;当超声处理时间为120 s时,菌体分散状态良好,荧光信号明显且强烈,便于观察计数;当超声处理时间偏长,菌体活性降低甚至会导致菌体死亡,使荧光信号变弱,并且会产生许多杂质,背景变得杂乱,导致荧光信号下降,增加观察计数的难度[7,31]。由图4g可知,随着超声时间的加长,在一定程度上灰度值呈增加趋势,在120 s时达到峰值,且高于未超声处理的灰度值。因此选择超声处理时间为120 s,间隔30 s。
2.4 细胞通透性对FISH检测的影响
使用FISH法检测菌体时,需要改变细菌的细胞通透性,从而增加特异性探针与目标核酸结合的几率,提高菌体检出率。由于细胞壁的存在,细菌细胞的通透化处理主要是通过添加溶菌酶,因为溶菌酶可以有效的水解细菌细胞壁中的主要成分肽聚糖[32]。Park等[33]通过比较两种不同的溶菌酶体系,发现先用70%乙醇清洗再加溶菌酶有利于细胞的通透化,有效保留细胞形态,减少了单一溶菌酶处理引起的破坏;Filion等[34]报道了在不同的化学物质以及溶菌酶的处理下,可以有效的提高细菌通透性,促进探针的杂交。
用溶菌酶处理地衣芽孢杆菌,结果见图5a。由图5a可知,通过添加一定浓度的溶菌酶提高可以提高菌体检出率,使细胞通透,更有利于探针与目的核酸的结合。随着溶菌酶的反应时间的增加,菌体检出率也随之增加,可能是因为地衣芽孢杆菌为革兰氏阳性菌,其含有丰富的肽聚糖且细胞壁较厚,因此在短时间的溶菌酶处理下无法完全破壁,菌体检出率较低;当溶菌酶处理时间为40 min以上时,菌体检出率达到94%,探针可以有效的与目的核酸的结合。因此选择溶菌酶处理40 min,更有利于杂交。
2.5 杂交条件的优化
杂交条件对杂交体系的稳定性有较大的影响,杂交时间、温度、杂交缓冲液中成分的浓度探针浓度(甲酰胺、氯化镁和氯化钠等)等变量会影响杂交效率[35-37]。由图5b可知,时间对菌体检出率有显著性影响,随着时间的增加,菌体检出率增加。当杂交时间较短时,探针无法与目的核酸完全杂交,导致荧光信号少,菌体检出率不高。当杂交时间为6 h以上时,有利于探针识别目的核酸,菌体检出率明显提高,达到95.12%。但是杂交时间不宜过长,在杂交温度37 ℃下杂交过久,杂交液会挥发,干燥的杂交环境会导致非特异性杂交,因此建议的杂交时间为6~8 h。通常,在FISH的检测过程中在反应体系中加甲酰胺以降低杂交温度。由图5c可知,甲酰胺的浓度对地衣芽孢杆菌的检出率影响较大,添加一定比例的甲酰胺溶液有利于杂交的进行,当甲酰胺的浓度达到30%的时候,菌体检出率为96.35%。因此,建议使用的甲酰胺浓度为30%,可以适当降低杂交温度,有利于探针特异性杂交。
2.6 特异性检测
以P1、P2为特异性荧光探针、EUB338为细菌通用探针和DAPI染料对不同菌种进行特异性检测,如表2所示,只有地衣芽孢杆菌在蓝光激发下发出绿色荧光,说明了本文章设计的P1、P2探针具有一定的特异性,可以特异性识别地衣芽孢杆菌。
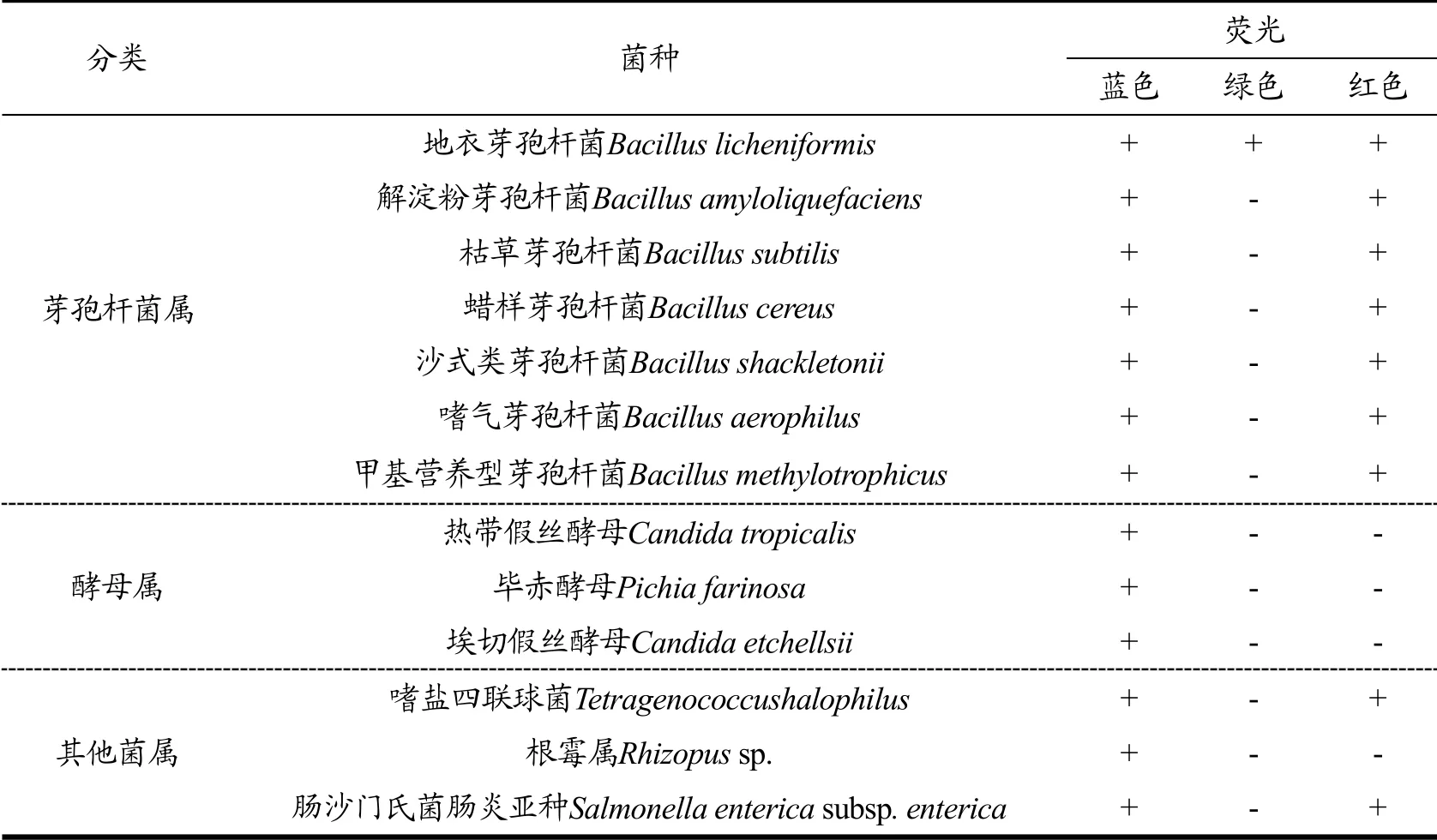
表2 特异性检测 Table 2 Specificity detection
3 结论
本实验以地衣芽孢杆菌为研究对象,研究了不同位点的特异性探针、菌体分散形式、细胞通透性及杂交条件对检测结果的影响。结果表明,根据16S rRNA设计的不同位点的特异性探针有两个可以特异性识别地衣芽孢杆菌,且利用双探针进行双位点检测可以提高1.54倍灰度值,荧光检测效果更佳;当超声分散菌体时间为120 s时,灰度值为41.16且菌体分散均匀便于观察;当溶菌酶处理40 min时,菌体检出率高达94%;当杂交条件为杂交时间6~8 h、杂交液中甲酰胺含量30%时,有利于FISH的检测,菌体检出率为95.12%和96.35%;对探针进行特异性检测,发现该方法在不同菌种中可以特异性结合地衣芽孢杆菌发出绿色荧光。
