氮硫磷氯共掺杂荧光碳点探针用于食品中 胭脂红的快速检测
2022-06-29钱敏捷孙慧娟何海林赵盛燕肖丽霞杨振泉胡钦
钱敏捷,孙慧娟,何海林,赵盛燕,肖丽霞,杨振泉,胡钦
(扬州大学食品科学与工程学院,江苏扬州 225001)
食品着色剂作为一种常用的食品添加剂,通常用于改善食品的口感、香味和颜色[1]。胭脂红(CRM)作为一种人造色素,已在食品工业中被广泛作为着色剂使用[2]。CRM属于合成偶氮颜料,呈颗粒状或粉末状,颜色为红色至深红色。据报道,CRM具有致癌和致突变作用[3,4],而且具有一定的遗传毒性潜力[5]。因此,许多国家严格规定了食品中CRM的最大使用限量。例如,CRM在中国和欧盟允许被使用,而在美国和日本则被禁止使用[2];CODEX规定食品中添加CRM的限量为50.0~500.0 mg/kg[6];我国允许在果汁、山楂制品、糖果、酱菜和饮料中添加CRM的限量不得超过50.0 mg/kg或50.0 mg/L[7];欧盟规定在香肠、果酱等食品中使用CRM的限量为100.0~200.0 mg/kg[8]。尽管不同国家对食品中CRM的使用都规定了严格的限量标准,但是在食品加工中仍存在CRM添加过量的情况。因此,开发一种简单、快速、准确的CRM检测方法对于保障食品安全和人类健康至关重要。
目前,常用的CRM检测方法包括分光光度法[9],毛细管电泳[10],高效液相色谱(HPLC)[11]和伏安法[12]等。然而,这些方法大多数都具有局限性。例如,分光光度法仪器设备简单、操作简便、快速,但检测准确度不高;毛细管电泳法分离效果好,所需样品量少,但其检测结果的重现性差;HPLC法虽然可以实现食品中胭脂红的有效分离和检测,但是其仪器价格昂贵,操作复杂且耗时长。因此,需要开发一种简单、成本低、灵敏、准确的快速分析方法来检测食品中的CRM。
碳量子点,简称碳点(carbon nanodots,CDs)是一种尺寸小于10 nm,具有类球形结构的新型荧光碳纳米材料[13]。由于CDs具有优良的物理化学性质,例如良好的生物兼容性[14]、低毒性[15]、发射光谱可调谐和高的光稳定性[16],其自2004年被发现以来,就迅速吸引了人们的广泛关注。目前,制备碳量子点的方法主要包括电弧放电[17]、水热合成[18]、热解法[19]、微波辅助加热[20]、中和加热[21]和超声处理[22]等。近期研究表明,通过选择合适的杂原子供体,向CDs中掺入适当的杂原子,制备掺杂化的CDs探针,是提升CDs探针选择性和灵敏度的有效手段[23]。迄今为止,已有大量工作表明,掺杂化的CDs在食品有害因子检测方面,包括柠檬黄[24]、谷胱甘肽[14]、单宁酸[25]、农药[26]等,展现出高选择性和高灵敏度的优势。
本工作以葡萄糖为碳源,乙二胺、磷酸、盐酸和硫酸为杂原子供体,借助酸碱中和自放热作用,制备出氮硫磷氯共掺杂碳点(N,S,P,Cl-CDs),并将其作为荧光探针用于食品中CRM的快速检测。本工作对实验条件进行了优化,研究了该方法的线性范围、灵敏度、选择性及抗干扰性,并探究了N,S,P,Cl-CDs和CRM之间的相互作用,进而提出CRM对N,S,P,Cl-CDs荧光猝灭的机理。最后,本检测方法被用于实际样品中CRM检测的可行性分析。
1 实验部分
1.1 实验试剂与仪器
本工作所有食品样品均采自江苏省扬州市本地市场;胭脂红和硫酸奎宁为分析纯,购自上海阿拉丁试剂有限公司;透析膜(截留分子量MWCO=500~1000 Da)购自美国Spectrum公司;其他药品和试剂均为分析纯,购自国药化学试剂有限公司;本实验室使用的超纯水来自Milli-Q-RO4超纯水净化系统,美国Millipore公司。
F-320荧光光谱仪,天津港东科技股份有限公司;HT 7800透射电子显微镜TEM,日本Hitachi公司;Cary 5000紫外-可见-近红外吸收光谱仪UV,美国Varian公司;Cary 610/670显微红外光谱仪IR,美国Varian公司。
1.2 N,S,P,Cl-CDs的制备
称取0.4 g葡萄糖置于50.0 mL玻璃烧杯中,依次加入6.0 mL乙二胺、2.0 mL浓H3PO4、2.0 mL浓HCl和2.0 mL H2SO4(质量浓度为70%)。在酸碱中和自放热作用下,反应混合物在数秒内变成泡沫状。获得的反应产物自然冷却至室温后,将反应产物转移至透析管(MWCO=500~1000 u)中,然后将其放入盛有1 L超纯水的烧杯中,透析3 d。在透析过程中,每隔24 h向烧杯中注入新的超纯水,并不断搅拌,最终得到棕色的N,S,P,Cl-CDs溶液。冷冻干燥后得到0.28 gN,S,P,Cl-CDs粉末,产率为70%。最后,将干燥后的N,S,P,Cl-CDs粉末置于干燥器中备用。
1.3 工作参数优化
影响荧光猝灭效率的关键实验条件,包括N,S,P,Cl-CDs溶液浓度、反应体系pH和反应时间。在不特殊说明的情况下,N,S,P,Cl-CDs溶液采用超纯水进行配制。设置激发波长(λex)和发射波长(λem)分别为380 nm和453 nm。
1.3.1 N,S,P,Cl-CDs溶液浓度优化
为优化N,S,P,Cl-CDs的浓度,使用超纯水制备不同浓度(0.01~1.0 mg/mL)的2.0 mLN,S,P,Cl-CDs溶液,记录加入10.0 μmol/L CRM前后N,S,P,Cl-CDs溶液荧光强度的变化(F0/F)。
1.3.2 反应体系pH优化
为优化pH,分别使用磷酸缓冲盐溶液(10 mmol/L,pH 2.0~11.0)和超纯水(pH 5.8)配制2.0 mL最优浓度的N,S,P,Cl-CDs溶液,记录添加10.0 μmol/L CRM前后N,S,P,Cl-CDs溶液荧光强度的变化(F0/F)。
1.3.3 反应时间优化
为优化反应时间,在最优浓度和最优pH条件下,配制2.0 mLN,S,P,Cl-CDs溶液,向其中加入10.0 μmol/L CRM,记录不同时间间隔反应体系荧光强度的变化(F0/F)。
1.4 线性范围测定
将不同浓度的CRM逐步添加到2.0 mLN,S,P,Cl-CDs溶液(0.03 mg/mL)中,使CRM在N,S,P,Cl-CDs溶液中的浓度在0.1~20.0 μmol/L范围内。在λex/λem=380/453 nm下记录含有不同浓度CRM的N,S,P,Cl-CDs溶液的荧光强度。绘制荧光猝灭效率F0/F与N,S,P,Cl-CDs溶液中CRM浓度的线性关系图,其中F0和F分别代表添加CRM前后N,S,P,Cl-CDs溶液的荧光强度。
1.5 选择性测试
在2.0 mLN,S,P,Cl-CDs溶液(0.03 mg/mL)中分别添加实际样品中可能存在的干扰物质,包括15种氨基酸(蛋氨酸,丝氨酸,精氨酸,苏氨酸,组氨酸,L-甲硫氨酸,DL-半胱氨酸,酪氨酸,甘氨酸,亮氨酸,谷氨酸,丙氨酸,色氨酸,天冬氨酸和苯丙氨酸)、3种小分子(GSH,葡萄糖和抗坏血酸)、10种阴离子(F-,Br-,I-,Cl-,NO3-,HCO3-,CO32-,SO42-,H2PO4-和HPO42-)和8种阳离子(Na+,Ag+,K+,NH4+,Mg2+,Zn2+,Fe2+和Ca2+),添加浓度均为0.1 mmol/L,在λex/λem=380/453 nm 下记录添加干扰物前后N,S,P,Cl-CDs溶液的荧光强度。
1.6 抗干扰性测试
首先,在2.0 mL 0.03 mg/mLN,S,P,Cl-CDs溶液中添加0.01 mmol/L CRM,然后分别添加实际样品中可能存在的上述干扰物质进行混合,添加浓度均为0.1 mmol/L。在λex/λem=380/453 nm下,记录添加干扰物前后N,S,P,Cl-CDs溶液的荧光强度。
1.7 实际样品分析
选取的含有CRM的食品样品,包括李干、蜜桃干、果丹皮、草莓果酱、西瓜霜、功能饮料,作为实际样品。对于固体样品,先将其研碎或剪碎,然后称取0.6 g固体样品,溶解于10.0 mL超纯水中,超声处理10 min。在10000 r/min下,离心5 min,收集上清液。对于液体样品,取适量样品,超声20 min,除去样品中的气泡,准确量取5.0 mL,用超纯水稀释至25.0 mL。将样品提取液通过醋酸纤维素膜过滤(0.22 μm,26 mm内径,天津津腾有限公司)后,取20.0 μL样品提取液,加入2.0 mL 0.03 mg/mLN,S,P,Cl-CDs溶液,在λex/λem=380/453 nm下,记录添加提取液前后N,S,P,Cl-CDs溶液的荧光强度。采用国标法[27]对上述样品中的CRM含量进行检测,以验证该方法的准确性。
1.8 数据处理
本工作的所有数据均采用Origin软件(v8.0)进行处理,特别指出,N,S,P,Cl-CDs的粒径分布是采用Nano Measurer软件(v1.2)进行处理。
2 结果与讨论
2.1 N,S,P,Cl-CDs的理化性质表征
利用TEM对N,S,P,Cl-CDs的形貌和尺寸分布进行表征,如图1a所示,制备的N,S,P,Cl-CDs颗粒分散性良好,具有类球形结构。图1a的插图是通过随机计数电镜图上100个颗粒的大小,得到的粒径分布直方图。N,S,P,Cl-CDs的粒径分布范围为0.25~5.0 nm,平均粒径为2.27 nm。
采用傅里叶红外光谱FT-IR对N,S,P,Cl-CDs的官能团进行了表征,如图1b所示,3500~3350 cm-1和3150~2760 cm-1处的宽吸收峰属于-NH和-OH伸缩振动,1670 cm-1处的强吸收峰来自C=O伸缩振动,表明N,S,P,Cl-CDs表面存在氨基和羧基,赋予了N,S,P,Cl-CDs良好的水溶性。1250 cm-1处的吸收峰归因于C-O伸缩振动。2300、1500、1180、995和827 cm-1处的强吸收峰,分别归因于S-H伸缩振动、N-H弯曲,C-N伸缩,P-O-C弯曲和C-Cl伸缩振动。以上结果表明,N、P、S和Cl杂原子被成功掺杂到CDs中。
通过紫外可见吸收光谱(UV-Vis)研究了N,S,P,Cl-CDs的紫外吸收性质。如图2a所示,N,S,P,Cl-CDs的UV-Vis光谱在紫外区域具有两个吸收峰,分别为290 nm和368 nm,前者是由于C=O键的n→π*跃迁,后者是由于N、P、S和Cl杂原子引起的表面激发态[28]。
采用荧光光谱研究了N,S,P,Cl-CDs的荧光性质。N,S,P,Cl-CDs的激发光谱,如图2a所示,N,S,P,Cl-CDs的激发峰位于380 nm。N,S,P,Cl-CDs的发射光谱,如图2a所示,N,S,P,Cl-CDs在380 nm处激发时的发射峰为453 nm。图2b为N,S,P,Cl-CDs在不同λex下的荧光光谱。当λex从300 nm增加到490 nm时,N,S,P,Cl-CDs的λem在453 nm到553 nm范围内变动,即N,S,P,Cl-CDs的λem表现出典型的λem依赖行为[29]。在紫外线照射下,N,S,P,Cl-CDs溶液呈现出强烈的蓝色荧光(图2b的插图)。如图2c所示,以硫酸奎宁为参考物质,测得N,S,P,Cl-CDs的量子产率为5.8%。
2.2 实验条件的优化
2.2.1 N,S,P,Cl-CDs浓度对检测CRM的影响
本实验研究了不同浓度的N,S,P,Cl-CDs对CRM检测的影响。如图3a所示,随着N,S,P,Cl-CDs浓度变化,F0/F也随之变化。当N,S,P,Cl-CDs浓度为0.03 mg/mL时,F0/F达到最高值。因此,选择0.03 mg/mL作为CRM检测的最佳N,S,P,Cl-CDs浓度。
2.2.2 pH对检测CRM的影响
本实验研究了不同pH值(pH=2.0~11.0)对CRM检测的影响。如图3b所示,F0/F在pH 2.0~11.0的酸碱度范围内无较大差别。为了简化后续的工作,选择pH 5.8(超纯水)作为检测CRM的最佳pH。
2.2.3 反应时间对检测CRM的影响
本实验在N,S,P,Cl-CDs浓度为0.03 mg/mL,pH为5.8的条件下,考察了反应时间对CRM检测的影响。由图3c所示,向N,S,P,Cl-CDs溶液(0.03 mg/mL)中加入CRM后,F0/F在1.0 min内迅速增加,随着时间的继续增加,F0/F并没有发生明显改变。因此,选择1.0 min作为检测CRM的最佳反应时间。
2.3 不同浓度CRM对N,S,P,Cl-CDs荧光的影响
在优化的实验条件下,探究了CRM对N,S,P,Cl-CDs荧光淬灭的可能性。图4a显示了在不同浓度CRM存在的条件下,N,S,P,Cl-CDs溶液荧光强度的变化。当CRM浓度逐步增加(0.0~105.0 μmol/L)时,N,S,P,Cl-CDs的荧光强度逐渐降低,表明CRM可以有效地猝灭N,S,P,Cl-CDs的荧光强度。由图4b可见,CRM的浓度在0.01~14.0 μmol/L范围内时,F0/F与CRM浓度呈线出良好的线性关系,符合Stern-Volmer方程。所提出荧光方法的检测限为9.38 nmol/L。将本工作与先前报道的基于CDs的荧光检测方法进行比较(表1),结果显示,本工作报道的基于N,S,P,Cl-CDs的检测方法,其灵敏度优于之前报道的基于CDs的荧光检测法,表明本检测方法具有高灵敏度。
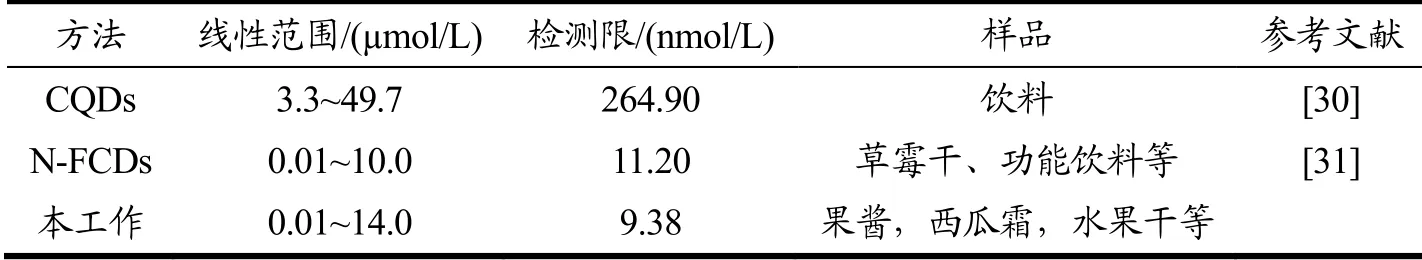
表1 基于CDs的胭脂红检测方法的对比 Table 1 Comparison of CDs-based fluorescence methods for CRM detection
2.4 . N,S,P,Cl-CDs的选择性和抗干扰性
本工作探究了N,S,P,Cl-CDs对实际样品中可能存在的干扰物质(不同种类的氨基酸,阴离子,阳离子和一些其他小分子)的选择性。由图5a所示,当向2.0 mL 0.03 mg/mLN,S,P,Cl-CDs溶液中加入0.01 mmol/L的CRM及其他干扰性物质时,只有加入CRM会明显猝灭N,S,P,Cl-CDs的荧光,而其他可能存在的干扰物质对N,S,P,Cl-CDs荧光强度的影响几乎可以忽略,表明N,S,P,Cl-CDs对CRM检测具有高选择性。
同时,本工作研究了N,S,P,Cl-CDs对CRM检测的抗干扰性。向2.0 mL 0.03 mg/mLN,S,P,Cl-CDs溶液中加入0.01 mmol/L的CRM后,再加入0.1 mmol/L其它干扰物质,测得加入干扰物质前后N,S,P,Cl-CDs/CRM检测体系荧光强度的变化。如图5b所示,在向N,S,P,Cl-CDs/CRM混合体系中加入上述可能存在的干扰物质后,没有观察到荧光强度的明显变化,表明N,S,P,Cl-CDs具有较强的抗干扰性。
2.5 CRM对N,S,P,Cl-CDs荧光的猝灭机理研究
为研究N,S,P,Cl-CDs和CRM之间的相互作用,本工作获得了CRM的紫外可见吸收光谱及N,S,P,Cl-CDs的荧光激发光谱和发射光谱。如图6a所示,CRM的紫外可见吸收光谱在200~700 nm范围内有吸收特性;N,S,P,Cl-CDs的荧光激发和发射光谱显示,其在380 nm处有一个激发峰,在453 nm处有一个相应的发射峰。可见,CRM的紫外可见吸收光谱与N,S,P,Cl-CDs的荧光激发和发射光谱有明显的重叠,表明CRM与N,S,P,Cl-CDs之间的荧光猝灭是由内滤效应引起的。
通常,荧光猝灭还可以分为静态猝灭和动态猝灭[32,33]。为进一步探究CRM对N,S,P,Cl-CDs的荧光猝灭机制,本工作研究了CRM对N,S,P,Cl-CDs荧光寿命的影响。图6b为N,S,P,Cl-CDs和N,S,P,Cl-CDs/CRM的荧光寿命衰减曲线。通过对荧光衰减曲线进行一阶函数拟合,发现N,S,P,Cl-CDs和N,S,P,Cl-CDs/CRM的寿命分别为2.48和2.20 ns,表明CRM的引入并未导致N,S,P,Cl-CDs平均寿命发生较大改变。因此,CRM与N,S,P,Cl-CDs之间的反应属于静态相互作用。总的来说,CRM对N,S,P,Cl-CDs的荧光猝灭是内滤效应和静态猝灭协同作用的结果。
2.6 实际样品的检测
为了研究本检测方法用于实际样品检测的可行性,本工作将该方法用于各种食品样品中的CRM检测。如表2所示,李干、蜜桃干、果丹皮、草莓果酱、西瓜霜和功能饮料提取物中的CRM含量分别为0.04、0.04、0.05、0.05、0.17和0.01 μmol/L。加标回收率结果显示,该实际样品检测的加标回收率在97.7%~104.2%的范围内,相对标准偏差(RSDs)低于3.29%,表明该方法具有高准确性。将检测结果与HPLC法(国标法)的检测结果进行比对,发现两种方法获得的检测结果相近,进一步证明了该检测方法的准确性。
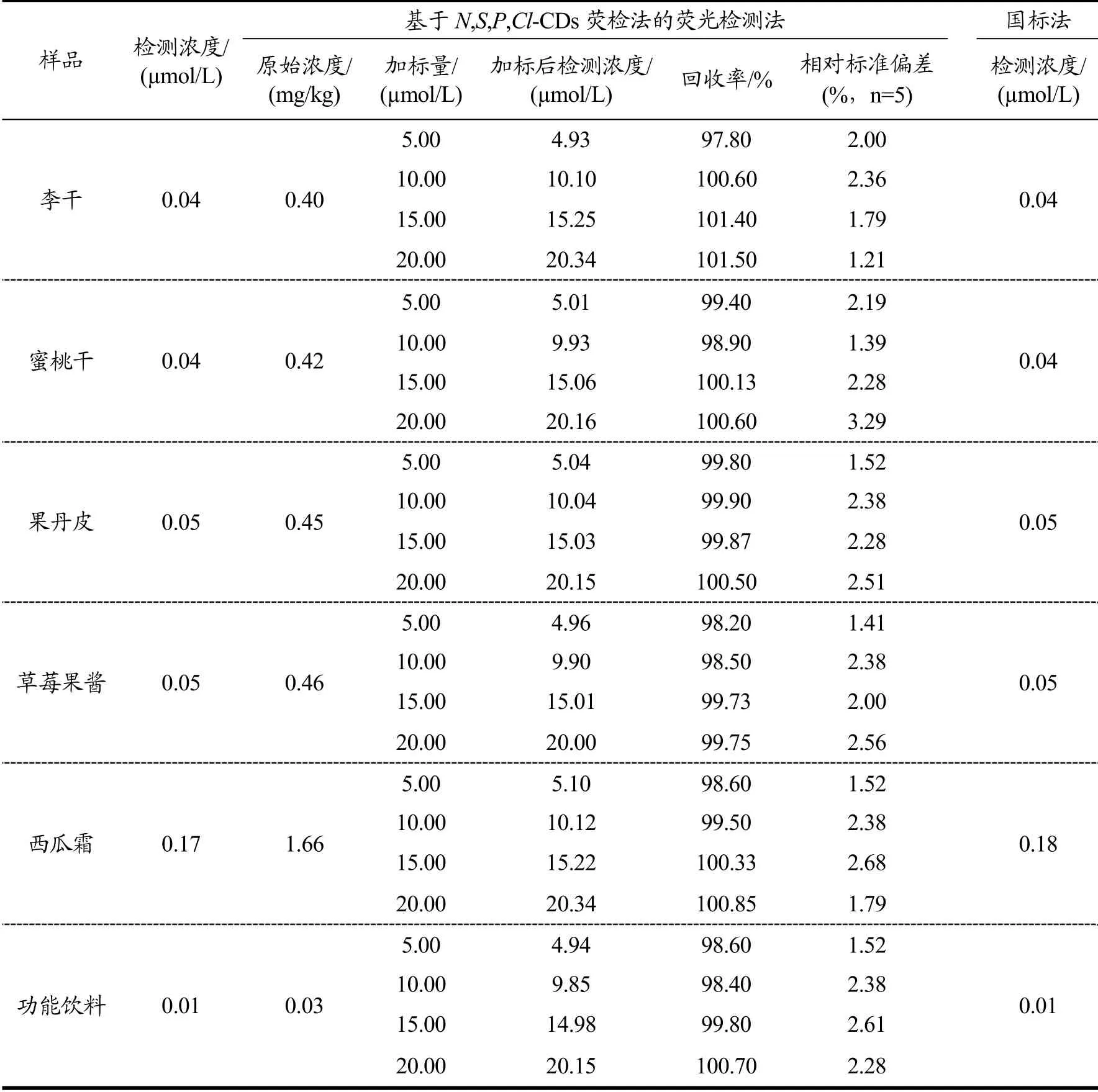
表2 食品样品中CRM的检测 Table 2 Detection of CRM in various food samples
3 结论
本工作建立了一种基于N,S,P,Cl-CDs的荧光检测方法用于CRM的快速检测。该方法获得的线性范围为0.01~14.0 μmol/L,检测限低至9.38 nmol/L。除了高灵敏度,该方法还具有制备简单、操作简便、成本低、选择性好、抗干扰性强以及检测速度快的优点。最后,本工作将该方法用于实际食品样品中CRM的检测,加标回收率在97.8%~101.5%之间,RSDs低于3.29%,结果令人满意,表明本工作制备的N,S,P,Cl-CDs探针在CRM检测方面具有良好的应用前景。
