两种巨噬细胞外泌体制备方法的对比研究
2022-09-16刘文涛冯兴超王新月廖礼彬
杨 毅,刘文涛,冯兴超,王新月,廖礼彬*
(1新疆医科大学第一附属医院骨科,乌鲁木齐 830054;新疆医科大学 2基础医学院,3公共卫生学院,乌鲁木齐 830017)
外泌体(exosomes,EXOs)是活细胞分泌的30~150 nm的囊泡,它们广泛存在于唾液、血液、尿液中,被视为特异性分泌的膜泡,其内部包括DNA、RNA、脂质、代谢产物等,参与细胞间通讯[1-3]。近年来,外泌体相关研究主要集中在间充质干细胞、肿瘤细胞、血管内皮细胞以及临床诊断性研究。巨噬细胞作为抗原呈递家族细胞之一,其在肿瘤和炎症等的发生发展中起重要作用,巨噬细胞介导的调控通路呈网络状调控,巨噬细胞的外泌体在此过程中具有重要意义[4]。目前外泌体的提取方法主要有超速离心法[5]、密度梯度离心法[6]、超滤法[7]等,但这些方法是否适合巨噬细胞外泌体的提取有待进一步研究,巨噬细胞外泌体提取的纯度及浓度决定了相关实验研究的深入性以及精确性。本研究主要以聚合物沉淀法和超速离心法提取的巨噬细胞外泌体进行对比,探索适用于巨噬细胞外泌体的制备方法,为后续外泌体的进一步研究提供方法和参考,提高相关实验的精确性。
1 材料与方法
1.1 材料
1.1.1 细胞株 鼠源巨噬细胞RAW264.7,购自武汉普诺赛生命科技有限公司。
1.1.2 材料与试剂RAW264.7专用培养基(武汉普诺赛);试剂包括外泌体提取试剂盒(华盈生物)、Phosphate Buffered Saline(HyClone)、蛋 白 定 量 试 剂 盒(Thermo)等。
1.1.3 耗材设备 冷冻离心机(4K15 SIGMA);4℃冰箱;恒温培养箱;透射电子显微镜(JEM-1230日本电子);超速离心机(Optima XPN);EP管(Biofil)。
1.2 方法
1.2.1 细胞培养RAW264.7细胞用专用培养基于37℃、含5%CO2培养箱中培养,3~4 d按照1∶3比例传代1次,待其在T25培养皿中融合度达到90%以上,数量约105~106个,收集细胞上清液。
1.2.2 Western blot向200μL的外泌体样本中加入200μL冷的蛋白提取液,吹打混匀,4℃震荡30 min,结束后4℃12 000 g离心15 min,上清即为外泌体总蛋白,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白,电转移至PVDF膜。5%脱脂牛奶室温封闭1 h,加入一抗CD63、TSG101、Alix,4℃孵育过夜,洗膜后,加辣根过氧化酶标记的二抗室温孵育1 h。ECL发光试剂显影,凝胶成像系统曝光拍照。
1.2.3 聚合物沉淀法 收集细胞上清液,4℃3 000 g离心15 min,转移上清于新的离心管中,将离心后的细胞上清与外泌体提取试剂按2∶1的比例混合,翻转混匀50次,4℃冰箱静置过夜约14 h,将上述混合液,4℃3 500 g离心50 min,离心后弃上清,用1 mL的PBS重悬,4℃10 000 g离心10 min,弃上清,再用200μL的PBS重悬,4℃10 000 g离心10 min,取上清。
1.2.4 超速离心法 收集细胞上清液,4℃300 g离心20 min,转移上清于新的离心管中,4℃2 000 g离心20 min,转移上清于新的离心管中,4℃10 000 g离心30 min,用0.22μm滤器过滤上清于新的离心管中,4℃100 000 g离心120 min,用200μL的PBS重悬沉淀。
1.2.5 样品制备及观察 提取的外泌体中取10μL滴加到碳覆膜铜网上,滴加时呈水滴样,样品吸附3 min,用滤纸吸去多余液体后晾干,向铜网上滴加磷钨酸染色液10μL,避光染色2 min,用滤纸吸去多余液体,晾干后透射电子显微镜下观察并拍照。
1.3 统计学分析采用SPSS 27.0软件进行统计分析,计量资料采用均数±标准差(-x±s)表示,采用两独立样本t检验,P<0.05为差异具有统计学意义。
2 结果

图1 电镜下外泌体形态学结果(A:50 000×B:50 000×C:100 000×D:100 000×)
2.1 外泌体形态学观察依据聚合物沉淀法提取的外泌体,浓度较高(图1 A),超速离心法提取的外泌体浓度较低(图1 B),透射电镜下观察到,铜网上的外泌体膜结构完整,轮廓清晰,直径在150 nm左右,能清晰地观察到圆盘状的结构(图1 C、1 D)。
2.2 外泌体标志蛋白检测外泌体Western blot结果验证了2种方法均提取到了EXOs(图2),标志蛋白Alix、TSG101以及CD63表达均无差异均有表达。
2.3 两种外泌体提取方法的比较与超速离心法相比,聚合物沉淀法提取的外泌体直径更大,结构完整程度更高,外泌体浓度更高,提取时间更短,差异均有统计学意义(P<0.05)。设备成本方面,超速离心法对仪器设备平台要求高,聚合物沉淀法更具经济优势(表1)。

图2 外泌体标志蛋白CD63、TSG101、Alix的表达(U-EXOs:超速离心法外泌体;P-EXOs:聚合物沉淀法外泌体)
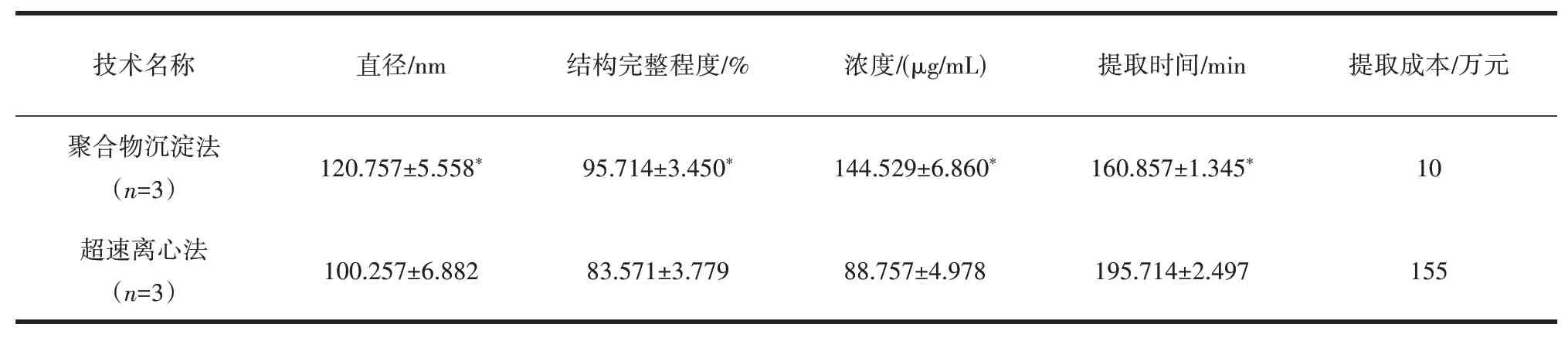
表1 聚合物沉淀法与超速离心法提取外泌体比较
3 讨论
多种细胞在正常及病理状态下均可分泌外泌体,其主要来源于细胞内内溶酶体微粒内陷形成的多囊泡体,经多囊泡体外膜与细胞膜融合后释放到胞外基质中[8],1983年,外泌体首次于绵羊网织红细胞中被发现,1987年Johnstone将其命名为“exosome”[9]。随着大量对其生物来源、其物质构成及运输、细胞间信号的传导以及在体液中分布的研究发现外泌体具有多种多样的功能。外泌体的功能取决于其所来源的细胞类型,其可参与到机体免疫应答、抗原提呈、细胞迁移、细胞分化、肿瘤侵袭等[10]。大量临床研究证实,外泌体在肿瘤、血管、免疫、内分泌及疾病诊断方面具有良好的应用前景。然而,外泌体的提取和纯化是外泌体研究的前提,而外泌体提取技术的可靠性及稳定性是外泌体实验研究精确性的重要前提。由于细胞外基质中外泌体的体积小,数量少,因此,外泌体的提取和纯化是目前实验研究面临的巨大挑战,而有关成体细胞外泌体的研究甚少,本研究在对巨噬细胞外泌体的实验研究中,将常用外泌体提取方法中超速离心法和聚合物沉淀法对外泌体的提取进行对比,进一步为外泌体的实验研究提供方法和参考。通过实验研究,两种外泌体的提取方法均提取出较为完整的盘状外泌体纳米囊泡,直径在94.5~129.9 nm,符合文献报道的30~150 nm之间。通过透射电镜对提取外泌体的形态及大小分布状况检测,聚合物沉淀法提取的外泌体,在溶液中分散性较好,与超速离心法提取的外泌体相比,镜下观察杂质较少,并且相同倍镜下所观察到的外泌体数量更多,完整性更好。Weng等[11]通过基于聚合物沉淀法成功地从细胞培养上清液中分离出外泌体,并揭示了基本机制。他们用高分辨率电子显微镜清楚地观察了外泌体的大小和形状,该分离方法具有成本低、简单、高效的特点。在设备要求上,超速离心法较聚合物沉淀法对设备、实验平台的要求更高,经济成本高。每一种提取和分离的方法都有各自的优缺点,虽然超速离心法作为目前最常用的外泌体提取方法,其一次能提取大量样本且成本较低,但该方法存在处理时间长、设备昂贵、回收率低、纯度低等缺点[12]。
综上,本研究仅从实验过程中对比了针对巨噬细胞来源的两种外泌体提取和纯化的方法,该研究存在未对提取的外泌体进行纯度及浓度的进一步验证。后续,本研究组将结合最新的分析技术如纳米示踪技术、核酸信息依赖性鉴定等对外泌体的提取方法、质和量进行更深入的研究。
