基于网络药理学和分子对接探讨黄药子-夏枯草-五味子治疗亚急性甲状腺炎的作用机制*
2022-06-29贾慧雨吕娜冯志海
贾慧雨,吕娜,冯志海
1.河南中医药大学,河南 郑州 450046; 2.河南省中医药研究院附属医院,河南 郑州 450000; 3.河南中医药大学第一附属医院,河南 郑州 450001
亚急性甲状腺炎(subacute thyroiditis,SAT)是一种最常见的痛性甲状腺炎,发病大多与病毒感染有关,也可发生于非病毒感染之后[1]。本病高发人群为30~50岁女性,主要特征为甲状腺部位疼痛,还可能伴有肌肉疼痛、心动过速、发热、食欲减退等全身症状,病程大多2~4个月,病情严重者常因疼痛明显而影响日常工作和休息。目前,西医治疗SAT主要通过应用非甾体类抗感染药或糖皮质激素来控制炎症,虽起效较快,但易产生不良反应,且容易反复发作。中医药治疗SAT不仅安全性更高,且可降低复发率。黄药子-夏枯草-五味子是仝小林院士提出的治疗SAT的靶向药[2],疗效确切,但其具体作用机制尚不明确。
网络药理学整体性与系统性的特点恰与中医传统文化中的整体观念、辨证论治的思想相对应,同时网络药理学“疾病-基因-靶点-药物”的研究模式与多味中药“多成分、多靶点、多途径”的作用特点相呼应[3]。因此,通过网络药理学方法研究黄药子-夏枯草-五味子治疗SAT的作用机制有其独特优势,并采用分子对接技术验证研究结果的可靠性。
1 资料与方法
1.1 药物有效成分筛选及靶点收集通过中药系统药理学数据库与分析平台(traditional Chinese medicine systems pharmacology database and analysis platform,TCMSP,http://tcmspw.com/tcmsp.php)获取黄药子、夏枯草、五味子的化学成分,以口服利用度(oral availability,OB)≥30%、类药性(drug likeness,DL)≥0.18为条件进行筛选,获取黄药子、夏枯草、五味子的有效成分。同时基于TCMSP获取黄药子、夏枯草、五味子有效成分的作用靶点,使用Uniprot数据库(http//www.uniprot.org/)将靶点转化为标准基因名。
1.2 SAT疾病靶点及黄药子-夏枯草-五味子治疗SAT的潜在作用靶点的获取在人类基因数据库(GeneCards,https://www.genecards.org/)、DrugBank(https://go.drugbank.com/)及人类孟德尔遗传数据库(online mendelian inheritance in man,OMIM,https://omim.org/)中以“subacute thyroiditis”为关键词搜索SAT相关靶点。运用venny 2.1.0(https://bioinfogp.cnb.csic.es/tools/venny/index.html)在线绘制韦恩图,得到黄药子-夏枯草-五味子有效成分相关靶点与SAT相关靶点的交集靶点,即为黄药子-夏枯草-五味子治疗SAT的潜在作用靶点。
1.3 蛋白质相互作用(protein-protein interaction,PPI)网络构建及关键靶点筛选在STRING数据库(https://www.string-db.org/)中导入黄药子-夏枯草-五味子治疗SAT的潜在靶点,将物种设置为人(homo sapines),将置信度得分阈值设置为high confidence=0.700,隐藏网络中的游离节点,得到潜在靶点蛋白相互作用关系。使用Cytoscape 3.7.2 构建PPI网络,并进行拓扑分析,根据度值(degree)、紧密中心性(closeness centrality,CC)及中介中心性(betweenness centrality,BC)筛选黄药子-夏枯草-五味子治疗SAT的关键靶点。
1.4 富集分析将潜在靶点导入Metascape数据库(https://metascape.org/gp/index.html#/main/step1),设置物种为人类,进行基因本体(gene ontology,GO)功能富集分析和京都基因与基因组百科全书(kyoto encyclopedia of genes and genomes,KEGG)通路富集分析,并以P<0.01为条件进行筛选分析,使用微生信在线工具(http://www.bioinformatics.com.cn/)将富集结果可视化。
1.5 “关键成分-潜在靶点-通路-疾病”网络构建与拓扑分析利用Excel找出潜在靶点涉及的中药成分,使用Cytoscape 3.7.2构建黄药子-夏枯草-五味子治疗SAT的“关键成分-潜在靶点-通路-疾病”网络,并进行拓扑分析。
1.6 分子对接验证分别选取度值排名前3位的关键靶点和成分作为受体蛋白和配体小分子。在PDB数据库(http://www1.rcsb.org/)中获取受体蛋白的晶体结构并下载其pdb格式文件,从TCMSP数据库下载配体小分子的MOL2结构式,使用AutoDockTools 1.5.6对配体和受体进行分子对接,并使用Pymol将分子对接结果可视化。
2 结果
2.1 黄药子-夏枯草-五味子的有效成分及靶点通过TCMSP数据库共筛选到黄药子有效成分15个,夏枯草有效成分11个,五味子有效成分8个,其中包括黄药子与夏枯草共有成分4个。在TCMSP数据库中查找各成分对应靶点,经查询发现黄药子素I、黄药子素H无对应靶点信息,将其剔除后共28个有效成分。利用Uniprot数据库中将靶点转换为标准基因名,整合重复靶点后共获取220个药物靶点。见表1。
2.2 SAT疾病靶点及黄药子-夏枯草-五味子治疗SAT的潜在作用靶点以“subacute thyroiditis”为检索词在GeneCards数据库中以“≥3.68(score值中位数)”为条件共搜集到768个疾病相关靶点,在OMIM数据库中共搜集到49个疾病相关靶点,在Drugbank数据库中共搜集到44个疾病相关靶点,去重整合后共有826个SAT相关靶点。运用venny 2.1.0在线绘制韦恩图,得到黄药子-夏枯草-五味子有效成分相关靶点与SAT相关靶点的交集靶点103个,即为黄药子-夏枯草-五味子治疗SAT的潜在作用靶点。见图1。
2.3 PPI网络构建及关键靶点筛选在STRING数据库输入103个潜在靶点,得到蛋白质相互作用关系,将结果导入Cytoscape 3.7.2构建PPI网络,结果显示,网络中共有103个节点和1 017条边,节点平均degree为19.7,且节点大小、颜色深浅与degree正相关。拓扑分析显示,degree中位数为44,CC中位数为 0.633 540 37,BC中位数为 0.002 952 07,筛选出degree、CC、BC均大于中位数的靶点共42个,即为黄药子-夏枯草-五味子治疗SAT的潜在关键靶点。见表2,图2。

表2 黄药子-夏枯草-五味子治疗SAT的前10位关键靶点

图2 黄药子-夏枯草-五味子治疗SAT关键靶点PPI网络图
2.4 GO功能富集分析和KEGG通路富集分析将103个潜在靶点输入Metascape数据库,物种选择人类,设置P<0.01,Min Overlap=3,Min Einrichment=1.5。GO富集分析筛选出6 448个条目,涉及对无机物的反应(response to inorganic substance)、凋亡信号途径(apoptotic signaling pathway)、氧化应激(response to oxygen levels)等生物过程(biological processes,BP)5 374个条目,膜筏(membrane raft)、细胞质的核周区域(perinuclear region of cytoplasm)、囊腔(vesicle lumen)等细胞组成(cellular components,CC)407个条目,转录因子结合(transcription factor binding)、蛋白结构域特异性结合(protein domain specific binding)、蛋白激酶活性(protein kinase activity)等分子功能(molecular functions,MF) 667个条目。KEGG通路分析共富集出癌症途径(pathways in cancer)、磷脂酰肌醇3-激酶/蛋白激酶B(phosphoinositide3-kinase/protein kinase B,PI3K/AKT)信号通路、肿瘤坏死因子(tumor necrosis factor,TNF)信号通路、核因子κB(nuclear factor kappa-B,NF-κB)信号通路、丝裂原活化蛋白激酶(mitogen activated protein kinase,MAPK)信号通路、甲状腺激素信号通路(thyroid hormone signaling pathway)等438条通路,将count值排名前20的通路作为重要通路。见图3、图4。

图3 GO富集分析图
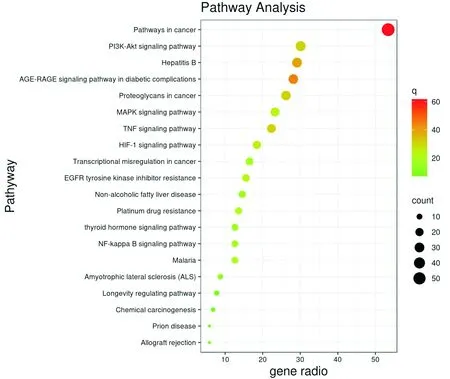
图4 KEGG通路富集分析图
2.5 “关键成分-潜在靶点-通路-疾病”网络构建及核心成分筛选103个潜在靶点对应黄药子有效成分9个,夏枯草有效成分8个,五味子有效成分6个,含黄药子和夏枯草共同成分4个。利用Cytoscape 3.7.2构建“关键成分-潜在靶点-通路-疾病”网络,并进行拓扑分析及可视化。结果显示,网络中共有143个节点、608条边,其中三角形代表相关作用通路,菱形代表疾病,橙色圆形代表潜在作用靶点,绿色六边形代表关键成分,节点越大、颜色越深,degree越大。对网络中的关键成分进行拓扑分析发现有19种关键成分,即为黄药子-夏枯草-五味子治疗SAT的关键成分,其中度值排名前3的分别为槲皮素、木犀草素、山奈酚。见图5。

图5 “关键成分-潜在靶点-通路-疾病”网络图
2.6 分子对接验证将p53肿瘤蛋白(tumor protein p53,TP53)、蛋白激酶Bα(protein kinase Bα,AKT1)、白细胞介素-6(interleukin-6,IL-6)作为受体蛋白,槲皮素、木犀草素、山奈酚作为配体小分子,使用AutoDockTools1.5.6对蛋白进行去水、加氢处理,对小分子进行加氢处理。使用AutoDock进行分子对接,并计算出靶点蛋白与小分子化合物之间的最低结合能,对接结果显示结合能全部小于-5 kcal·mol-1,表明受体与配体之间结合良好,且TP53与木犀草素、AKT1与山奈酚及IL-6与山奈酚的结合能最低。使用Pymol将分子对接结果可视化。见表3,图6。

表3 分子对接结合能

图6 分子对接结果
3 讨论
目前,SAT的发病机制不甚清晰,可能和病毒感染所致的自身免疫反应有关[4],临床中也发现SAT患者有时可有甲状腺自身抗体滴度的升高。黄药子-夏枯草-五味子是仝小林院士提出的治疗SAT的靶向药。黄药子性味苦、寒,有小毒,《本草纲目》描述其具有“凉血、降火、消瘿、解毒”之功效,在甲状腺疾病以及疮疡肿毒等病症的治疗中往往颇有成效[5]。临床研究显示,在中药汤剂中加入黄药子治疗SAT可减少发热、疼痛,缩短甲状腺肿大消退时间,促进血沉恢复[6]。但黄药子有小毒,具有一定的肝肾毒性,且与给药剂量、时间有关[7],因此合理、规范用药尤为重要。《本草经疏》记载:“药子之类,少服,止可外敷。”《中药学》规定黄药子用量为 5~15 g,《中医内科学》建议不宜超过10 g。临床中黄药子煎汤内服常用剂量为3~9 g,且不宜长期服用,以免造成肝肾损害。另外,合理配伍五味子、黄芩、黄柏、当归、甘草等可对黄药子起到减毒增效之功[8-9]。夏枯草作为药物最早见于《神农本草经》云:“味苦辛、寒。主寒热、瘰疬、鼠瘘、头疮、破症,散瘿结气,脚肿湿痹。”研究表明,夏枯草颗粒联合常规西药治疗SAT较对照组改善实验室指标、临床症状更佳,且复发率更低[10]。五味子酸甘性温,肝体阴而用阳,酸甘之味敛阴可养肝体、助肝阳,现代药理研究发现,其具有保肝功效,可减轻黄药子的肝毒性[11]。三药合用具有清肝泻火、消瘿散结、敛肝护肝之效,在临床治疗SAT时常可取得满意疗效。
本研究运用网络药理学方法筛选到黄药子-夏枯草-五味子有效成分28种,提示黄药子-夏枯草-五味子中多种成分共同发挥作用治疗SAT。其中度值排名前3位的槲皮素、木犀草素、山奈酚均具有抗感染、抗病毒及免疫调节等作用[12-18]。研究表明,槲皮素可能通过参与调控 NF-κB/Toll样受体4(Toll-like receptor 4,TLR4)通路,抑制炎性因子、趋化因子及炎性细胞介质的表达而发挥抗感染作用[19]。木犀草素主要以黄酮苷(木犀草苷、荭草素及异荭草素)的形式存在,可显著抑制IκB激酶β亚基(IκB kinaseβ,IKKβ)和κB抑制因子α亚基(α inhibitor of κB,IκBα)磷酸化,减少细胞核中p65表达量,抑制NF-κB信号通路以发挥抗感染活性,荭草素还可促进核因子E2相关性因子2 (nuclear factor erythroid 2 related factor 2,Nrf2)的表达和核移位从而发挥良好的抗氧化作用[20]。山奈酚除抗感染作用外,还可调节甲状腺激素的合成[21]。
本次研究筛选出TP53、AKT1、IL-6、TNF、血管内皮生长因子A(vascular endothelial growth factor A,VEGFA)、半胱天冬酶3(caspase 3,CASP3)等42个黄药子-夏枯草-五味子治疗SAT的关键靶点。研究发现,TP53、AKT1通过调控miRNA的表达,诱导细胞分化和凋亡,调节细胞周期,参与炎症反应过程[22-24]。IL-6作为经典的炎性细胞因子,可调节细胞的生长和分化,参与炎症和免疫反应过程[25-26]。TNF抑制剂的应用可能诱导SAT的发生,其机制可能与细胞因子失衡有关[27]。VEGFA可使新生血管形成、增加血管通透性,在许多炎症性疾病中发挥作用[28-30]。由此推测,黄药子-夏枯草-五味子有效成分可作用于多个靶点通过发挥抗感染、免疫调节、调节细胞周期、抑制细胞凋亡等作用治疗SAT。
GO富集分析结果表明,黄药子-夏枯草-五味子可能通过膜筏、囊腔、细胞质核周区域等细胞成分参与调节对无机物的反应、氧化应激、细胞凋亡等生物过程从而发挥转录因子结合、蛋白结构域特异性结合、蛋白激酶活性等分子功能,发挥治疗SAT的作用。KEGG通路富集分析表明,黄药子-夏枯草-五味子治疗SAT的通路主要包括PI3K/AKT通路、TNF信号通路、NF-κB信号通路、MAPK信号通路、甲状腺激素信号通路等。研究表明,激活PI3K/AKT通路,上调PI3K及AKT的磷酸化水平,可促进甲状腺功能恢复,并抑制炎症发生[31]。TNF信号通路、NF-κB 信号通路及MAPK信号通路均为与炎症反应、免疫应答及细胞凋亡相关的重要通路[32-34]。甲状腺激素信号通路与甲状腺激素水平直接相关,本研究亦表明TP53、AKT1均在此通路中表达。由此可推测,黄药子-夏枯草-五味子有效成分可通过炎症反应、免疫应答、调节细胞周期与甲状腺激素水平等途径治疗SAT。
分子对接结果表明,核心成分与靶点之间具有良好的结合活性,与TP53结合最稳定的成分为木犀草素,与AKT1、IL-6结合最稳定的成分为山奈酚,预测木犀草素和山奈酚在黄药子-夏枯草-五味子治疗SAT中发挥关键作用。
综上所述,本研究基于网络药理学构建了黄药子-夏枯草-五味子的网络模型,筛选出其有效成分,并分析其潜在靶点和相关通路,探究了黄药子-夏枯草-五味子主要有效成分及潜在靶点治疗SAT的作用机制,表明黄药子-夏枯草-五味子治疗亚急性甲状腺炎是多种成分通过多条通路作用于多个靶点的结果,分子对接结果表明,核心成分与核心靶点结合良好,为临床应用黄药子-夏枯草-五味子治疗SAT提供了思路,为今后的相关体内外实验提供理论基础。但本研究仍有不足之处,如数据收集尚不十分全面,由于条件限制尚未进行体内外实验,后期有待深入研究,以进一步验证本研究结果。
