超声引导切割针穿刺活检在儿童腹部实体肿瘤中的应用研究
2022-06-28刘登辉向强兴刘金桥黎明李勇
刘登辉,向强兴,刘金桥,黎明,李勇
湖南省儿童医院,1.普外科,2.超声科,湖南 长沙 410007
目前,儿童腹部实体瘤仍采用以手术和化疗为主的综合性治疗,对难以手术切除的病人常建议行术前新辅助化疗,待肿瘤体积缩小后争取手术的完整切除,提高患儿手术切除率,改善患儿预后[1]。明确病理诊断和合理临床分期是制定新辅助化疗方案的基础。超声引导穿刺活检已在成人肿瘤中广泛开展并指导临床治疗[2-4],虽近年来超声引导穿刺活检在儿童肿瘤诊治中逐渐开展[5-7],但在儿童腹部实体肿瘤中应用的大宗病例研究报道较少。本研究通过回顾性分析2017年1月至2020年12月湖南省儿童医院普外科收治的难以一期手术完整切除的43例腹部实体肿瘤患儿临床资料,探讨超声引导下切割针穿刺活检在儿童腹部实体肿瘤中的应用价值。
资料与方法
一、一般资料
43例患儿中,男性26例,女性17例,中位年龄为6岁7个月(2岁3个月~14岁)。主要临床表现以“腹胀”就诊,检查发现腹部肿块,其他有腹痛、下肢疼痛、呕吐甚至贫血等。术前影像学检查[彩超、增强CT及正电子发射计算机断层显像-CT(PET-CT)等]显示腹部占位性实性肿块,提示神经母细胞瘤21例,肝母细胞瘤10例,肝脏局灶性结节增生1例,肾母细胞瘤4例,非霍奇金淋巴瘤1例,腹部横纹肌肉瘤2例,4例患儿未能在影像学上提供诊断依据。2例神经母细胞瘤患儿合并转移病灶(骨和骨髓)、3例患儿合并中度贫血,无瘤体内出血病例,凝血功能、肝肾功能基本正常。手术可切除情况的评估标准及化疗方案选择参照中国抗癌协会儿童肝母细胞瘤、神经母细胞瘤、腹部淋巴瘤、横纹肌肉瘤等的多学科诊疗专家共识以及《儿童血液病、恶性肿瘤相关10个病种诊疗规范(2019年版)》等。本研究已经医院医学伦理委员会批准(批件号:HCHLL-2021-56),所有患儿入院检查及治疗前均签署知情同意书。
二、研究方法
本研究中实体肿瘤的穿刺活检在超声引导下进行,使用可重复穿刺自动活检枪(美国BardUrolical 18G);一次性穿刺切割活检针(18G Tru-cut活检针规格:内径1.0 mm、外径1.2 mm、射程22 mm),见图1A。其优势在于肿瘤穿刺后针芯位留在套管内,避免肿瘤针道播种。穿刺禁忌证:病情严重,基础条件差;有明显腹水、凝血功能异常、急性出血等。大龄儿童或能够固定体位的婴幼儿在局部麻醉下穿刺活检,不合作患儿或哭闹不能固定的婴幼儿在全身麻醉下穿刺活检。穿刺操作流程:术前常规超声评判,了解肿块部位、大小、与周围器官如血管、肠管和脏器之间的关系,标记最佳穿刺位置以确定穿刺进针点及方向(2~3个方位,见图1B、C、D),选择最短路径施行实性肿瘤区域取材。全身麻醉患儿以穿刺点为中心,穿刺部位需常规消毒3遍,术中彩超再次确定穿刺点和进针深度以确定最佳穿刺途径,击发扣动扳机,缓慢取出活检针(建议取4~6条组织标本,立即予以2 mL 0.9%NaCl溶液直接将标本从针道冲入固定液中)。穿刺后再次消毒,无菌纱布压迫5~10 min,术中超声再次检查肿瘤穿刺部位无活动性出血后加压包扎。患儿麻醉苏醒后转回病房,重点监护心率、呼吸、血压等生命体征及血氧饱和度等,于术后4 h复查血常规,嘱术后平躺并避免剧烈哭吵、运动。待穿刺组织病理诊断结果进行化疗。我们通过穿刺活检组织病理诊断和手术切除标本病理诊断之间的吻合率判定穿刺活检的准确性;通过穿刺术后并发症(出血量、伤口感染)及穿刺道瘤灶种植情况判定操作安全性。
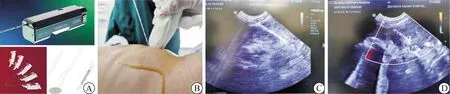
图1 超声引导下切割针穿刺活检 A.切割穿刺活检枪及活检针;B.术中超声定位;C.超声引导穿刺进针路径;D.穿刺后彩超检查无活动性出血
结 果
本研究43例患儿中,40例通过超声引导穿刺活检获取肿瘤组织标本,另3例患儿穿刺失败以开腹手术肿瘤活检明确诊断(神经母细胞瘤2例,横纹肌肉瘤1例)。活检病理诊断结果:神经母细胞瘤23例,肝母细胞瘤12例,肾母细胞瘤3例,非霍奇金淋巴瘤1例,横纹肌肉瘤1例。根据患儿病理诊断和临床分期进行规范化化疗,但有2例神经母细胞瘤患儿在明确诊断后家属放弃治疗,1例神经母细胞瘤患儿在化疗期间出现肿瘤溶解综合征死亡,余40例患儿在化疗后接受手术,术后大体标本病理诊断与穿刺活检病理诊断结果一致。穿刺活检成功率为93.02%(40/43)。所有患儿无穿刺部位伤口感染、出血、穿刺通道瘤灶种植转移等并发症发生。典型病例肿瘤化疗前后CT对比见图2。

图2 典型病例肿瘤化疗前后CT片对比 A.神经母细胞瘤化疗前可见肿块巨大且包绕腹腔干、肠系膜上动脉及肾动脉;B.神经母细胞瘤化疗后肿瘤病灶明显缩小;C.肝母细胞瘤化疗前可见肝脏巨大肿块,且包绕肝右、中静脉,门静脉及下腔静脉明显挤压变形,残肝体积<20%;D.肝母细胞瘤化疗后肿块明显缩小,仅门静脉右后支被包绕
讨 论
儿童腹部实体肿瘤发病隐匿,以神经母细胞瘤、肝母细胞瘤以及肾母细胞瘤三大肿瘤常见,其他恶性肿瘤有淋巴瘤、横纹肌肉瘤等[1]。多数患儿在就诊时肿瘤已处于晚期,无法一期手术完整切除,因而术前新辅助化疗在综合治疗中显得尤其重要[8]。参照中国抗癌协会儿童实体瘤多学科治疗专家共识以及《儿童血液病、恶性肿瘤相关10个病种诊疗规范(2019年版)》,对于难以一期手术切除的肿瘤患儿,建议应先行肿瘤活检明确病理诊断,术前以规范化新辅助化疗,待肿瘤病灶缩小后再手术,提高肿瘤切除率,改善患儿预后。
目前,通过开放手术、腔镜手术、超声或CT引导穿刺等多种手术方式获取肿瘤组织标本[2-4],但在儿童肿瘤领域仍以开腹手术活检为主,近年来有开展超声或CT引导穿刺活检的研究,但应用并不是很广泛。超声引导下粗/细针穿刺活检兼顾创伤小、恢复快,关键在于穿刺时可实时测量,引导进针深度,从不同方位选择进针位置,避开重要的血管、组织和器官,CT引导与超声定位引导穿刺有明显优势:无辐射、易操作、可重复性及家属易接受等[5,9-10]。与粗/细针穿刺活检比较,本研究应用超声引导的切割针穿刺活检,能获取较多组织标本满足病理检测需求,并且活检枪在击发后切割针针芯刺入肿瘤而外置套管停留在肿瘤表面,基本无肿瘤穿刺通道种植转移情况,明显提高了病理诊断的准确性及安全性。超声引导下肿瘤穿刺活检准确率高,在成人中广泛应用。近年来超声引导穿刺活检在儿童肿瘤诊治中逐渐开展[5-7],但评估其安全性、准确性的研究报道较少。Avanzini等[11]报道超声引导细针穿刺活检在儿童神经母细胞瘤中的诊断率为100%(29/29);Metz等[5]发现在儿童软组织肿瘤粗针穿刺标本病理准确率为97%(105/108);Yunker等[12]报道穿刺活检在儿童甲状腺肿瘤诊断中敏感性为85%(63/74)。在本研究中43例儿童腹部实体肿瘤行超声引导下切割针穿刺活检,获组织标本量较多,冰冻病理诊断与术后大样本组织诊断一致,且穿刺样本量完全能满足免疫组织化学的检测要求。由此可以看出,在超声引导下切割针穿刺活检准确性较高,能够提供明确的病理诊断。但有3例在超声定位下穿刺失败,主要原因在于所获取组织标本水肿、质地易脆,且穿刺时未能准确定位到肿瘤实性组织中,以及肿瘤病灶中有坏死成分,所取样本量少,因而术中转开腹手术以满足病理活检要求。这与Raymond等[10]报道一致。
在本研究中,超声定位穿刺无辐射、可重复操作,能准确引导进针深度,避开重要血管、组织,而且与自动活检枪结合应用能安全、快速、准确完成组织取材;还可观察到穿刺针是否进入实性的肿块内,提高了取材成功率。关键在于穿刺前彩超医师、临床医师对肿瘤穿刺可行性进行充分评估,建议在预计手术切口路径上确定穿刺点,选择最短路径施行实性肿瘤区域取材,提高穿刺成功率。本研究中局部麻醉下完成穿刺活检29例,全身麻醉下完成穿刺活检14例,操作过程中利用可固定穿刺针的超声探头精准把握进针方向和深度,避开脏器和血管,穿刺后加压止血以避免并发症的发生。超声引导下穿刺活检的主要并发症是出血,应要求在穿刺后伤口加压5~10 min止血以及卧床休息,避免穿刺部位出血,本组病例中无穿刺部位活动性出血情况发生。针刺活检穿刺创伤小,基本不留瘢痕,术后无明显疼痛,亦未见穿刺部位伤口感染、肿瘤穿刺通道种植转移等并发症发生。同时,为保证病理诊断获得足量的标本,建议活检穿刺不同方向约4~6条标本组织,个别肿瘤病灶穿刺组织数更多,以明确病理类型,且能为临床提供更多的信息。
术前新辅助化疗在儿童实体瘤诊治中尤其重要,化疗后再手术明显观察到术中肿瘤病灶大量坏死、钙化,对化疗敏感患儿其肿瘤病灶血供明显减少,病灶表面组织失去肿瘤活性以及转移淋巴结减活,大大降低了术中肿瘤种植风险;另外,一般化疗后瘤体体积可缩小至原来的1/3~1/2,手术视野相对开阔,部分包裹的重要器官、血管能有较好的显露,更有可能完整切除肿瘤而保留邻近重要组织,术中出血量少,手术并发症低;同时化疗还可有效杀灭血液循环中微小转移灶和远处转移灶[13]。一般建议术前4周期化疗后评估病情,再行根治性手术[8]。本组所有病例在穿刺活检后明确病理诊断,选择化疗方案,所有患儿肿瘤病灶体积均有缩小,2例患儿远处转移灶消失。37例患儿化疗4个疗程(其中有5例神经母细胞瘤患儿化疗6个疗程)后肿瘤完全切除,但仍有3例患儿仅切除病灶的90%~95%,2例放弃治疗,1例化疗期间出现肿瘤溶解综合征而死亡。因此,对于小儿腹部实体瘤,首次就诊时应该充分评估手术是否可完整切除,在完整切除肿瘤的同时保证周围血管、脏器不受损伤,达到肿瘤切除后重要血管骨骼化目的,对于不可完全切除的肿瘤应行穿刺活检明确诊断,先期行新辅助化疗是十分必要的,也是儿童实体肿瘤规范化治疗的重要措施[14]。
总之,超声引导下穿刺活检在诊断儿童腹部实体肿瘤中的临床应用安全、准确,值得临床推广应用。
