预测肝癌术后生存率的列线图模型在评价术后辅助性TACE疗效中的价值
2022-06-28哈丽达夏尔甫哈孜冯娟范晓棠石绣江陈兰克拉热阿合买提阿丽亚热哈提
哈丽达·夏尔甫哈孜,冯娟,范晓棠,石绣江,陈兰,克拉热·阿合买提,阿丽亚·热哈提
新疆医科大学第一附属医院消化病二科,新疆 乌鲁木齐 830054
肝癌根治术和肝移植是治疗肝癌的有效方法,但肝癌恶性程度高,具有极强的血管侵袭能力,病人术后无瘤生存率低,复发率高,远期预后差[1-3]。文献报道肝癌根治术后早期复发率高达40%,5年复发率为50%~70%,肝移植术后肝癌的复发率为15%~30%,严重影响病人预后[4-6]。由于肝癌术后较高的复发和转移率,因此,正确有效的辅助治疗对预防肝癌术后复发转移具有非常重要的临床意义。经导管动脉化疗栓塞术(transcatheter arterial chemoembolization,TACE)是目前肝癌术后应用最多的辅助治疗,用于治疗肿瘤的微转移灶,灭活残余肿瘤灶,降低复发率。理论上,癌前病变及残癌细胞在进展为实体瘤的过程中,必先有肿瘤血管的生成。术后行TACE治疗可在残肝中保持较高的药物浓度,起到阻断肿瘤血供、杀灭可能存在的残癌和抑制癌前病变的效果;同时,癌灶中的碘油还可提高对微小病变的检出率,起到早期诊断、早期治疗的双重作用。基于上述优点,辅助性TACE的应用似有越来越广泛的趋势[7-8]。但对于肝癌根治术后行辅助性TACE治疗是否能使病人获益,国内外文献报道尚存争议。如何根据不同情况制定与病人个体化相适宜的辅助性TACE治疗方案,目前仍处于探索阶段,本研究通过建立预测肝癌术后生存率的列线图模型,用以评价肝癌术后辅助性TACE的疗效,旨在为临床肝癌术后生存情况的精准评估和术后TACE治疗的优化使用提供依据。
资料与方法
一、研究对象
收集2013年12月至2015年12月在我院普通外科接受根治性手术切除的201例肝细胞癌(hepatocellular carcinoma,HCC)病人的临床病理资料。纳入标准:(1)首次确诊肝癌并接受肝癌根治术;(2)年龄30~70岁,男女不限;(3)Child-Pugh分级为A级或B级。排除标准:(1)合并广泛的肝内肝外转移以及淋巴结侵犯;(2)合并门静脉或腔静脉癌栓;(3)姑息性切除;(4)合并其他恶性肿瘤。
本研究经新疆医科大学第一附属院医学伦理委员会审核批准(批件号:K20131115423),所有病人及家属均知情同意并签署知情同意书。
二、研究方法
1.根治性肝癌切除术标准 术中完整切除肿瘤,切缘无癌残留;术后3个月影像学检查未见肿瘤残存,术前甲胎蛋白阳性者术后 2个月内降至正常。
2.辅助性TACE治疗 所有病人经术后综合评估如存在肿瘤直径较大,侵袭性较强,多发肿瘤或微血管侵犯(microvascular invasion,MVI)阳性则建议术后行辅助性TACE治疗。具体操作: 采用 Seldinger 技术经股动脉穿刺插管,引导导管至肝固有动脉,然后行数字减影血管造影(DSA),导管插在肝固有动脉处灌注奥沙利铂50 mg、表柔比星30 mg,然后用20 mg表柔比星乳化3~5 mL碘油后栓塞。
3.血管内皮生长因子(vascular endothelial growth factor,VEGF)检测方法与结果判读 采用免疫组织化学SP方法检测HCC癌组织VEGF表达,兔抗人VEGF单克隆抗体(即用型)为福建迈新公司产品。石蜡切片常规脱蜡至水,磷酸盐缓冲液(PBS)冲洗3 次,每次5 min;3%过氧化氢室温孵育15 min,以彻底消除标本中内源性过氧化氢酶的活性。PBS冲洗 3次,每次5 min。切片置枸橼酸盐缓冲液中加热至95~98 ℃,持续10 min,然后自然冷却约50 min,PBS冲洗3次,每次5 min。5%正常山羊血清封闭,室温孵育20 min。滴加一抗(VEGF为即用型工作液),PBS冲洗 3次,每次5 min。滴加1∶50稀释的生物素标记的二抗(1% BAS-PBS稀释),37 ℃孵育1 h,PBS冲洗3次,每次5 min;应用3,3′-二氨基联苯胺(DAB)对其显色。PBS充分冲洗,苏木精复染,脱水,中性树胶封固。PBS代替一抗作为阴性对照。被染成棕黄色或棕褐色的内皮细胞或细胞簇团均认为是新生的肿瘤血管。先在低倍视野内找到肿瘤组织微血管密度最高的区域,然后在高倍视野内计数微血管的数目,计算此区域的微血管数目。VEGF阳性者免疫组织化学染色细胞膜和胞质着色,阳性细胞数≥30%者为阳性,<30%为阴性,见图1。
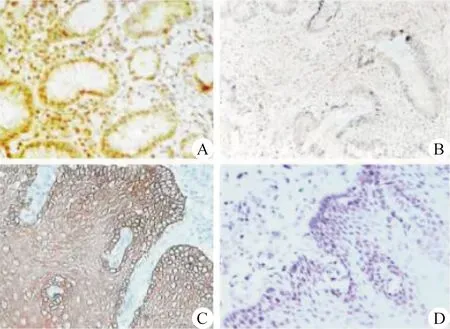
图1 免疫组织化学检测血管内皮生长因子(VEGF)在肝癌组织和癌旁组织中的表达 A.肝癌组织VEGF阳性表达(HE,×200);B 肝癌组织VEGF阴性表达(HE,×200);C.癌旁组织VEGF阳性表达(HE,×200);D.癌旁组织VEGF阴性表达(HE,×200)
4.MVI的诊断标准 参考《原发性肝癌诊疗规范(2019年版)》[9],由我院专业病理科医师判定,阳性定义为显微镜下于内皮细胞衬覆的血管腔内见到癌细胞巢团,多见于癌旁肝组织内的门静脉小分支或肿瘤包膜内血管,见图2。

图2 肝癌病人微血管侵犯的病理学检查 A.微血管侵犯阳性(HE,×100),箭头所示为血管腔内的癌细胞巢团;B.微血管侵犯阴性(HE,×100)
5.术后随访 本研究纳入的201例病人术后均规律随访,无1例失访者,所有病人自手术后第1个月开始,每月随访1次,连续随访2次后改为每3个月随访1次。项目包括血常规、生化、凝血、肿瘤标志物以及腹部彩超和CT或 MRI,随访截止时间为2020年12月或病人肝癌术后5年内因肿瘤复发转移死亡,总生存期为肝癌术后至因肝癌复发转移死亡的生存时间。
三、统计学处理
应用SPSS(22.0版)软件进行统计分析,对所有指标先进行Kaplan-Meier单因素分析,然后将单因素分析中有统计学意义的指标代入Cox模型进行多因素校正,采用向前逐步回归,得到独立预测因子,根据独立预测因子结合术后1、3、5年的基准死亡风险,应用R软件,构建列线图模型,以Bootstrap法进行内部验证,计算区分度评价指标C-index ,并通过Hosmer-Lemeshow(H-L)检验进行模型的内部验证并评价其校准能力,应用受试者工作特征(ROC)曲线获得列线图总评分的最佳诊断截点,将所有病人分为高、低危组,Kaplan-Meier生存分析比较高危组和低危组不同TACE治疗的各阶段累积生存率,P<0.05为差异有统计学意义。
结 果
一、研究对象的一般资料
共201例在我院接受手术治疗的HCC病人纳入研究,201例HCC病人中男性130例(64.7%),女性71例(35.3%),年龄为(55±8)岁,肝癌术后1、3、5年总生存率分别为81.2%、57.5%、42.8%,中位生存时间为(38±9)个月,术后接受辅助性TACE治疗的病人有131例(65.2%),未行辅助性TACE治疗者70例(34.8%),接受辅助性TACE治疗病人中多发肿瘤伴MVI有26例(19.8%),多发肿瘤伴最大肿瘤直径≥5 cm者42例(32.1%),MVI伴最大肿瘤直径≥5 cm者35例(26.7%),多发肿瘤伴最大肿瘤直径≥5 cm以及MVI者28例(21.4%)。
二、Kaplan-Meier单因素分析和Log-rank检验
结果显示,7个指标的各阶段累积生存率在单因素分析中差异有统计学意义,分别为乙型肝炎病毒DNA载量、中性粒细胞与淋巴细胞比值(NLR)、MVI、肿瘤最大直径、肿瘤数目、肿瘤分化程度、VEGF(均P<0.05),见表1。

表1 肝细胞癌病人围术期临床病理指标的单因素分析
三、多因素Cox回归分析
将单因素分析中有统计学意义的指标代入多因素Cox模型进行分析,校正和控制混杂变量后,筛选出5个对肝癌术后生存情况有显著性影响的独立预测因子:MVI(β=1.310;HR=3.706)、肿瘤数目(β=0.671;HR=1.956)、VEGF(β=0.532;HR=1.702)、肿瘤最大直径(β=0.792;HR=2.208)、肿瘤分化程度(β=0.421;HR=1.523),均P<0.05,见表2。
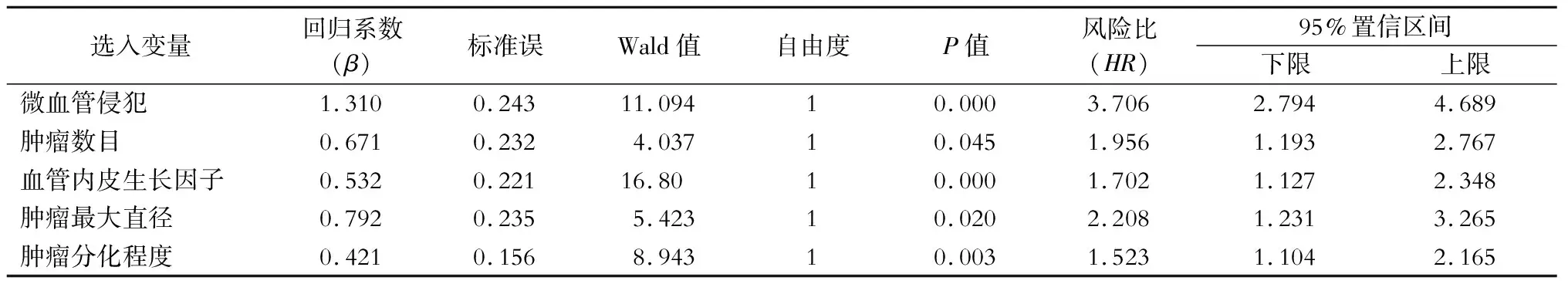
表2 Cox多因素分析
四、独立预测因素的赋分
根据列线图原理对每个独立预测指标进行拟合系数转化,以系数转化值最大的指标(MVI的系数转化值:1.310)为参考基础,设定得分范围为(0,10),其他指标以MVI的系数转化值为基础,按照一定的公式转换成比例得到其他指标的最大得分,即相应指标的最大得分=10×(相应指标的系数转化值/1.310),见表3。
五、列线图模型的建立
基于Cox多因素分析结果获得的5个独立预测因素,结合术后1、3、5年的基准死亡风险建立列线图模型并通过R软件构建列线图,图3为结合了VEGF基因预测肝癌根治术后1、3、5年总生存率的列线图,每个独立预测指标刻度线上的数值对应分数刻度线上的评分(见表3的赋值过程),所有指标的评分相加为列线图总评分,每位病人的列线图总评分对应其肝癌根治术后1、3、5年总生存率的预测值。

表3 独立预测因素的赋分
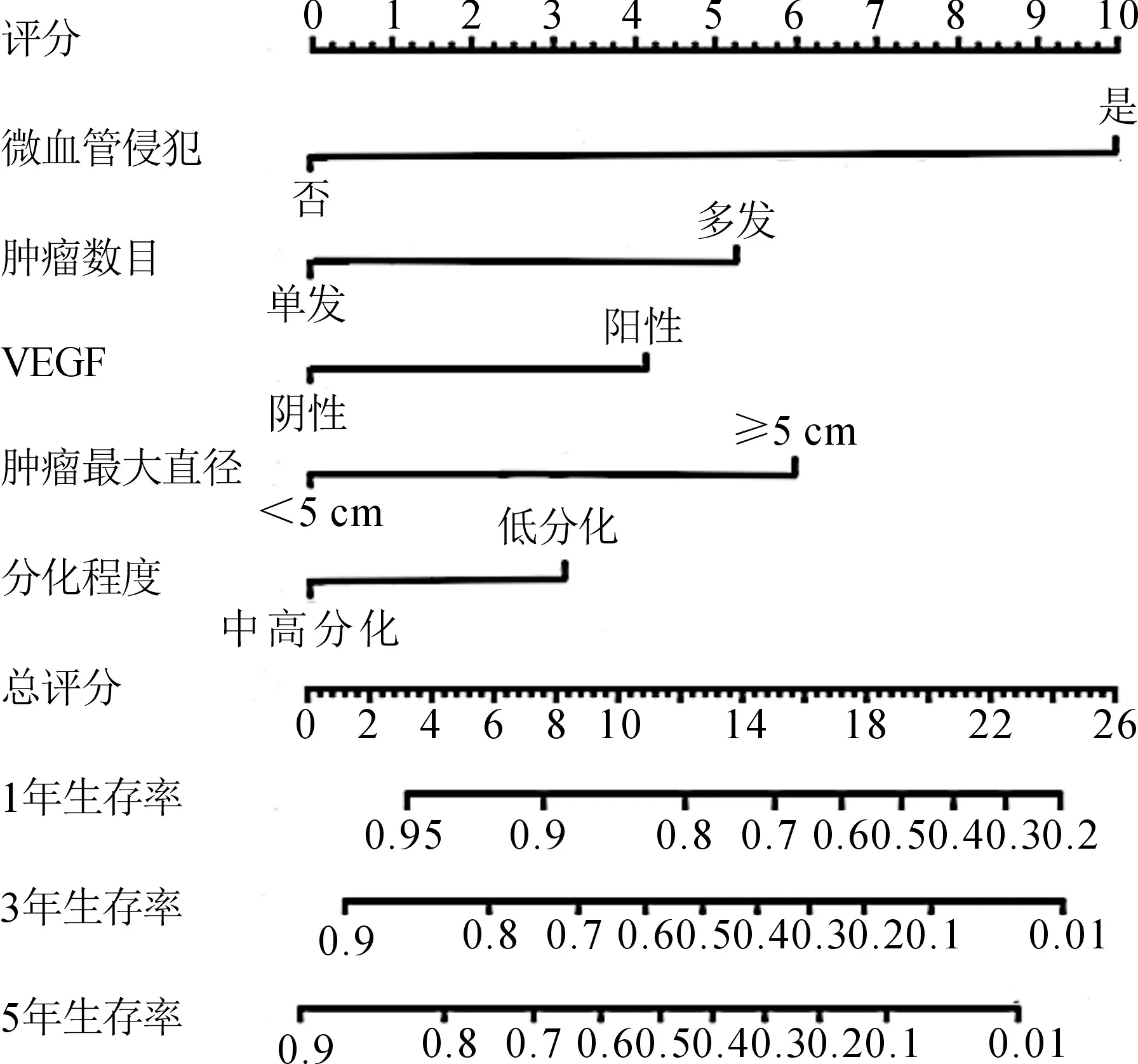
图3 结合了血管内皮生长因子(VEGF)基因预测肝细胞癌(HCC)术后1、3、5年总生存率的列线图
六、列线图模型的验证
对列线图预测模型采用Bootstrap法进行内部验证,自抽样1 000次,其区分度评价指标C-index为0.818[95%CI(0.775,0.927)],提示该模型具有较好的区分度和诊断效能。将201例病人的列线图总评分从低到高排成一个队列,并按照列线图总评分的五分位将队列分为5组,计算出每组病人术后1、3、5年总生存率预测值的均值,并与每组病人术后1、3、5年实际总生存率相比较,术后1年生存率比较(预测:93.5%、78.2%、65.7%、48.2%、41.2%,实际:95.7%、74.1%、61.5%、49.2%、39.8%,χ2=1.124,P=0.263);术后3年生存率比较(预测:79.2%、57.2%、41.3%、29.1%、25.2%,实际:81.2%、60.5%、38.1%、25.0%、23.1%,χ2=0.966,P=0.317);术后5年生存率比较(预测:61.4%、46.4%、27.5%、21.1%、10.2%,实际:63.7%、44.5%、25.6%、19.1%、9.6%,χ2=0.846,P=0.386),H-L检验提示列线图模型的预测值与实际观测值符合度良好,预测能力较准确。
七、 Kaplan-Meier 生存分析
根据ROC曲线获得列线图总评分的最佳诊断截点为15.1分,最佳诊断截点用于预测肝癌术后5内死亡的灵敏度和特异度分别为83.6%和76.9%,根据最佳诊断截点将所有病人分为低危组(总评分<15.1分)和高危组(总评分≥15.1分),低危组65例(32.3%),其中TACE治疗12例(18.5%),未行TACE治疗53例(81.5%);高危组136例(67.7%),其中TACE治疗≥2次57例(41.9%),TACE治疗1次62例(45.6%),未行TACE治疗17例(12.5%)。低危组:TACE组术后1、3、5年累积生存率(91.6%、83.3%、75.0%)与未行TACE组(92.4%、71.6%、56.6%)比较,差异无统计学意义(P=0.168)。高危组:TACE治疗≥2次、TACE治疗1次和未行TACE治疗3组进行两两比较,TACE治疗≥2次组术后1、3、5年累积生存率(100.0%、63.2%、26.3% )显著高于TACE治疗1次组(90.3%、27.4%、20.9%,P=0.029);而TACE治疗1次组各阶段累积生存率(90.3%、27.4%、20.9%)显著高于未行TACE治疗组(76.4%、11.8%、11.8%,P=0.043),见图4,图5。
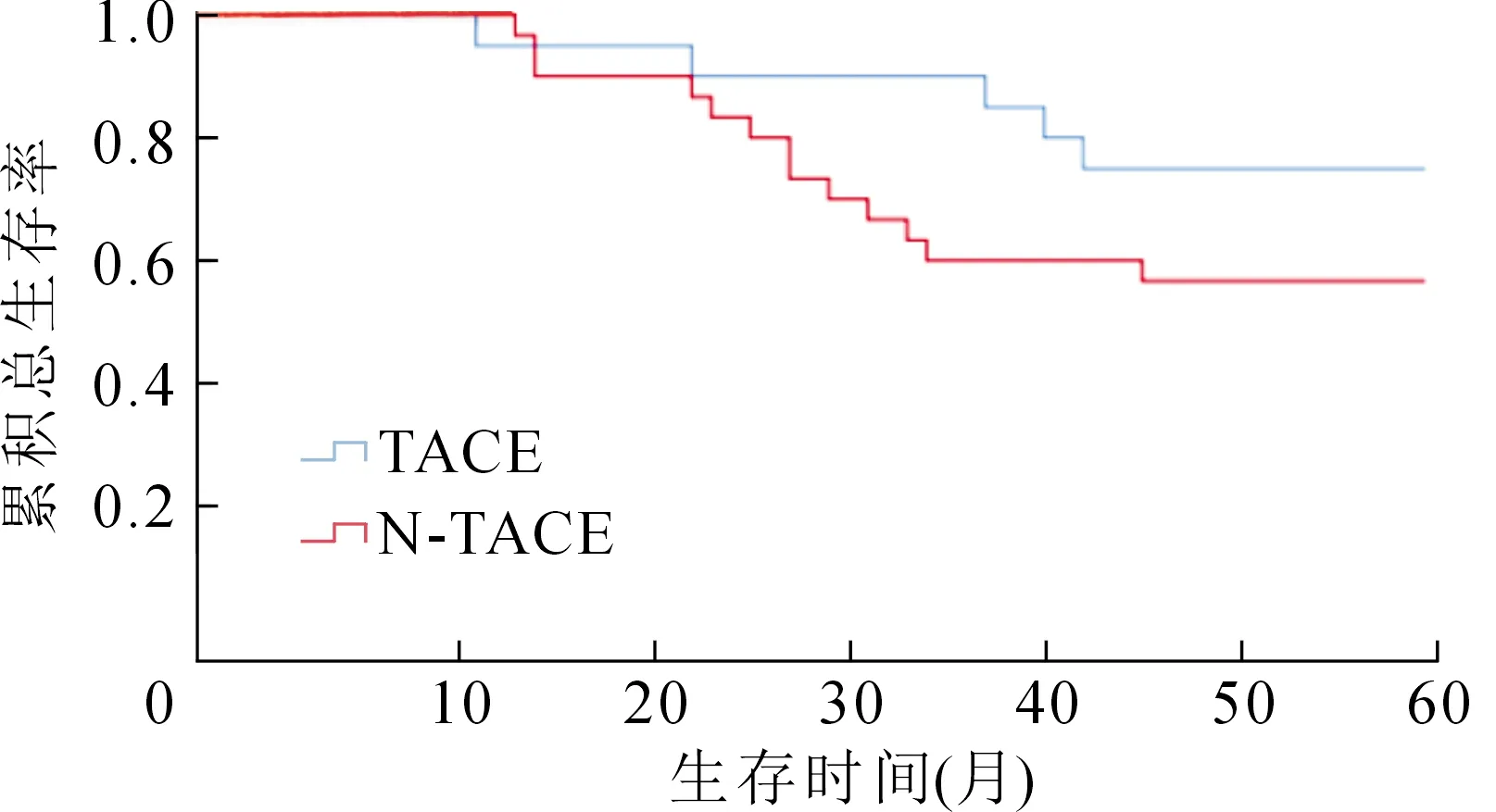
图4 肝癌根治术后低危组病人不同经导管动脉化疗栓塞术(TACE)治疗次数各阶段累积生存率比较的生存曲线分布图

图5 肝癌根治术后高危组病人不同经导管动脉化疗栓塞术(TACE)治疗次数各阶段累积生存率的生存曲线分布图
讨 论
目前肝癌切除术和肝移植术仍是根治肝癌的主要方法,但由于肝癌细胞极易侵犯血管,无论是肝癌切除还是肝移植术都不能预防其复发和转移,MVI作为肿瘤细胞入侵血管的中间阶段,是肝癌向肝内及远处复发转移的关键步骤[10-13],国内外大量研究[14-17]证实MVI是影响肝癌术后复发转移和长期生存的独立危险因素,肝癌合并MVI术后早期复发风险显著高于无MVI的病人,无瘤生存期和总生存时间短,预后差。美国癌症联合委员会肝癌分期系统重点关注了影响肝癌术后预后的病理因素,其中包括有无MVI[18],而本研究的多因素分析也显示,MVI为影响肝癌术后生存的独立危险因素,且伴有MVI的肝癌病人术后5年内死亡的风险为非MVI肝癌病人的2.94倍,再次证实了以上结论。
恶性肿瘤的生长、浸润和转移依赖于肿瘤血管生成,近些年来 VEGF 在肝癌血管生成和进展中的作用被广泛研究。VEGF 能通过旁分泌形式特异性作用于血管内皮细胞,通过促进内皮细胞增殖、增加血管通透性,以诱导肿瘤血管生成,在肿瘤的发生发展中起关键作用[19-20]。张继红等[21]的研究发现肝癌组织中 VEGF 的表达水平高于癌旁肝组织,并且在肝癌组织中 VEGF 的表达与微血管侵袭有关,而且随着肝癌组织血管形成的逐步发展,VEGF 的表达程度也逐渐增加。Rastegar等[22]的研究结果表明,VEGF 是一种增加血管通透性并促进新血管生长的细胞因子,在肝癌组织中呈高表达,并与侵袭转移和预后等生物学行为关系密切,VEGF 高表达病人肝癌根治术后无瘤生存率与总生存率明显低于VEGF 低表达者。本研究多因素分析结果显示,VEGF高表达者HCC术后5年内死亡的风险是VEGF低表达者的1.51倍,与以上研究报道一致,其可能机制为高表达的VEGF可通过促进肝窦内皮细胞增殖、收缩、迁移而促进肝窦毛细血管化,促进肝癌肝内转移。
但根据临床病理因素评估肝癌术后生存情况需要一个客观、统一的评估标准,因此基于多因素研究结果得到的5个独立预测因素结合肝癌术后1、3、5年基准死亡风险,我们成功建立了列线图预测模型,通过列线图模型可得到肝癌术后1、3、5年的生存概率,提高了临床对肝癌术后病人生存状态的准确评估能力,此外,本研究中引入VEGF基因构建了一个新的风险预测模型,将肝癌的各个临床病理特征(肿瘤分期、肿瘤负荷、侵袭潜能)以及生物学特性结合各自的量化权重均体现于模型中,相比之前研究用单一因素去预测将来某结局事件发生的风险,本模型预测价值有了明显提高,经H-L外部验证,该模型得出的预测值与实际观察值符合度良好,预测能力较准确,具有较好的临床应用前景。
TACE通过超选择性栓塞肝小动脉,提高局部肝组织化疗药物浓度,进入肝动脉的化疗药物通过缓释作用抑制和清除微血管内的癌细胞团,同时TACE可通过肝动脉与门静脉之间的微小吻合支直接清除门静脉微小分支内微血管侵犯灶,血管栓塞也可以通过缺血缺氧导致肿瘤细胞死亡,理论上,术后TACE通过以上途径消灭残余肝内微小的转移灶,减少肿瘤的复发转移,但其改善肝癌预后的疗效仍然存在较大争议。主要原因是目前国内外尚无肝癌术后辅助性TACE治疗的推荐指南以及尚未制定出适合不同病情的对应术后TACE的治疗方案。为解决以上问题,我们根据ROC曲线获得列线图总评分的最佳诊断截点,将所有病人分为低危组(总评分<15.1分)和高危组(总评分≥15.1分)。Kaplan-Meier生存分析提示对于总评分≥15.1分的高危病人,术后辅助性TACE治疗明显增加其术后生存时间,并且予以2次以上辅助性TACE治疗将为这些病人带来更明显的生存获益,而在总评分<15.1分的低危病人中,TACE组术后各年的累积生存率虽高于未行TACE组,但总体差异无统计学意义。造成这种情况的原因可能是有少数低危病人伴有1种或2种侵袭性危险因素,手术不易达到根治,而术后TACE治疗可帮助消灭术后残癌灶或癌前病变组织,减少肿瘤术后复发转移的概率,提高了这类病人的总生存率。因此,推荐这些伴有危险因素的低危病人在术后接受1次TACE治疗,而多数不伴有危险因素的低危病人,术后TACE治疗并不能明显改善其术后生存时间,故推荐术后不予以TACE治疗,定期复查随访即可。
综上所述,结合VEGF基因的列线图模型可较准确地预测肝癌术后1、3、5年总生存率,并且根据列线图总评分可制定出与病人个体化相适宜的TACE治疗方案,为临床肝癌术后生存情况的精准评估和术后TACE治疗的优化使用提供依据,具有重要的临床意义。
利益冲突所有作者均声明不存在利益冲突
