腹腔镜胃袖状切除术对肥胖合并代谢性疾病的治疗效果分析
2022-06-28胡梦杰文君君龚铖刘志苏袁玉峰潘定宇李震
胡梦杰,文君君,龚铖,刘志苏,袁玉峰,潘定宇,李震
武汉大学中南医院肥胖症与代谢病外科中心 武汉大学中南医院肝胆胰外科 湖北省肝胆胰疾病微创诊治临床医学研究中心,湖北 武汉 430071
据报道,2016年全球20岁以上的人口中,男性肥胖病人达2.81亿,女性为3.9亿[1]。至2030年,全球肥胖人口预计将达到11.2亿(占成年人人口的20%)[2]。肥胖及其并发症导致肥胖人群死亡率增加[3-4]。这些并发症不仅会降低预期寿命,还会降低生活质量[5]。与生活方式改变和内科减重相比,减重手术是目前唯一有效治疗肥胖及其合并症且疗效持久的治疗方式[6-7]。腹腔镜Roux-en-Y胃旁路术(laparoscopic Roux-en-Y gastric bypass,LRYGB)是经典的减重术式,长期随访疗效确切[8]。20世纪90年代后期兴起的胃限制性手术成为肥胖外科学发展中标志性术式,腹腔镜胃袖状切除术(laparoscopic sleeve gastrectomy,LSG)最初用于手术风险较高的病人的一期手术,近年来因其手术操作简单、短期疗效好而越来越得到全世界减重代谢外科医生的重视[7-11]。我国减重代谢外科近年来发展迅速,但对于术式的选择和手术疗效的评价仍然存在争议,缺乏大样本、中长期随访报道。本研究对2017年8月至2021年3月武汉大学中南医院肥胖症与代谢病外科中心完成的439例LSG病例进行回顾性分析,探讨其治疗效果以及存在的问题,现报告如下。
资料与方法
一、一般资料
2017年8月至2022年4月武汉大学中南医院肥胖症与代谢病外科中心收治肥胖病人1 075例,从中选取2017年8月至2021年3月具有较完整随访数据的病人490例。术式的选择基于术前体质量指数(body mass index,BMI)值、血生化检查指标、胃镜报告结果和《中国肥胖及2型糖尿病外科治疗指南(2019版)》[12]。术式分布为:LSG 439例,LRYGB 39例,LSG+单吻合口十二指肠回肠旁路术(single-anastomosis duodenoilealbypass with sleeve gastrectomy,SADI-S)4例,LSG+十二指肠-空肠旁路术(duodenal to jejunal bypass,DJB)2例,LSG+空肠-空肠旁路术(jejuno-jejunal bypass,JJB)5例,LRYGB修正手术1例。因为LSG以外的术式病例数少,不纳入本项研究,故本研究聚焦439例LSG病人进行回顾性分析。
所有病人均被详细告知每种技术的风险和益处,所有病人均签署知情同意书,该项目实施获得武汉大学中南医院医学伦理委员会批准(批件号:2019021)。
439例病人中男性110例,女性329例;年龄为(30.58±7.31)岁,年龄范围为15~62岁;术前BMI为(37.70±6.49) kg/m2。术前合并症:术前合并胆囊结石25例,胆囊息肉10例,2型糖尿病73例,脂代谢异常277例,高尿酸血症285例。
二、术前准备
所有病人均由肥胖症与代谢病外科中心团队(肥胖症与代谢病外科、内分泌科、心内科、呼吸科、麻醉科、重症医学科和睡眠呼吸医学中心医生)进行术前评估。完成多学科小组的术前检查,对所有病人进行胃镜和腹部超声检查。术前治疗并控制可能的幽门螺杆菌感染和相关的胃溃疡疾病,同时锻炼并改善心肺功能。
三、手术要点
按照《中国肥胖及2型糖尿病外科治疗指南(2019版)》[12]的术式要点,手术方法简介如下:取“大”字仰卧、头高脚低位,常规4孔操作,沿胃大弯侧自幽门至贲门逐步游离胃结肠韧带及胃脾韧带,切断胃网膜左动脉、胃短动脉,游离至食管左侧。置入36F胃管,紧贴胃小弯,自幽门上方约4 cm以切割缝合器靠近胃管切除胃大弯及胃底直至食管左侧。His角以倒刺线半荷包包埋,余切割线以倒刺线行全层加强缝合,可附带网膜复位(早期手术未作网膜复位)。见图1。

图1 腹腔镜胃袖状切除术的步骤 A.游离胃结肠韧带及胃脾韧带,切断胃网膜左动脉、胃短动脉、胃后动脉;B.置入36F胃管,紧贴胃小弯,自幽门上方约4 cm以单极电凝标记切割线;C.以切割缝合器靠近胃管切除胃大弯及胃底直至食管左侧;D.His角以倒刺线半荷包包埋,余切割线以倒刺线行全层加强缝合,可附带网膜复位 图2 术后第3天行上消化道碘水造影
四、术后处理
所有病人术后均给予抗感染、抑酸、补液、抗凝等治疗。术后48 h开始进水,术后第3天行上消化道碘水造影(图2)。明确无胃漏、消化道通畅性良好后,给予出院;由个案管理师指导病人术后饮食:进清流食,逐步过渡为流食(至少2周)、半流食、普食。出院后口服抑酸药物1个月,术后半年口服复合维生素及微量元素等。于术后1、3、6、12、24个月门诊随访,之后每年门诊随访1~2次,并指导饮食与生活管理。
五、观察指标及标准
回顾了病人的住院病历、门诊电子病历,结合小程序、微信、电话随访术后病人,收集术前和术后1~36个月临床资料如下:(1)人体测量结果[体重、BMI、多余体重减少百分比(percent excess weight loss,%EWL)];(2)血糖代谢结果[空腹血糖、糖化血红蛋白(HbA1c)和空腹胰岛素];(3)脂代谢及生化结果[总胆固醇、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、三酰甘油(TG)、丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、尿酸]。
血糖缓解标准:术后空腹血糖<7.0 mmol/L,HbA1c<6.5%[13]。%EWL=(初始体重-术后测量时的体重)/[初始体重-理想体重(指BMI=25 kg/m2的体重)]×100%。所有血液生化值均参照标准参考值来定义是否异常。
六、统计学方法
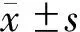
结 果
一、一般情况
439例均顺利完成LSG手术,其中14例同时行胆囊切除术,1例LSG同时行阑尾切除术。439例病人住院时间为(10.38±2.71) d。对病人进行随访,随访时间为术后1~36个月。
二、术后体重、BMI及%EWL变化
术后病人体重及BMI均持续下降,与术前比较差异均有统计学意义(均P<0.05),术后1、3、12、24、36个月病人%EWL见表1。术后36个月随访的50例病人均连续接受前4次体重随访。随访过程中病人未出现严重营养不良等情况。
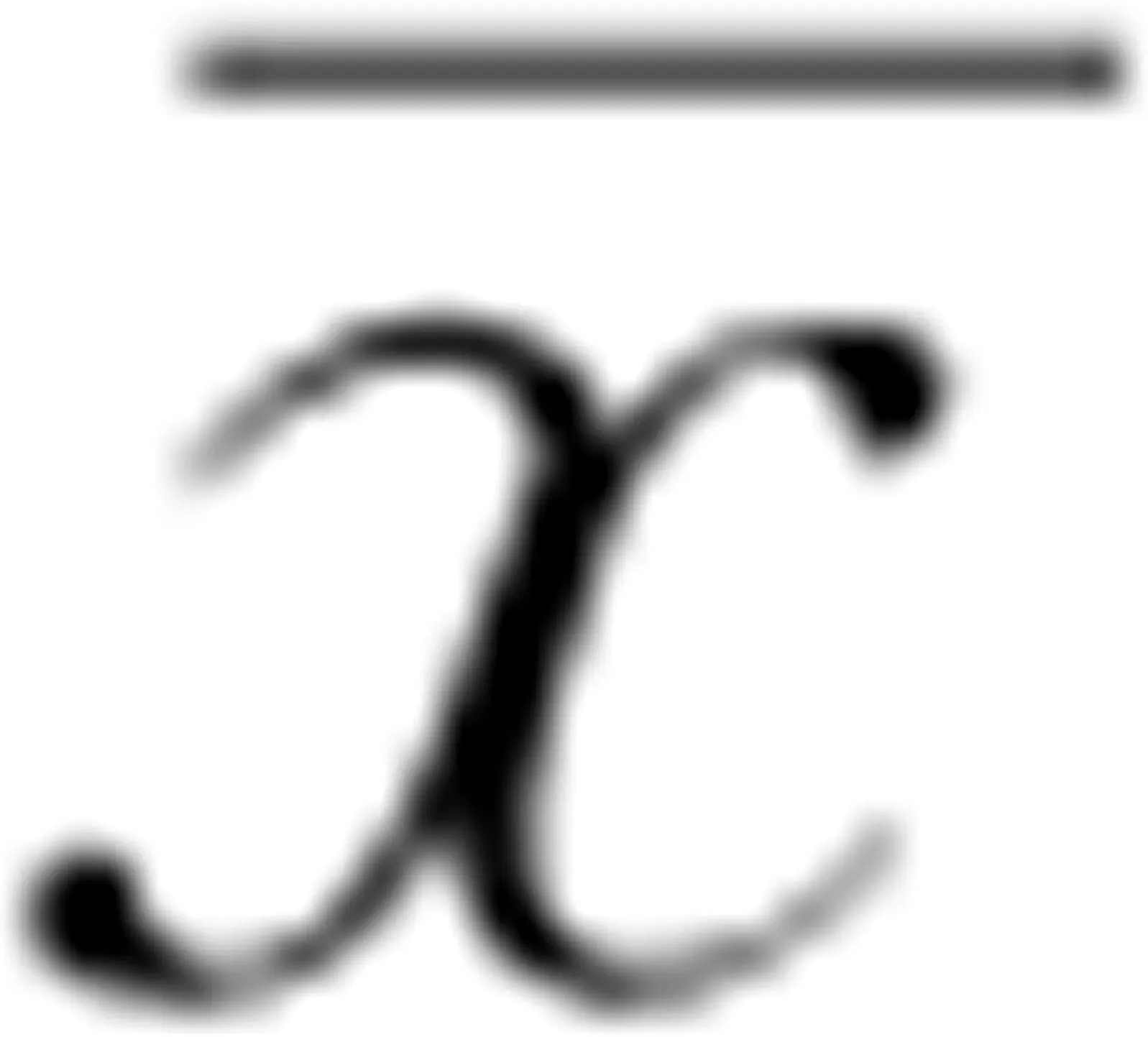
表1 术前与术后体重、BMI及EWL的变化(±s)
从体重、BMI和%EWL趋势图分析可得知:术后12个月时体重降至最低,此时BMI为(25.48±4.45) kg/m2,%EWL达到最高水平,为(109.82±43.27)%,术后24个月、36个月体重出现少量回升,但较术前下降趋势仍显著,差异有统计学意义(P<0.05)。见图3。

图3 体重、体质量指数(BMI)、多余体重减少百分比(%EWL)变化趋势 A.体重变化趋势;B.BMI变化趋势;C.%EWL变化趋势
三、术后空腹血糖、HbA1c、空腹胰岛素变化
所有病人术后空腹血糖、HbA1c、空腹胰岛素持续下降,术后3、6、12个月空腹血糖和HbA1c较术前明显下降,差异均有统计学意义(均P<0.05)。术前有73例病人合并2型糖尿病,术后2型糖尿病病人持续随访48例,其中45例糖尿病完全缓解,缓解率为93.75%。术后3、6、12个月空腹胰岛素较术前降低,但差异无统计学意义(P>0.05),我们考虑与术后随访缺失、病例数较少有关。详见表2。

表2 术前与术后糖代谢三项水平比较
四、血脂、肝功能及血尿酸变化
随访24个月结果显示,术后1、3、6、12个月的TG、总胆固醇、LDL-C水平呈下降趋势,与术前(早期有部分病人未完善血脂检查或者院外血脂全套检查)比较,差异均有统计学意义(均P<0.05);在术后24个月略有回升,TG与术前比较差异无统计学意义(P>0.05),总胆固醇和LDL-C指标与术前比较差异有统计学意义(P<0.05),可能与样本量小有关。术后3、6、12、24个月HDL-C较术前持续升高,与术前比较差异有统计学意义(P<0.05)。具体见表3。
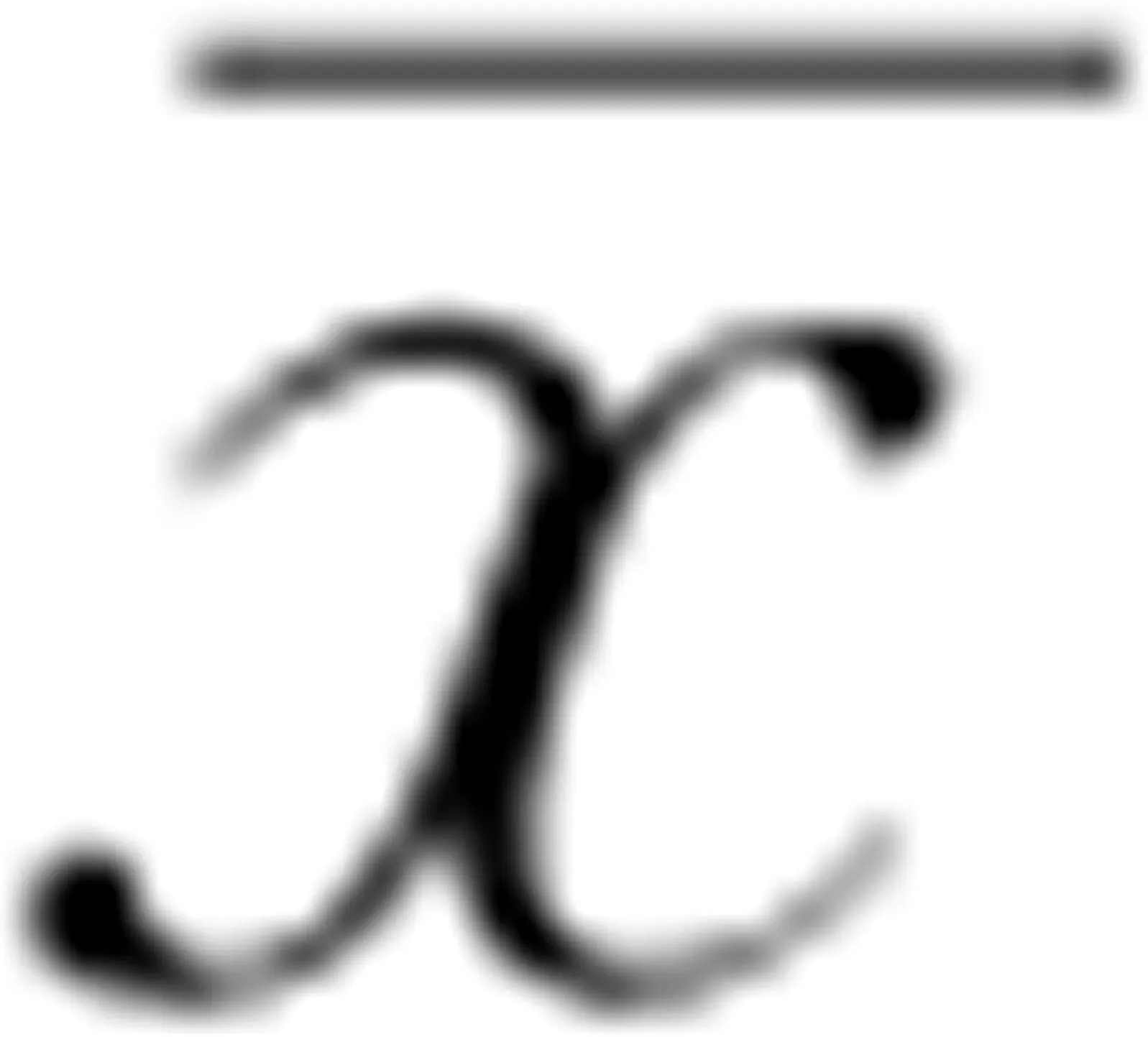
表3 术前与术后血脂四项变化(±s,mmol/L)
术后血尿酸和肝功能变化情况见表4。
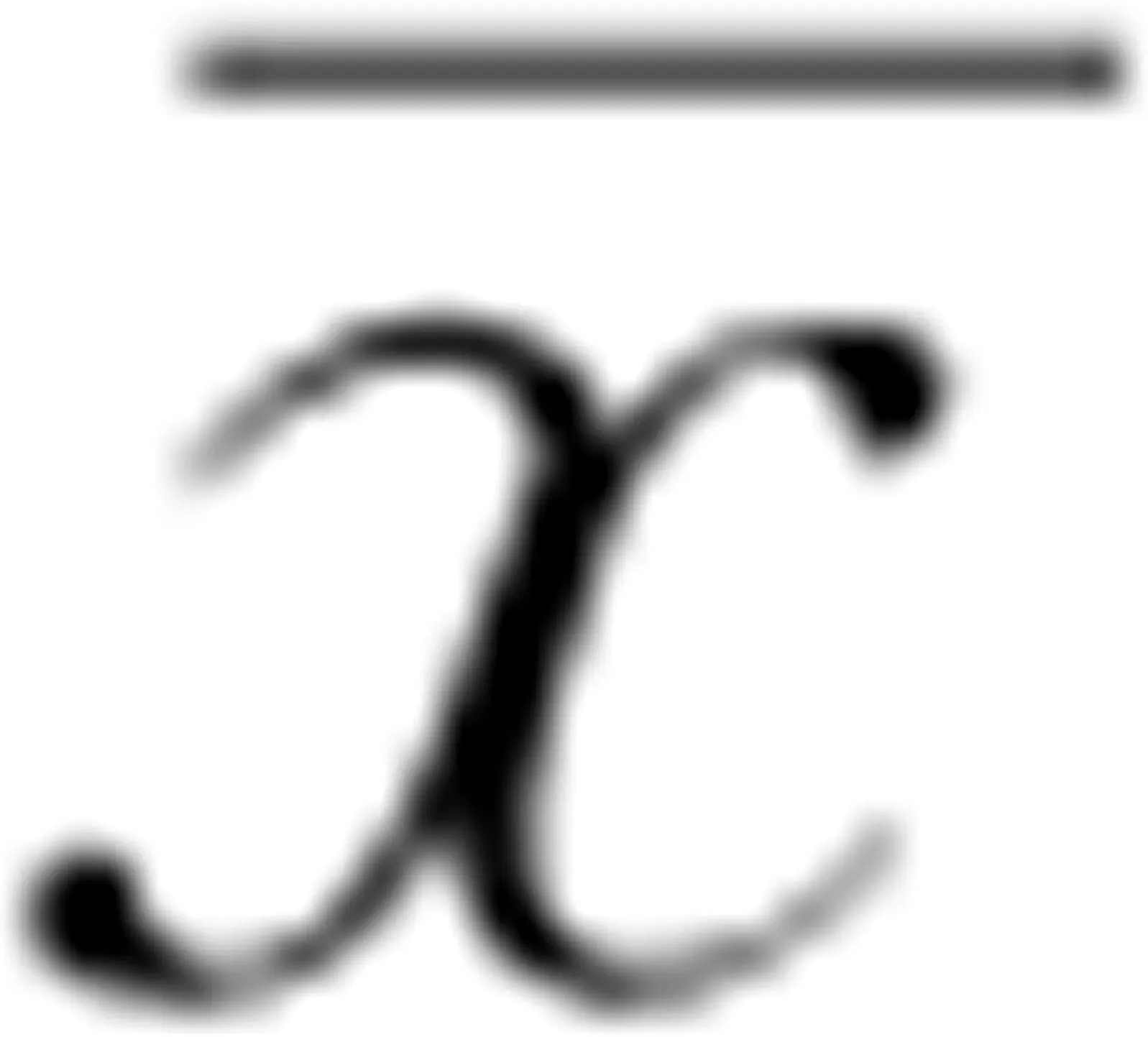
表4 术前与术后尿酸、ALT及AST水平的比较(±s)
表4结果显示,术后24个月随访内,尿酸水平持续下降,每个复诊阶段与术前比较均显著降低(P<0.05)。ALT和AST在术后前6个月持续降低,与术前比较差异有统计学意义(P<0.05),术后12个月、24个月时较术前下降,但与术前比较差异无统计学意义(P>0.05)。
讨 论
Schauer等[14]研究报道5年随访LSG的减重效果略逊于LRYGB。但对于空腹血糖、HbA1c、TG、HDL-C的作用两者差异无统计学意义,两者均优于内科治疗。此外,有不少关于LSG和LRYGB疗效分析的报道[15-16],均表明减重手术后%EWL值在手术的1年内达到最大值,1年后开始缓慢降低,即减重效率在1年后达到高峰。本研究中病人术后1年%EWL为(109.82±43.27)%,回顾病例资料,我们考虑%EWL超过100%可能由于%EWL的一些较高值导致。原因有二:(1)部分病例术前是低BMI合并2型糖尿病;(2)极个别病例在术后出现短期呕吐等情况使得体重较术前下降较多。这两类病人%EWL较高,容易出现较高值。因此,从这个细节问题上,我们可以总结:对于低BMI的病人应该严格把握手术适应证,同时对术后病人加强饮食营养指导和监测。在本研究中,病人体重及BMI于术后1个月开始下降,12个月后BMI达到最低值,随后缓慢回升,本研究随访术后3年部分病人BMI有小幅度回升,但总体较为稳定,36个月时%EWL为(93.77±33.22)%,优于文献报道的3年%EWL值[16-18]。所有病人中,术后并未出现不可控制的营养不良。
糖代谢方面,本研究结果表明术后3、6、12个月空腹血糖、HbA1c水平较术前下降,与术前比较差异有统计学意义(P<0.05)。术后空腹胰岛素较术前降低,但差异无统计学意义,我们考虑与术后随访缺失、病例数较少有关。高胰岛素血症是胰岛素抵抗的间接征象,因此手术对于糖代谢和胰岛素抵抗有直接改善作用。减重手术对2型糖尿病缓解机制有较多的研究,包括体重依赖性和非体重依赖性两方面机制。体重依赖性机制是指%EWL直接与血糖和HbA1c相关,因为脂肪组织体积(多余体重)直接影响胰岛素敏感性,从而导致胰岛素抵抗[19]。有研究表明,2年之内体重减轻超过10 kg,2型糖尿病缓解率达到64%;而体重减轻15 kg,2型糖尿病缓解率可达70%[20]。而非体重依赖性机制则包括胰高血糖素、胰多肽家族成员-酪酪肽、饥饿素相关[21]。这其中一些激素可以刺激内源性胰岛素释放,抑制胰高血糖素分泌,从而增加外周葡萄糖摄取和胰岛素敏感性[22]。
减重手术对脂代谢水平改善是明确的,本研究结果表明LSG术后1年内TG、LDL-C、总胆固醇水平呈下降趋势,但在2年时略有回升,其中TG差异无统计学意义,总胆固醇和LDL-C指标差异有统计学意义。术后1个月时HDL-C暂时性下降,随后在3、6、12、24个月则表现为持续升高。有研究表明,与高血压和2型糖尿病缓解原理一样,总体重减少也可以显著改善脂质代谢,当%EWL>50%时机体的脂质分泌可得到改善[23]。除此之外,随着多余体重的减轻,肝脏脂肪变性和机体胰岛素抵抗得到缓解,这一过程对脂质代谢可能带来益处[23-24]。
文献报道减重术后尿酸在短期内暂时升高、随后持续降低[25],本研究印证了这一点。本研究中术后1个月尿酸水平较术前基线水平高,且差异有统计学意义,但随后持续降低,2年时大部分病人尿酸水平恢复正常值。有研究表明,高尿酸的发生可能与代谢综合征和胰岛素抵抗有关[26-27]。减重术后尿酸水平下降可能是由于减重术后胰岛素敏感性增强导致的[28]。
减重手术对非酒精性脂肪肝的治疗效果已被证实[29],非酒精性脂肪肝疾病常常合并肝功能不全甚至非酒精性脂肪性肝炎。本研究中约27%的病人术前合并有肝功能不全。在术前两项转氨酶(AST、ALT)基线指标普遍升高的情况下,LSG术后可带来其明显下降。转氨酶水平在术后6个月即可达到最低水平,并且在2年随访时继续保持较低水平。文献报道转氨酶在减重术后1年内改善率可达到55.6%,改善的机制可能包括体重减轻、胰岛素敏感性增加、血脂异常和炎性因子的改善[30-32]。因此,对于患有非酒精性脂肪肝的病人,尽早进行减肥手术是获益的。
综上所述,随着减重代谢外科不断发展,减重手术越来越成熟,术后可以获得良好的减重效果和并发症的缓解。然而,对于手术方式的评估,我们需要对更大的病人群进行长期随访的随机研究。本研究的局限性:(1)本文是一项回顾性研究,存在选择偏差。后续调查是通过电话或在线问卷进行的,因此可能会受到回忆偏差的影响;尽管个案管理师制定了饮食方案,但病人的依从性难以评估。(2)该项研究是一项减重术后短、中期疗效分析,对于术后的长期效果仍需要进一步研究。(3)本研究聚焦439例LSG为我中心自开展减重手术以来最早的一批病例,在临床资料收集和随访资料收集工作方面非常欠缺,因此随访的连续性和随访频率有待进一步改进,这也为我中心今后数据收集提供指导意义。最近1年的减重手术病例资料收集在逐步完善,期望进一步探讨长期随访疗效。
利益冲突所有作者均声明不存在利益冲突
