miR-4539 通过靶向作用于叉头盒转录因子1 抑制胶质瘤细胞生长的实验研究
2022-06-25王宏欣付苏淳雪莉张
王宏欣付 苏淳雪莉张 帆∗
(1.成都上锦南府医院,四川大学华西医院上锦医院神经外科,成都 510117;2.四川大学华西医院,成都 510117)
胶质瘤是成年人最常见的原发性恶性脑肿瘤,近年来形成了以手术切除为主,配合以放化疗的综合治疗体系,但胶质瘤患者的生存率并没有显著提高[1]。 尤其对恶性度较高的IV 级胶质瘤,也被称为多形性胶质母细胞瘤(GBM),患者的中位生存期仅为一年[2]。 因此,迫切需要开发出新的更有效的生物标志物来及早诊断及治疗脑胶质瘤。 miRNAs是一种内源性的非编码小RNA 分子,约有18~25个核苷酸,通过与靶信使RNAs(miRNAs)3’-非翻译区(3’-UTR)的互补序列结合,在转录后调节其靶基因的表达[3-4]。 越来越多的证据表明,miRNAs 在各种人类癌症中调控失调,并参与肿瘤发生过程,包括细胞增殖、凋亡、血管生成和侵袭[5-6]。 以前的研究结果已经在人脑胶质瘤中发现了几个致癌和抑瘤的miRNAs,如miR-10b[7]、miR-30[8]、miR-203[9]等。 这些特异的miRNAs 可以潜在地作为有效的生物标志物来提高诊断和预后的准确性,或者作为针对恶性脑瘤的新的治疗策略的靶点。 但关于miR-4539 在脑胶质瘤中的研究很少,因此,本研究探讨了miR-4539 抑制胶质瘤细胞生长的效应及相关机制,以期为脑胶质瘤的诊断、治疗提供更多潜在的靶点。
1 材料和方法
1.1 实验材料
1.1.1 实验动物
SPF 级雌性免疫缺陷裸鼠(BALB/C-null),4 周龄,20 只,体重20~22 g,购自北京维通利华实验动物技术有限公司[SCXK(京)2017-0033],饲养于海南医学院动物实验中心[SYXK (琼)2017-0033]。实验室内温度约为25℃,相对湿度为50%~60%,每日12 h /12 h 明暗交替,实验前适应性饲养1 周。实验研究过程按照3R 原则,动物实验开展前获得本院实验动物伦理委员会审批(IACUC-2019-324)。
1.1.2 组织样本及细胞系
脑胶质瘤患者新鲜肿瘤组织取自我院神经外科,新鲜胶质瘤标本离体后立即冷冻于液氮中,保存于-80℃进行核酸提取。 所有的组织病理学诊断都是由两位经验丰富的神经病理学家根据世界卫生组织的标准独立确定的。 瘤患者在术前均未接受过化疗或放疗,8 个非肿瘤性脑组织是在交通事故中死亡的个人同意的情况下通过收集捐赠获得的,并且被证实没有任何先前的病理损害。 本研究由中国医科大学伦理委员会批准。 正常脑胶质细胞株HEB 及脑胶质瘤细胞U87、U251、U373、T98G、LN18、LN229 和SF295 均购自美国典型培养物保藏中心,在添加10%胎牛血清和青霉素/链霉素(100 U/mL)的Eagle’s 培养基中培养。 细胞在37℃含5% CO2的孵育箱中孵育。
1.2 主要试剂与仪器
慢病毒载体(上海吉满生物科技有限公司);MirVana miRNA 试剂盒(上海觅拓生物科技有限公司);荧光素酶报告分析系统试剂盒(美国Santa Cruz 公司);Annexin V-FITC 凋亡检测试剂盒(北京索莱宝科技有限公司);BCA 蛋白定量试剂盒(上海晶抗生物工程有限公司);cyclinD1 蛋白、cyclinE1蛋白、Ser780 蛋白、Foxp1 蛋白多克隆抗体(艾美捷生物公司);TaKaRa RNA PCR 试剂盒(南京诺唯赞生物科技股份有限公司)。 实时荧光定量聚合酶链反应(polymerase chain reaction, PCR)仪(杭州博日科技有限公司);光学显微镜(日本Olympus 公司);Western blot 垂直电泳仪(北京六一生物科技有限公司)。
1.3 实验方法
1.3.1 RT-PCR 检测
RT-PCR 定量分析根据MirVana miRNA 试剂盒说明书的操作步骤进行。 从冷冻的胶质瘤组织和胶质瘤细胞系中提取总RNA,测定RNA 浓度。 合成cDNA 后进行定量实时PCR,以RNU6B 作为内源性对照,用非肿瘤性脑组织进行校正。 为评价miR-4539 转染胶质瘤细胞后Foxp1 mRNA 表达的变化,采用TaKaRa RNA PCR 试剂盒和SYBR PreMix Ex TaqII 试剂盒进行cDNA 合成和实时定量PCR,GAPDH 作为内源性对照。 所有反应均重复3 次。用2-ΔΔCt法计算相关基因mRNA 表达的相对定量。引物序列见表1。

表1 目的基因的引物序列Table 1 Primer sequence of target gene
1.3.2 慢病毒载体、质粒构建及转导
从miRBase 数据库获得miR-4539 成熟序列。用限制性内切酶EcoRI 线性化GV217 载体(Ubi-EGFP-MCS)。 将含有成熟miR-4539 序列的片段导入GV217 载体的多克隆位点。 使用HEK-293T 包装细胞,采用脂质体2000 制造病毒。 慢病毒载体在-80℃保存直至使用。 为了实现靶向高表达,将人Foxp1cDNA 克隆到pcDNA3.1 载体中。 将胶质瘤细胞株T98G 细胞和LN18 细胞接种于6 孔板中。 当细胞融合达到30%时,分别用1 μL 的miR-4539 慢病毒载体(滴度:3×108TU/mL)或1 μL 的慢病毒载体(滴度:3×108TU/mL)感染细胞。 感染后14 h 更换细胞培养液。 分别于感染后24、48、72 h 用倒置荧光显微镜观察胶质瘤细胞株中绿色荧光蛋白(GFP)的表达情况,评价其感染效率,转导后72 h荧光蛋白表达水平相对较高。 质粒转染按脂质体3000 转染试剂厂家说明书进行。
1.3.3 小鼠模型构建及检测指标
小鼠被安置和维持在层流橱柜中,自由饮食水。 将稳定转染的T98G 细胞(miR-4539 和miRNC)按每0.2 毫升5×106个的密度注射到裸鼠腋下。 每周用游标卡尺测量肿瘤大小1 次,用公式V=(D×d2)/2 计算肿瘤体积,其中D 为最长直径(mm),d 为最短直径(mm)。 6 周后处死小鼠,称量肿瘤重量并拍照。
1.3.4 双荧光素酶报告实验
HEK-293T 细胞以每孔1×104细胞密度接种于96 孔板。 将3’-UTR 质粒共转染HEK-293T 细胞。转染48 h 后收集细胞裂解产物,用双荧光素酶报告分析系统测定荧光素酶活性。 将相对的Renilla 荧光素酶活性进行归一化,作为转染效率的内对照。
1.3.5 CCK-8 检测及流式细胞检测
CCK-8 检测:培养24 h 后收集转染细胞,悬浮于DMEM 中,以3×103个/孔的密度接种于96 孔板中。 于接种后不同时间点(0、24、48、72 h)检测细胞增殖情况。 在这些特定的时间,每孔加入10 μL 的CCK-8 溶液进行检测。 在37℃孵育2 h 后,在450 nm 处测定光密度(OD)值。 流式细胞检测:应用Annexin V-FITC 凋亡检测试剂盒检测细胞凋亡。 转染后48 h 胰蛋白酶消化细胞,冰PBS 洗涤。 将这些细胞重新悬浮在100 μL 的结合缓冲液中,并用5 μL 的Annexin V-FITC 和5 μL 的碘化丙啶处理。 在室温黑暗中孵育20 min 后,用流式细胞仪对细胞进行分析。
1.3.6 Western blot 检测
收集各组细胞后提取总蛋白,BCA 法测定蛋白浓度。 混合上样缓冲液,煮沸变性,电泳、转膜、封闭、一 抗/二 抗 孵 育、 ECL 法 显 影 定 影。 通 过Quantity One 软件分析条带强度,以GAPDH 为内参,检测cyclinD1 蛋白、cyclinE1 蛋白、Ser780 蛋白、Foxp1 蛋白的表达。
1.4 统计学方法
采用SPSS 20.0 统计软件分析处理数据,计量资料均以平均数±标准差(±s)描述,多样本计量资料比较采用方差分析,两两样本比较采用SNK-q检验。P<0.05 为差异有统计学意义。
2 结果
2.1 miR-4539 在胶质瘤组织中的表达
RT-PCR 检测结果显示,与正常脑组织比较胶质瘤组织中miR-4539 的表达水平明显降低(P<0.05)。miR-4539 在7 个常用的人脑胶质瘤细胞系(U87、U251、U373、T98G、LN18、LN229 和SF295)中的表达量明显低于人正常脑胶质细胞株HEB(P<0.05),图1。

图1 miR-4539 在胶质瘤组织及细胞系中的表达Figure 1 Expression of miR-4539 in glioma tissues and cell lines
2.2 miR-4539 过表达对胶质瘤细胞增殖活性的影响
与miR-NC 组相比,miR-4539 组中的miR-4539表达水平、OD450在T98G 细胞和LN18 细胞中均明显增加(P<0.05),EDU 染色结果显示,miR-4539 转染的T98G 细胞和LN18 细胞的EDU 掺入率明显低于相应的miR-NC 组细胞,图2。
2.3 miR-4539 过表达对胶质瘤细胞周期的影响
与miR-NC 组相比,miR-4539 组G0/G1 期细胞百分率增加,S 期细胞百分率及cyclinD1、cyclinE1和Ser780 蛋白表达均明显降低,差异有统计学意义(P<0.05),图3。

注:A:miR-4539 相对表达量;B:miR-4539 对T98G 细胞和LN18 细胞活性的影响;C:Edu 染色检测miR-4539 对T98G 细胞和LN18 细胞增殖的影响。图2 miR-4539 过表达对胶质瘤细胞增殖活性的影响Note. A, Relative expression level of miR-4539. B, Effects of miR-4539 on T98G and LN18 cell activities. C, Edu staining was used to detect the effects of miR-4539 on proliferation of T98G cells and LN18 cells.Figure 2 Effect of overexpression of miR-4539 on proliferation of glioma cells

注:A:流式细胞检测各组细胞G0/G1 期和S 期细胞百分率;B:Western blot 检测各组周期蛋白的表达。图3 miR-4539 过表达对胶质瘤细胞周期的影响Note. A, Percentage of G0/G1 and S phase cells in each group was detected by flow cytometry. B, Western blot was used to detect cyclin expression in each group.Figure 3 Effect of miR-4539 overexpression on glioma cell cycle
2.4 Foxp1 作为miR-4539 的直接靶点的鉴定
与 pGL3-FOXP1 3’-UTR-mut/NC 相 比,pGL3-FOXP1 3’-UTR-mut/miR-4539 荧光素酶活性明显降低,差异有统计学意义(P<0. 05);pGL3-FOXP1 3 ’-UTR-wt/miR-4539 与 pGL3-FOXP1 3’-UTR-wt/NC 的荧光素酶活性无明显差异(P>0. 05),图4。

注:1:pGL3-FOXP1 3’-UTR-mut/NC;2:pGL3-FOXP13’-UTR-mut/miR-4539;3: pGL3-FOXP1 3’-UTR-wt/miR-4539; 4pGL3-FOXP1 3’-UTR-wt/NC。图4 Foxp1 作为miR-4539 的直接靶点的鉴定Note. 1, pGL3-FOXP1 3’-UTR-mut/NC. 2, pGL3-FOXP1 3’-UTRmut/miR-4539. 3, pGL3-FOXP1 3’-UTR-wt/miR-4539. 4, pGL3-FOXP1 3’-UTR-wt/NC.Figure 4 Identification of Foxp1 as a direct target for miR-4539
2.5 转染miR-4539 对小鼠肿瘤生长抑制作用
miR-4539 组裸鼠腋下移植瘤平均体积及肿瘤的平均重量明显低于miR-NC 组,差异有统计学意义(P<0.05),图5。
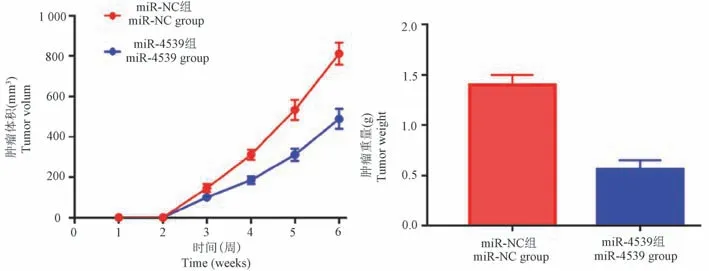
图5 转染miR-4539 对小鼠肿瘤生长抑制作用Figure 5 Inhibitory effect of miR-4539 transfection on tumor growth in mice
2.6 miR-4539 对胶质瘤细胞中Foxp1 的调控作用
与miR-NC 组相比,miR-4539 组T98G 和LN18胶质瘤细胞中Foxp1 mRNA、蛋白表达水平均明显降低,差异有统计学意义(P<0.05);免疫荧光分析发现,miR-4539 降低了Foxp1 在T98G 细胞和LN18细胞中的表达,图6。

注:A:Foxp1 mRNA 相对表达量;B:Western blot 检测各组Foxp1 蛋白表达;C:免疫荧光检测Foxp1 蛋白表达。图6 miR-4539 对胶质瘤细胞中Foxp1 的调控作用Note. A, Relative expression level of Foxp1 mRNA. B, Foxp1 protein expression in each group was detected by Western blot. C, Foxp1 protein expression was detected by immunofluorescence.Figure 6 Regulatory effect of miR-4539 on Foxp1 in glioma cells
3 讨论
研究表明,miRNAs 在各种人类癌症中通过调节靶基因表达水平而发挥癌基因或肿瘤抑制因子的功能,如miR-141、miR-196、miR-155、miR-34a、miR-326 和miR-184 被发现参与了胶质瘤的细胞增殖、凋亡和侵袭等几个关键过程[10]。 此外,这些失调的miRNAs 还被证明对诊断和预测预后以及对胶质瘤患者的最终治疗干预具有重要价值。 然而,miR-4359 在胶质瘤中的临床意义和生物学功能尚不清楚。 本研究中,我们发现miR-4359 在胶质瘤组织和细胞系中的表达明显低于在非肿瘤性脑组织或细胞系中的表达。 这些结果提示miR-4359 可能作为一种肿瘤抑制因子负向调节胶质瘤的发生。因此,我们进一步评估了miR-4359 对胶质瘤细胞增殖的影响。结果表明,miR-4359 过表达可显著抑制胶质瘤细胞增殖,诱导细胞周期阻滞,促进细胞凋亡。 我们还发现miR-4359 在体内对胶质瘤细胞的致瘤性有抑制作用。
为了确定miR-4359 调节胶质瘤生长的机制,我们使用公开可用的在线算法(TargetScan、Miranda 和PITA)预测了它的目标基因,并通过执行微阵列分析、Western blot 和荧光素酶分析最终确定,miR-4359 负调控其靶基因Foxp1 在胶质瘤细胞中的表达。 Foxp1 是Foxp 转录因子基因家族的成员,包括43 个人类基因,参与转录调节和DNA 修复,并在免疫反应、器官发育和癌症发病机制中发挥关键作用。 与其他家族成员相似,Foxp1 具有多种功能,例如调节B 细胞发育、单核细胞分化、促进心脏瓣膜和肺发育等[11]。 此外,根据细胞类型的不同,Foxp1可作为癌症驱动因子或肿瘤抑制因子参与调节各种人类癌症的发生。 Foxp1 的表达缺失最初报道在几种类型的实体肿瘤中,如结肠癌[12]和乳腺癌[13]。作为癌基因,Foxp1 在B 细胞淋巴瘤中直接抑制广泛的促凋亡基因。 最近的一项研究表明[14],在B 细胞淋巴瘤、结直肠癌和黑色素瘤等不同的人类癌症中,Foxp1 是Wnt/β-catenin 信号通路的转录增强子。 然而,Foxp1 在肿瘤发生中的作用及其在胶质瘤中的临床意义仍然知之甚少。 Gomez 等[15]人发现,Foxp1 高表达预示胶质母细胞瘤患者生存率较低,沉默Foxp1 的表达则可抑制肿瘤的生长,因此,Foxp1 可能在脑胶质瘤中起到了癌基因的作用。 在本研究中,通过RT-PCR 和Western blot 检测发现,当T98G 细和LN18 细胞过表达miR-4539 后,Foxp1 mRNA 和蛋白表达都显著降低,这表明在脑胶质瘤中,Foxp1 可被miR-4359 直接靶向并下调,并且Foxp1 在功能上参与了miR-4359 介导的肿瘤生长抑制。 但miR-4359/Foxp1 对具体的下游信号讨论的影响仍值得进一步研究。
综上所述,本研究发现,miR-4359 通过直接调节转录因子Foxp1 的表达抑制肿瘤生长,抑制胶质瘤细胞增殖。 我们的结果证实了miR-4359 在胶质瘤中作为一种肿瘤抑制性miRNA 的作用,并提示miR-4359 可能成为治疗胶质瘤的新靶点。
