血清剥夺反应因子(Sdpr)敲除及转基因小鼠的建立与表型分析
2022-06-25李欣悦石桂英雷雪裴黄艺滢李珂雅侯丽雅王凯瑜汤家鸣白
李欣悦石桂英雷雪裴黄艺滢李珂雅侯丽雅王凯瑜汤家鸣白 琳
(国家卫生健康委员会人类疾病比较医学重点实验室,中国医学科学院医学实验动物研究所,北京协和医学院比较医学中心,北京市人类重大疾病实验动物模型工程技术研究中心,北京 100021)
胞膜窖(caveolae)是细胞表面内陷的结构,陷窝由脂质筏形成并通过小窝蛋白(caveolin)聚合,在细胞内吞、细胞膜组装、细胞内运输、胆固醇稳态调节、信号传导及肿瘤生成等生物学活动中具有重要作用[1-2]。
Cavin 家族是调节胞膜窖形成和功能的家族[3-4],包括了Cavin-1、Cavin-2、Cavin-3、Cavin-4 4个成员[5]。 其中Cavin-2 也称血清剥夺反应因子(serum deprivation-response protein,SDPR),为胞膜窖调节蛋白家族成员,位于人2 号染色体的q32-q33位,由418 个氨基酸组成,在不同物种中具有高度的同源性。 SDPR 是最初人血小板中纯化为磷脂酰丝氨酸(PS)结合蛋白[6],并在体外被证明是蛋白激酶C(protein kinase C, PKC)异构体的底物[7],被发现在血清饥饿的细胞中高表达[8]。 近年来对其功能的研究发现,SDPR 直接参与胞膜窖生物发生和形态,是形成胞膜窖时膜内陷所必需的,且其功能可能一部分独立于胞膜窖[9],另一方面可以调节胞膜窖的形态,诱导微管形成的动力学过程[10]。 近几年来对SDPR 的研究主要集中在肿瘤学的研究,已发现在多种肿瘤如前列腺癌、乳腺癌和肾癌中Sdpr基因表达下调,提示Sdpr可能为作为抑癌基因影响肿瘤的发生发展[11-13]。Sdpr可通过阻断转化生长因子-β 信号通路抑制乳腺癌的进展[14],也通过促进细胞凋亡作为乳腺癌转移的抑制因子,降低肿瘤迁移和内侵/外渗能力[15]。
现有对Sdpr基因的研究中大多利用细胞系或肿瘤患者组织样本,为深入研究Sdpr基因的相关功能及其相关胞膜窖蛋白在不同组织器官中的作用机理,本研究中我们利用CRISPR/Cas9 技术和过表达载体建立了Sdpr基因敲除小鼠和Sdpr转基因小鼠模型,为该基因生物学功能的研究及在多种疾病致病机制及不同疾病进程发展的体内研究中提供有效动物模型。 同时,通过对该模型的初步检测分析中发现Sdpr基因对小鼠免疫系统具有重要作用。
1 材料与方法
1.1 实验动物
实验所需动物为SPF 级C57BL/6J 小鼠(雌性,15 只,3~4 周龄,体重7~12 g;雄性,30 只,6~8 周龄,体重18~25 g)及ICR 小鼠(雌性,4 只,8~10周,体重27~30 g;雄性,2 只,10 周龄,体重35~38 g),购入于北京华阜康生物科技股份有限公司[SCXK(京)2019-0008],长期饲养于中国医学科学院医学实验动物研究所[SYXK(京)2019-0014]SPF 级动物屏障环境动物设施。 饲养环境:温度20℃~26℃,湿度40%~70%,光照周期明暗比12 h/12 h。 饲养期间动物可自由进食饮水,饲料、水瓶、垫料、鼠盒均经过高温高压灭菌处理。 实验中涉及动物的操作程序已通过本所实验动物使用与管理委员会审批(BL17001),遵循3R 原则。
1.2 主要试剂与仪器
MEGAshortscriptTMT7 转录试剂盒(Invitrogen,Am1354); 鼠尾直接 PCR 试剂盒( Bimake,B45012 ); DL2000 DNA Marker ( TaKaRa );PrimeScriptTMRT reagent Kit(TaKaRa)TB Green ®Premix Ex TaqTM(TaKaRa);RIPA 裂解液(Beyotime,P0013B);BCA 蛋白浓度测定试剂盒(Beyotime,P0009);PAGE 凝胶快速制备试剂盒(10%)(雅酶,PG112 ); 一 抗: SDPR Polyclonal Antibody(proteintech, 12339-1-AP ), β-actin ( Bioss, bs-0061R);二抗:山羊抗兔(中杉金桥, ZB-5301);红细胞裂解液(BD, 555899);流式抗体CD3、CD4、CD8、B220、CD11b、NK1.1(Invitrogen)。
PCR 仪(Hema);StepOnePlusTM实 时 荧 光 定 量PCR 仪(applied biosystems,美国);多样品研磨珠均质仪(OMNI, Bead Ruptor 24 Elite);垂直电泳仪(Bio-Rad,美国);组织脱水机、石蜡包埋机、石蜡切片机(Leica,德国);流式细胞仪(BD FACSAria,美国)。
1.3 实验方法
1.3.1Sdpr基因敲除小鼠制备
利用CRISPR/Cas9 技术进行Sdpr基因敲除小鼠的建立。 小鼠Sdpr基因(Gene ID: 20324)位于第一号染色体的1 C1.1 区段(ENSMUSG00000045954)。 针对Sdpr基因选择两个 sgRNA 靶点(靶点 1:GGCCATCCGAGACAACTCGCAGG 及靶点2: GGTA CTTGGAGAGCTTGGTGAGG),合成两对寡聚核苷酸链(Mice-Sdpr-1-gRNA up: TAGGCCATCCGAGACAACT CGC 和Mice-Sdpr-1-gRNA down: AAACGCGAGTTGTC TCGGATGG;Mice-Sdpr-2-gRNA up: TAGGTACTTGGAG AGCTTGGTG 和Mice-Sdpr-2-gRNA down: AAACCACC AAGCTCTCCAAGTA)。 将合成的sgRNA 单链通过退火复性结合成小片段,插入经Bsa Ⅰ酶切线性化的pUC57-sgRNA 表达载体,并将构建完成的sgRNA 载体通过MEGAshortscriptTMT7 转录试剂盒体外转录成为可注射的sgRNA。
将3~4 周龄C57BL/6 雌鼠注射PMSG 和HCG激素进行超数排卵,与成年C57BL/6 小鼠交配后获得受精卵用于注射。 Cas9 载体通过体外转录成为可注射的Cas9-RNA (30 ng/μL), 与转录后的sgRNA(10 ng/μL)混合后注射到小鼠受精卵中。 采用8~10 周龄ICR 雌鼠与结扎的雄鼠交配后选取见栓的雌鼠作为受体鼠,将注射后的受精卵移植到受体鼠输卵管壶腹部,等待小鼠出生后鉴定基因型。
1.3.2Sdpr基因转基因小鼠制备
用PCR 扩增的小鼠Sdpr(Gene ID:20324)基因全长克隆至pUBC-SBase 表达载体,将扩增片段插入 pUBC 载 体 的 UBC 启 动 子 下 游, 由 PvuI(TaKaRa)对载体线性化后获得转基因DNA 片段,经过Sephedex G50 柱纯化并调整浓度为5 ng/μL,通过显微注射技术将线性化的转基因载体注射到SPF 级C57BL/6J 小鼠受精卵中,将注射后的受精卵移植至假孕受体ICR 小鼠体内,等待小鼠出生后鉴定基因型。
1.3.3 基因型鉴定
小鼠出生后编号并剪取尾尖,利用鼠尾直接PCR 试剂盒裂解鼠尾提取基因组DNA。 根据序列信息设计设计检测引物(上海英潍捷基)。 敲除检测 引 物 为: Mice-SdprKO-F: 5’-GCTCACTTCAG ACCAACCAGCC-3 ’ 和 Mice-SdprKO-R: 5 ’-GGACTGAGCTCAAGTAGGTGGAGG-3’ (野 生 条 带为612 bp,敲除条带为451 bp);转基因检测引物为:Sdpr-F1: 5’-ATCCAGAACGACCTCACCAAG-3’和Sdpr-R1: 5’-TATCGACTTTCTTGAGGCTGGAT-3’(条带为445 bp)PCR 反应体系为20 μL。 反应程序为95℃5 min;(95℃30 s,60℃30 s,72℃45 s)×30个循环;72℃10 min。 采用浓度1.5%的琼脂糖凝胶电泳并成像。
1.3.4 qRT-PCR 检测SdprmRNA 表达情况
Sdpr敲除小鼠及同窝野生型小鼠各3 只,Sdpr转基因小鼠及同窝野生型小鼠各3 只。 脱颈处理后,TRIzol 法提取肝、脾、胸腺总RNA,利用反转录试剂盒获得cDNA。 根据Sdpr序列信息设计检测引物 ( 上 海 英 潍 捷 基)Sdpr-sense: 5 ’-CATCCAGAACGACCTCACCAA-3 ’ 和Sdpr-antisense: 5’-GGGAACTGGCTCCTTCACAA-3’。 以βactin为参照基因合成引物β-actin-sense:TGCTGTCCCTGTATGCCTCT 和β-actin-anti-sense:TTGATGTCACGCACGATTTC。 采用SYBR Green 法对不同样本中的Sdpr基因表达进行分析,计算Ct值,利用2-ΔΔCt法进行相对定量分析。
1.3.5 Western blot 检测各组织中SDPR 蛋白表达
取后续繁育的6 月龄雄性Sdpr基因敲除小鼠(Sdpr-/-)及其同窝野生型小鼠(Sdpr+/+)各3 只;6月龄雄性Sdpr基因转基因小鼠(Sdpr-Tg)及其同窝野生型小鼠(WT)各3 只。 安乐死后取小鼠心、肝、脾、肺、胸腺组织置于含研磨珠的研磨管中,加入RIPA 裂解液,使用OMNI 均质仪研磨后,冰上裂解30 min,12000 r/min 4℃离心20 min 后取上清为组织总蛋白,经BCA 试剂盒浓度测定后调整蛋白浓度。 制备10% PAGE 凝胶,上样量为每孔30 μg。一抗:SDPR(1 ∶1000)、β-actin(1 ∶2000),4℃孵育过夜。 二抗:山羊抗兔(1 ∶5000),室温孵育1 h。TBST 洗膜后使用ECL 发光液显影。
1.3.6 苏木精-伊红(hematoxylin-eosin staining,HE)染色
取6 月龄的Sdpr基因敲除小鼠和其同窝野生型小鼠,Sdpr转基因小鼠和其同窝野生型小鼠。 取材固定:脱颈后取心、肝、脾、肺、肾等新鲜组织置于10%福尔马林中固定48 h 以上。 经乙醇梯度脱水、二甲苯透明、石蜡包埋、切片贴片后,进行常规HE染色,封片后于光学显微镜下进行组织病理学变化观察。
1.3.7 免疫细胞流式分析
小鼠眼眶静脉丛采集外周血100 μL,加入红细胞裂解液混匀后室温静置5 min,离心后加入PBS缓冲液重悬细胞备用。 小鼠脱颈椎法处死,取胸腺、脾置于预冷的PBS 缓冲液中。 用载玻片磨砂端沾取PBS 后将胸腺、脾研磨成细胞悬液备用;取小鼠双侧后肢骨,使用研钵将骨髓压出,分两次加入6 mL预冷PBS 缓冲液反复吹打直至骨组织发白。将细胞悬液经300 目尼龙膜过滤后,1500 r/min离心5 min。 加入PBS 重悬细胞,调整细胞浓度后取106个细胞荧光抗体标记。
免疫细胞分析采用如下抗体标记:FITC CD4、PE CD45、 PerCP-cy5.5 CD3、 PE-Cy7 B220、 APC CD8、APC-Cy7 CD11b。 细胞悬液离心后,加入PBS稀释(1 ∶200)的荧光抗体标记,4℃避光染色30 min,PBS 洗1 次,2500 r/min 离心5 min,200 μL PBS 重悬细胞,经300 目尼龙膜过滤后上机。FlowJo 计算标记阳性细胞比率。
1.4 统计学方法
数据采用GraphPad Prism 8.4.0 和IBM SPSS Statistics 26 进行统计分析,实验中所有数据均以平均数±标准差(±s)表示。 各组间数据分析采用独立样本t检验,P<0.05 认为有统计学差异。
2 结果
2.1 Sdpr 基因敲除小鼠和转基因小鼠的构建
我们利用CRISPR/Cas9 的技术构建了Sdpr基因敲除小鼠,针对Sdpr基因设计了两个sgRNA 作用靶点,sgRNA 表达载体经线性化形成粘性末端,退火后与pUC57-sgRNA 链接(图1A),测序验证序列结果正确(图1B)。 sgRNA 使Cas9 可在sgRNA 作用下识别含有PAM 的序列,实现DNA 双链断裂。将成功构建的sgRNA 表达载体和Cas9 表达质粒经T7 RNA 聚合酶体外转录为可注射的sgRNA 和Cas9 mRNA,混合后注射到小鼠受精卵中,移植入假孕受体ICR 小鼠中,待小鼠出生后与野生型小鼠交配繁殖。 在后续繁育中剪取小鼠尾尖提取DNA 进行基因型鉴定,经PCR 扩增野生条带为612 bp,敲除条带为451 bp。 同时在612 bp、451 bp 处有两条带,为杂合子小鼠(图2A)。

注:A:利用CRISPR/Cas9 建立Sdpr 敲除小鼠构建示意图,在第一外显子处设计作用靶点,蓝色为sgRNA 对应的两靶点,红色为PAM 基序,Cas9/sgRNA 介导的基因打靶产生移码突变,产生Sdpr 缺失的表达载体;B:Sdpr 敲除片段测序结果;C:pUBC-Sdpr 表达载体构建。图1 Sdpr 敲除及转基因小鼠建立方案Note. A, Schematic diagram of Sdpr knockout mice with CRISPR/Cas9 technology. The target was designed on the first exon, the blue was the two targets corresponding to sgRNA, whereas the red was the PAM motif. The Cas9/sgRNAmediated gene targeting generates frame-shift mutation resulting in Sdpr-deficient expression vector was established. B,Chromatographs from Sdpr knockout sequences of truncated PCR products. C, Construct of pUBC-Sdpr expression vector.Figure 1 Establishment of Sdpr knockout mice and transgenic mice
同时将Sdpr基因插入过表达质粒UBC 启动子下游,构建得到Sdpr转基因过表达载体pUBC-Sdpr(图1C)。 利用显微注射将线性化的载体注射到C57BL/6J 小鼠受精卵,移植入假孕受体ICR 小鼠中,待小鼠出生后与野生型小鼠交配获得Sdpr全身过表达的转基因小鼠,后续可稳定传代。 转基因阳性小鼠DNA 扩增片段经电泳后在445 bp 处可见条带,野生型C57BL/6J 小鼠在445 bp 处无条带(图2B)。

注:A:PCR 鉴定Sdpr 敲除小鼠的基因型;B:PCR 鉴定Sdpr 转基因小鼠的基因型;M:Marker DL2000(TaKaRa);H2O:水;+/+:野生型对照;+/-:Sdpr 杂合子小鼠对照; -/-:Sdpr 敲除纯合小鼠;+:阳性小鼠;WT:野生型小鼠。图2 Sdpr 敲除及转基因小鼠的鉴定Note. A, Identify the genotype of Sdpr knockout mice by PCR. B, Identify the genotype of Sdpr transgenic mice by PCR. M, DNA molecular weight marker DL2000 (TaKaRa). H2O,Water. +/+,Wild-type mice. +/-,Sdpr heterozygous mice. -/ -,Sdpr knockout homozygous mice. +,Positive mice.WT, Wild type.Figure 2 Identification of Sdpr knockout mice and transgenic mice
2.2 Sdpr 基因敲除和转基因小鼠各组织中的表达
通过qRT-PCR 和Western blot 检测Sdpr在基因敲除小鼠和转基因小鼠各组织中mRNA 表达水平和蛋白表达水平。结果显示在肝、胸腺和脾组织中Sdpr基因敲除小鼠mRNA 表达水平显著低于野生型小鼠(图3A),在肝、肺、胸腺、脾组织中SDPR 蛋白表达显著低于野生型小鼠(图4A、4C);Sdpr转基因小鼠的肝、胸腺、脾组织的mRNA 相对表达水平高于野生型小鼠(图3B),在转基因小鼠的心、肝、胸腺、脾组织中SDPR 蛋白的表达均明显高于野生型小鼠(图4B、4D)。
2.3 组织病理学变化
在小鼠饲养繁殖过程中发现Sdpr敲除小鼠和转基因小鼠在寿命、生殖能力等方面与野生型小鼠没有明显差异。
通过在光学显微镜下对6 月龄的小鼠进行组织的病理学观察,发现与野生型小鼠相比,Sdpr敲除小鼠肝细胞出现脂肪变性,多处可见肉芽肿形成,中央静脉周围可见明显髓外造血;肺局部血管周围炎性细胞浸润,肺泡间隔增宽;脾红髓出现髓外造血;骨髓中细胞形态出现变化,淋巴细胞比例减少,粒细胞比例增加;脂肪存在多处炎性细胞浸润;心脏、肾、胸腺病理未发现异常。
Sdpr转基因小鼠肝有轻微脂肪变性;小鼠肺中肺泡间隔轻微增宽;脾动脉淋巴鞘周围淋巴细胞增生,红髓细胞增多;骨髓中淋巴细胞比例增多,粒细胞比例减少;心脏、肾、胸腺、脂肪未发现病理变化(图5)。
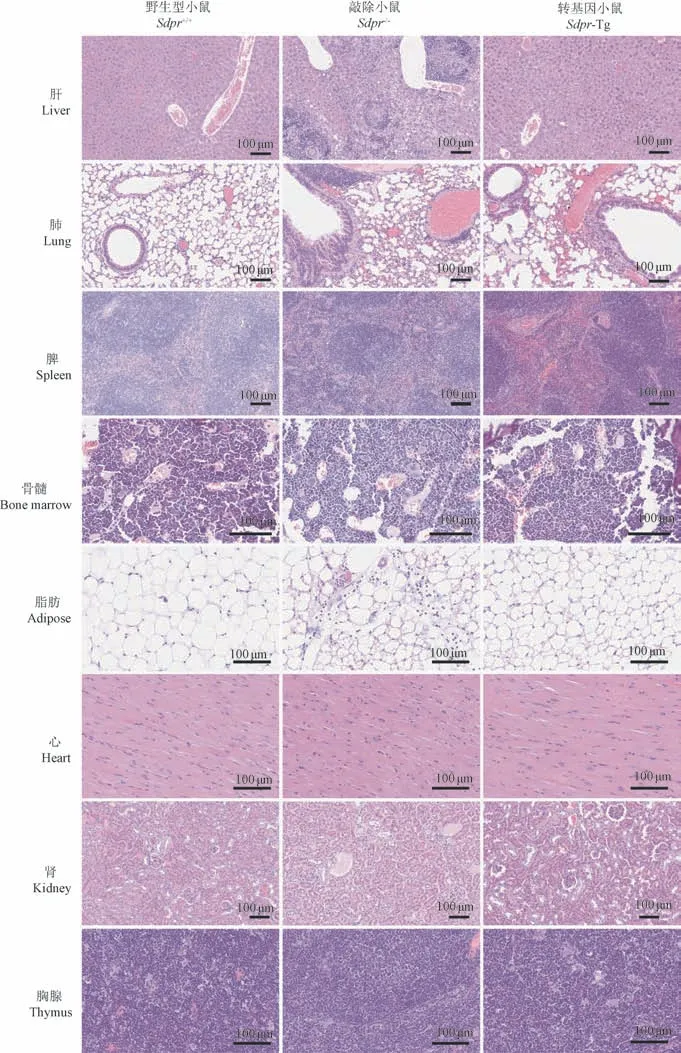
图5 Sdpr 敲除及转基因小鼠主要脏器组织HE 染色Figure 5 Histology of the major organs of Sdpr knockout and transgenic mice(HE staining)
2.4 Sdpr 对免疫细胞的影响
为了解Sdpr对小鼠免疫细胞的影响,我们选取了Sdpr基因敲除小鼠、Sdpr转基因小鼠与野生型小鼠每组各9 只,分别取外周血、骨髓、脾及胸腺中的免疫细胞进行荧光抗体染色标记后利用流式细胞仪进行分析,检测免疫细胞的比例。结果显示与野生型小鼠对照相比,在外周血中Sdpr转基因小鼠的B 细胞(B220+)比例明显增加,粒细胞(CD11b+)和T 细胞(CD3+)比例降低(图6A);在骨髓中Sdpr基因敲除小鼠T 细胞比例降低(图6B);在脾中Sdpr敲除小鼠、Sdpr转基因小鼠免疫细胞均没有明显变化(图6C);T 细胞在胸腺中经历几个阶段发育成熟,结果分析发现在Sdpr基因敲除小鼠胸腺中CD4-CD8-双阴性细胞增多,CD4+CD8+双阳性细胞减少。Sdpr转基因小鼠胸腺CD4+T 细胞显著增多,CD4+CD8+双A 阳性细胞减少(图6D)。 上述结果表明Sdpr基因对小鼠免疫系统有着重要的影响。
3 讨论
SDPR 在多种组织细胞中广泛表达[8],在胞膜窖形成中发挥重要作用[9]。 胞膜窖是脂肪细胞表面大量存在结构域,参与胰岛素信号传导、膜运输和脂质稳态[16-18]。 因此,caveolin 蛋白和Cavin 蛋白家族的转录控制机制对脂肪细胞生物学具有重要意义[4],该领域的研究可能有助于深入了解胰岛素抵抗和糖尿病。 在脂代谢的研究中发现,在脂肪生成的过程中,CEBPα(CEBPA)和PPARγ(PPARG)是两个关键转录因子,通过相互诱导表达并共同靶向脂肪生成中的关键基因[19-20],而Sdpr可在脂肪细胞分化过程中与CEBPα 和PPARγ 平行上调,并且CEBPα 和PPARγ 的激活可诱导原代脂肪细胞及其前体中的SDPR 表达,可能表明了脂肪细胞中CEBPα/PPARγ 介导的Sdpr的重要转录控制机制[21]。 近期一项研究利用Cavin-2 KO 小鼠和Cavin-2 敲低的3T3-L1 细胞发现,SDPR 通过结合胰岛素受体(IRβ)增强其稳定性并调节胰岛素信号传导,该结果强调了Sdpr在脂肪生成和脂质代谢中的关键作用,有助于开发治疗病理性肥胖和脂肪生成疾病的新疗法[22]。

注:A:基因敲除小鼠肝、胸腺、脾组织中mRNA 相对表达水平;Sdpr+/+:基因敲除野生型小鼠;Sdpr-/-:敲除小鼠;B:转基因小鼠肝、胸腺、脾组织中mRNA 相对表达水平;WT:转基因野生型小鼠;Sdpr-Tg:转基因小鼠。 与基因敲除野生型小鼠相比,∗P<0.05,∗∗∗P<0.001;与转基因野生型小鼠相比,∗P<0.05,∗∗P<0.01。图3 Real-time PCR 检测Sdpr 敲除及转基因小鼠组织中mRNA 表达水平Note. A, Relative level of mRNA expression in liver, thymus and spleen of knockout mice. Sdpr+/+, Knockout wild-type mice. Sdpr-/-, Knockout mice.B, Relative level of mRNA expression in liver, thymus and spleen of transgenic mice. WT, Transgenic wild-type mice. Sdpr-Tg, Transgenic mice.Compared with Sdpr+/+, ∗P<0.05,∗∗∗P<0.001. Compared with WT, ∗P<0.05, ∗∗P<0.01.Figure 3 Sdpr mRNA expression level of knockout mice and transgenic mice in different tissues detected by Real-time PCR
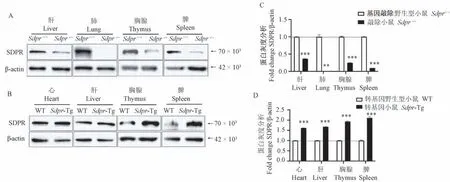
注:A:Western blot 检测SDPR 蛋白在基因敲除小鼠肝、肺、胸腺、脾中的表达;Sdpr+/+:基因敲除野生型小鼠;Sdpr-/-:Sdpr 基因敲除纯合小鼠,β-actin 为内参;B:Western blot 检测SDPR 蛋白在转基因小鼠心、肝、胸腺、脾中的表达;Sdpr-Tg:Sdpr 转基因小鼠;WT:转基因野生型小鼠,β-actin 为内参;C:敲除小鼠各组织蛋白表达灰度分析;D:在转基因小鼠各组织蛋白表达灰度分析。 与基因敲除野生型小鼠相比,∗∗P<0.01,∗∗∗P<0.001;与转基因野生型小鼠相比,∗∗∗P<0.001。图4 SDPR 蛋白在敲除及转基因小鼠各脏器中的蛋白表达Note. A, Expression level of SDPR protein in liver,lung,thymus and spleen of knockout mice detected by Western blot. Sdpr+/+,Knockout wildtype mice. Sdpr-/-, Sdpr knockout homozygous mice, β-actin as internal reference. B, Expression level of SDPR protein in the heart, liver,thymus and spleen of transgenic mice detected by Western blot. WT, Transgenic wild-type mice. Sdpr-Tg, Sdpr transgenic mice, β-actin as internal reference. C, Normalization of protein expression levels in tissues of knockout mice. D, Normalization of protein expression levels in tissues of transgenic mice. Compared with Sdpr+/+, ∗∗P<0.01, ∗∗∗P<0.001. Compared with WT, ∗∗∗P<0.001.Figure 4 The SDPR protein expression level of knockout mice and transgenic mice in different tissues
在肿瘤的研究中发现,Sdpr在前列腺癌、乳腺癌和肾癌中表达均是降低的[23]。Sdpr已成为肝癌和胃癌等癌症的潜在诊断指标[24-26]。 比较基因组分析显示在PC3 细胞中加入促进细胞存活的细胞因子IL-6、IGF-1 和TGFβ1 后Sdpr的mRNA 水平表达降低,说明Sdpr参与了IL-6、IGF-1 和TGFβ-1 诱导激活的下游信号通路[27]。 在肺癌的研究中发现Sdpr在肺腺癌细胞和组织中的表达下调,且低表达Sdpr与免疫系统抑制之间存在相关性,对其调控机制的研究发现Sdpr与免疫检查点分子(PD-L1、TNFRSF18、TNFRSF9 和TDO2)之间存在负相关,有可能成为肺癌尤其是非小细胞肺癌(NSCLC)和KRAS 突变肺癌治疗及预后的潜在靶点[28]。
本研究通过CRISPR/Cas9 技术和pUBC 过表达质粒及显微注射技术构建了Sdpr基因敲除小鼠和转基因小鼠全身过表达小鼠模型,该模型与野生型小鼠在寿命、生殖能力等方面无明显差异,且可以稳定传代。 通过在DNA、mRNA、蛋白水平上对该模型进行鉴定,并在组织病理学和免疫细胞比例变化上与野生型C57BL/6J 小鼠进行了比较。

注:A:外周血中B 细胞、粒细胞、T 细胞的比例;B:骨髓中B 细胞、粒细胞、T 细胞的比例;C:脾中B 细胞、粒细胞、T 细胞的比例;D:胸腺中CD4+、CD8+、CD4-CD8-及CD4+CD8+T 细胞的比例。 与基因敲除野生型小鼠相比,∗P<0.05, ∗∗P<0.01, ∗∗∗P<0.001。图6 外周血、骨髓、脾及胸腺中免疫细胞的比例Note. A, Proportion of B(a), myeloid(b) and T cells(c) in peripheral blood. B, Proportion of B(a), myeloid(b) and T cells(c) in bone marrow.C, Proportion of B(a), myeloid(b) and T cells(c) in spleen. D, Proportion of CD4+, CD8+, CD4-CD8- and CD4+CD8+T cells in thymus.Compared with Sdpr+/+, ∗P<0.05, ∗∗P<0.01, ∗∗∗P<0.001.Figure 6 Percentages of immune cells in the peripheral blood, bone marrow, spleen and thymus
研究结果发现,Sdpr基因的缺失导致小鼠长期处于炎症状态,在敲除小鼠的肺局部血管周围及脂肪组织多处出现炎性细胞浸润,骨髓中细胞形态与比例出现变化,肝、脾可见髓外造血,流式结果显示敲除小鼠骨髓中T 细胞比例降低;在转基因小鼠肝细胞有轻微脂肪变性,脾有淋巴细胞增生,红髓细胞增多;骨髓中淋巴细胞比例增多,粒细胞比例减少,流式结果显示粒细胞和T 细胞比例降低,B 细胞比例增加,与HE 染色结果一致。 胸腺是小鼠T 细胞发育成熟的场所当来自胎肝或骨髓的T 细胞进入胸腺后,可经历不同的发育阶段。 通过对胸腺组织中免疫细胞进行CD4/CD8 抗体标记,流式分析发现敲除小鼠胸腺中CD4-CD8-双阴性细胞增多,CD4+CD8+双阳性细胞减少,证明Sdpr缺失影响胸腺中T 细胞成熟,使T 细胞的发育大量停留在早期;Sdpr转基因小鼠胸腺CD4+T 细胞增多,CD4+CD8+双阳性细胞减少,可推断Sdpr促使双阳性T 细胞经正负选择更多分化发育为具有免疫功能的成熟CD4+T 细胞。 因此可推断Sdpr基因对小鼠免疫系统及胸腺发育过程有着重要的影响。
免疫细胞的调控与造血系统中造血干/祖细胞的发育密不可分,造血干细胞的增殖、分化等过程直接影响到机体免疫系统的调控。 且在研究结果中发现,缺失Sdpr基因的小鼠出现髓外造血的现象,可推测Sdpr基因对血液细胞发育可能存在影响,因此Sdpr基因对造血系统发育的调控仍需进一步研究。 通过本研究建立了血清剥夺反应因子Sdpr基因敲除小鼠和转基因小鼠模型,为Sdpr在生物学过程中的功能、作用机制的研究提供基础,同时为胞膜窖及胞膜窖调节蛋白相互作用的研究提供了模型支持。
