烟酰胺(NAM)对SIV/SHIV 感染猴CD4+T 细胞中潜伏病毒的激活作用研究
2022-06-25翠陆佳涵魏强薛婧丛
党 翠陆佳涵魏 强薛 婧丛 喆
(中国医学科学院医学实验动物研究所,北京协和医学院比较医学中心,国家卫生健康委员会人类疾病比较医学重点实验室,国家中医药管理局人类疾病动物模型三级实验室,新发再发传染病动物模型研究北京市重点实验室,北京 100021)
由于病毒潜伏库的持续存在,艾滋病迄今无法实现彻底治愈[1-3]。 “柏林病人”和“伦敦病人”的成功由于其特殊性而难以复制[4]。 而此时“圣保罗病人”的出现,给通过药物治疗实现艾滋病功能性治愈带来了希望。 Jon[5]通过施行“shock and kill”这一策略,在抗逆转录病毒治疗(antiretroviral therapy, ART)治疗同时,服用了烟酰胺(NAM),用来激活病毒潜伏库,在停药后一年时间内都未出现病毒反弹。 这一结果显然是具有积极意义的。 NAM 作为维生素B3 的酰胺化合物[6],其生物安全性较高,如果可以作为病毒潜伏感染激活剂,将是非常好的选择。
1 材料和方法
1.1 实验材料
1.1.1 实验动物SPF 级中国恒河猴6 只,体重5~10 kg,年龄5~8岁,2 只雌性,4 只雄性,购自北京协尔鑫生物资源研究所[SCXK(京)2015-0011]。 实验动物流程操作经本单位实验动物福利伦理委员会审批(XJ19007、XJ19003),在本单位生物安全三级实验室[SYXK(京)2017-0027]进行,严格遵守3R 原则。 6 只恒河猴中除1 只正常恒河猴外,其余5 只均曾感染SIV 或SHIVSF162P3,目前血浆病毒载量呈阴性。
1.1.2 细胞SIV/SHIVSF162P3感染恒河猴和正常恒河猴的外周血单核淋巴细胞(PBMC)。
1.2 主要试剂与仪器
1.2.1 潜伏感染激活剂
NAM(Cat.N0636)、Prostratin(Cat.P0077)和PHA-P(Cat.L1668)购自sigma 公司;GS-9620(Cat.S7221)购自selleck 公司;IL-2(Cat.202-IL-050)购自R&D 公司。
1.2.2 抗体
使用抗体详细信息见表1。
表1 抗体一览表Table 1 List of antibodies
1.2.3 其他试剂
CCK8 试剂盒(Cat.C0038)、BCA 蛋白浓度测定试剂盒(Cat.P0010)和BeyoGelTMPlus PAGE 预制胶(Tris-Gly, 4%~15%, 10 孔)(Cat.P0645S)购自碧云天公司;CD4+T Cell Isolation Kit(Cat.130-092-144)和LS 柱(Cat.130-042-401)购自Miltenyi Biotec公司;PMSF(Cat.P0100)、高效RIPA 组织裂解液(Cat.R0010)购自索莱宝公司。
1.2.4 仪器
美国BD FACS AriaⅡ分选型流式细胞仪;美国BD Accuri C6 Flow Cytometry 流式细胞仪;美国ABI 7500 Real time PCR 仪;美国Bio-Rad PowerPacTM基础电泳仪和ChemiDocTMXRS+成像仪;日本Nicon TS100 显微镜。
1.3 实验方法
1.3.1 PBMC 的分离
采集EDTA 抗凝的猴外周血,利用Ficoll 分离PBMC,计数,备用[7]。
1.3.2 CCK8 法测定药物对细胞的半数毒性浓度(CC50)
药物用DMSO 溶解,然后稀释到起始工作浓度。 NAM 为200 mmol/L,Prostratin 为500 μmol/L,GS-9620 为48.6 μmol/L。 然后分别用10%胎牛血清RPMI 1640 生长液进行10 倍系列稀释,即原倍、1 ∶10、1 ∶100……,共8 个浓度,每个浓度4 个复孔,每孔100 μL。 每孔再加入100 μL 浓度为每毫升1×107PBMC 细胞悬液,37℃、5% CO2培养。 3 d 后,每孔加入10 μL CCK8 溶液,培养箱内孵育2.5 h,测定吸光(A) 值,计算细胞存活率,即:Cell viability(%) = (A实验-A空白)/(A对照-A空白) ×100%[8-9];其中,A空白孔含培养基和CCK8,A对照孔含细胞、CCK8,A实验孔含细胞、CCK8、NAM 溶液[8-9]。 用Graphpad Prism 8.0 计算药物的CC50,以确定后续实验安全用药浓度。
1.3.3 CCK8 法测定细胞生长曲线
利用1 mmol/L NAM 处理PBMC,分别在0、2、4、6、8、10 d 利用CCK8 检测吸光(A) 值,4 个复孔。观察细胞增殖情况,确定后续实验培养时间[10]。
1.3.4 CD4+T 细胞的分选
取出所需数量的PBMC,加入CD4+T cell Biotin Antibody cocktail,4℃孵育10 min。 加入Anti-Biotin Microbeads,4℃孵育15 min,然后将LS 柱吸附于MACS 分选器上,将细胞过柱进行分选。
1.3.5 不同组合的潜伏感染激活剂刺激细胞
将分选得到的CD4+T 细胞,用10%胎牛血清RPMI 1640 生长液稀释为每毫升2×106个细胞,每孔加入500 μL。 之后加入稀释好的潜伏感染激活剂500 μL,同时设立不加潜伏感染激活剂的空白对照。最终药物浓度分别为:NAM (1 mmol/L) 、PHA(4 μg/mL ) 、 IL-2 ( 20 ng/mL ) 、 GS-9620(24.3 μmol/L) 、Prostratin (250 nmol/L) 。 培养时间为6 d。 第6 天收取细胞培养上清,测定病毒载量。 此外,在0、2、4、6 d 收取细胞,进行后续的流式实验。 另外,NAM 刺激2 d 后,收取细胞,Western blot 检测CD4+T 细胞核内抗原SIRT1 的表达。
1.3.6 病毒载量的测定
从上清中提取病毒RNA,使用Real time RTPCR 法测定病毒载量[11]。
1.3.7 流式方法检测CD4+T 细胞表面活化分子的变化[7]
在流式管管底加入细胞,然后加入CD69-BV421、CD3-BV605、CD38-FITC 、CD4-BV785、HLADR-BV510,4℃孵育30 min 后,1%多聚甲醛固定20 min,PBS 重悬,过滤,上机检测。
1.3.8 流式方法检测T 细胞表面CD4、CXCR4 和CCR5 的变化
将NAM 作用后的CD4+T 细胞加入流式管中,再加入CXCR4-PerCP/Cy5.5、CD3-PE、CCR5-Alexa Fluor® 647、CD4-FITC,4℃孵育30 min 后,PBS 重悬,上机检测。
1.3.9 Western blot 检 测CD4+T 细 胞 核 内 抗 原SIRT1 的表达
收取NAM 作用2 d 的CD4+T 后,利用RIPA 缓冲液和PMSF (50 ∶1) 提取总蛋白,测浓度。 取20 μg 的待测样本进行PAGE 凝胶电泳,电转于PVDF膜上。 封闭后,加入SIRT1 抗体(1 ∶1500)4℃孵育过夜,之后加入二抗(1 ∶3000;ZB-2305) 室温下孵育1 h。 内参蛋白GAPDH (1 ∶1000) 与SIRT1 蛋白相同条件孵育过夜,之后加入二抗(1 ∶3000;ZB-2301) 室温下孵育1 h[12]。 增强发光法显色,ImageJ软件获取图像。 蛋白表达量=蛋白灰度值/内参蛋白灰度值。
1.4 统计学方法
流式实验分别使用BD Arial Ⅱ和BD Accuri C6流式细胞仪进行样品分析,利用Flowjo 10 软件对数据进行处理;本研究所有数据采用Graphpad 8. 0 进行绘图和数据统计。 实验结果均以平均数±标准差(ˉx±s)表示,ns 为P>0.05,表示无统计学差异,P<0.05、P<0.01、P<0.001,表示具有统计学差异。
2 结果
2.1 NAM 对细胞活力的影响
正常猴PBMC 经不同浓度的NAM 刺激3 d 后,细胞存活率出现了不同程度的变化。 NAM 浓度≤1 mmol/L 时,其细胞存活率均在80%以上,而当NAM浓度≥10 mmol/L 时,细胞存活率急速骤降至20%以下(图1A),计算得到NAM 的CC50为4.01 mmol/L,选定最大无毒浓度1 mmol/L 进行后续刺激实验。
利用1 mmol/L NAM 刺激PBMC 后,每2 d 检测细胞生长情况。 对照组和NAM 组细胞增殖变化趋势基本一致,在2 d 内都有一个升高的过程,之后开始缓慢下降。 可以看出,1 mmol/L NAM 在6 d内,对细胞增殖无抑制作用,且NAM 组与对照组比较,在2、4、6 d 增长幅度分别提高了(4.00 ±0.11)%、(22.15±0.10)%、(13.30±0.15)%。 在第6 天后,细胞生长状况逐渐变差(图1B)。
2.2 不同潜伏感染激活剂对SIV/SHIV 感染猴外周血CD4+T 细胞中潜伏病毒的激活效果比较
感染猴在不同时间多次采集外周血,分离CD4+T 细胞,经不同组合的潜伏感染激活剂作用后,部分样本培养上清中病毒载量检测呈阳性。 与此同时,所有样本中不加潜伏感染激活剂的对照检测均为阴性,即上清中没有检测到病毒。 其中,PHA+IL-2组阳性率最低,只有2 个病毒载量检测阳性,为14.29%,NAM 单药组为28.57%,Prostratin 单药组为35.71%,GS-9620 单药组最高,达到71.43%。NAM 和其他3 种潜伏感染激活剂联合组中,NAM+Prostratin 组和NAM+GS-9620 组与Prostratin 组和GS-9620 单药组的阳性率一致,而NAM+PHA+IL-2组阳性率则提高到35.71%,明显高于两个单药组28.57%和14.29%的阳性率。 各组之间阳性率进行卡方检验,有显著性差异(P<0.001)(表2)。
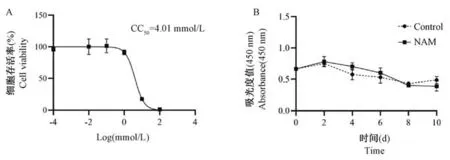
注:A:PBMC 经不同浓度的NAM 作用3 d 后细胞存活率的变化;B:1 mmol/L NAM 刺激PBMC 后,不同时间细胞存活率的变化。图1 NAM 对PBMC 存活率的影响(n=4)Note. A,Changes in viability after treated with different concentrations of NAM for 3 d.B,Changes in viability at different times after treated with 1 mmol/L NAM.Figure 1 Changes of survival rate of PBMC treated with NAM
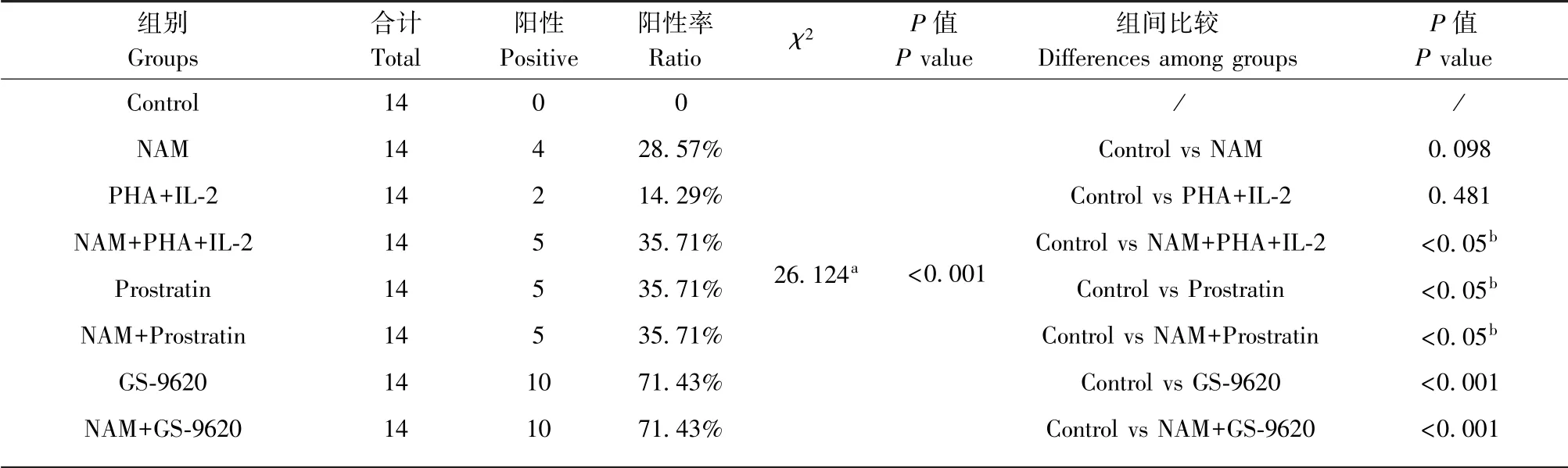
表2 潜伏感染激活剂组阳性率比较Table 2 Comparison of positive rate of latency-reversing agent group
所有样本经不同潜伏感染激活剂作用后,上清中的载量通常在102~104copies/mL 之间。 其中,PHA+IL-2 组病毒载量平均值最低,为1.64E+02 copies/mL,NAM 单药组为2.38E+02 copies/mL,Prostratin 单药组为4.02E+02 copies/mL,GS-9620单药组最高,达到9.85E+02 copies/mL。 NAM 和其他3 种潜伏感染激活剂联合组中,NAM+Prostratin组与和Prostratin 组相比变化不大,其余两组与单药组比都有不同程度的升高。 PHA+IL-2 组载量均值为1.64E+02 copies/mL,而NAM+PHA+IL-2 组提高到4.12E+02 copies/mL;GS-9620 组载量均值为9.85E+ 02 copies/mL,NAM +GS-9620 组提高到2.12E+03 copies/mL(图2)。
2.3 NAM 对CD4+T 细胞活化的影响
正常猴PBMC 经刺激后,流式结果显示:对照组和NAM 组CD4+T 细胞在培养6 d 内,活化分子CD69、CD38 和HLA-DR 的表达量及变化趋势基本一致,仅NAM 组CD38 在第2 天的表达量略高于对照组,对照组(53.53±2.96)%,NAM 组(59.6±0.37)%。 PHA+IL-2 可刺激T 细胞活化,作为T细胞活化标志物的阳性对照组。 样本经PHA+IL-2 刺激后CD69、CD38、HLA-DR 表达量均有明显上调(图3A)。
将作用2 d 的CD4+T 细胞表面活化分子的表达量进行组间比较发现,NAM 组与对照组3 个活化分子CD69、CD38 和HLA-DR 的表达量对比,均无统计学差异,PHA+IL-2 组与对照组对比皆有显著性差异,其中,CD69 的表达量差异性P<0.01,CD38 的表达量差异性P<0.01,HLA-DR 的表达量差异性P<0.001(图3B)。
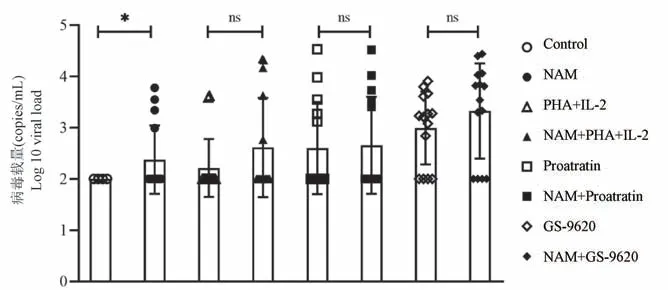
注:与对照组相比,∗P<0.05。图2 不同潜伏感染激活剂对SIV/SHIV 感染猴外周血CD4+T 细胞中潜伏病毒的激活效果比较(n=14)Note. Compared with Control group,∗P<0.05.Figure 2 Comparison of reactivation effect on latent reservoir in CD4+T cells from SIV/SHIV-infected maceques by different LRAs
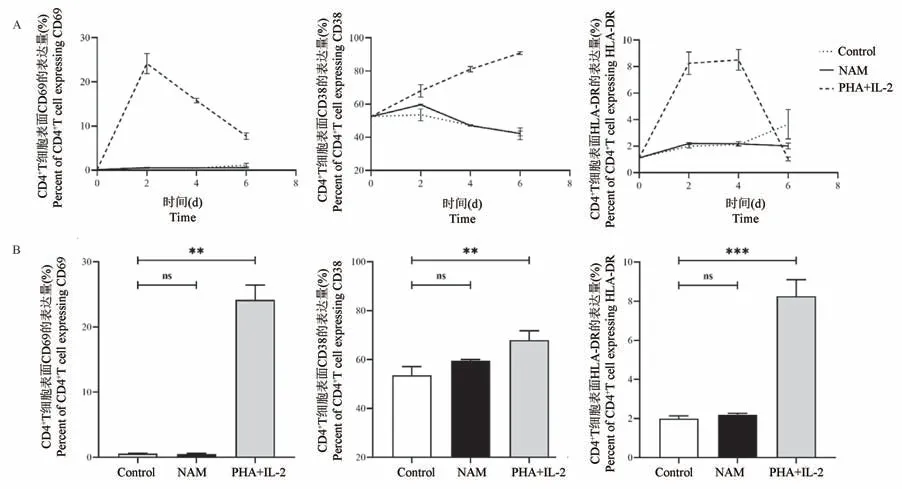
注:A:作用不同时间,CD4+T 细胞表面活化分子CD69、CD38 和HLA-DR 表达量的变化;B:作用2 d 后,CD4+T 细胞表面活化分子CD69、CD38、HLA-DR 表达量的差异分析。 与对照组相比,∗∗P<0.01, ∗∗∗P<0.001。图3 NAM 对CD4+T 细胞表面活化分子CD69、CD38 和HLA-DR 的影响(n=3)Note. A, Expression levels of CD69, CD38 and HLA-DR on the surface of CD4+T cells after treated with NAM. B, Comparison of expression levels treated with NAM and PHA+IL-2. Compared with Control group,∗∗P<0.01, ∗∗∗P<0.001.Figure 3 Changes of activated T cell surface marker CD69, CD38 and HLA-DR on CD4+T cell after treated with NAM
2.4 NAM 对CD4+T 细胞表面辅助受体CXCR4、CCR5 表达的影响
对正常猴PBMC 作用2 d 后,阴性对照组、NAM组和Prostratin 组CXCR4 表达量分别为(25.03±0.19)%、(27.33±0.78)%、(7.58±0.56)%;CCR5表达量分别为(5.00±0.37)%、(5.66±0.79)%、(0.31±0.05)%。 与对照组相比,Prostratin 显著下调辅助受体CXCR4、CCR5 的表达(P<0.001),而NAM 组均稍高于对照组。 其中,CXCR4 的表达量的增加具有统计学差异(P<0.05)(图4)。
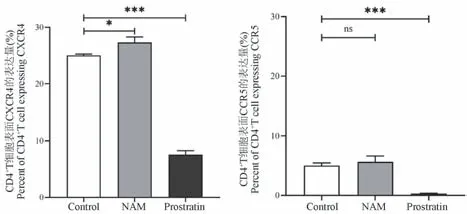
图4 NAM 对CD4+T 细胞表面辅助受体表达情况的影响(n=3)Figure 4 Effects of co-receptor on CD4+T cells treated with NAM
2.5 NAM 对CD4+T 细胞核内抗原SIRT1 表达量的影响
正常猴CD4+T 细胞经NAM 作用2 d 后,SIRT1蛋白表达量明显下降(图5A),为对照组表达量的(46.85±22.50) %。 与对照组相比,具有统计学差异(P<0.05)(图5B)。
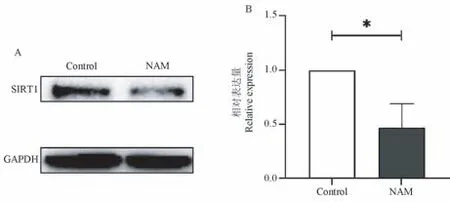
图5 NAM 对CD4+T 细胞中SIRT1 的表达量的变化(n=3)Figure 5 Effects of NAM on SIRT1 expression in CD4+T cells
3 讨论
烟酰胺(NAM),是维生素B3 的酰胺化合物,其生物安全性较高,体外利用NAM 激活HIV 潜伏库,显示出较好的病毒激活效果[13]。 临床实验中,Diaz 团队发现在ART 治疗同时,加服NAM 的5 名艾滋病患者之一,即“圣保罗病人”,在停药后,病毒反弹延迟了66 周,这说明烟酰胺可能激活潜伏库细胞的病毒表达,而当这些细胞产生新的病毒时,就会发生凋亡或者被宿主免疫系统杀伤,从而减小了潜伏库,进而延迟了病毒反弹[5,14]。
本研究尝试利用病毒载量持续阴性的感染猴的CD4+T 细胞来研究NAM 对病毒潜伏库的激活作用[15-16]。 研究发现,经NAM 刺激后,病毒潜伏库一定程度上被激活。 虽然相较于成熟的TLR7 激动剂GS-9620[17],激活效果还有差距,但NAM 和GS-9620联用,能够更大程度地激活病毒潜伏库,提高培养上清中的病毒载量水平。 NAM+PHA+IL-2 组相比NAM 组和PHA+IL-2 组,也能看到类似的协同效应。
在激活病毒潜伏库的同时,NAM 并没有引起T细胞的广泛活化,提示其具有较好的安全性。 目前的潜伏感染激活剂中,一些激活剂,如PKC 激动剂,由于具有广泛的非特异性T 细胞活化,可引起机体的不良反应,从而使得其难以在临床应用[18]。 此外,某些激活剂,如Prostratin 可通过下调CD4、CXCR4 以及CCR5 的表达来增强抗病毒活性[19]。NAM 对CCR5 的表达没有影响,只略微上调CXCR4的表达,这需要在应用过程中加以注意。
关于NAM 激活潜伏库细胞病毒表达的机制,尚未见报道。 目前,潜伏感染激活剂的药物,主要有以下几种类型:TLR7 激动剂、组蛋白去乙酰化酶抑制剂(HDACi)、 甲基化酶抑制剂(MTi)、蛋白酶C 激活剂(PKC)、T 细胞激活剂等。 其中,HDACi 研究较为广泛。 SIRT1 属于HDAC Ⅲ类家族,兼有组蛋白和非组蛋白去乙酰化酶活性[20-21]。 有文献证实,当SIRT1 被抑制后,去乙酰化作用将会受到抑制,从而导致NFκB 持续活化[22],进而活化T 细胞激活HIV 基因组表达[23]。 NAM 是SIRT1 的抑制剂[24-25],而这也可能是NAM 激活潜伏库病毒表达的机制,但NAM 激活病毒潜伏库的表达是否还有其他的作用机制,仍需进一步研究。
