急性白血病患儿化疗期间合并血流感染的危险因素分析及风险列线图模型的建立
2022-06-20周晓红张春旭宋丽琴
周晓红,张春旭,宋丽琴
急性白血病(acute leukemia,AL)是以造血干细胞恶性克隆为主要病理特点的血液系统恶性肿瘤,临床中根据血细胞分化程度可将其分为急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL)和急性髓细胞白血病(acute myeloid leukemia,AML)[1]。AL患儿由于血液中白细胞等免疫细胞因子数量和功能异常,常可伴有不同程度的免疫功能下降,而病人在接受化疗等免疫抑制剂治疗期间可进一步加重细胞免疫功能损伤,导致感染的发生[2]。有调查研究发现,AL患儿化疗期间感染的发生率高达35.0%,已成为目前AL病人的常见并发症,其中血流感染是最常见的感染类型之一,致病菌可随血液循环导致多部位出现感染灶,具有较高的死亡率[3]。已有研究证实,感染作为一种癌症激活因子,是恶性肿瘤进展恶化的驱动因素之一[4]。AL病人一旦发生血流感染不仅直接影响化疗的临床疗效,还可进一步导致病情进展恶化加快,死亡率增加[3]。因此,加强对AL患儿并发血流感染的预测,进而采取个体化的干预措施,对于加强化疗的治疗效果、延长病人生存期、改善治疗预后具有重要的临床意义。然而,诱发AL患儿发生血流感染的因素较复杂,除与病人免疫力下降有关外,还可能与疾病类型及医源性因素密切相关,且不同研究间对这些风险因素的认识尚存在一定争议[5]。本研究拟对AL患儿化疗期间发生血流感染的危险因素进行分析,并通过构建列线图模型将风险因素定量化,预测病人发生血流感染的风险,以期为高危病人的早期识别和干预提供参考依据,现报告如下。
1 对象与方法
1.1 研究对象 选取我院儿科重症监护室(PICU)2019年6月—2021年5月收治的AL患儿作为研究对象,根据病人住院化疗期间是否发生血流感染,分为血流感染组和未感染组。纳入标准:①经骨髓形态学、流式细胞术及组织病理检查确诊为AL,且符合由美国血液病协会制定的《急性白血病初始诊断检查指南(2017)》[6]中的相关标准;②血流感染应在临床诊断基础上具有明确的病原学诊断依据,即血培养阳性或血液中检测到病原体的抗原物质或基因测序识别出病原微生物;③年龄<18岁;④于我院行规范化疗,且临床病例资料保留完整;⑤签署知情同意书。排除标准:①伴有严重的心功能不全、肝肾功能障碍或实体恶性肿瘤等;②入院化疗前已存在感染。本研究经我院医学伦理委员会批准同意。最终纳入符合标准的AL患儿443例,其中男269例(60.7%),女174例(39.3%);年龄3~16(9.21±2.23)岁;AML病人305例(68.8%),ALL病人138例(31.2%)。化疗过程中发生血流感染病人97例,感染发生率为21.9%。
1.2 研究方法 首先收集两组AL患儿住院化疗期间的相关临床资料并进行单因素分析。①人口学特征,如患儿性别、年龄、体质指数(BMI)等;②患病和治疗情况,如AL发病类型(ALL或AML)、化疗方案、住院时间、是否伴有中性粒细胞缺乏、化疗阶段(诱导期或巩固期)、化疗周期、经外周静脉置入中心静脉导管(PICC)时间、是否预防性使用抗菌药物、白细胞计数、血清白蛋白等。然后根据单因素分析中有统计学意义的因素进一步进行二元Logistic回归分析,并在此基础上建立列线图模型,并对模型进行验证。

2 结果
2.1 血流感染致病菌分布和耐药性分析 97例血流感染AL患儿共检出致病菌132株,其中革兰阴性菌77株(58.3%),革兰阳性菌51株(38.6%),真菌4株(3.1%),致病菌分布情况详见表1。革兰阴性菌中检出产β内酰胺酶菌株39株(50.6%),产碳青霉烯酶菌株12株(15.6%),革兰阳性菌中耐甲氧西林葡萄球菌3株(5.9%)。
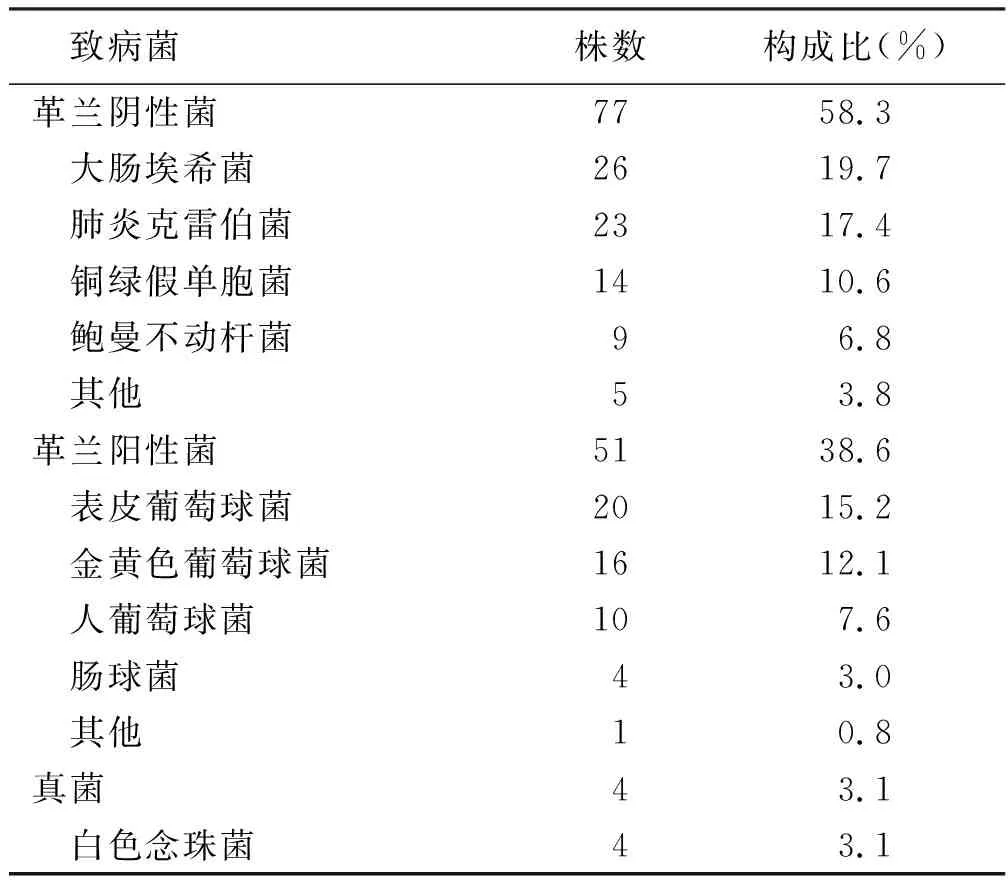
表1 97例血流感染AL患儿致病菌分布情况(n=132)
2.2 AL患儿化疗期间合并血流感染的单因素分析 对血流感染组和未感染组患儿临床资料进行比较发现,血流感染组住院时间≥30 d、PICC置管时间≥20 d、近30 d内抗菌药物暴露史≥3个品种、血白细胞计数<4.0×109/L、血中性粒细胞绝对值<0.5×109/L、血清白蛋白<30 g/L及处于化疗诱导期的患儿比例明显高于未感染组,差异具有统计学意义(P<0.05)。详见表2。
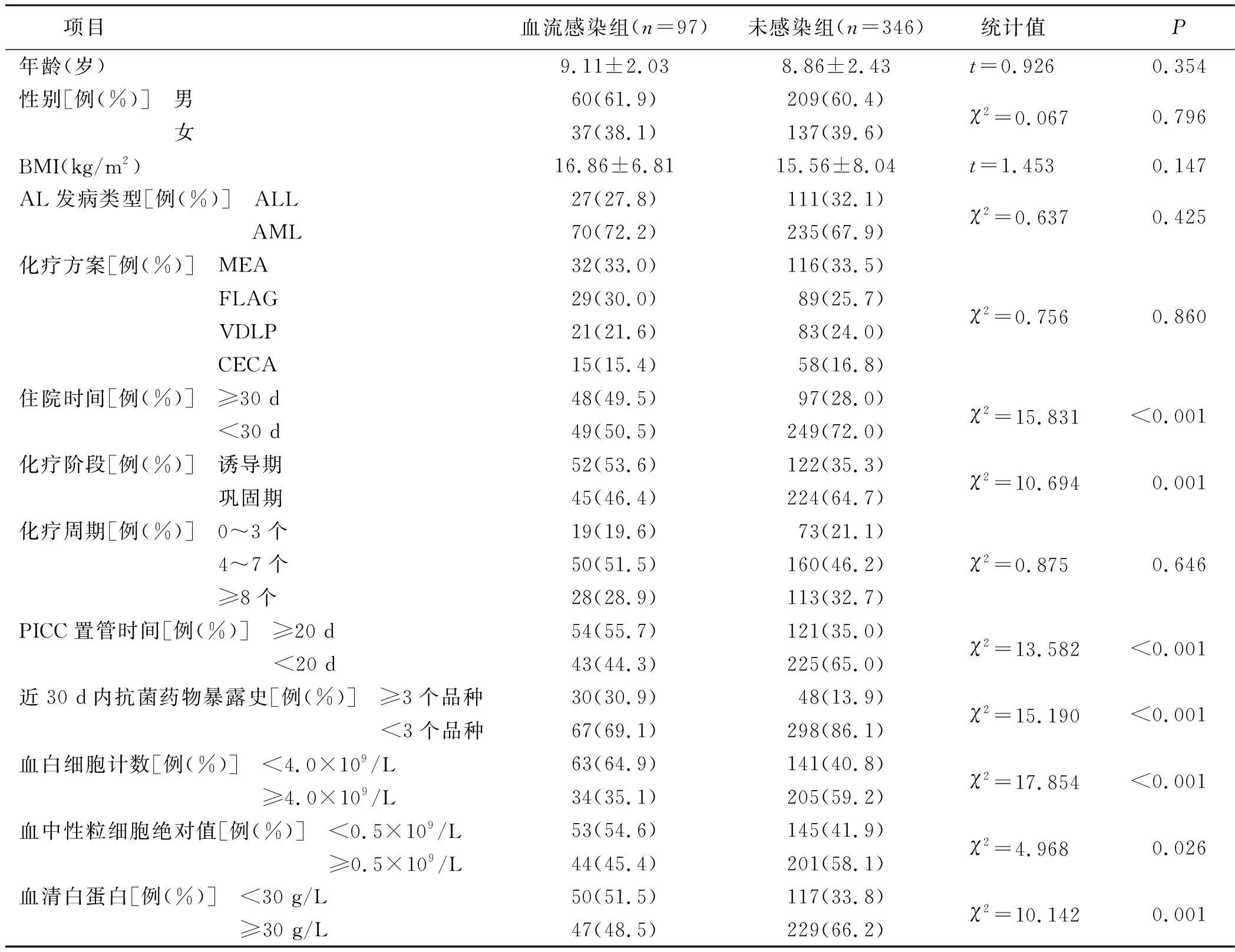
表2 AL患儿化疗期间合并血流感染的单因素分析
2.3 AL患儿化疗期间合并血流感染的二元Logistic回归分析 将单因素分析中有统计学意义的因素作为自变量,以AL患儿化疗期间是否合并血流感染作为因变量,进行二元Logistic回归分析(各变量赋值情况详见表3)。结果发现,在控制其他混杂因素的前提下,住院时间≥30 d(OR=3.011,即相对于住院时间<30 d的病人,住院时间≥30 d发生血流感染的风险增加3.011倍)、30 d内抗菌药物暴露史≥3个品种(OR=1.967,即相对于30 d内抗菌药物暴露史<3个品种病人,30 d内抗菌药物暴露史≥3个品种病人发生血流感染风险增加1.967倍)、血白细胞计数<4.0×109/L(OR=2.602,即相对于白细胞计数>4.0×109/L病人,血白细胞计数<4.0×109/L病人发生血流感染风险增加2.602倍)、血清白蛋白<30 g/L(OR=2.083,即相对于血清白蛋白≥30 g/L病人,血清白蛋白<30 g/L病人发生血流感染风险增加2.083倍)、病人化疗阶段处于诱导期(OR=2.041,即相对于化疗阶段处于巩固期病人,诱导期病人发生血流感染风险增加2.041倍)及PICC置管时间≥20 d(OR=2.244,即相对于PICC置管时间<20 d病人,PICC置管时间≥20 d病人发生血流感染风险增加2.244倍)是AL患儿化疗期间合并血流感染的独立危险因素(P<0.05)。而中性粒细胞绝对值则与AL患儿是否合并血流感染无统计学相关性。详见表4。

表3 自变量和因变量赋值情况

表4 AL患儿化疗期间合并血流感染影响因素的二元Logistic回归分析
2.4 AL患儿化疗期间合并血流感染的风险预警模型的建立与应用 将回归分析得到的6个具有统计学意义的独立危险因素,通过R软件rms程序包建立AL患儿化疗期间合并血流感染的列线图风险预测模型(见图1)。在实际临床应用中,首先临床医生可根据化疗病人的个体情况,在图1中找到上述各项独立危险因素在“评分”上的分值;然后将各因素分值相加即可得到总分,并将其在“总评分”标尺上读数;最后找到总评分在“血流感染发生风险”数轴上对应的数值,即为该病人发生血流感染的风险系数。
2.5 AL患儿化疗期间合并血流感染风险预警模型的效应评价 对上述列线图模型进行内部验证,采用C-index对模型进行评价,结果发现初始列线图的C-index为0.878(见图2A),通过1 000次Bootstrap法对模型进行验证后,C-index为0.876(见图2B),且校正曲线显示模型预测值和观察值具有一定的相关性(见图3),说明该模型对预测AL患儿化疗期间发生血流感染的概率与实际发生概率具有较高的一致性。
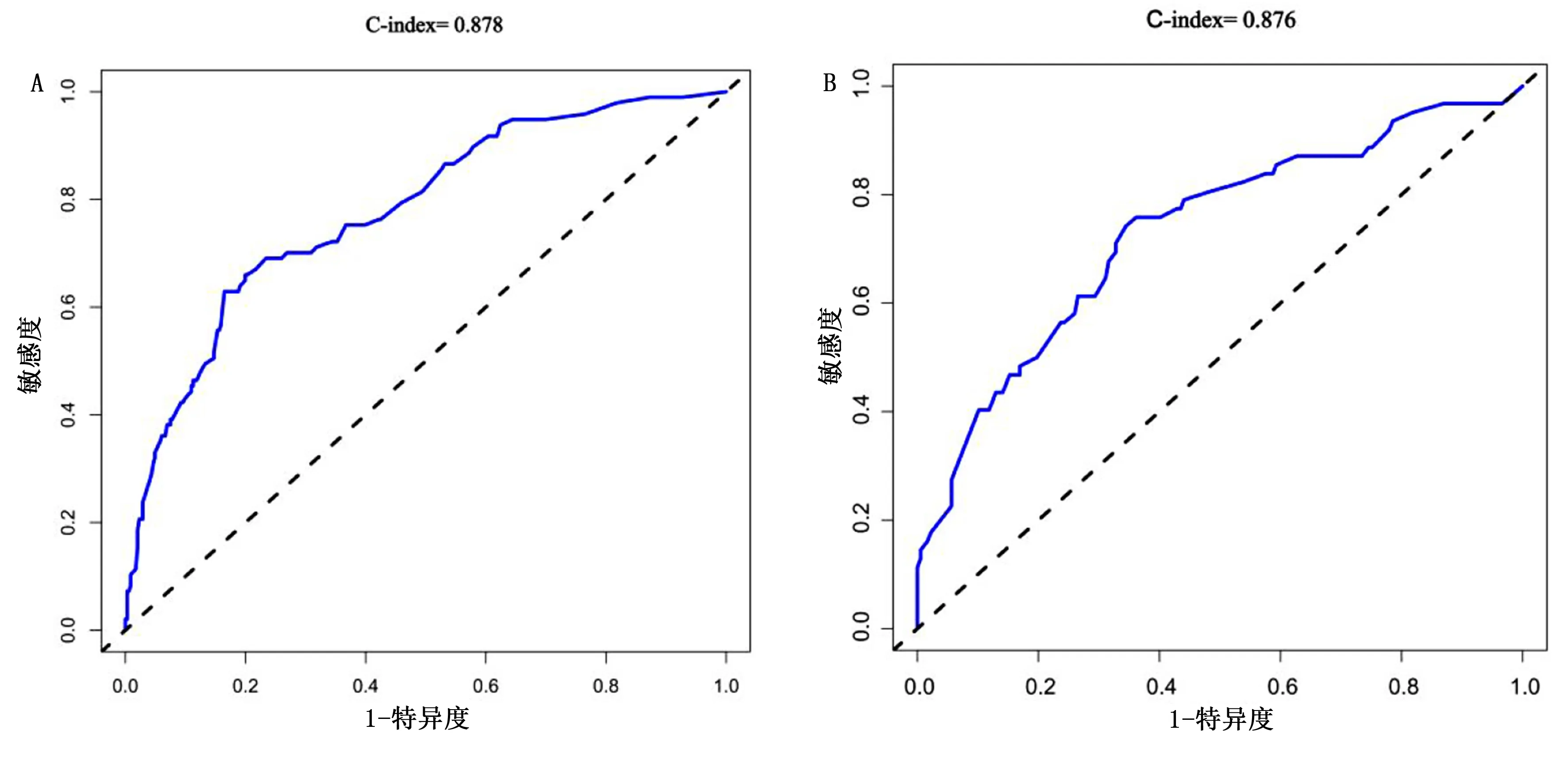
图2 初始列线图模型(A)和1 000次Bootstrap内部验证(B)的ROC曲线

图3 预测AL患儿化疗期间合并血流感染列线图模型的校正曲线验证
3 讨论
骨髓抑制是AL病人主要的病理表现之一,因此疾病本身即可导致患儿存在不同程度的免疫缺陷,而在治疗过程中,由于高强度化疗、激素治疗、免疫抑制剂治疗及各种医源性操作如PICC置管术等可进一步使患儿细胞和机械免疫屏障同时遭到破坏,加之超广谱抗菌药物的不合理使用,使得AL患儿成为医院获得性感染的高危人群,其中血流感染是该类病人常见的感染类型。多项研究表明,在AL合并医院获得性感染病人中,血流感染的发生率虽然仅次于排名第1位的肺部感染,但血流感染病人住院时间最长,病死率最高,预后最差[7-8]。由此可见,血流感染不仅可影响病人AL的临床治疗效果,且严重威胁病人生命,是AL病人死亡的主要原因之一。因此,加强对AL病人发生血流感染危险因素的筛查,并通过建立诊断模型对感染发生风险进行早期评估,进而采取个体化的治疗方案,对于降低血流感染的发生率、提高AL的临床治疗效果具有重要意义。本研究发现,AL患儿化疗期间合并血流感染的发生率为21.9%,病原学诊断提示致病菌主要以革兰阴性菌为主,其中产β内酰胺酶和碳青霉烯酶菌株占革兰阴性菌总株数的50.6%和15.6%,而在革兰阳性菌中耐甲氧西林葡萄球菌占5.9%,这与牛晓红等[9]报道较为一致。
AL患儿化疗期间血流感染的发生和进展较为复杂,往往是多个因素共同作用下的结果[10]。本研究在对两组病人临床资料单因素分析中发现,血流感染组住院时间≥30 d、PICC置管时间≥20 d、近30 d内抗菌药物暴露史≥3个品种、血白细胞计数<4.0×109/L、血中性粒细胞绝对值<0.5×109/L、血清白蛋白<30 g/L及处于化疗诱导期的病人比例明显高于未感染组,差异具有统计学意义(P<0.05)。但在二元Logistic回归分析中并未发现血中性粒细胞绝对值与血流感染的发生存在统计学相关性,通过将其与其他变量进行共线性诊断发现,血中性粒细胞绝对值与血白细胞计数存在明显相关性(P<0.05),因此考虑血中性粒细胞绝对值作为混杂因素而未被纳入模型。
多项研究证实,住院时间较长与医院获得性感染的发生存在密切关系[11-13]。本研究中同样发现,住院时间≥30 d是AL患儿发生血流感染的独立危险因素,其主要原因为住院时间越长,致病菌定植风险越高,病人易感因素的暴露机会也更大,使病人感染的风险明显增加[14]。已经证实,碳青霉烯类等抗菌药物暴露史是铜绿假单胞菌和鲍曼不动杆菌定植和感染的独立危险因素[15]。AL患儿由于需要进行反复化疗,往往需要多次反复住院,感染发生的风险较大,导致患儿含酶抑制剂复方制剂和碳青酶烯类抗菌药物的暴露史明显增加,使得血流感染的风险升高。本研究发现病人近30 d内抗菌药物暴露史≥3个品种是血流感染发生的独立危险因素,其中大部分病人存在联合用药,且含酶抑制剂复方制剂和碳青酶烯类抗菌药物的使用频率较高,这与胥萍瑶等[16]的研究结果较为类似。本研究还发现,处于化疗诱导期的病人发生血流感染的风险明显高于巩固期,且是血流感染发生的独立危险因素,其主要原因可能与在化疗诱导期患儿血液中存在大量的白血病细胞,且中性粒细胞缺乏严重,导致机体免疫功能明显下降有关[17]。白细胞具有产生抗体和吞噬血液中异物的作用,是机体预防病原微生物入侵的主要免疫细胞,当白细胞数量减少时,可使病人对微生物的抵抗能力下降,从而导致感染的发生。血清白蛋白是机体营养状况的重要指标,不仅是维持血浆胶体渗透压的重要物质,也是运送机体内源性和外源性物质很重要的载体,AL患儿化疗期间可因化疗药物作用引起各种胃肠道不适,如恶心、呕吐和厌食等,导致白蛋白丢失过多或摄入不足,使机体抵抗力下降,容易合并感染[18]。除此之外,本研究还发现PICC置管时间≥20 d是AL患儿化疗期间发生血流感染的独立危险因素。刘春等[19]研究证实,PICC留置导管时间与化疗病人导管相关性感染的发生率存在密切关系。PICC作为临床中肿瘤化疗病人常见的治疗手段,是一种有创性操作,若医护人员操作不够熟练或管道护理不规范极易导致血管内皮细胞损伤,损伤机体机械性免疫屏障,病原微生物可随导管侵入引起导管相关性血流感染[20-21]。
综上所述,AL患儿化疗期间血流感染发生率较高,致病菌以革兰阴性菌为主,且细菌耐药情况较为严重。患儿住院时间≥30 d、30 d内抗菌药物暴露史≥3个品种、血白细胞计数<4.0×109/L、血清白蛋白<30 g/L、病人化疗阶段处于诱导期及PICC置管时间≥20 d是AL患儿化疗期间合并血流感染的独立危险因素。基于以上风险因素建立的列线图模型具有较高的诊断效能,但本研究为单中心研究,样本量有限,仍需多中心、大样本研究进一步证实。
