离子色谱法同时测定乌梅中4种有机酸的含量
2022-06-17夏雪琴罗钰颖吕尚金浩鑫魏惠珍饶毅江西中医药大学南昌0004江西省药品认证审评中心南昌0046中药固体制剂制造技术国家工程研究中心南昌0006
★夏雪琴 罗钰颖 吕尚 金浩鑫 魏惠珍 饶毅(. 江西中医药大学 南昌 0004;2.江西省药品认证审评中心 南昌 0046;.中药固体制剂制造技术国家工程研究中心 南昌 0006)
乌梅为蔷薇科植物梅Prunus mume(Seib.)Sieb.et Zucc. 的干燥近成熟果实,是一种重要的药食同源药材,具有敛肺、生津等功效[1],也常被应用于保健食品中[2-3]。乌梅中药配方颗粒是将乌梅药材经水提取制成一定规格仅供医疗机构中医临床配方使用的制成品,具有新颖、便捷、有效的特点[4]。
乌梅中含有丰富有机酸,其中含量较高的是柠檬酸和苹果酸[5]。有研究表明,乌梅及其制剂对多种细菌有体外抑制作用[6-7]。乌梅提取物中的有效成分柠檬酸能降低肺炎克雷伯菌荚膜多糖生物合成的转录水平而发挥抗菌作用[8]。有研究发现,乌梅其所含的有机酸成分可能与加速过氧亚硝酸清除、减轻过氧化损伤等方面有关[9-10]。Anke S等[11]发现,延胡索酸盐在清除炎症过程中释放的破坏性‘氧自由基’,是乌梅抗氧化作用的关键有机酸。
目前测定乌梅中的有机酸的方法主要有液相色谱法、离子色谱法等。液相色谱法虽有简便、准确度高等特点,但有机酸极性较大,在反向硅胶色谱柱上不易洗脱,同时测定多种有机酸时,分离度较差[12-13]。国内外虽已有离子色谱法将其同时分析数种有机酸的相关报道[14-15],但同时检测乌梅及乌梅配方颗粒中4种主要有机酸的相关研究尚未见报道。本实验同时测定乌梅及乌梅配方颗粒中柠檬酸、苹果酸、草酸、延胡索酸4种有机酸含量,结合药理分离提取有效的有机酸成分,为提高乌梅的使用效率以及为进一步研究阐明乌梅有机酸成分药理作用的机制提供科学依据。
1 仪器与试药
1.1 仪器
戴安ICS2100离子色谱仪、Dionex IonPacTM AS19型分离柱(250mm×4mm)、电导检测器、抑制器、Chromeleon色谱工作站(美国Thermo公司);AB104-N万分之一天平(梅特勒-托利多公司)。
1.2 试药
柠檬酸(批号:100396-201603,含量100%);延胡索酸(批号:111541-201803,含量99.4%);草酸钠AR(阿拉丁试剂);L-苹果酸(批号:190014-201302,含量100%);超纯水(电阻率≥18.2 MΩ·cm)。
乌梅配方颗粒5501批(批号:B190805501)、乌梅配方颗粒5601批(批号:B190805601)、乌梅配方 颗 粒 5701批( 批 号:B190805701)( 江 西天施康中药股份有限公司);乌梅配方颗粒样品1(批号:20190301S)、乌梅配方颗粒样品2(批号:20190302S)、乌梅配方颗粒样品3(批号:20190303S)、乌梅配方颗粒样品4(批号:20200701S)(江西百神药业股份有限公司);乌梅药材1号(产地:福建),乌梅药材2号(产地:云南),乌梅药材3号(产地:四川),乌梅药材4号(产地:云南)。
2 方法
2.1 样品前处理
2.1.1 乌梅药材供试品溶液的制备精密称取乌梅药材粉末0.2 g(精确至0.000 1 g),置具塞锥形瓶中,精密加入超纯水50 mL,加热回流30 min,取出,放冷,滤纸过滤,再精密量取续滤液2 mL,置100 mL容量瓶中,加超纯水定容至刻度线,摇匀,即得。
2.1.2 乌梅配方颗粒供试品溶液的制备精密称取乌梅配方颗粒0.2 g(精确至0.000 1 g),置具塞锥形瓶中,精密加入超纯水50 mL,加热回流30 min,取出,放冷,滤纸过滤,再精密量取续滤液5 mL,置50 mL容量瓶中,加超纯水定容至刻度线,摇匀,即得。
2.2 色谱条件
色谱柱:Dionex IonPacTM AS19型分离柱(250 mm×4 mm);流动相:KOH梯度淋洗液(程序见表1);KOH淋洗液流速:1.00 mL/min;抑制电流:75 mA;电导检测器检测;进样量:25 μL,以峰面积定量。

表1 淋洗液梯度程序
3 结果
3.1 色谱条件的选择
3.1.1 色谱柱的选择考察了AS19和AS11两种色谱柱的分离效果,两者的离子交换功能基基均为烷醇季铵基,亲水性较强,对OH-的选择性强。但AS11的柱容量小仅有45 μmol /柱;而AS19柱的柱容量高,为350 μmol /柱,对二价有机酸、苹果酸、草酸等的保留较强,峰形较好,有利于实现多组分的同时分离。实验证明AS11对目标化合物的分离效果较 AS19差,特别是对弱保留组分。故实验选用AS19分析柱。
3.1.2 淋洗液与梯度的优化以 KOH 作淋洗液,OH-为强亲水性离子,容易进入固定相的水合区,有效地从离子交换位置上置换其他阴离子[16]。因此,本实验选用KOH作淋洗液。以EG40淋洗液自动发生器由纯水在线生成高纯度的KOH淋洗液,可以避免杂质污染,保证淋洗液浓度准确,从而最大限度地降低梯度淋洗导致的基线漂移,使得流速、淋洗液浓度在仪器可承受的范围内变化时,基线能始终保持平直,且平衡时间短。
由于不同有机酸与固定相的亲和力差异大,采用等浓度淋洗会出现多种组分共淋洗或强保留组分洗脱时间过长的现象。为使4种有机酸在一定时间内能完全淋洗,须采用梯度洗脱。本文以单标进样并逐渐提高淋洗液浓度的方式考察了 4种有机酸的洗脱情况,发现最易洗脱的乳酸和乙酸在淋洗液浓度为4 mmol /L 时能得到完全分离的尖锐峰形;淋洗液浓度为54 mmol /L 时,柠檬酸和异柠檬酸能较快被洗脱。经反复实验,确定淋洗液浓度梯度程序如表 1 所示。在该淋洗条件下,4 种有机酸可实现基线分离。图1为4种有机酸混合标准溶液的色谱图。
3.1.3 流速的选择分别设定淋洗液的流速为0.6、0.8、1.0、1.2 mL/min,实验发现,随着淋洗液液流速的不断增大,分离时间逐渐缩短,但对分离度影响不大。随着流速的增大,柱压升高,柱压过高会损害色谱柱。因此,综合考虑选择流速为1.0 mL/min。
3.2 绘制标准曲线
分别称取柠檬酸对照品26.06 mg、延胡索酸对照品7.86 mg、草酸钠对照品8.70 mg、L-苹果酸对照品9.77 mg,分别溶于4个100 mL容量瓶中,加入超纯水至刻度,作为各样品的标准液,浓度分别为 0.047 7、0.007 9、0.008 7、0.009 8 mg/mL。 用上述标准液分别加入1、2、5、8、10 mL的延胡索酸、草酸、L-苹果酸标准液和2、5、10、25、20 mL柠檬酸标准液于5个50 mL容量瓶中,加入超纯水至刻度。得到不同浓度的标准对照品混合溶液,在“1.3”的色谱条件下进样。
以峰面积为纵坐标Y,各组分的质量浓度(mg/L)为横坐标X,绘制标准曲线,标准曲线方程、线性范围、相关系数见表2。结果显示被测组分的峰面积与进样质量浓度呈良好的线性关系,且线性范围宽,该方法对有机酸检测显示了较高的灵敏度。
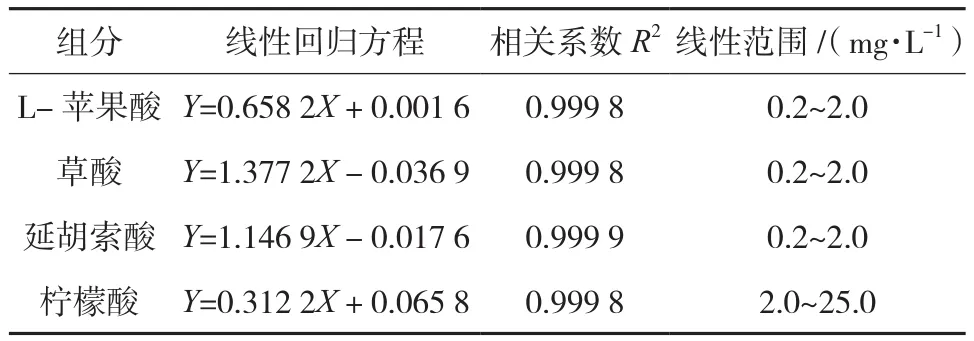
表2 4种有机酸的线性回归结果
3.3 精密度试验
取“2.2”项下的对照品混合溶液,在“1.3”的色谱条件下重复进样5次,计算各组分峰面积的相对标准偏差(RSD),L-苹果酸、草酸、延胡索酸、柠檬酸的RSD分别为0.47%、2.66%、1.23%、1.86%,表明该方法具有较好的精密度。
3.4 稳定性试验
精密称取样品0.2g,按照“1.2”方法制备供试液。在 0、2、4、8、12 h 进样 1 次,进样量 25 μL,L-苹果酸、草酸、延胡索酸和柠檬酸5次进样峰面积的RSD分别为0.82%,2.59%,2.51%,0.11%。表明乌梅提取液在12 h内基本稳定。
3.5 重复性试验
取同一样品,称取5份,精密称定,按照“1.2”方法制备供试液。进样量为25μL,L-苹果酸、草酸、延胡索酸和柠檬酸5次进样峰面积的RSD分别为1.03%,2.10%,2.05%,1.25%。表明该方法重复性良好。
3.6 样品测定结果
选用乌梅配方颗粒以及乌梅药材进行有机酸的测定,将乌梅配方颗粒以及乌梅药材按照“1.2”方法处理后测定,计算4种有机酸的含量。见表3。样品离子色谱图见图1。
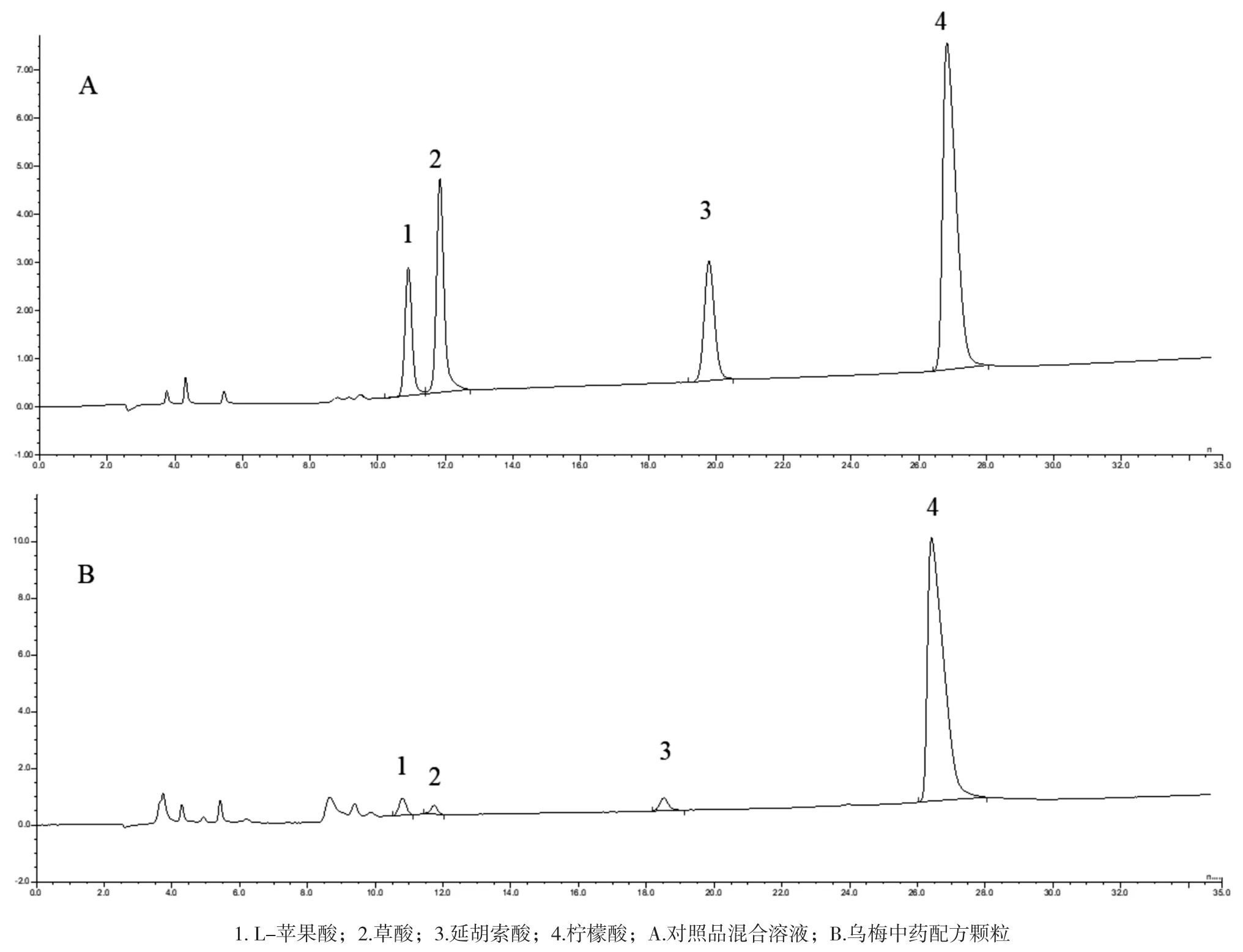
图1 各样品HPLC色谱图
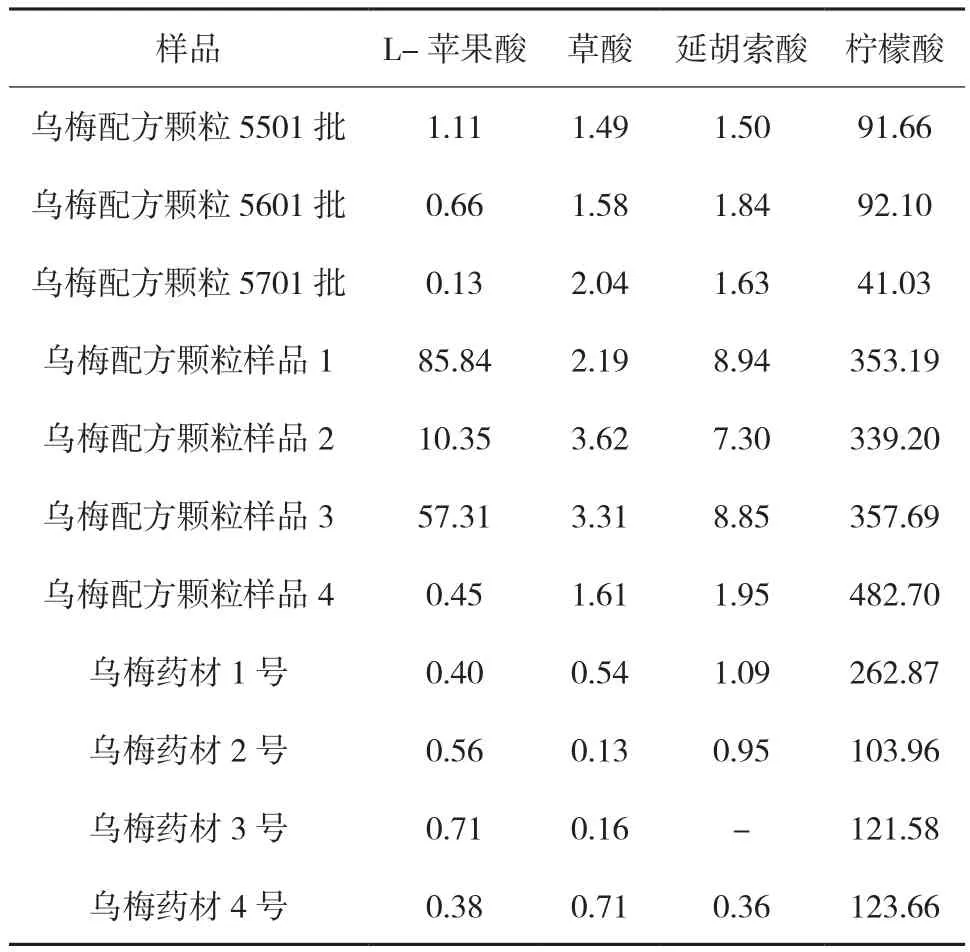
表3 4种有机酸的含量 mg/g
3.7 加样回收率试验
精密称取已知含量的种乌梅药材或中药配方颗粒样品0.1g,共6份,每份按1∶1分别准确加入“2.2”项下L-苹果酸、草酸、延胡索酸和柠檬酸对照品适量,按照“1.3”色谱条件进样测定,分别计算加样回收率。见表4。
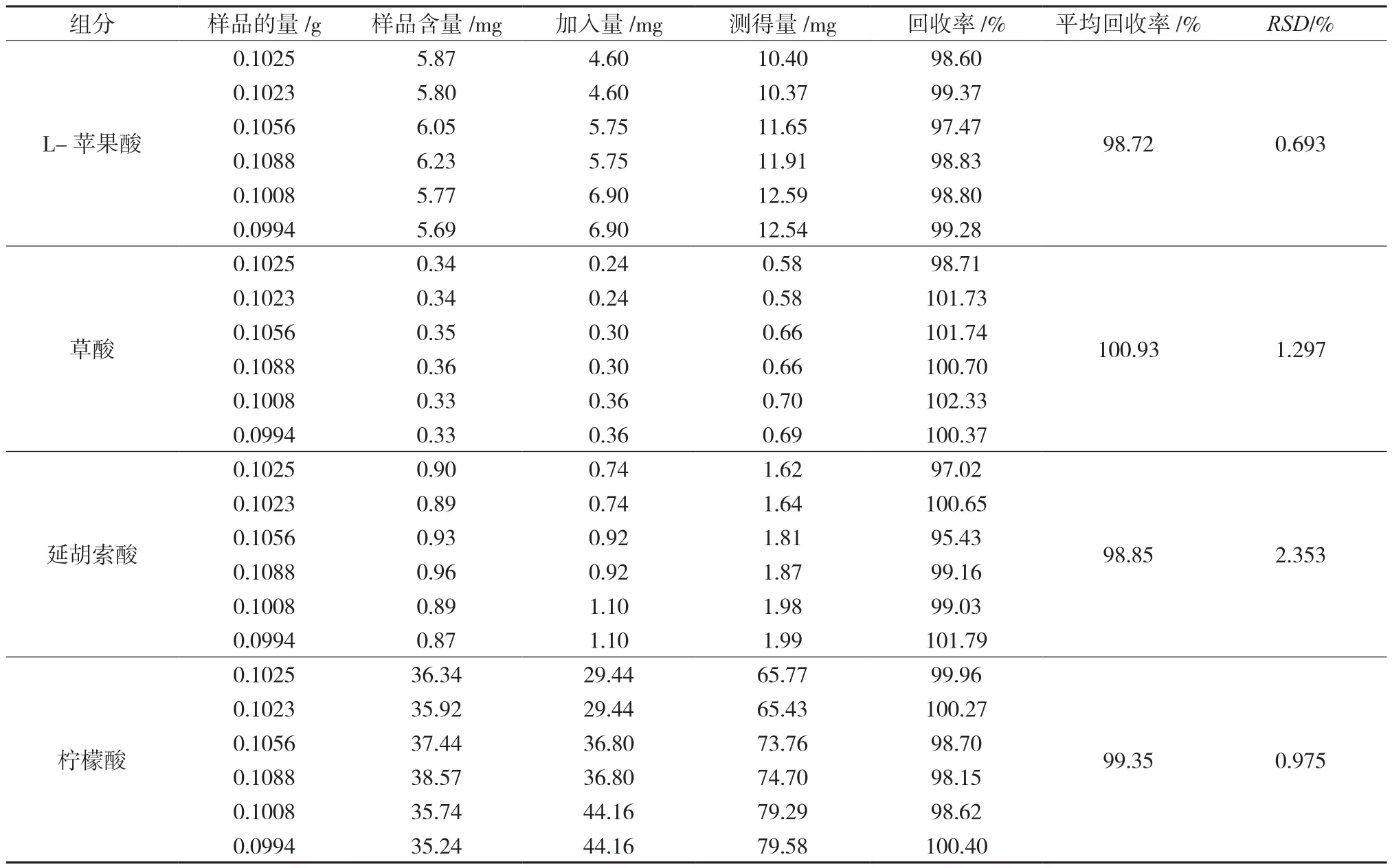
表4 4种有机酸的加样回收率(n=6)
4 讨论
结果表明,不同公司生产的乌梅配方颗粒以及不同产地的乌梅药材中4种有机酸含量差别很大,其中柠檬酸含量最高。该方法具有简单、快速、灵敏度高,适合于快速测定乌梅药材及配方颗粒中L-苹果酸、草酸、延胡索酸和柠檬酸含量,结合药理分离提取有效的有机酸成分,具有提高乌梅的使用效率以及研究阐明乌梅有机酸成分药理作用的机制等实际意义。该方法中L-苹果酸、草酸、延胡索酸和柠檬酸4种有机酸分离度良好,适合于快速测定乌梅、青梅等富含有机酸的药材及食材,能够为进一步开发乌梅等富含有机酸的药材及食材提供可靠的科学依据。
