肠复方逆转肠癌髓源性抑制细胞对CD8+ T细胞免疫功能抑制的机制研究
2022-06-16谭骏岚任丽芝龙梦铃林宏远
谭骏岚,任丽芝,龙梦铃,李 宁,林宏远,梁 慧
(1.湖南中医药大学,湖南 长沙 410208;2.湖南省肿瘤医院,湖南 长沙 410031)
结直肠癌是常见的消化道恶性肿瘤,其发病率仅次于肺癌及乳腺癌,排第三位,其病死率在女性中仅次于肺癌排第二位,在男性中仅次于肺癌及肝癌排第三位[1]。尽管近年来对结直肠癌患者全身治疗的疗效有所提升,但晚期患者的5年生存率仍只有12%~14%[2]。髓源性抑制细胞(myeloid-derived suppressor cells,MDSCs)是肿瘤微环境中关键的免疫抑制细胞,在对不同癌症患者的血清及肿瘤组织标本进行检测过程中均发现了MDSCs增多[3-4]。在结直肠癌中,MDSCs在患者的外周血及肿瘤组织中同样有着高表达[5],且MDSCs与病情进展存在正相关性[6]。对T细胞的显著抑制作用是MDSCs的重要特征,其中MDSCs可通过增强gp91phox、p47phox的表达分泌大量的活性氧(ROS)而抑制CD8+T细胞的免疫功能[7]。CD8+T细胞是机体抗肿瘤细胞免疫的关键效应细胞,可通过分泌免疫促进相关因子白细胞介素-2(IL-2)、γ-干扰素(IFN-γ)和行使细胞毒性作用来拮抗结直肠癌的发生发展。中医治疗结直肠癌在提高患者的生活质量、减轻放化疗毒副反应、缓解临床症状、调节免疫方面发挥了重要作用[8-10]。目前中药单体靶向MDSCs而发挥抗肿瘤作用已被证实[11-12],但针对复方及对肠癌MDSCs的相关研究开展较少。本课题组前期研究发现肠复方可以通过抑制小鼠外周血及瘤体MDSCs的增殖,提高肠癌小鼠体内CD8+T细胞的活性而发挥抗肿瘤效应[13]。本实验基于前期的实验基础,通过观察经肠复方含药血清干预后的肠癌MDSCs对CD8+T细胞免疫功能的影响,探究其可能的作用机制。
1 实验材料与方法
1.1动物 清洁级雌性SD大鼠20只,体重(200±20)g;SPF级BALB/c小鼠20只,雌性,5~6周龄,体重(20±2)g。大小鼠均购自湖南斯莱克实验动物有限公司,动物许可证号:SCXK(湘)2019-0004,在SPF级别下饲养于湖南省肿瘤医院动物实验中心,予以自由饮食饮水。
1.2细胞 结肠癌CT26细胞(编号:ZQ0190)购自中国科学院细胞库。
1.3药物 肠复方由党参10 g、黄芪30 g、白术15 g、茯苓10 g、陈皮10 g、薏苡仁30 g、莪术15 g、土鳖虫15 g、半枝莲30 g、百花蛇舌草30 g、壁虎12 g、甘草6 g等组成,所有中药购自湖南省肿瘤医院中药房,经湖南省肿瘤医院药学部中药鉴定员鉴定后使用。香菇菌多糖片(湖北广仁药业有限公司,规格:10 mg/片,批号:2003015)。
1.4实验试剂及仪器 胎牛血清(批号:040011ACS)购自美国Gibco公司;RPMI-1640培养基(批号:R8758500ML)购自美国Sigma公司;小鼠CD8+T细胞分选磁珠(批号:130104075)、小鼠MDSC细胞分选磁珠(批号:130094538)、Gr-1流式抗体-PE(批号:12593181)、LS分选柱(批号:130042401)均购自德国Miltenyi公司;CD11b流式抗体-FITC(批号:11011281)、CD8流式抗体-PE(批号:12008181)、Anti-CD3e(批号:16003182)、Anti-CD28(批号:16028182)购自美国eBioscience公司;IL-2(批号:KE1004)、IFN-γ(批号:KE1001)ELISA试剂盒,小鼠gp91phox一抗(批号:190131AP),小鼠β-actin一抗(批号:600081Ig),HRP标记的羊抗鼠二抗(批号:SA000011)购自美国Proteintech公司;小鼠p47phox一抗(批号:ab795)购自英国abcam公司;ROS检测试剂盒(批号:S0033)购自上海碧云天公司;低速离心机(SL02,上海知信实验仪器公司),流式细胞分析仪(A0011102,美国Beckman公司);直热式二氧化碳培养箱(DH160I,上海三藤仪器公司)蛋白质电泳仪(DYY6C)、转膜仪(DYCZ40D)均为北京六一生物科技公司产品;多功能酶标分析仪(MB530,深圳市汇松科技发展有限公司);台式高速冷冻离心机(H1650R,湖南湘仪实验室仪器开发有限公司)。
1.5实验方法
1.5.1细胞培养 常规复苏CT26细胞,将细胞培养于10%胎牛血清RPMI 1640培养液中,置于37 ℃、含5%的CO2培养箱内培养并传代。
1.5.2结肠癌荷瘤小鼠模型建立 取对数生长期的CT26细胞,用0.25%胰蛋白酶消化收集,使用PBS液配制成细胞密度为1×107/mL的单细胞悬液。用1.0 mL注射器,按照每只0.2 mL的量分别注射于BALB/C小鼠右腋皮下,建立小鼠结肠癌皮下移植瘤模型,正常饲养21 d,不予干预。
1.5.3模型小鼠脾脏MDSCs和外周血CD8+T细胞的分离纯化 乙醚吸入麻醉荷瘤小鼠,无菌操作摘取小鼠眼球采血,拉颈处死小鼠后,取脾脏并研磨,加无菌红细胞裂解液裂解红细胞,4 ℃下1 500 r/min离心10 min,去上清后加700 μL Buffe重悬细胞,调整细胞数为1×108个。加50 μL小鼠FcR抗体,4 ℃孵育10 min,随后加入CD11b-FITC混匀,室温避光孵育30 min。孵育后加入100 μL抗Gr-1抗体混匀,4 ℃孵育10 min。孵育结束后加5 mL Buffe洗涤,4 ℃下1 500 r/min离心10 min弃去上清。用800 μL buffer重悬细胞,加入200 μL免疫磁珠抗体,4 ℃孵育15 min。孵育后用10 mL Buffe重悬,4 ℃下1 500 r/min离心10 min后去上清。准备好磁珠分选器及操作台,将LS分离柱置于磁性分选器中,缓慢过柱,快过完柱时,用缓冲液冲洗LS分选柱,将在分选柱上的细胞快速用活塞推入离心管,收集细胞悬液,用台盼蓝染色鉴定MDSCs的活性,随后上机进行流式检测,Gr-1+CD11b+为 MDSCs细胞群。取小鼠新鲜外周血,用淋巴细胞分离液常规分离单个核细胞,40 μL buffer重悬细胞,调整细胞数为1×107个。加入CD8磁珠mAb混匀,4 ℃孵育15 min,过柱分选CD8+T细胞,余法同上,收集细胞悬液,用台盼蓝染色鉴定CD8+T细胞的活性,随后上机流式检测,CD8+为CD8+T细胞群。
1.5.4肠复方含药血清的制备 按照随机数字表法将20只SD大鼠随机分为模型组、香菇多糖组及肠复方高、中、低、剂量组,每组4只。采用人(60 kg)与大鼠(200 g)等效剂量计算,以60 kg人每日生药剂量为280 g计算,200 g大鼠给药剂量为25 g/kg,则肠复方高、低剂量组分别为50 g/kg和12.5 g/kg。大鼠给药量的标准为2 mL/100 g体重,因此每只大鼠每天给药4 mL,则肠复方高、中、低剂量组分别给予5 g/mL、2.5 g/mL、1.25 g/mL的肠复方液灌胃。香菇多糖组给予蒸馏水配成的0.37 mg/mL香菇多糖药液灌胃。模型组给予等体积的蒸馏水灌胃。各组每天灌胃2次,每次2 mL,连续7 d,灌胃前均禁食6 h。第7天末次灌胃1 h后,采用10%水合氯醛3 mL/kg腹腔麻醉大鼠,腹主动脉取血,1 000 r/min离心10 min收集血清,用0.22 μm微孔滤过器过滤血清,56 ℃水浴30 min灭活血清抗体及补体,于-20 ℃冰箱保存备用。
1.5.5流式检测MDSCs中ROS水平 将磁珠分选的MDSCs按1×105/100 μL每孔接种于24孔板中,分为空白血清组、香菇多糖组及肠复方低、中、高剂量组,分别添加相应血清培养基200 μL,置于37 ℃含5%的CO2培养箱内悬浮生长72 h。收集各组含药血清干预72 h后的MDSCs,1 500 r/min离心5 min收集细胞,PBS洗1次;按照1∶1 000用无血清培养液稀释DCFH-DA,稀释好的DCFH-DA加入细胞沉淀中重悬细胞,37 ℃避光孵育20 min,每3~5 min混匀1次,离心收集细胞沉淀,用无血清培养基洗涤细胞2次,用流式细胞仪、选择FITC通道检测,以平均荧光强度代表ROS水平高低。
1.5.6Western blot法检测MDSCs中gp91phox、p47phox蛋白表达情况 取各组含药血清干预后的MDSCs细胞裂解,于4 ℃下12 000 r/min离心15 min后提取蛋白,按照BCA蛋白定量试剂盒使用说明测定总蛋白浓度。临用前取蛋白总量相同的各样品5×SDS上样缓冲液混匀,沸水煮5 min,放入冰盒中速冷备用,随后上样于凝胶加样孔内在76 V恒定电压下电泳130 min。随后将蛋白转移至NC膜上,将膜浸入配制好的5%脱脂奶粉中,室温放置60 min,再将膜分别浸入对应一抗溶液(1∶1 000)中,4 ℃过夜,次日室温放置30 min。取出膜后用PBST洗3次,每次15 min,分别浸入用HRP标记的对应羊抗鼠IgG(1∶5 000)二抗溶液中,室温放置60 min后用PBST洗3次,每次10 min。使用ECL化学发光液与膜孵育,用滤纸吸尽液体,用塑封膜将膜包裹杂交膜,在暗盒内与X胶片曝光15 min;显影冲洗,用Quantity One专业灰度分析软件进行分析。
1.5.7ELISA法检测共培养体系上清液中IL2、IFN-γ水平 收集各组含药血清干预后的MDSCs,和CD8+T细胞1∶1共培养处理,同时加入anti-CD3(1 μg/mL)和anti-CD28(1 μg/mL)激活CD8+T细胞,培养72 h。4 ℃下离心后取上清液。按照ELISA试剂盒中的操作说明,检测各组上清液中IL-2、IFN-γ水平。
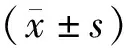
2 结 果
2.1分选后MDSCs的活性及纯度鉴定 肠癌小鼠分选后的MDSCs90%以上为活细胞,且纯度为91.35%。见图1及图2。

图1 肠癌小鼠髓源性抑制细胞活力检测台盼蓝染色情况(×100)

图2 肠癌小鼠髓源性抑制细胞纯度检测情况
2.2分选后CD8+T细胞的活性及纯度鉴定 肠癌小鼠分选后的外周血CD8+T细胞90%以上为活细胞,且纯度为99.78%。见图3及图4。

图3 肠癌小鼠外周血CD8+ T细胞活力检测台盼蓝染色情况(×100)

图4 肠癌小鼠外周血CD8+ T细胞纯度检测情况
2.3各组MDSCs中ROS水平比较 肠复方中、高剂量组MDSCs中ROS水平均明显低于空白血清组(P均<0.05),且肠复高剂量组明显低于肠复方中剂量组(P<0.05);香菇多糖组与肠复方低剂量组MDSCs中ROS水平虽较空白血清组有下降趋势,但差异均无统计学意义(P均>0.05)。见图5。

图5 空白血清组和各含药血清干预组肠癌髓源性抑制细胞中ROS水平
2.4各组MDSCs中gp91phox和p47phox蛋白表达情况比较 肠复方中、高剂量组MDSCs中gp91phox、p47phox蛋白表达量均明显低于空白血清组(P均<0.05),且肠复方高剂量组均明显低于肠复方中剂量组(P均<0.05);香菇多糖组、肠复方低剂量组MDSCs中gp91phox、p47phox蛋白表达量与空白血清组比较差异均无统计学意义(P均>0.05)。见图6及图7。

图6 空白血清组和各含药血清干预组肠癌髓源性抑制细胞中gp91phox及p47phox蛋白印迹

图7 空白血清组和各含药血清干预组肠癌髓源性抑制细胞中gp91phox及p47phox蛋白表达灰度值
2.5各组共培养体系上清液中IL-2、IFN-γ水平比较 香菇多糖组及肠复方低、中、高剂量组共培养体系中IL-2、IFN-γ水平均明显高于空白血清组(P均<0.05),且肠复方低、中、高剂量组均明显高于香菇多糖组(P均<0.05),肠复方高剂量组明显高于肠复方低、中剂量组(P均<0.05)。见表1。

表1 空白血清组和各含药血清干预组肠癌髓源性抑制细胞和CD8+ T细胞共培养体系上清液中IL-2、IFN-γ水平比较
3 讨 论
结直肠癌是我国高发恶性肿瘤之一,中医称之为“肠蕈”“肠澼”“锁肛痔”等。本课题组在长期临床实践中发现,“虚,湿,瘀,毒”并存是结直肠癌的核心病机特点,而虚、湿、瘀、毒等肿瘤病理因素与免疫状态的相关性也是中医药发挥抗肿瘤作用的重要方面。故根据结直肠癌的特点,以健脾益气扶正、祛湿化瘀解毒为基本法创立了肠复方作为治疗该病的专方。方中党参、白术、黄芪、甘草等健脾益气扶正,茯苓、陈皮、薏苡仁、莪术、白花蛇舌草等祛湿化瘀解毒,全方配伍攻补兼施,标本兼顾。
MDSCs是肿瘤免疫抑制微环境中的关键免疫抑制细胞,在肿瘤的发生发展及免疫逃逸中发挥重要作用。在各种人类癌症和小鼠肿瘤模型中发现MDSCs可以稳定产生高水平的ROS[14],ROS通过一系列反应生成过氧亚硝酸盐(PNT),PNT使与其接触的CD8+T细胞受体复合物的酪氨酸氮化,这一过程使CD8+T细胞与特异性多肽-主要组织相容性复体(pMHC)结合发生障碍从而诱导CD8+T细胞产生抗原特异性耐受[15],抑制机体抗肿瘤细胞免疫反应,介导肿瘤细胞的免疫逃逸。NADPH氧化酶亚基gp91phox和p47phox蛋白表达上调是肠癌MDSCs产生大量ROS的关键,因此抑制NADPH氧化酶亚基gp91phox和p47phox蛋白的表达而减少肠癌MDSCs中ROS的产生,将有可能提高结直肠癌患者体内CD8+T细胞的免疫效应,抑制肠癌细胞的生长,使患者生存期延长而达到临床获益。
本实验研究发现:与空白血清组相比,香菇多糖组与肠复方低剂量组MDSCs中ROS水平及gp91phox、p47phox蛋白表达量均无明显降低,肠复方中、高剂量组均明显降低,其中肠复方高剂量组降低更为明显。提示肠复方可以调控肠癌MDSCs的分泌功能,通过抑制gp91phox、p47phox蛋白的表达而降低肠癌MDSCs中ROS水平,并呈一定的浓度依赖性。这可能与肠复方中含有具有调控MDSCs的药物有关,如甘草有效成分甘草酸可降低MDSCs对环氧化酶2(COX2)、ARG1、iNOS等抑制性因子的生成[16]。莪术有效成分莪术果胶多糖可降低MDSCs的免疫抑制功能,促进CD8+T、CD4+T细胞活化[12]。陈皮有效成分油皮素可抑制MDSCs的增殖[17]。通过进一步将经药血清干预后的肠癌MDSCs与CD8+T细胞建立共培养体系,研究发现香菇多糖组及肠复方低、中、高剂量组中IL-2、IFN-γ水平均明显高于空白血清组,其中以肠复方高剂量组升高最为明显。说明香菇多糖可减弱MDSCs对CD8+T细胞抑制作用,但其作用不如肠复方强。本实验中肠复方低剂量没有显示出对MDSCs中gp91phox、p47phox蛋白表达和ROS水平的调控作用,但能在一定程度上调控肠癌MDSCs对CD8+T细胞抑制作用,分析原因可能是肠复方可能从多靶点调控MDSCs的功能,这也突显了中医药防治结直肠癌的特点与优势。
综上所述,肠复方含药血清可以减弱肠癌MDSCs对CD8+T细胞免疫功能的抑制作用,其机制可能与抑制gp91phox、p47phox蛋白表达而降低MDSCs中ROS水平相关。
利益冲突:所有作者均声明不存在利益冲突。
