黄芪甲苷对大鼠创伤性脑损伤后脑水肿、炎症反应、细胞凋亡的影响
2022-06-16李慧堂张岱男张新中金保哲李海明
李慧堂,张岱男,2,张新中,金保哲,肖 萌,李海明
(1.新乡医学院第一附属医院河南省神经修复重点实验室,河南 卫辉 453100;2.首都医科大学附属北京天坛医院,北京 100071)
创伤性脑损伤指由外部物理力量造成的正常大脑功能的破坏,其包括原发性损伤和继发性损伤,原发性损伤在撞击的瞬间发生,是不可逆的[1-2];继发性损伤为原发性损伤后导致脑组织缺氧缺血,发生氧化应激、脑水肿、炎症反应、细胞凋亡等[3],给予有效干预可逆转。有证据表明,继发性脑损伤在很大程度上决定了脑外伤患者的预后[4]。尽管随着时代的发展,在手术技术和术后管理方面取得了巨大进步,但结果仍不令人满意,需要能够促进创伤性脑损伤患者神经功能修复的新型药物。黄芪甲苷是从黄芪中提取的三萜皂苷,是黄芪的主要活性成分之一,具有清除自由基、抗炎、抗凋亡、促进血管新生、促神经修复等作用,是潜在的神经保护剂[5-8],但关于黄芪甲苷对创伤性脑损伤神经保护机制的报道很少。因此,本实验观察了黄芪甲苷对创伤性脑损伤后神经功能、脑水肿、炎症反应、细胞凋亡的影响,探讨其可能的作用机制。
1 实验材料与方法
1.1实验动物 选取120只2月龄SPF级雄性Sprague-Dawley(SD)大鼠,体重(200±20)g,购自济南朋悦实验动物繁育有限公司,质量合格证号:SCXK(鲁)20190003。在河南省神经修复重点实验室标准化动物饲养房饲养,动物饲养在清洁级条件下,自然昼夜照明,通风良好,温度(25±2)℃,湿度控制在(55±5)%,饲以国家标准啮齿类动物饲料,自由饮食水,所有大鼠自购买后适应性饲养7 d,检查无异常后再用于实验。
1.2主要试剂与仪器 黄芪甲苷(纯度≥98%)购自上海源叶生物科技有限公司;HE染色试剂盒、尼氏染色试剂盒购自索莱宝生物科技有限公司;ELISA试剂盒购自深圳市达科为生物工程有限公司;TUNEL试剂盒购自南京凯基生物科技发展有限公司;10%水合氯醛购自碧云天生物科技有限公司;大鼠自由落体打击器购自安徽正华生物仪器设备有限公司;医用显微手术颅钻购自上海光电技术有限公司;石蜡切片机购自上海华骏医疗器械有限公司;组织包埋机购自孝感市宏业医用仪器有限公司;4 ℃离心机购自赛默飞世尔科技公司;倒置荧光显微镜成像系统购自日本Nikon公司。
1.3分组、造模与干预方法 将120只SD大鼠随机分为假手术组、模型组和黄芪甲苷组,每组40只。模型组和黄芪甲苷组采用改良Feeney DM自由落体硬膜外撞击法造模:大鼠术前禁食8 h,腹腔注射10%水合氯醛(0.34 mL/100 g)麻醉后,顶枕部备皮,俯卧位将大鼠头部固定于打击器底座,消毒铺巾;沿矢状缝切开一长约3 cm纵向切口,逐步游离软组织及骨膜以暴露颅骨,在人字缝前2.0 mm、颅骨中线右侧旁2.0 mm处钻一直径为5 mm的圆形骨窗,保护硬膜完整;以50 g砝码,沿金属套管自20 cm的高处自由落体打击大鼠骨窗,造成大鼠右侧大脑半球创伤性脑损伤;造模成功后,压闭止血,骨蜡封闭骨窗,缝合头皮;假手术组只头皮切开、游离骨膜、钻开骨窗,不进行自由落体打击。术后6 h评估改良神经功能缺损严重程度评分(mNSS),>2分表明造模成功[9]。黄芪甲苷组于脑损伤后给予黄芪甲苷20 mg/(kg·d)腹腔注射,假手术组和模型组每天给予等量0.9%NaCl腹腔注射,直至处死。
1.4检测指标及方法
1.4.1神经功能缺损程度评分 由非参与本实验且经过评价学习的2名实验人员于造模后12 h、1 d、3 d、5 d、7 d对各组大鼠进行mNSS评分,mNSS评分包括运动(肌肉状态、异常运动)、感觉(视觉、触觉、本体感觉)、反射和平衡测试,总分为 0~18分,正常为0分,分值越高提示神经功能缺损越严重。
1.4.2脑含水量 分别于造模后12 h、1 d、3 d、5 d、7 d随机从各组中各取6只大鼠,用10%水合氯醛(0.34 mL/100 g)腹腔注射深度麻醉,于冰上快速断头取脑,电子分析天平称湿重,然后用滤纸吸除表面水分及血渍,统一标准重量锡纸包裹,置入100 ℃烘箱烘烤24 h取出,恢复到室温后称干重,反复称量至恒重(最后两次重量之差小于0.2 mg)。由非参与本实验且经过脑含水量测定学习的2名实验人员进行脑含水量测定,脑含水量=(湿重-干重)/湿重×100%。
1.4.3HE及尼氏染色脑组织病理观察 每组选取造模后3 d大鼠5只,以10%水合氯醛(0.34 mL/100 g)腹腔注射麻醉,用生理盐水和4%多聚甲醛心脏灌注后断头取脑,置于4%多聚甲醛中固定24 h。石蜡包埋切片,行HE和尼氏染色,镜下观察脑组织神经元细胞病理形态学。
1.4.4损伤灶及周围脑组织神经细胞凋亡情况切片获取方法同“1.4.3”,严格按TUNEL试剂盒说明步骤进行检测。在高倍镜下观察,凋亡神经元细胞呈现为不均一的红色,正常神经元细胞呈现为蓝色,以Image J软件计数视野内凋亡神经元细胞。凋亡率=阳性细胞数/(阳性细胞数+阴性细胞数)×100%。
1.4.5损伤灶及周围脑组织中炎症因子TNF-α、IL-6和IL-1β含量 每组选取造模后3 d大鼠5只,以10%水合氯醛(0.34 mL/100 g)腹腔注射麻醉,断头取出全脑,取损伤灶及边缘2 mm区域,按照脑湿重:生理盐水100 mg:0.9 mL的比例进行组织匀浆,经短暂超声处理,离心后取其上清液,采用ELISA法检测TNF-α、IL-6和IL-1β含量,严格按照ELISA试剂盒内所附说明书步骤进行操作。
2 结 果
2.1各组大鼠神经功能缺损mNSS评分比较 造模后12 h、1 d、3 d、5 d、7 d,模型组、黄芪甲苷组mNSS评分均明显高于同期假手术组(P均<0.05),且造模后12 h mNSS评分最高,此后逐渐降低;造模后12 h,黄芪甲苷组mNSS评分与模型组比较差异无统计学意义(P>0.05);造模后1 d、3 d、5 d、7 d,黄芪甲苷组mNSS评分均明显低于同期模型组(P均<0.05)。见表1。
表1 假手术组和脑损伤各组大鼠不同时间点神经功能缺损mNSS评分比较分)
2.2各组大鼠脑组织含水量比较 造模后12 h、1 d、3 d、5 d、7 d,模型组、黄芪甲苷组脑组织含水量均明显高于同期假手术组(P均<0.05),且造模后3 d脑组织含水量达到峰值,之后逐渐降低;造模后12 h、1 d,黄芪甲苷组脑组织含水量与模型组比较差异均无统计学意义(P均>0.05);造模后3 d、5 d、7 d,黄芪甲苷组脑组织含水量均明显低于同期模型组(P均<0.05)。见表2。
表2 假手术组和脑损伤各组大鼠不同时间点脑组织含水量比较
2.3各组大鼠脑组织病理表现 造模3 d后,HE染色显示:假手术组脑组织结构完整,细胞形态规则,排列有序,核仁清晰可见,胞浆染色均匀;模型组脑组织细胞胞体肿胀,形态不规则,部分胞核皱缩,血管扩张,并可见炎性细胞浸润;与模型组比较,黄芪甲苷组脑组织细胞肿胀数目减少且程度较轻,间隙变小,胞体及核仁皱缩数目下降,仅个别血管扩张,可见少量炎性细胞浸润。大脑皮质神经元尼氏染色显示:假手术组神经元细胞排列有序,形态规则,尼氏体染色均匀、清晰,且数量较多;模型组损伤灶及周围脑组织神经元细胞排列紊乱,神经元数量明显减少,并可见坏死及胞核固缩;与模型组比较,黄芪甲苷组神经元细胞数量及尼氏体数量明显增加,正常形态细胞稍多,神经元损伤较轻。见图1。

图1 假手术组和脑损伤各组大鼠脑损伤后3 d脑组织病理表现(×400)
2.4各组大鼠神经细胞凋亡情况 造模3 d后,假手术组大鼠脑组织神经元凋亡较少,神经细胞凋亡率为(11.52±2.16)%;模型组及黄芪甲苷组大鼠脑组织神经元细胞凋亡明显,神经细胞凋亡率分别为(76.77±5.20)%、(61.48±4.29)%,均明显高于假手术组(P均<0.05),但黄芪甲苷组神经细胞凋亡率明显低于模型组(P<0.05)。TUNEL染色表现见图2。

图2 假手术组和脑损伤各组大鼠脑损伤后3 d损伤灶周围脑组织细胞凋亡情况(×400)
2.5各组大鼠脑组织中TNF-α、IL-6、IL-1β含量比较 造模3 d后,模型组和黄芪甲苷组大鼠损伤灶及周围脑组织中TNF-α、IL-6、IL-1β含量均明显高于假手术组(P均<0.05),但黄芪甲苷组各指标均明显低于模型组(P均<0.05)。见图3。
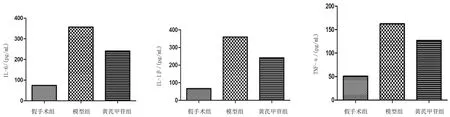
图3 假手术组和脑损伤各组大鼠脑损伤后3 d脑组织中TNF-α、IL-6、IL-1β含量
3 讨 论
创伤性脑损伤是一个重要的公共卫生问题,其发生率约为5 000万人次/年,在中国,脑损伤死亡率约为13/10万人[10]。创伤性脑损伤除了损伤后立即由机械力造成的原发损伤外,脑损伤还可促进脑组织的延迟死亡,即继发性损伤[11]。如何有效阻止创伤性脑损伤后的脑水肿、氧化应激、炎症损伤、细胞凋亡等继发性损伤对神经功能恢复具有重要意义。
黄芪甲苷是一种羊毛脂-醇型四环三萜皂甙,具有多种生物活性,在我国使用已久,无明显的肝肾毒性作用[12]。本研究通过建立创伤性脑损伤大鼠模型,探讨了黄芪甲苷对创伤性脑损伤的保护作用及可能机制。创伤性脑损伤导致一系列细胞外和细胞间事件,包括炎症细胞的浸润,神经元和胶质细胞的破坏,神经元功能障碍和死亡。神经细胞和神经胶质细胞是组成神经组织的基本组成成分,而尼氏体为神经元合成蛋白质的主要场所,与神经元功能的发挥联系密切[13]。当神经元变性死亡时,尼氏体可出现数量及位置的变化,甚至溶解,因此尼氏体的数量可以反映神经元胞体损伤情况[14]。本实验结果显示,黄芪甲苷干预后各时间点大鼠mNSS评分均较低(黄芪甲苷干预12 h差异不明显考虑与药物作用时间较短有关),并随损伤时间延长明显降低。对大鼠脑组织进行HE及尼氏染色发现,颅脑损伤后脑组织细胞胞体肿胀,神经元可见核固缩、坏死,同时细胞数量明显减少,形态不规则,排列紊乱,血管扩张,并可见炎性细胞浸润;黄芪甲苷干预后,脑组织细胞肿胀数目减少且程度减轻,神经元细胞数量、尼氏体数量增多,神经元损伤较轻。说明黄芪甲苷可以改善神经功能缺损,减轻神经细胞损伤,促进神经修复。
脑水肿是脑组织对创伤性脑损伤的一种病理生理反应,其病理改变主要是由于脑细胞代谢紊乱、血脑屏障受损、组织液循环障碍、炎症反应等所致。脑水肿会引起细胞胞体肿胀,改变脑组织细胞代谢物浓度,导致能量代谢障碍,引起颅内压迅速增加,导致大脑功能障碍。本实验结果显示,模型组和黄芪甲苷组脑组织含水量显著升高,创伤后3 d脑组织含水量达到峰值,之后逐渐下降,与脑损伤后由血脑屏障破坏引起的脑组织水肿恰恰在损伤后 48~72 h达到高峰[15]相一致;且与模型组比较,黄芪甲苷组脑含水量更低(黄芪甲苷干预12 h、1 d与模型组比较差异不明显考虑与药物作用时间较短有关)。说明黄芪甲苷能够减轻脑损伤后血脑屏障的破坏,降低毛细血管通透性,减轻脑水肿。
细胞凋亡在创伤性脑损伤后脑组织继发性损伤中扮演着重要角色,其特征是细胞萎缩、染色质浓缩、DNA降解和碎裂及细胞分裂成凋亡小体,随后被吞噬细胞吞噬和降解[16]。细胞凋亡的调控在保护神经元和改善认知方面起着重要作用[17]。以往研究表明,细胞凋亡主要有两种信号通路,即内源性(线粒体)信号通路和外源性(死亡受体)信号通路[18],内源性凋亡刺激因子(Cyt C)、外源性死亡配体(Bcl-2家族蛋白)和下游Caspase家族成员(Capase-3、Capase-7、Capase-9)最终激活线粒体途径[19]。另外,越来越多的研究表明自噬也与细胞凋亡密切相关。黄芪甲苷可能通过抑制死亡受体途径和线粒体途径中关键因子的激活以及调节自噬来减轻细胞凋亡[6,20]。本实验结果显示,创伤性脑损伤后大鼠脑组织神经元细胞凋亡明显,黄芪甲苷干预后神经细胞凋亡率明显降低,证实黄芪甲苷可以通过抑制细胞凋亡来减轻创伤性脑损伤后继发性损伤。
创伤性脑损伤后的炎症反应机制为脑组织缺氧缺血及细胞炎症因子释放进入中枢神经组织。细胞炎症因子具有广泛活性,可进一步导致血脑屏障破坏、神经细胞死亡等,从而加重了脑水肿、中枢神经系统损伤[21]。由星形胶质细胞和小胶质细胞分泌的促炎细胞因子如TNF-α、IL-6、IL-1β,广泛存在于病变部位,是有效评估创伤性脑损伤患者炎症反应的指标。本实验结果显示,模型组脑组织中TNF-α、IL-6、IL-1β含量较假手术组明显增高,表明颅脑损伤使抗炎能力减弱,促进神经损伤;黄芪甲苷组IL-6、IL-1β、TNF-α含量明显低于模型组,提示黄芪甲苷可提高创伤性脑损伤大鼠的抗炎能力,从而产生神经保护作用。
综上所述,黄芪甲苷具有明显神经保护作用,其可能通过减轻脑组织水肿和神经细胞损伤、抑制细胞凋亡及中枢性炎症反应减轻创伤性脑损伤后继发性损伤。
利益冲突:所有作者均声明不存在利益冲突。
