黄芩苷对挤压综合征大鼠急性肾损伤的保护作用机制研究
2022-06-16邢兆国王彦志贾东昭李琦军
邢兆国,王彦志,贾东昭,李琦军
(石家庄市第三医院,河北 石家庄 050011)
挤压综合征主要发生在地震、滑坡和交通事故等创伤性事件后,长时间压迫缺血的骨骼肌一旦再灌注,会导致横纹肌溶解症(肌细胞分解)。除了局部效应外,还可导致急性呼吸窘迫综合征、急性肾损伤、循环性休克、全身炎症反应综合征、多器官衰竭和混杂的晚期症状引起的全身衰竭,急性期病死率高[1-2]。液体疗法是挤压综合征的一线治疗方法,通过早期输液可以预防休克和急性肾衰竭,使用含碳酸氢钠的生理盐水可有效治疗急性肾衰竭导致的高钾血症[3],但这些措施很难防止缺血再灌注损伤后炎症的发生。黄芩苷是从黄芩根中分离得到的一种天然黄酮,具有抗炎、抗氧化和抗凋亡作用[4-5]。近年研究证实黄芩苷可防止急性肾损伤,其作用机制可能与一氧化氮(NO)有关[6-8]。本研究复制挤压综合征大鼠模型,探讨了黄芩苷是否通过损伤肌肉中内皮型一氧化氮合酶(eNOS)激活机制影响线粒体功能障碍而发挥保护作用。
1 实验材料与方法
1.1实验动物 雄性SPF级SD大鼠120只,体重250~300 g,由河北医科大学实验动物中心提供,动物合格证号:SCXK(冀)2018-1-05。将大鼠安置在温度为(23±3)℃、相对湿度为(55±15)%的房间中,光照/阴暗周期为12∶12 h,可自由获取食物和水。
1.2实验仪器与药品 PowerLab数据采集系统(AD Instruments,日本名古屋),Celltac血液分析仪(日本东京日本高登公司),大鼠白细胞介素-1β(IL-1β)ELISA试剂盒、大鼠肿瘤坏死因子-α(TNF-α)ELISA试剂盒、大鼠TIM-1/KIM-1/HAVCR ELISA试剂盒(R&D公司,美国明尼苏达州),髓过氧化物酶(MPO)(Abcam公司,美国),超氧化物歧化酶(SOD)分析试剂盒-WST(Dojindo实验室,日本东京),线粒体分离试剂盒(Thermo Fisher科技公司,日本神奈川),JC-1线粒体膜电位分析试剂盒(Cayman化学公司,美国),eNOS抗体、磷酸化eNOS(p-eNOS)抗体(Ser1177)、诱导型一氧化氮合酶(iNOS)抗体与β-actin抗体(Cell Signaling公司,日本东京),血红素氧化酶(HO)-1抗体(Thermo Fisher科技公司,美国),黄芩苷(Sigma Aldrich公司,美国)。
1.3动物分组与造模方法 将大鼠随机分为假手术组、模型组、生理盐水组、生理盐水+黄芩苷组,每组30只。假手术组麻醉后不做任何处理;其余组大鼠腹腔注射戊巴比妥钠(50 mg/kg)进行麻醉后,参考文献[9]建立挤压综合征模型:将2.0 kg的金属圆筒绑在大鼠的双侧后肢上,应用橡胶止血带缠绕5次,并将带子的末端粘上。压迫5 h后,切断绷带,取下止血带,解除压迫。生理盐水组和生理盐水+黄芩苷组用橡皮止血带减压,然后立即分别进行1,3,6,24 h再灌注,以30 mL/(kg·h)的速度进行大量液体复苏,生理盐水+黄芩苷组同时给予黄芩苷20 mg/kg静滴。
1.4观察项目及方法
1.4.1平均动脉压(MAP) 使用PowerLab数据采集系统记录地图,计算各组大鼠再灌注后0,1,3,6,24 h的MAP。
1.4.2血液生化参数 各组分别于再灌注后0,1,3,6,24 h从颈静脉采集静脉血并离心,测量血钾(K+)和肌酸磷酸激酶(CPK)水平。使用Celltac血液分析仪(日本东京日本高登公司)测量血细胞比容(Hct)。
1.4.3细胞因子水平 采用ELISA法检测各组再灌注后0,1,3,6,24 h血清IL-1β和TNF-α水平。
1.4.4肾脏功能 利用PE-50进行膀胱插管,从减压前1 h开始直到减压后立即(0 h)采集尿样,每1 h采集1次,持续24 h,并在20~25 ℃下以1 500×g离心5 min,根据试剂盒说明测定N-乙酰-β-D-氨基葡萄糖苷酶(NAG)水平,采用ELISA法测定尿液中肾损伤因子-1(KIM-1)水平(采用尿肌酐校正)。同时检测各组再灌注后0,1,3,6,24 h血清NAG水平。
1.4.5硝酸盐水平 参考文献[10]的方法,使用专用的HPLC系统(ENO-20,Eicom,京都,日本)测定损伤肌肉(腓肠肌)中亚硝酸盐(NO2-)、硝酸盐(NO3-)含量。
1.4.6MPO、SOD活性及活性氧(ROS)含量和线粒体功能 分别于再灌注后0,1,3,6,24 h取各组大鼠损伤腓肠肌组织,测定MPO、SOD活性及硫代巴比妥酸反应产物(TBARS)含量(反映ROS产生情况),同时测量各时间点血液中MPO活性;利用线粒体分离试剂盒分离肌肉中的线粒体,使用JC-1线粒体膜电位分析试剂盒评估线粒体膜电位(即线粒体内膜功能);使用Quantikine®cyt c免疫分析法(R&D公司)测量损伤肌肉细胞质(不包括线粒体)中细胞色素C(Cyt C)含量评估线粒体外膜功能。所有操作程序均按照相应的说明手册执行。
1.4.7损伤肌肉组织中eNOS、p-eNOS、iNOS、HO-1表达情况 采用Western blot法检测:取各组大鼠损伤肌肉组织,匀浆并离心,用SDS-PAGE分离裂解液中的蛋白质。分别使用抗eNOS、p-eNOS、iNOS、HO-1、β-actin抗体检测膜上的蛋白质。然后使用结合辣根过氧化物酶的二抗(Pierce Biotechnology)和增强化学发光检测系统(Pierce生物科技公司)观察蛋白质条带。

2 结 果
2.1各组大鼠MAP及血清K+、CPK、Hct比较 模型组大鼠再灌注1,3,6,24 h的MAP均明显低于假手术组(P均<0.05),血清K+、CPK和Hct均明显高于假手术组(P均<0.05),且血清K+、Hct再灌注6 h最高,CPK再灌注3 h最高。生理盐水组和生理盐水+黄芩苷组再灌注1,3,6,24 h的MAP均明显高于模型组(P均<0.05),血清K+、CPK和Hct均明显低于模型组(P均<0.05),生理盐水+黄芩苷组再灌注6 h血清K+和再灌注3,6 h CPK水平均明显低于生理盐水组(P均<0.05)。见图1。

图1 假手术组和挤压损伤综合征各组大鼠再灌注后各时间点MAP及血清K+、CPK、Hct
2.2各组大鼠血清IL-1β、TNF-α水平比较 模型组大鼠再灌注1,3,6,24 h的血清IL-1β、TNF-α水平均明显高于假手术组(P均<0.05),且再灌注6,24 h的血清IL-1β水平和3,6,24 h的血清TNF-α水平均明显高于再灌注1 h(P均<0.05)。生理盐水组和生理盐水+黄芩苷组再灌注1,3,6 h的血清IL-1β、TNF-α水平及生理盐水+黄芩苷组再灌注24 h的血清IL-1β水平均明显低于模型组(P均<0.05),生理盐水组与生理盐水+黄芩苷组比较差异均无统计学意义(P均>0.05)。见图2。

图2 假手术组和挤压损伤综合征各组大鼠再灌注后各时间点血清IL-1β、TNF-α水平
2.3各组大鼠尿液与血浆中NAG水平和KIM-1/Cr比较 再灌注0,1,3,6 h,各组大鼠尿液中NAG水平、KIM-1/Cr比较差异均无统计学意义(P均>0.05);再灌注24 h,模型组尿液中NAG水平、KIM-1/Cr均明显高于假手术组(P均<0.05),且再灌注6 h和24 h血浆中NAG水平均明显高于假手术组(P均<0.05)。再灌注24 h,生理盐水组、生理盐水+黄芩苷组尿液中NAG水平和生理盐水+黄芩苷组血浆中NAG水平、KIM-1/Cr均明显低于模型组(P均<0.05)。见图3。

图3 假手术组和挤压损伤综合征各组大鼠再灌注后各时间点尿液与血浆中NAG水平及KIM-1/Cr
2.4各组大鼠肌肉组织中NO2-与NO3-含量比较再灌注0,1,3 h,模型组损伤肌肉组织中NO2-和NO3-含量均明显低于假手术组(P均<0.05),而再灌注24 h均明显高于假手术组(P均<0.05)。生理盐水组再灌注各时间点损伤肌肉组织中NO2-和NO3-含量与模型组比较差异均无统计学意义(P均>0.05);生理盐水+黄芩苷组再灌注1,3 h损伤肌肉组织中NO2-和NO3-含量与假手术组比较差异均无统计学意义(P均>0.05),再灌注6,24 h损伤肌肉组织中NO2-和NO3-含量均明显低于模型组(P均<0.05),且再灌注24 h NO3-含量明显低于生理盐水组(P<0.05)。见图4。

图4 假手术组和挤压损伤综合征各组大鼠再灌注后各时间点损伤肌肉组织中NO2-与NO3-含量
2.5各组大鼠肌肉组织和血液中MPO活性及肌肉组织中SOD活性、TBARS、JC-1与细胞浆中Cyt C含量比较 模型组再灌注6,24 h肌肉组织中MPO活性和再灌注3,6,24 h血液中MPO活性均明显高于假手术组(P均<0.05),生理盐水+黄芩苷组均明显低于模型组(P均<0.05),生理盐水组仅肌肉组织中MPO活性明显低于模型组(P均<0.05)。再灌注3,6 h,模型组肌肉组织中SOD活性明显低于假手术组(P均<0.05),TBARS水平明显高于假手术组(P均<0.05);生理盐水组SOD活性与模型组比较差异均无统计学意义(P均>0.05),TBARS水平明显低于模型组(P均<0.05);生理盐水+黄芩苷组SOD活性明显高于模型组(P<0.05),TBARS水平明显低于模型组(P<0.05),但与生理盐水组比较差异均无统计学意义(P均>0.05)。再灌注1,3,6,24 h,模型组JC-1荧光强度均明显低于假手术组(P均<0.05),细胞质中Cyt C含量均明显高于假手术组(P均<0.05);生理盐水组JC-1荧光强度与模型组比较差异均无统计学意义(P均>0.05),细胞质中Cyt C含量均明显低于模型组(P均<0.05);生理盐水+黄芩苷组JC-1荧光强度均明显高于模型组(P均<0.05),细胞质中Cyt C含量均明显低于模型组(P均<0.05)。见图5。
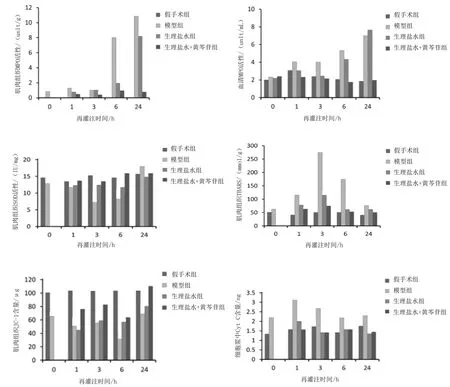
图5 假手术组和挤压损伤综合征各组大鼠再灌注后各时间点肌肉组织和血清中MPO活性及肌肉组织中TBARS、SOD活性、JC-1与细胞浆中Cyt C含量
2.6各组大鼠肌肉组织中p-eNOS、iNOS、HO-1表达情况比较 再灌注1,3 h,假手术组、模型组、生理盐水组损伤肌肉组织中p-eNOS/eNOS和iNOS、HO-1相对表达量比较差异均无统计学意义(P均>0.05),生理盐水+黄芩苷组p-eNOS/eNOS表达量均明显高于模型组(P均<0.05)。模型组再灌注24 h损伤肌肉组织中 p-eNOS/eNOS表达量和再灌注6,24 h的iNOS、HO-1相对表达量均明显高于假手术组(P均<0.05),生理盐水+黄芩苷组均明显低于模型组(P均<0.05),生理盐水组有降低趋势,但与模型组比较差异均无统计学意义(P均>0.05)。见图6。

图6 假手术组和挤压损伤综合征各组大鼠再灌注后各时间点肌肉组织中p-eNOS、iNOS、HO-1表达情况
3 讨 论
肾损伤所致肾衰竭是挤压综合征的严重并发症,可由循环休克、肾小动脉血管收缩、肌红蛋白在肾小管内沉积或代谢性酸中毒(尿酸度)引起[11-12],且肌红蛋白在肾小管内沉积会导致氧化损伤[13]。目前临床主要使用含生理盐水和碳酸氢盐的液体来预防挤压综合征引起的高钾血症和循环性休克,维持尿液pH值在6.5以上以防止肌红蛋白的管内沉积[14],必要时需要肾脏替代治疗,但患者的病死率仍较高。本实验探讨了黄芩苷保护肾损伤的机制,以为其临床应用提供可靠依据。
本实验结果显示,模型组大鼠再灌注1,3,6,24 h的MAP均明显低于假手术组,血清K+、CPK和Hct均明显高于假手术组,且血清K+、Hct再灌注6 h最高,CPK再灌注3 h最高;生理盐水组和生理盐水+黄芩苷组各时间点的MAP均明显高于模型组,血清K+、CPK和Hct均明显低于模型组,且生理盐水+黄芩苷组再灌注6 h血清K+和再灌注3,6 h CPK水平均明显低于生理盐水组。提示黄芩苷干预可改善血压,预防高钾血症的发生,机制可能与降低CPK水平,减少肌肉损伤,促进肾排泄K+和细胞摄取K+有关。
挤压综合征肾损伤的发生与炎症反应密切相关,IL-1β、TNF-α过度表达会加剧肾损伤。尿酸氮、肌酐是评估肾功能的常用指标,但肾损伤早期这些指标变化不明显。NAG是肾近曲小管上皮细胞中的一种溶酶体酶,在肾小管受损时可被释放,尿液和血清液中均可以检测到,但血液中含量明显低于尿液中含量[15]。KIM-1是肾近曲小管上皮细胞一种跨膜糖蛋白,急性肾损伤时其在受损后再生的近曲小管上皮细胞中表达增多。本实验结果显示,模型组大鼠再灌注1,3,6,24 h的血清IL-1β、TNF-α水平均明显升高,且随着时间推移逐渐增高;生理盐水组和生理盐水+黄芩苷组各时间点的血清IL-1β、TNF-α水平均明显低于模型组。再灌注0~6 h,各组大鼠尿液中NAG水平、KIM-1/Cr变化不明显,再灌注24 h明显升高,血浆中NAG水平再灌注6 h和24 h均明显升高。再灌注24 h,生理盐水组、生理盐水+黄芩苷组尿液中NAG水平和生理盐水+黄芩苷组血浆中NAG水平、KIM-1/Cr均较模型组明显降低。提示黄芩苷可抑制炎症因子过度表达,从而减轻炎症损伤,保护肾功能。临床中由于挤压综合征肾损伤患者出现无尿,采集尿样比采血更困难,故可通过检测血NAG用于评估肾损伤情况。
挤压综合征再灌注后会出现肌细胞溶解后的线粒体功能障碍,在缺氧缺血条件下,线粒体功能障碍会使ROS大量生成,导致氧化损伤,血浆中氧化应激标志物MPO与SOD活性增强[16],Cyt C泄漏到细胞质[17]。NO是一种重要的调节因子,可抑制白细胞黏附[18]、细胞间黏附分子和p-选择素的表达[19],其可作为氧自由基清除剂保护线粒体[20]。挤压的局部肌组织中eNOS和iNOS表达上调,NO生成增加,肌肉组织中NO2-与NO3-含量也相应增多,NO参与挤压综合征引起的肾脏损伤[21]。HO-1由NF-κB诱导生成,在缺血再灌注损伤后具有细胞保护作用[22]。本实验结果显示,再灌注0,1,3 h,模型组损伤肌肉组织中NO2-和NO3-含量均明显降低,再灌注24 h均明显升高;生理盐水组再灌注各时间点NO2-和NO3-含量与模型组比较变化不明显,生理盐水+黄芩苷组再灌注6,24 h NO2-和NO3-含量均明显低于模型组。模型组再灌注6,24 h肌肉组织中MPO活性和再灌注3,6,24 h血液中MPO活性均明显升高,生理盐水+黄芩苷组均明显低于模型组,生理盐水组仅肌肉组织中MPO活性明显低于模型组。再灌注3,6 h,模型组肌肉组织中SOD活性明显降低,TBARS水平明显升高;生理盐水组SOD活性与模型组比较变化不明显,TBARS水平明显低于模型组;生理盐水+黄芩苷组SOD活性较模型组高,TBARS水平较模型组低,但与生理盐水组比较差异不明显。再灌注1,3,6,24 h,模型组JC-1荧光强度均明显降低,细胞质中Cyt C含量明显升高;生理盐水组JC-1荧光强度与模型组比较差异不明显,生理盐水+黄芩苷组均明显高于模型组;生理盐水组和生理盐水+黄芩苷组细胞质中Cyt C含量均明显低于模型组。再灌注1,3 h,假手术组、模型组、生理盐水组损伤肌肉组织中p-eNOS/eNOS和iNOS、HO-1相对表达量均无明显变化,生理盐水+黄芩苷组p-eNOS/eNOS表达量均明显高于模型组;模型组再灌注24 h损伤肌肉组织中 p-eNOS/eNOS表达量和再灌注6,24 h的iNOS、HO-1相对表达量均明显升高,生理盐水+黄芩苷组均较模型组低。提示再灌注后损伤肌肉存在SOD活性降低和线粒体功能紊乱,黄芩苷干预未显示出直接清除自由基的能力,但可通过改善线粒体膜电位和线粒体外膜功能来防止线粒体损伤,可激活eNOS的抗自由基作用,减轻氧化损伤。生理盐水+黄芩苷组HO-1相对表达量降低,其原因可能是缺血再灌注损伤后HO-1蛋白表达受到抑制。
综上所述,黄芩苷可能通过改善挤压综合征肌细胞溶解后的线粒体功能障碍,抑制炎症反应来发挥肾脏保护作用。
利益冲突:所有作者均声明不存在利益冲突。
