活血消瘿方含药血清对脂多糖诱导的甲状腺滤泡上皮细胞炎性损伤、凋亡及JAK2/STAT3通路的影响*
2022-11-07左新河
裴 迅,左新河,赵 勇,李 扬,付 畅
(湖北省中医院/湖北中医药大学附属医院/湖北省中医药研究院,湖北 武汉 430074)
结节性甲状腺肿以甲状腺肿大伴结节为主要表现,多在弥漫性肿大的基础上发生,为弥漫性肿大的晚期表现[1]。近年来其发病有明显上升趋势,虽然多为良性结节,但由于患者一方面担心结节继续增大而引起压迫症状需要接受手术治疗,另一方面担心其恶变,给患者的生活带来了困扰,严重影响患者的生活质量[2]。因此,控制结节的增大及阻止其向恶性转化成为当前内科治疗的关键。中医学将结节性甲状腺肿归于“瘿病”范畴,认为痰瘀、气滞是其主要病理因素[3]。湖北省陈氏中医瘿病学术流派代表性传承人陈如泉教授所拟中药复方制剂活血消瘿方,是活血化痰、消瘿散结治法的代表方,用以治疗结节性甲状腺肿,临床疗效确切[4-5],然而其具体的作用机制尚不完全清楚。脂多糖(lipopolysaccharide,LPS)也被称为内毒素,是革兰氏阴性菌细胞壁的主要成分,是诱导上皮细胞炎性损伤的炎性启动子[6-7]。因此,本研究将构建LPS诱导的TFECs损伤模型,观察活血消瘿方含药血清对TFECs损伤模型细胞形态及凋亡情况的影响,并探讨其作用机制是否与Janus激酶2(Janus kinase2,JAK2)/信号转导和转录激活因子3(signal transducer and activator of transcription 3,STAT3)通路有关,旨在为结节性甲状腺肿的中医治疗提供新的思路和实验依据。
1 材 料
1.1 实验动物6~8周SPF级SD雄性大鼠30只,体质量140~160 g,购自湖北省实验动物研究中心,动物许可证号:SCXK(鄂)2015-0018。所有大鼠均在本院动物实验中心实验室集中分笼饲养,5只/笼,饲养环境为恒温(20℃)、恒湿(50%)、12/12 h循环,自由饮食饮水,生长良好。本研究经本院动物伦理委员和医学实验动物管理委员会批准,遵循3R原则处理实验动物。
1.2 药物与试剂 活血消瘿方由蜣螂虫、土鳖虫、蜈蚣、桃仁、莪术、猫爪草、王不留行、柴胡等组成,上述药材均由本院药剂科提供;LPS(批号:L5293)购自Sigma-Aldrich公司;优甲乐(左甲状腺素钠片)(批号:H20140052)购自德国默克公司;MTT试剂(批号:ST1537)购自上海碧云天公司;甲状腺球蛋白(Tg)抗体(批号:ab156008)、JAK2抗体(批号:ab32101)、p-JAK2抗体(批号:ab32101)、STAT3抗体(批号:ab68153)、p-STAT3抗体(批号:ab267373)、半胱氨酸天冬氨酸蛋白酶-8抗体(Caspase-8)(批号:ab32397)、Caspase-3抗体(批号:ab32351)、B淋巴细胞瘤-2抗体(Bcl-2)(批号:ab32124)、Bax抗体(批号:ab32503)、p53抗体(批号:ab26)均购自美国Abcam公司;BCA蛋白定量试剂盒(批号:GK10009)购自美国Glpbio公司;胰蛋白酶(批号:E020)购自上海如吉生物公司。1.3主要仪器SMZ745型光学显微镜(日本尼康公司);DYCZ-24EN型蛋白电泳仪、170-3940型Trans-Blot SD半干转印槽转膜仪(美国Bio-Rad公司);GIS-500型凝胶成像仪(杭州米欧仪器有限公司)。
2 实验方法
2.1 TFECs原代细胞分离与培养 将文献[8]的方法改良后,无菌分离SD雄性大鼠双侧甲状腺组织。将每侧甲状腺组织剪切成1.5 cm3的小块,消化酶(含0.5 mL的206 kU/L胶原酶I和0.5 mL的2.75 kU/L消化酶)消化、离心后,弃上清,使用RPMI-1640培养液调整细胞浓度至1×105个/mL,经特异抗原NIS免疫荧光染色鉴定为TFECs后,接种至6孔细胞培养板上,每隔3 d换液1次。
2.2 制备活血消瘿方含药血清 取30只SD雄性大鼠,按照随机数字表法分为对照组、优甲乐组和活血消瘿方组,每组10只。优甲乐组和活血消瘿方组大鼠每天分别灌服0.1 mg/L的优甲乐溶液2 mL和27 g/kg的活血消瘿方,对照组大鼠每天灌服等体积的双蒸水,连续7 d。大鼠于末次灌胃1 h后,摘除眼球取血,无菌分离得到对照血清、优甲乐含药血清和活血消瘿方含药血清,经56℃、30 min灭活处理,再用0.45 μm微孔滤膜过滤除菌,置-20℃保存备用。
2.3 MTT法检测TFECs增殖情况TFECs接种至96孔板,24 h后,除去原来的培养液,分别添加0.5%、1.0%、2.5%、5.0%、10.0%、20.0%、40.0%、80.0%活血消瘿方含药血清和对照血清,孵育12 h后,采用1 mg/L LPS[9]处理24 h,然后分别加入20 μL MTT试剂(5 mg/mL),继续培养4 h,酶标仪检测450 nm处的吸光度(A)值,并计算其增殖抑制率(%)=(A对照组-A给药组)/A对照组×100%。然后使用SPSS 22.0软件通过增殖抑制率计算活血消瘿方半数抑制浓度(IC50)。
2.4 细胞模型的建立与分组 在前期预实验的基础上,将体外培养的TFECs分为对照组、模型组、低浓度活血消瘿方含药血清组、中浓度活血消瘿方含药血清组、高浓度活血消瘿方含药血清组和优甲乐含药血清组。对照组培养基中加入对照血清;模型组培养基中加入对照血清处理12 h后,再用1 mg/L LPS处理24 h;低浓度活血消瘿方含药血清组培养基中加入50%IC50即10%活血消瘿方含药血清处理12 h后,再用1 mg/L LPS处理24 h;中浓度活血消瘿方含药血清组培养基中加入100%IC50即20%活血消瘿方含药血清处理12 h后,再用1 mg/L LPS处理24 h;高浓度活血消瘿方含药血清组培养基中加入含200%IC50即40%活血消瘿方含药血清处理12 h后,再用1 mg/L LPS处理24 h;优甲乐含药血清组培养基中加入优甲乐含药血清处理12 h后,再用1 mg/L LPS处理24 h。给药结束后,收集各组细胞,对各指标进行检测。
2.5 ELISA法检测各组TFECs中炎症因子水平 使用ELISA试剂盒检测各组细胞中炎症因子TNF-α、IL-6水平,具体操作方法严格按照试剂盒说明书进行。
2.6 流式细胞仪检测各组TFECs凋亡率 收集各组TFECs,采用流式细胞仪测定其凋亡情况,计算凋亡率。凋亡率(%)=凋亡细胞数/细胞总数×100%。
2.7 Western blotting检测各组TFECs中各蛋白表达水平 提取各组TFECs总蛋白后进行定量、电泳及转膜,脱脂奶粉封闭 后 加 入Tg、JAK2、p-JAK2、STAT3、p-STAT3、Caspase-8、Caspase-3、Bcl-2、Bax、p53抗体,4℃培养过夜,加入相应二抗,继续培养2 h。ECL显影后,以GAPDH为内参,分析各组TFECs中各蛋白表达情况。
2.8 统计学方法 采用SPSS 22.0统计学软件进行分析,计量资料以“均数±标准差”(±s)表示,多组比较采用单因素方差分析,两两比较采用LSD-t法。P<0.05为差异有统计学意义。
3 结果
3.1 活血消瘿方含药血清对LPS诱导的TFECs增殖的影响与对照血清组比较,不同浓度活血消瘿方含药血清处理后细胞增殖抑制率均明显升高(P<0.05),且增殖抑制率随着浓度的增加而升高。活血消瘿方含药血清对LPS诱导的TFECs增殖抑制率的IC50为20%。(见表1)
表1 活血消瘿方含药血清对LPS诱导的TFECs增殖的影响(±s,n=6)
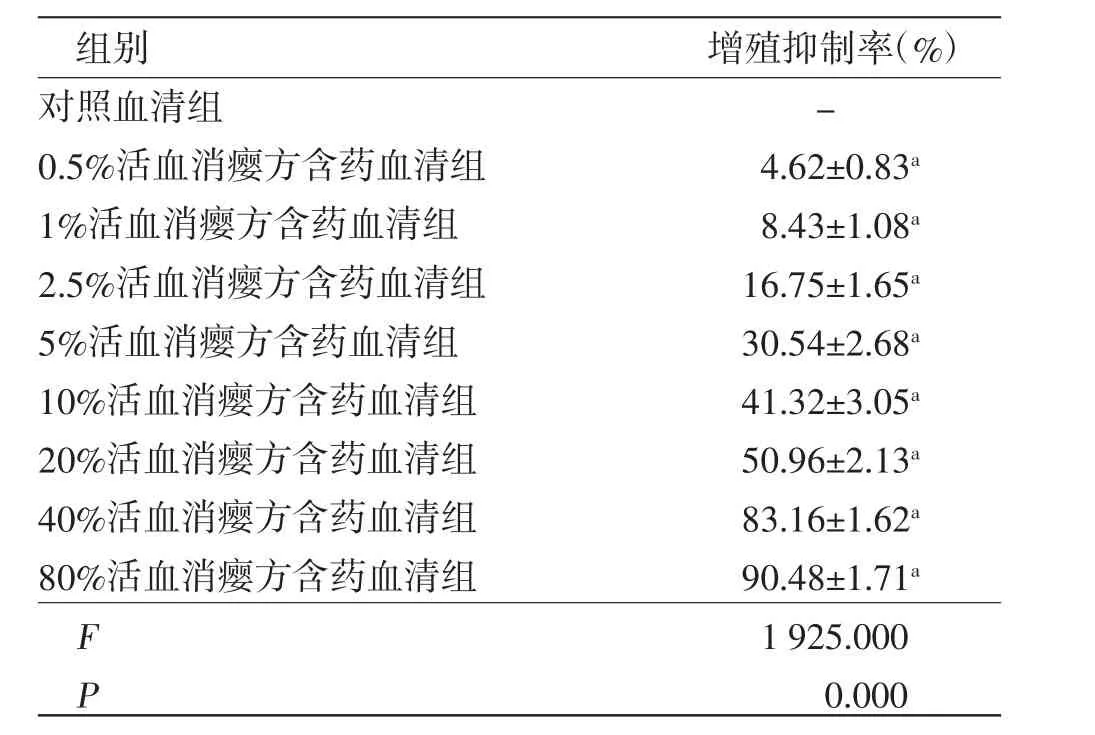
表1 活血消瘿方含药血清对LPS诱导的TFECs增殖的影响(±s,n=6)
注:与对照组比较,aP<0.05
组别 增殖抑制率(%)对照血清组 -0.5%活血消瘿方含药血清组 4.62±0.83a 1%活血消瘿方含药血清组 8.43±1.08a 2.5%活血消瘿方含药血清组 16.75±1.65a 5%活血消瘿方含药血清组 30.54±2.68a 10%活血消瘿方含药血清组 41.32±3.05a 20%活血消瘿方含药血清组 50.96±2.13a 40%活血消瘿方含药血清组 83.16±1.62a 80%活血消瘿方含药血清组 90.48±1.71a F 1925.000 P 0.000
3.2 活血消瘿方含药血清对LPS诱导的TFECs形态的影响对照组TFECs呈多边形或瓷砖样,细胞较小且排列紧密,胶质丰富,折射清晰;与对照组比较,模型组TFECs变大,排列松散,呈碎片状,胶质减少,折射不清晰;与模型组比较,优甲乐含药血清组和低、中、高浓度活血消瘿方含药血清组TFECs排列逐渐紧密,且胶质增多。(见图1)

图1 各组TFECs形态比较(×200)
3.3 活血消瘿方含药血清对LPS诱导的TFECs细胞中Tg蛋白的影响 与对照组比较,模型组TFECs细胞中Tg蛋白表达明显降低(P<0.05);与模型组比较,低、中、高浓度活血消瘿方含药血清组TFECs细胞中Tg蛋白表达均明显升高(P<0.05),且具有浓度依赖性;高浓度活血消瘿方含药血清组TFECs细胞中Tg蛋白表达与优甲乐含药血清组比较,差异无统计学意义(P>0.05)。(见表2)
表2 各组TFECs中Tg蛋白表达比较(±s,n=6)

表2 各组TFECs中Tg蛋白表达比较(±s,n=6)
注:与对照组比较,aP<0.05;与模型组比较,bP<0.05;与低浓度活血消瘿方含药血清组比较,cP<0.05;与中浓度活血消瘿方含药血清组比较,dP<0.05
组别 Tg对照组 0.73±0.02模型组 0.35±0.03a低浓度活血消瘿方含药血清组 0.49±0.02b中浓度活血消瘿方含药血清组 0.57±0.03b c高浓度活血消瘿方含药血清组 0.71±0.05b c d优甲乐含药血清组 0.72±0.04b c d F 127.612 P 0.000
3.4 活血消瘿方对LPS诱导的TFECs中炎症因子的影响 与对照组比较,模型组TFECs中TNF-α、IL-6含量明显升高(P<0.05);与模型组比较,低、中、高浓度活血消瘿方含药血清组TFECs中TNF-α、IL-6含量均明显降低(P<0.05),且低浓度活血消瘿方含药血清组>中浓度活血消瘿方含药血清组>高浓度活血消瘿方含药血清组;高浓度活血消瘿方含药血清组TFECs中TNF-α、IL-6含量与优甲乐含药血清组比较,差异无统计学意义(P>0.05)。(见表3)
表3 各组TFECs中炎症因子水平比较(±s,n=6)

表3 各组TFECs中炎症因子水平比较(±s,n=6)
注:与对照组比较,aP<0.05;与模型组比较,bP<0.05;与低浓度活血消瘿方含药血清组比较,cP<0.05;与中浓度活血消瘿方含药血清组比较,dP<0.05
组别 TNF-α(ng/L) IL-6(ng/L)对照组 31.25±8.36 19.16±6.47模型组 76.41±10.32a 52.57±7.23a低浓度活血消瘿方含药血清组 60.34±9.24b 40.75±6.53b中浓度活血消瘿方含药血清组 46.17±9.78b c 29.29±6.89b c高浓度活血消瘿方含药血清组 30.36±10.21b cd 18.34±7.32b cd优甲乐含药血清组 29.46±8.15b cd 17.24±7.18b cd F 25.435 25.890 P 0.000 0.000
3.5 活血消瘿方对LPS诱导的TFECs凋亡的影响 与对照组比较,模型组TFECs凋亡率及凋亡相关蛋白Caspase-3、Caspase-8和Bax表达水平均明显升高(P<0.05),而Bcl-2和p53蛋白表达水平均明显降低(P<0.05);与模型组比较,低、中、高浓度活血消瘿方含药血清组TFECs凋亡率及凋亡相关蛋白Caspase-3、Caspase-8和Bax蛋白表达水平均明显降低(P<0.05),而Bcl-2和p53蛋白表达水平均明显升高(P<0.05),且呈浓度依赖性;高浓度活血消瘿方含药血清组TFECs凋亡率及相关蛋白表达水平与优甲乐含药血清组比较,差异无统计学意义(P>0.05)。(见图2~3、表4~5)
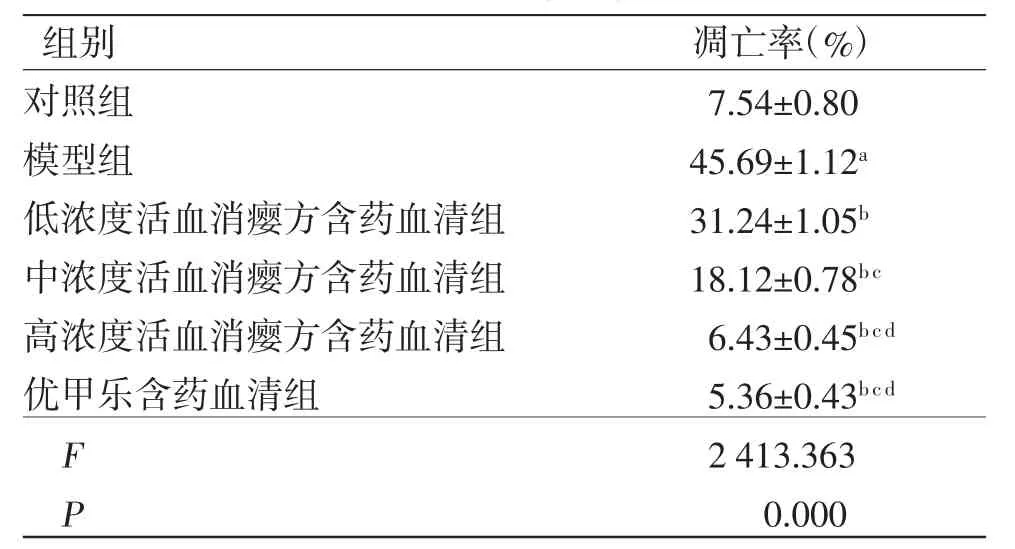
注:与对照组比较,aP<0.05;与模型组比较,bP<0.05;与低浓度活血消瘿方含药血清组比较,cP<0.05;与中浓度活血消瘿方含药血清组比较,dP<0.05
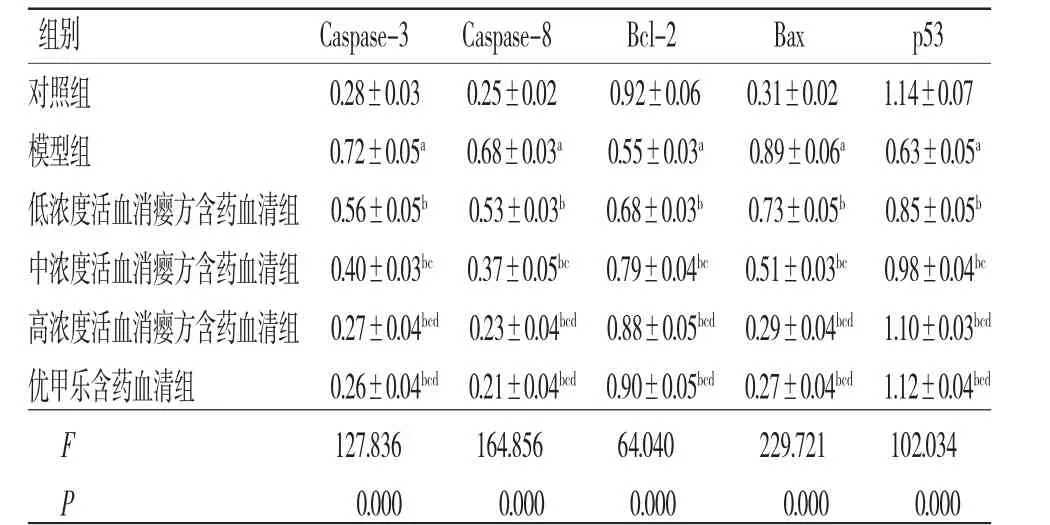
注:与对照组比较,aP<0.05;与模型组比较,bP<0.05;与低浓度活血消瘿方含药血清组比较,cP<0.05;与中浓度活血消瘿方含药血清组比较,dP<0.05

图2 各组TFECs凋亡流式图
3.6 活血消瘿方对LPS诱导的TFECs中JAK2/STAT3信号通路蛋白的影响 与对照组比较,模型组TFECs中p-JAK2/JAK2、p-STAT3/STAT3比值均明显上调(P<0.05);与模型组比较,低、中、高浓度活血消瘿方含药血清组TFECs中p-JAK2/JAK2、p-STAT3/STAT3比值均明显下调(P<0.05);高浓度活血消瘿方含药血清组TFECs中p-JAK2/JAK2、p-STAT3/STAT3比值与优甲乐含药血清组比较,差异无统计学意义(P>0.05)。(见图4、表6)
表6 各组TFECs中JAK2/STAT3信号通路蛋白比较(±s,n=6)
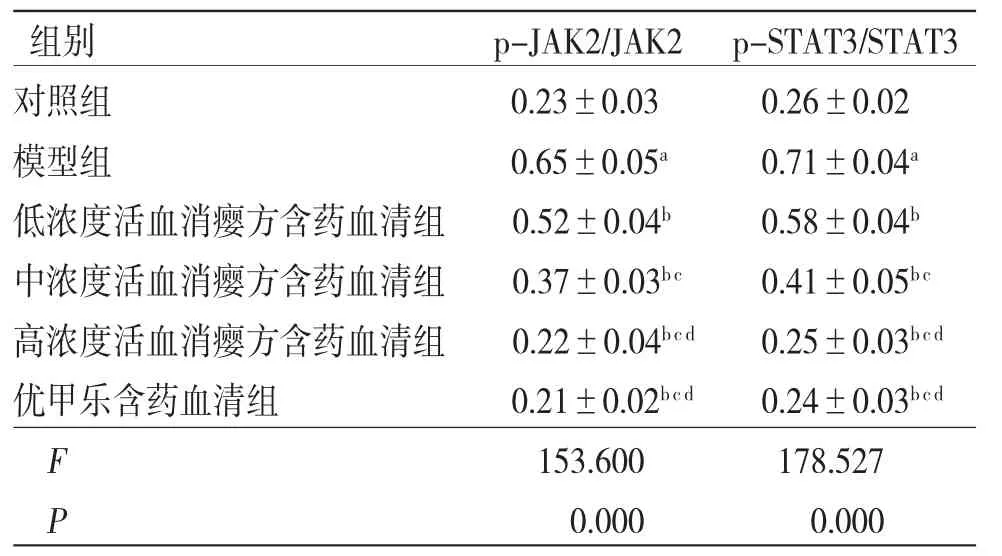
表6 各组TFECs中JAK2/STAT3信号通路蛋白比较(±s,n=6)
注:与对照组比较,aP<0.05;与模型组比较,bP<0.05;与低浓度活血消瘿方含药血清组比较,cP<0.05;与中浓度活血消瘿方含药血清组比较,dP<0.05
组别 p-JAK2/JAK2 p-STAT3/STAT3对照组 0.23±0.03 0.26±0.02模型组 0.65±0.05a 0.71±0.04a低浓度活血消瘿方含药血清组 0.52±0.04b 0.58±0.04b中浓度活血消瘿方含药血清组 0.37±0.03b c 0.41±0.05b c高浓度活血消瘿方含药血清组 0.22±0.04b cd 0.25±0.03b cd优甲乐含药血清组 0.21±0.02b cd 0.24±0.03b cd F 153.600 178.527 P 0.000 0.000
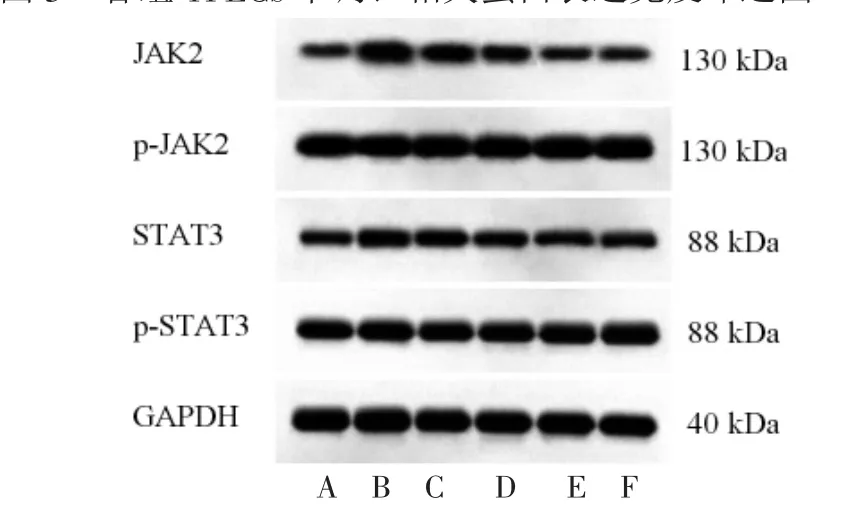
图4 各组TFECs中JAK2/STAT3信号通路蛋白表达免疫印迹图
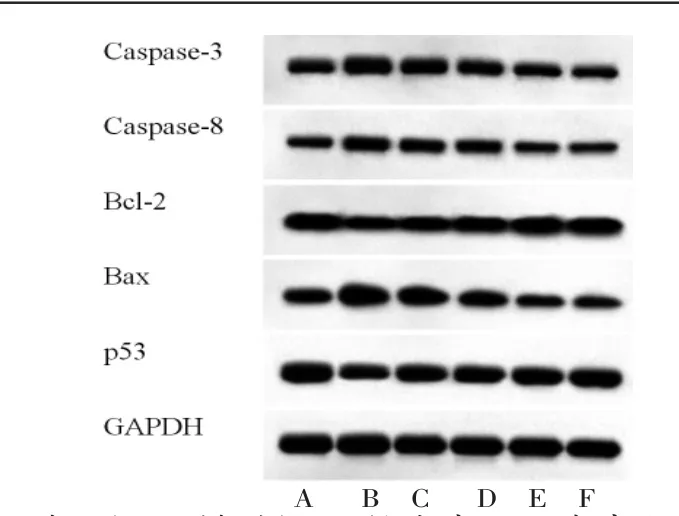
图3 各组TFECs中凋亡相关蛋白表达免疫印迹图
4 讨论
由于结节性甲状腺肿病情的反复进展,滤泡上皮由弥漫性增生转变为局灶性增生,同时发生增生性病变和退行性病变的反复交替。腺体内出现不同发展阶段的结节,出现毒性症状时,即为毒性结节性甲状腺肿;若上皮细胞出现过度增生,可进一步形成腺瘤或乳头状腺癌,也可形成甲状腺癌,且具有较高的癌变率[11]。国内报道结节性甲状腺肿伴甲状腺癌发生率逐年升高[12]。因此,明确结节性甲状腺肿的转化机制不仅能为早期诊断提供支持,还能进一步研究出阻止结节性甲状腺肿发展的针对性干预措施,进而降低其癌变率或延缓其发展进程。
中医学将结节性甲状腺肿归属于“瘿病”范畴,认为痰瘀贯穿于整个病程之中[12]。陈如泉根据痰血瘀阻理论创立了活血消瘿方,该方在结节性甲状腺肿的临床治疗中被广泛使用[13]。吴淑琼等[5]研究发现,活血消瘿方能够通过降低结节性甲状腺肿患者血清中血管内皮生长因子、胰岛素样生长因子水平并适度升高转化生长因子-β1水平来发挥治疗作用。此外,活血消瘿片合夏枯草胶囊可有效治疗桥本甲状腺炎伴结节[14]。既往研究[15]发现活血消瘿片能够有效降低缺碘性甲状腺肿模型大鼠的甲状腺质量,但对甲状腺功能的影响较小。目前,活血消瘿方治疗甲状腺疾病的分子机制尚不明确。本研究表明,LPS诱导后TFECs细胞损伤加重,Tg表达降低,TNF-α、IL-6升高,且表现出明显的细胞凋亡,以上结果均说明模型构建成功。Tg蛋白是TFECs细胞内胶质的主要成分,其含量可反映TFECs的损伤程度[16]。有研究[17]表明,优甲乐对结节性甲状腺肿有治疗作用。因此,本研究以优甲乐含药血清为阳性对照,观察活血消瘿方含药血清对LPS诱导的大鼠TFECs损伤模型细胞的影响。结果显示,活血消瘿方含药血清可改善TFECs损伤,增加胶质含量,且能够逆转LPS诱导的炎症因子和凋亡率的升高。说明活血消瘿方含药血清能通过降低凋亡蛋白和炎症因子表达来改善LPS诱导的大鼠TFECs凋亡,并减轻其炎性损伤。
JAK2/STAT3信号通路与细胞损伤或细胞凋亡密切相关。JAK2是STAT3的上游激活剂,LPS的刺激可使JAK2活化,从而促进下游STAT3蛋白发生磷酸化,最后导致肠上皮细胞和人脐静脉内皮细胞损伤[18-19]。另外,JAK2、STAT3磷酸化程度的降低能够抑制LPS诱发的支气管上皮细胞凋亡和炎症的发生[20]。然而,目前尚无JAK2/STAT3信号通路在TFECs中的研究。本研究发现,LPS诱导的TFECs中JAK2、STAT3磷酸化水平显著上调,与QIN Y等[21]在肺泡上皮细胞中的研究一致,而活血消瘿方含药血清能抑制其磷酸化。说明活血消瘿方含药血清对LPS诱导的TFECs凋亡和损伤的抑制作用可能是通过抑制JAK2/STAT3信号通路实现的。
综上所述,活血消瘿方含药血清可能通过抑制JAK2/STAT3信号通路,减轻LPS诱导的TFECs炎性损伤,并抑制细胞凋亡。本研究结果可为结节性甲状腺肿的中医治疗提供新思路,但是本研究仅在细胞层面探讨了活血消瘿方的作用机制,后续仍需进行动物实验,继续深入研究。
