藏猪源唾液乳酸杆菌的分离鉴定及生物学特性研究
2022-06-14孔庆辉李家奎索朗斯珠徐业芬商振达谭占坤刘锁珠
孔庆辉,李家奎,索朗斯珠,徐业芬,商振达,3,谭占坤,3,刘锁珠,3
(1 西藏农牧学院 动物科学学院,西藏 林芝 860000;2 华中农业大学 动物医学院,湖北 武汉 430070;3 西藏高原饲料加工工程研究中心,西藏 林芝 860000)
藏猪是中国特有的高原型地方猪种,主要分布于西藏、四川、云南等高原地区[1]。与其他猪种相比,藏猪具有抗病力强、耐粗饲、肉质好等优点[2]。肠道微生物对动物的生长发育和免疫调节具有重要作用[3-4],其受机体的基因型和生活环境等因素的共同影响[5],因此藏猪的优良性状与其肠道微生物息息相关。
益生菌是一类对宿主有益的活性微生物,当其在机体肠道中达到一定数量时能够给宿主带来诸多益处[6]。如益生菌在肠梗阻性疾病、肠应激综合征、便秘、腹泻、高血压和糖尿病等疾病的治疗中具有一定的作用[7]。优质的乳酸菌具有可粘着于肠道黏膜上皮、耐酸耐胆盐能力强、安全性好(无毒理基因、无溶血活性)、抗菌特性强等优良的生物学特性[8-9],已被广泛应用于畜牧业的生产中。已有研究表明,鼠李糖乳杆菌 (Lactobacillusrhamnosus)和双歧杆菌(Bifidobacterium)可以预防肥胖小鼠的非酒精性脂肪肝疾病[10];约氏乳酸菌(Lactobacillusjohnsonii)可以改善鸡的脂质代谢和肠道菌群,从而预防亚临床坏死性肠炎并降低呼吸道病毒感染风险[11]。肠膜明串珠菌(Leuconostocmesenteroides)能抑制病原体的生长,可作为潜在的益生菌用于进一步的研究[12-13]。除此之外,乳酸菌胞外多糖是一种难以消化的纤维,能够赋予发酵乳制品特殊的质构和风味[14],可以用来发酵饲料。饲料乳酸菌发酵技术是近年来兴起的一项新型饲料生产技术,饲料经乳酸菌发酵后,会形成许多有助于饲料消化的酶和有机酸等物质,同时使发酵饲料中产生大量的益生菌,抑制有害菌的生长,有助于维持动物肠道菌群平衡,促进动物生长[15]。
已有研究者分别从猪[16]、鸡[17]和牛[18]的消化道中筛选出生物学特性较好的乳酸菌,但对藏猪肠道中乳酸菌的分离、鉴定及生物学特性的研究尚未见报道。因此,本研究对藏猪源乳酸杆菌进行了分离鉴定及生物学特性分析,旨在为探索藏猪的健康养殖奠定基础。
1 材料与方法
1.1 材 料
20只(雌雄各半)、6~8周龄、体质量为15~18 g的SPF级小白鼠,购自西藏自治区拉萨市生物制药厂,用于乳酸杆菌安全性评估试验。
PBS(PH1812),购自Phygene公司;MRS肉汤(CM187)、MRS琼脂(CM188),购自北京陆桥公司;琼脂糖、猪胆盐、乳酸含量测定试剂盒(BC2230),购自Solarbio公司;细菌DNA提取试剂盒(DP302)、琼脂糖凝胶回收试剂盒(DP209),购自天根生化科技有限公司;金黄色葡萄球菌(CMCC 26003)、大肠杆菌(CMCC 44102),购自南京便诊生物科技有限公司;血琼脂平板,购自比克曼生物有限公司。
不同生长阶段藏猪(仔猪、保育猪、母猪)粪便,采集于西藏农牧学院藏猪协作研究中心养殖基地,粪样装入无菌冻存管带回实验室,用于菌种的分离、鉴定。
1.2 试验方法
1.2.1 乳酸杆菌的分离 无菌称取藏猪粪便0.1 g,用PBS溶液进行10倍梯度稀释,自10-1至10-8,共8个稀释梯度。取各稀释液100 μL均匀涂布于含10 g/L碳酸钙的MRS固体培养基上,37 ℃恒温培养24 h,挑取有溶钙圈的单一菌落划线接种至MRS固体培养基中,37 ℃恒温培养24 h,如此纯化3次直至革兰氏染色镜检为阳性纯菌株。
1.2.2 菌株产酸能力的测定 参照Missotten等[19]的方法,挑取革兰氏阳性菌株扩大培养后,按体积百分比5%的接种量接种于MRS肉汤培养基中(150 μL菌液加入到2 850 μL MRS培养基中),37 ℃恒温培养24 h。取100 μL菌液接种于10 mL含0.01 g/L溴酚蓝的MRS肉汤中,37 ℃恒温培养。培养期间随时观察培养基颜色的变化(从紫色变为黄色),记录变色时间,培养90 h后测定其pH值。选择变色时间短(<32 h)、pH值低(<4.20)的菌株,取100 μL菌液接种至10 mL含20 g/L CaCO3的MRS肉汤培养基中,37 ℃厌氧培养48 h后取样,用乳酸含量测定试剂盒测定乳酸含量。
1.2.3 分离菌株的鉴定 对分离所获的菌株进行生化鉴定,试验项目包括过氧化氢酶试验、硝酸盐还原试验、葡萄糖产酸试验、明胶液化试验、硫化氢产生试验等。使用细菌DNA提取试剂盒提取分离所获菌株的基因组DNA,以之为模板,利用16S rDNA通用引物27F(5′-GAGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-TACGGCTACCTTGTTACGAC-3′)进行PCR扩增,反应体系(20 μL):TaqDNA聚合酶0.5 μL,模板1 μL,10×TaqBuffer 2 μL,dNTP Mixture 1.6 μL,上下游引物各0.5 μL,ddH2O 13.9 μL。PCR反应程序:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,30个循环;72 ℃修复延伸10 min。对PCR产物进行1.5%的琼脂糖凝胶电泳检测,切胶回收后送至华大基因进行测序。将获得的碱基序列在NCBI基因数据库中进行Blast比对,并利用MEGA5软件构建系统发育树。
1.2.4 分离菌株生长曲线的绘制 将鉴定后的纯菌株接种至MRS液体培养基中,37 ℃厌氧培养24 h,于培养0,2,4,…,24 h取样,在600 nm处测发酵液吸光值(OD600),以吸光值为纵坐标、培养时间为横坐标,绘制生长曲线。
1.2.5 分离菌株耐酸耐胆盐能力的测定 参照Kobierecka等[20]的方法测定分离所获菌株的耐酸和耐胆盐能力。用1 mol/L的盐酸将MRS肉汤培养基的pH值分别调整为2,3,4和5,同时用常规的MRS做对照。将1 mL活化的乳酸菌杆菌液(菌体含量1×108CFU/mL)接种于7 mL不同pH值的MRS肉汤中,37 ℃厌氧培养3 h后,吸取100 μL菌液进行倍比稀释,均匀涂布到MRS琼脂培养基上,37 ℃厌氧培养48 h后,进行计数,计算乳酸杆菌的存活率。用猪胆盐将MRS肉汤培养基的胆盐浓度分别调整为2,3,4和5 g/L,同时用常规的MRS做对照。将1 mL活化的乳酸菌菌液(菌体含量1×108CFU/mL)接种到7 mL不同胆盐质量浓度的MRS肉汤中,37 ℃厌氧培养3 h后,吸取100 μL菌液,倍比稀释后均匀涂布于MRS琼脂培养基上,37 ℃厌氧培养48 h后,进行计数,计算乳酸杆菌的存活率。存活率=(不同胆盐浓度或不同pH值MRS培养基培养3 h 后的活菌数/MRS对照管培养3 h后的活菌数)×100%。
1.2.6 分离菌株的体外抑菌试验 参照Kang等[21]的方法提取菌株的细菌素,取3 mL菌液(1×108CFU/mL),4 ℃下12 000 r/min离心20 min,弃沉淀,取上清液,用0.2 μm的微孔滤膜过滤,低温保存。分别取100 μL大肠杆菌菌液(1×108CFU/mL)和金黄色葡萄球菌菌液(1×108CFU/mL)均匀涂布于LB琼脂培养基上,3 min后,用5 mm打孔器在LB琼脂平板上打孔。取150 μL细菌素溶液(1×108CFU/mL)注入孔中,培养24 h后测量抑菌圈直径。
1.2.7 分离菌株的安全性评估 (1)溶血活性检测。将孵育后的乳酸杆菌菌液划线接种含羊血的血琼脂平板,37 ℃培养24 h后评估该菌株的溶血活性,以金黄色葡萄球菌为阳性对照。
(2)益生基因检测。参照Kang等[21]和Du等[22]的方法,利用Premier 5.0软件设计EntA、EntB、EntP、EntL50、EntQ、EntL50(2)和EntP2等益生基因的引物(表1)。以乳酸菌基因组DNA为模板,利用引物对上述益生基因进行PCR扩增,反应体系(20 μL):TaqDNA聚合酶0.5 μL,模板1 μL,10×TaqBuffer 2 μL,dNTP Mixture 1.6 μL,上下游引物各0.5 μL,ddH2O 13.9 μL;PCR反应程序:94 ℃预变性5 min;94 ℃变性30 s,56~60 ℃退火30 s,72 ℃延伸30 s,30个循环;72 ℃修复延伸10 min。对PCR扩增产物进行琼脂糖凝胶电泳检测。

表1 试验用益生基因引物序列Table 1 Primer sequences for bacteriocin gene in the test
(3)15 d小鼠饲喂试验。将20只SPF级小鼠随机分为对照组和试验组,每组10只,分别灌胃生理盐水和生理盐水稀释的乳酸菌菌液(菌体含量2×109CFU/mL)0.5 mL/d,连续灌胃15 d。观察小鼠体况,并测定小鼠的初始体质量以及灌胃15 d后的体质量,计算小鼠生长状况。灌胃结束后,在无菌环境下对小鼠进行大体解剖,取其肝脏、心脏、肺脏、肾脏、脾脏等组织称质量,计算脏器指数。
(4)细菌移位试验。取小鼠的心脏、肺脏、肝脏、肾脏、脾脏等器官,用无菌棉签擦拭脏器表面,涂布于MRS琼脂培养基上,将血液涂于BHI培养基上,37 ℃下培养48 h,观察有无菌落生长。
1.3 数据统计分析
试验数据经Excel进行初步统计后,使用IBM SPSS Statistics软件进行单因素方差分析。
2 结果与分析
2.1 乳酸杆菌的分离及产酸能力测定
从不同生长阶段藏猪粪便中共分离得到48株菌(其中仔猪、保育猪和母猪粪便中分别分离得到11,14和23株),有溶钙圈(图1-A);形态学观察(图1-B)表现为边缘圆整或不规则,菌落中间隆起,呈乳白,半透明和灰白色,菌落半径在0.2~1.5 mm;革兰氏染色阳性杆菌(图1-C)为40株。
由表2可见,藏猪粪便分离得到的40株革兰氏染色阳性菌的产酸能力存在差异,大部分菌株在含有溴酚蓝指示剂的MRS培养基中的变色时间都在90 h以内,其中Ld3、Ld6、Ld7、Lc1、Lc5、Lc6和Lc7等7株乳酸杆菌的pH值低于3.70;8株菌(La8、La11、Lb4、Lb5、Ld5、Ld8、Lc9和Lc15)在培养90 h后仍未变色,且这些菌株在培养90 h后的pH值均高于4.5。根据产酸速度和终末pH值测定结果,筛选出32株产酸速度快、终末pH值低的菌进行乳酸含量测定,结果(表3)显示,Lb1、Ld4、Lc1、Lc2、Lc4、Lc6、Lc7、Lc8、Lc11和Lc12等10株菌培养液中乳酸的含量较高,其中Ld4最高,达(0.070±0.05) mol/L;La2、La4、Lb3、Lb6、Ld1、Ld2、Ld6、Ld7、Lc5、Lc10、Lc13和Lc14发酵液中乳酸的含量较低。

表2 藏猪源乳酸杆菌产酸速度(变色时间)以及接种90 h后的pH值Table 2 Acid producing rate (discoloration time) and pH at 90 hours after inoculation of lactic acid bacteria from Tibetan pigs
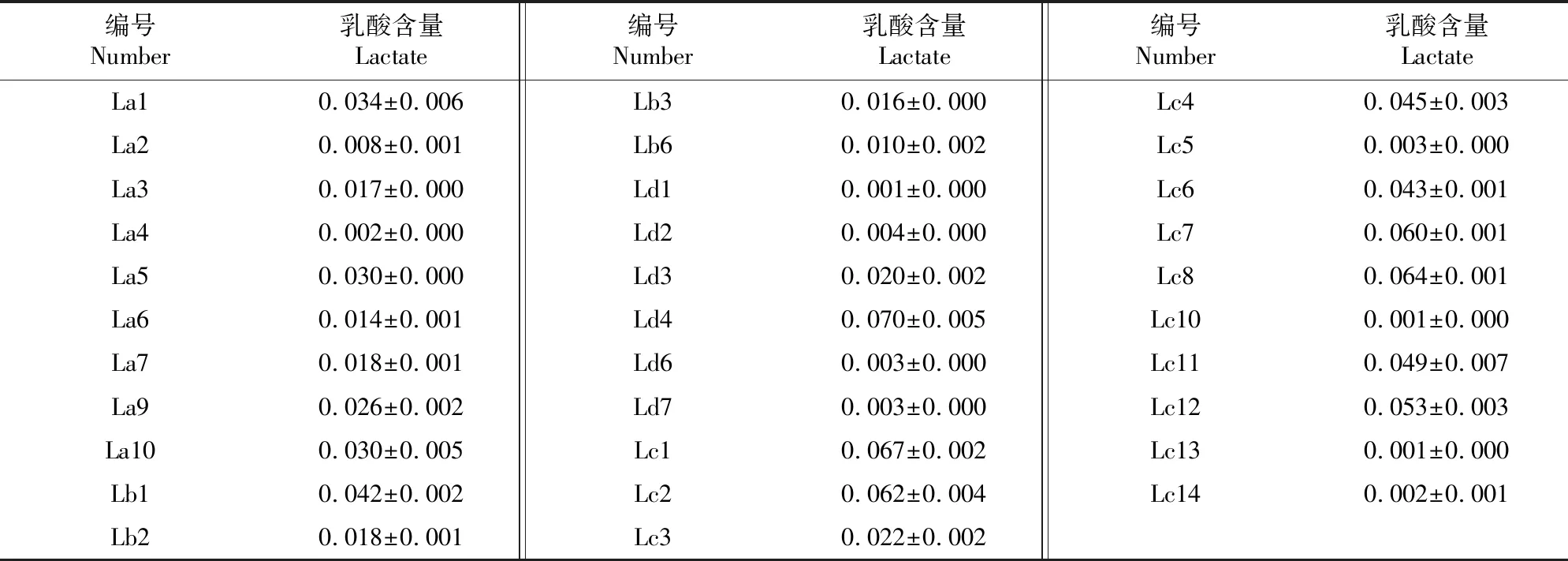
表3 藏猪源乳酸杆菌产酸量的测定Table 3 Determination of acid production of lactic acid bacteria from Tibetan pigs mol/L
2.2 乳酸杆菌的鉴定
对得到产酸能力较强的10株菌株Lb1、Ld4、Lc1、Lc2、Lc4、Lc6、Lc7、Lc8、Lc11和Lc12进行生理生化鉴定。结果显示,Ld4、Lc1、Lc4、Lc6、Lc7、Lc8、Lc11和Lc12能发酵葡萄糖产酸,且明胶液化、过氧化氢、硫化氢和硝酸盐试验均为阴性,初步认为这8株菌是乳酸杆菌。对这8株候选菌株进行16S rDNA 测序后,在NCBI基因数据库中进行Blast比对,结果(图2)显示,Ld4、Lc4、Lc8、Lc11均为唾液乳酸杆菌(Lactobacillussalivariusstrain),Lc4、Lc8和Lc11与唾液乳酸杆菌(MT585431.1)相似性达99.93%,而Ld4与唾液乳酸杆菌(MT573705.1)相似性为99.65%。
2.3 乳酸杆菌生长曲线及耐酸耐胆盐能力测定
绘制Ld4、Lc4、Lc8和Lc11等4株菌的生长曲线,结果见图3。由图3可知,Ld4和Lc8在接种2 h后快速增长,进入对数生长期;Lc4和Lc11在接种4 h后快速增长,进入对数生长期。菌株Lc8和Lc11接种10 h后进入生长稳定期,菌株Ld4在接种14 h后进入生长稳定期,而菌株Lc4在接种16 h后进入生长稳定期。结果表明,4株藏猪源乳酸杆菌均可在营养丰富的环境中生长,其中Ld4生长更快。
测定Lc4、Ld4、Lc8和Lc11等4株菌的耐酸耐胆盐能力,结果见图4。由图4可知,4株乳酸菌的存活率随着pH的降低而逐渐下降,在pH=5时,Ld4、Lc11、Lc8和Lc4的存活率依次为89.13%,75.30%,63.80%和68.90%;在pH=3时,4株乳酸菌中,菌株Ld4的存活率最高,为42.16%;而当pH为2时,只有菌株Ld4存活,存活率为12.12%,其他3株乳酸菌均无法存活。胆盐耐受性能测定结果显示,随着胆盐质量浓度的升高,4株乳酸杆菌的存活率均逐渐下降,当胆盐质量浓度为4 g/L时,菌株Lc4、Lc8和Lc11全部死亡,菌株Ld4的存活率为28.12%;当胆盐质量浓度为5 g/L时,菌株Ld4的存活率为7.63%。
2.4 乳酸杆菌体外抑菌能力
测定Ld4菌株的体外抑菌能力,结果(图5)显示,Ld4对大肠杆菌和金黄色葡萄球菌都具有较好的抑制作用,其中对大肠杆菌的抑菌圈直径为(16.35±0.58) mm,对金黄色葡萄球菌的抑菌圈直径为(15.21±0.26) mm。
2.5 乳酸杆菌的安全性评估
2.5.1 溶血活性检测 菌株Ld4和金黄色葡萄球菌在血琼脂培养基上培养24 h后,通过以下方法判断菌株的溶血活性:血琼脂培养基上菌落周围出现草绿色溶血环,为α-溶血;菌落周围出现较宽的透明溶血环,为β-溶血;菌落周围无溶血环,为γ-溶血。试验结果(图6)显示,阳性对照金黄色葡萄球菌为β-溶血,而Ld4为γ-溶血。
2.5.2 益生基因检测 益生基因检测结果(图7)表明,菌株Ld4中仅检测到益生基因EntP2,未检测到益生基因EntA、EntB、EntP、EntL50、EntQ和EntL50(2)。
2.5.3 15 d小鼠饲喂试验 将菌株Ld4连续灌胃小鼠15 d后,两组小鼠生长、行为和精神状况良好,毛发、摄食、饮水、排泄正常,未见明显腹泻等中毒症状,也无死亡情况。统计分析2组小鼠体质量变化情况,结果表明,对照组小鼠和灌胃菌株Ld4小鼠体质量没有显著差异(P>0.05)。将小鼠进行大体解剖,各组织器官正常,未见器质性病变(表4),说明菌株Ld4对小鼠各组织器官均无显著影响。

表4 藏猪源乳酸杆菌菌株Ld4对小鼠脏器的影响Table 4 Effect of lactic acid bacteria Ld4 from Tibetan pigs on internal organ indices of mice
2.5.4 细菌移位试验 将灌胃组小鼠的心脏、肺脏、肝脏、肾脏和脾脏组织涂布于MRS固体培养基上,将血液涂布于BHI琼脂培养基上,培养48 h后均未发现有细菌生长,故未观察到菌血症和细菌移位现象。
3 讨 论
目前,抗生素已广泛用于养殖业中,但同时也出现了诸多问题,特别是动物病原菌的耐药性问题[23]。因此,寻找一种安全绿色有效的微生态制剂来替代抗生素显得尤为重要。作为机体内的常驻益生菌,乳酸杆菌具有与致病菌竞争肠道定殖位点和抗菌的能力,具有较好的替代抗生素的应用前景[24-25]。Ma等[26]研究表明,重组鸡源乳酸杆菌在鸡体内显示出较好的免疫原性,可以有效地治疗禽致病性大肠杆菌引起的疾病;Jiang等[27]研究发现,罗伊氏乳杆菌可以激活巨噬细胞,调节一氧化氮(NO)信号通路,减轻鼠伤寒沙门氏菌引起的炎症反应,有效保护小鼠免受鼠伤寒沙门氏菌对肝脏和脾脏的侵袭。由此推断,乳酸杆菌在保护动物肠道健康中具有一定作用。乳酸菌在厌氧环境中可以产生大量的乳酸,使动物肠道中的pH下降,从而抑制大肠杆菌、沙门氏菌、金黄色葡萄球菌、志贺氏菌等多种致病菌的生长,调节动物肠道菌群结构平衡,维护动物肠道健康。因此,乳酸杆菌的产乳酸能力与其抑菌能力密切相关[28]。在本研究从藏猪粪便中分离得到48株菌株,通过形态观察和革兰氏染色鉴定,筛选出40株乳酸杆菌,其中10株乳酸杆菌的产酸速度较快,最高产乳酸量可以达到0.070 mol/L,低于李雪莉等[29]筛选得到的猪源乳酸菌的产乳酸能力,但高于刘虹等[30]筛选得到的鸡源乳酸菌的产乳酸能力,说明藏猪源乳酸杆菌的产酸性能较强。
细菌的生长情况能够反映出细菌的数量变化和代谢状况。本研究利用16S rDNA技术对10个乳酸产量较高的菌株进行分子鉴定,结果显示有4个菌株为唾液乳酸杆菌,其均在培养2~4 h后进入对数生长期,10~16 h后进入稳定期,与陈松彪等[31]测定的猪源屎肠球菌(E.faecium)的生长曲线和张在等[32]测定的猪源乳酸肠球菌(L.enterococcus)的生长曲线相比,藏猪源乳酸杆菌的生长性能更好,其能较早进入对数生长期,较晚进入生长稳定期,说明4株藏株源乳酸杆菌的生长性能符合优良益生菌的生物学特性。
益生菌在促进宿主生理健康中发挥作用的关键是能够在肠道中生存[33],优良的乳酸菌需要在动物消化道低pH值和高胆盐的情况下具有较好的稳定性[34],因此乳酸菌的耐酸耐胆盐特性对其发挥抑菌功能尤为重要。本研究发现,4株藏猪源唾液乳酸杆菌中,菌株Ld4的耐酸耐胆盐特性最好,其在培养基pH值为2.0时的存活率为12.12%,在胆盐质量浓度为5 g/L时的存活率为7.63%,这与Yaneisy等[35]对9株乳酸菌耐酸耐胆盐的测定结果相一致。
抑制病原体的生长是益生菌重要的生物学特性,因此对耐酸耐胆盐性能强的菌株Ld4进行体外抑菌效果研究,结果显示其对大肠杆菌和金黄色葡萄球菌的抑菌圈直径分别为16.35和15.21 mm。王银梦等[36]研究得到9株牦牛源乳酸菌对大肠杆菌的抑菌圈直径介于13.90~17.09 mm;黄奕雯等[37]研究表明6株鸡源乳酸菌对金黄色葡萄球菌的抑菌圈直径介于14.40~20.80 mm,这与本研究的抑菌结果相一致。除此之外,本研究还在藏猪源乳酸杆菌Ld4中检测到肠道菌素EntP2基因,其编码的肠菌素P2属于П类细菌素[38],具有广泛的抑菌谱[39]。以上结果均说明,藏猪源乳酸杆菌Ld4具有较好的抑菌作用。
绝大多数益生菌对机体是安全的,但有些益生菌具有溶血等副作用[40]。因此,对乳酸菌的溶血活性进行研究是体外益生菌安全性测试的重要组成部分。本研究对筛选得到的藏猪源唾液乳酸杆菌进行溶血活性评估,结果表明菌株Ld4未检测到溶血活性;小鼠安全性评估试验发现,饲喂藏猪源唾液乳酸杆菌15 d后,小鼠的生长性能和精神状况良好,毛发、摄食、饮水、排泄正常,未见明显腹泻等中毒症状,也无死亡情况,体质量变化和脏器指数与生理盐水组相比较均无显著差异,也无菌血症和细菌移位现象。
综上所述,本研究从48株藏猪源乳酸菌中,筛选出1株(Ld4)生长速度快、产酸性能强、抑菌效果好、耐酸耐胆盐性能优、具有益生潜力的藏猪源唾液乳酸杆菌,为藏猪益生菌开发和藏猪健康养殖奠定了基础。
