miR-7靶向缺氧诱导因子1α对肝癌细胞的影响*
2022-06-13郭康党珊
郭 康 党 珊
(新乡医学院,1 第三附属医院肿瘤内二科,2 三全学院,453003 新乡)
肝癌是一种具有较高发病率和死亡率的实体恶性肿瘤,全球每年约50%新发病例在我国,且临床死亡率一直居高不下[1]。近年来,随着基因组学和表观遗传学的不断发展,越来越多研究显示原癌基因激活和抑癌基因失活与癌症的发生密切相关[2]。微小RNA(miR)是一类非编码蛋白的小分子RNA,目前已有研究表明其作为癌基因或抑癌基因在多种肿瘤组织中表达异常,且参与调控肿瘤细胞的增殖、侵袭、转移等过程。miR-7在肝癌、肺癌、乳腺癌等恶性肿瘤组织中表达降低,且能通过靶向不同目的蛋白调控肿瘤细胞侵袭、凋亡、化疗耐药等过程[3-4]。目前关于miR-7对肝癌细胞的许多生物学行为的调控机制尚未完全明确,本研究旨在探讨miR-7对肝癌细胞MGCC97H侵袭、转移、干细胞特性的影响及分子机制。
1 材料和方法
1.1 主要试剂
MGCC97H细胞(ATCC);DMEM、胎牛血清、青链霉素、胰酶、转染试剂盒(美国Hyclone公司);质粒载体miR-7模拟物、pc-HIF1α及HIF-1α突变型和野生型(Genepharm公司);TRIzol、RNA提取试剂盒及RT-PCR试剂盒(大连宝生生物科技公司);缺氧诱导因子1α(hypoxia-inducible factor 1α,HIF-1α)、β-actin及二抗(南京福麦斯生物公司); Transwell小室(美国BD公司);EdU试剂盒(美国Santa Cruz公司);双荧光素酶基因检测试剂盒(美国Promega公司)。
1.2 细胞培养及分组处理
细胞在含10%胎牛血清的DMEM培养基中常规培养,在37℃ 5% CO2培养箱中培养到指数期,胰酶消化后接种于6孔板,待细胞生长到贴壁后采用慢病毒感染细胞,并按照处理方式不同分为对照组(不做处理)、miR-7模拟物组(转染miR-7模拟物)、miR-7干扰组(转染miR-7模拟物+scramble,为miR-7模拟物组的阴性对照)、HIF1α过表达组(转染pc-HIF1α)和共转染组(转染miR-7模拟物+pc-HIF1α),培养48 h后进行检测。
1.3 RT-PCR检测各组细胞miR-7、HIF-1αmRNA表达量
在各组细胞中加入TRIzol试剂提取总RNA,并检测其浓度,然后逆转录合成cDNA,并进行RT-PCR分析,以2-ΔΔCt法计算miR-7、HIF-1α mRNA的相对表达量,每组重复测定3次取平均值。miR-7:上游引物序列为5'-AGCTGGTGTTGTGAATCAGGCCG-3',下游引物序列为 5'- CAGTGCGTGTCGTGGAGT-3';HIF-1α: 上 游引物序列为5'- TTGCTCATCAGTTG CCACTTCC-3',下 游引物序列为5'-AGCAATTCAT CTGTGCTTTC ATGTC-3'。
1.4 免疫印迹检测各组HIF-1α蛋白的表达量
在细胞中加入裂解液后提取总蛋白,并检测其浓度,每组取20 μg进行SDS-PAGE,然后转膜、脱脂奶粉封闭、加兔来源的HIF-1α一抗(1∶500)室温孵育2 h、洗涤、加山羊抗兔单克隆二抗(1∶800)室温孵育1 h、显色,运用Image J软件对灰度值进行分析,HIF-1α蛋白相对表达量=HIF-1α蛋白灰度值/β-actin灰度值。
1.5 检测细胞迁移能力
用无血清DMEM将各组细胞制备成单细胞悬液(密度为1×106/mL),加入装有基底膜的上室中,在下室中加入含20%血清培养基,在37℃下培养24 h,采用结晶紫对上室底部细胞染色,并将上室内面细胞除去,然后在光学显微镜下统计细胞数量,计算迁移的细胞比率。
1.6 检测细胞凋亡情况
用1×binding buffer将各组细胞制备成单细胞悬液(密度为1×106/mL),加入FIFC避光室温孵育10 min,然后加入PI避光室温孵育5 min,最后上流式细胞仪对染色细胞进行分析。
1.7 检测各组干细胞特性
用无血清DMEM将各组细胞制备成单细胞悬液(密度为1×106/mL),取100 μL接种在另一孔板中并加入100 μL EdU处理2 h,4% 甲醛固定20 min、甘氨酸处理5 min、洗涤、Triton X -100透化细胞、洗涤、Apollo染色10 min、DAPI核染色、洗涤,随后在荧光显微镜下随机选择10个视野,计算阳性细胞比例作为成瘤率。
1.8 荧光素酶实验验证miR-7与HIF-1α靶向关系
将携带HIF-1α野生型、突变型的质粒分别转入细胞中,或同时转入miR-7模拟物,均培养48 h,随后吸去培养液,并洗涤细胞,加入细胞裂解液处理5~10 min,然后以3 000 r/min离心5 min,取上清液进行发光测定。
1.9 统计学处理
采用SPSS 22.0软件分析数据,符合正态分布计量资料以±s表示,多组间比较采用单因素方差分析,两组间比较行snt-q检验。P<0.05为差异有统计学意义。
2 结果
2.1 miR-7、HIF-1αmRNA表达量
RT-PCR检测结果显示,miR-7模拟物组miR-7表 达量高 于对 照 组、miR-7干扰 组(P<0.01),HIF-1α mRNA表达量低于对照组、miR-7干扰组(P<0.05)(图1)。
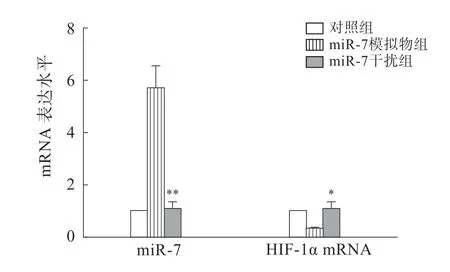
图1 各组细胞miR-7、HIF-1α mRNA的相对表达量
2.2 HIF-1α蛋白的表达
免疫印迹检测结果显示,miR-7模拟物组HIF-1α 蛋白表达量低于对照组(P<0.05),HIF-1α过表达组HIF-1α 蛋白高于对照组(P<0.01),共转染组HIF-1α 蛋白低于HIF-1α过表达组(P<0.05)(图2)。

图2 各组细胞HIF-1α蛋白表达
2.3 各组细胞的迁移能力比较
Transwell实验显示,miR-7模拟物组迁移率低于对照组(P<0.01),HIF-1α过表达组HIF-1α 蛋白高于对照组(P<0.01),共转染组HIF-1α 蛋白低于HIF-1α过表达组(P<0.05)(图3)。
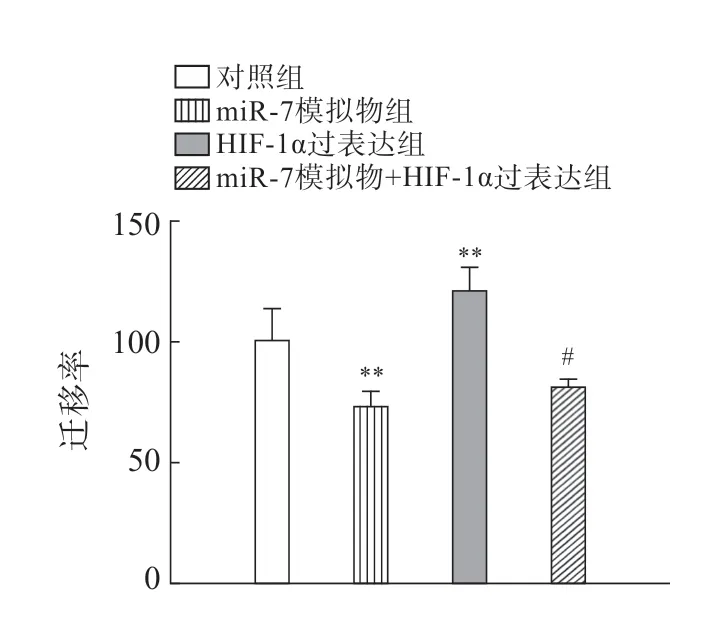
图3 各组细胞迁移能力比较
2.4 各组细胞凋亡率
流式细胞仪对各组细胞凋亡的检测显示,miR-7模拟物组 凋亡率高于对照 组(P<0.01),HIF1α过表达组凋亡率低于对照组(P<0.01),共转染组凋亡率高于HIF-1α过表达组(P<0.01)(图4)。

图4 各组细胞凋亡率比较
2.5 各组细胞的克隆形成率
软琼脂克隆形成实验显示,miR-7模拟物组克隆形成率低于对照组 (P<0.01),HIF-1α过表达组克隆形成率高于对照组(P<0.01),共转染组克隆形成率低于HIF-1α过表达组(P<0.05)(图5)。

图5 各组细胞克隆形成比较
2.6 miR-7与HIF-1α靶向关系
荧光素酶实验显示,HIF-1α野生型序列与miR-7互补序列发生突变后,HIF-1α野生型与HIF-1α突变型细胞中荧光素酶活性无明显差异(P>0.05),而在HIF-1α野生型中转染miR-7模拟物后荧光素酶活性降低(P<0.01),但在HIF-1α突变型中转染miR-7模拟物后荧光素酶活性无明显差异(P>0.05)(图6)。

图6 荧光素酶实验验证miR-7与HIF-1α靶向关系
3 讨论
肝癌是我国常见的恶性肿瘤之一,肿瘤转移是引发患者死亡的重要原因[5]。随着近年来对肝癌外科治疗及肝癌分子生物学的认识不断进展,靶向治疗在肝癌治疗中受到关注,寻找合适靶点对改善肝癌患者治疗效果具有重要意义。
miRNA是一类在多种恶性肿瘤组织中异常表达的单链RNA,其中多个家族成员目前已经发现在肝癌中异常表达[6-7]。多项研究显示,miR-7参与了炎症、心肌损伤、恶性肿瘤发生等多个病理生理过程,且与患者预后密切相关[8-10]。在目前发现的大多数恶性肿瘤中,miR-7主要以抑癌基因角色发挥作用,而其在肝癌中具体作用机制尚未完全研究清楚。本次研究通过构建miR-7高表达的肝癌细胞系,采用软琼脂克隆形成实验分析各组干细胞特性,miR-7模拟物组克隆形成率高于对照组,提示miR-7可能通过抑制肝癌细胞干性来抑制肝癌进展。此外,肝癌患者病情恶化及远期转移与肿瘤迁移能力有关,而迁移能力也是评价肿瘤细胞恶性程度的重要参考指标[11]。本研究中miR-7模拟物组细胞迁移率低于对照组,凋亡率高于对照组,提示miR-7可抑制细胞转移和促进细胞凋亡。相关研究显示,miR-7可参与肿瘤细胞的上皮间质化(EMT)过程从而起到抑癌作用,促进细胞凋亡[12]。有研究显示,miR-7能在体外实验中通过抑制PI3K/Akt信号通路抑制乳腺癌细胞的增殖和转移[13]。还有研究表明,miR-7能抑制基质金属蛋白酶-9(MMP-9)和干细胞标志物Nanog表达[14],这可能是miR-7可影响肝癌细胞转移和凋亡的原因。
肝癌发展过程常伴过度的细胞增殖和不充分血管化,细胞慢性暴露在低水平氧环境会引发肿瘤区产生被低氧细胞包裹的坏死区,因此缺氧也是肿瘤微环境的组成部分[15-16]。相关研究显示,HIF-1α是肿瘤发展过程常见的缺氧诱导因子,常在肿瘤细胞中表达上调,能促进EMT过程而促进肿瘤的侵袭和转移[17]。此外,HIF-1α还能促进血管内皮生长因子转录从而促进血管的生成[18]。目前已有大量研究显示HIF-1α在肝癌组织和细胞中呈高表达,可通过影响细胞增殖、凋亡、迁移等多个过程促进肝癌发生发展[19-20]。本研究结果显示,与对照组相比,HIF-1α过表达组细胞迁移率、克隆形成率均偏高、细胞凋亡率偏低就证实了这一点。此外,本研究结果还显示miR-7模拟物组HIF-1α mRNA及蛋白均表达下调,且共转染组低于HIF-1α过表达组,提示miR-7可能抑制了HIF-1α表达。双荧光素酶实验显示,miR-7能靶向作用于HIF-1α的3'UTR,两者之间存在靶向调控关系,提示miR-7可通过下调HIF-1α表达从而参与肝癌进展。此外,与HIF-1α过表达组相比,转入miR-7模拟物的共转染组细胞HIF-1α 蛋白、细胞迁移率、克隆形成率降低,而凋亡率升高,提示miR-7可抑制HIF-1α表达从而降低肝癌细胞迁移能力、干细胞特性,促进其凋亡。
综上所述,miR-7靶向HIF-1α可降低肝癌细胞迁移、干细胞特性,促进细胞凋亡,而miR-7及HIF-1α有望成为肝癌治疗的新靶点。
