siRNA下调VEGF基因沉默对人舌癌细胞株Tca8113的生物学作用
2019-11-26崔云峰金明光
崔云峰,金 月,魏 来,金明光
(1.北京劲松口腔医院,北京100020;2.长春工业大学医院 口腔科;3.长春市中医院 口腔科;4.吉林大学口腔医院)
近年来,抗血管生成治疗已成为治疗肿瘤的新策略,尤其是血管内皮生长因子(vascular endothelial growth factor VEGF)与肿瘤的发生,发展,浸润,转移的关系备受关注,VEGF水平表达升高与多种肿瘤不良预后密切相关[1],因此抑制VEGF基因表达,可阻止肿瘤细胞的生长,研究显示,VEGF在舌癌组织中呈高表达状态[2]。故本研究应用siRNA沉默VEGF基因表达。旨在为人口腔舌癌基因治疗提供理论依据。
1 材料与方法
1.1 材料人舌癌细胞株(Tca8113细胞)由北京大学口腔医院馈赠,实验所用试剂均购自武汉博士德生物工程有限公司。MTT(噻唑蓝)试剂购美国sigma公司。反转录聚合酶链反应(RT-PCR)试剂盒(日本Takara公司)。
1.2 方法
1.2.1siRNA的制备参照[3]进行操作,略加改进。
所有siRNA都通过T7RNA聚合酶体外转录法进行,具体操作参照promega T7 Ribo-MAX Express RNAi syste 试剂盒方案。
1.2.2细胞培养及siRNA转录参照[4]进行。
2 结果
2.1 siRNA转染24 h后Tca8113细胞增殖变化转染24 h后各组Tca8113细胞有明显的改变,与空载体对照组相比,无论在细胞形态学方面还是细胞增殖数量均明显不同见图1、2。

图1 脂质体对照组细胞(100×) 图2 siRNA转染组细胞(100×)
2.2 Westeen Blot结果
转染正义链siRNA1的Tca8113细胞蛋白表达明显被抑制,与错义链siRNA2脂质体容载量siRNA3及对照组相比有明显差异,见图3,表明siRNA可有效特异的抑制VEGF蛋白表达、证明其转染的siRNA是成功的。同时抑制了Tca8113细胞的增殖。

1.siRNA1 2.siRNA2 3.siRNA3 4.正常对照组
2.3 MTT结果
结果显示siRNA 正义组与脂质体组及正常对照组之间相比差异显著,P<0.01,而脂质体组,错义组与正常对照组相比无显著差异,P>0.05.证明重组的siRNA降低Teag8113细胞代谢,能够特异的抑制Tca8113细胞的增殖。见表1。
2.4 流式细胞术结果
在共转染Tea8113细胞培养24 h后,进行流式细胞仪分析,结果显示,G0/G1期细胞增多,S期细胞减少, G2/M期细胞相对增多,且细胞凋亡率升高与脂质体空载组及正常对照组相比差异非常显著。见表2。

表1 siRNA正义组与其他各组对Teag8113细胞增殖抑制率

表2 转染siRNA24 h后细胞周期进程及凋亡率
2.5 VEGF含量表达
siRNA转染Teag8113细胞上清液中VEGF含量检测明显低于各对照组,差异有统计学意义。见表3。
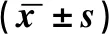
表3 各组Teag8113细胞培养上清中VEGF含量表达
3 讨论
siRNA干扰是近年来发展起来的特异性调控基因表达的分子生物学技术,小分子RNA按照碱基互补配对原则,与靶基因特异性结合并使其降解、沉默、从而抑制基因的表达。本研究利用siRNA干扰技术,共转染VEGF siRNA小片段分子,可特异有效的下调Tca8113细胞的VEGF基因沉默。从而抑制Tca8113细胞的增殖[5]。研究结果显示,共转染siRNA24 h后,Tca8113细胞增殖数量明显减少。与对照组及空载组、错义组相比差异有显著意义。细胞增殖变缓,数量减少。Western Blot结果亦印证Tca113细胞RNA蛋白量减少,细胞增殖发生了特异性抑制现象。MTT结果表明共转染的siRNA正义组与siRNA错义组、脂质体空载组、正常对照组之间差异非常明显,P<0.01,证明siRNA能够降低Tca8113细胞的代谢。此外,本研究应用流式细胞术法检测共转染的siRNA Tca8113细胞周期与细胞凋亡率的改变,结果显示,共转染的细胞与对照组细胞相比,其细胞周期有明显的S期,G2/M期阻滞,G0/G1期细胞增多与对照组相比差异有统计学意义。细胞不能进入S期,造成G2/M期细胞相对增多,而G2/M期细胞增多是细胞凋亡的普遍反应。细胞周期与细胞凋亡看似相互独立的生殖过程,实际上是统一在整个细胞的网络中,并通过一系列调控机制协调两者之间的关系[6]。即可阻滞细胞周期进程,还可引起细胞凋亡。
VEGF不仅是新生血管形成的前提条件,同时也是促进肿瘤生长和转移的重要因素,因此抗血管生成已成为目前肿瘤治疗的重要方向。尤其在晚期肿瘤治疗中VEGF及VEGFR抑制剂已经陆续取得成功。期待未来能够开展更多的临床研究。
本研究通过共转染技术,从基因水平上观察其对肿瘤细胞凋亡和细胞周期的影响。为肿瘤的基因治疗提供了一条新的思路。
