竹荚鱼冻藏过程中肌肉品质与蛋白质理化性质的变化及其相关性分析
2022-06-11李红月王金厢李学鹏励建荣李婷婷王明丽郭晓华于建洋劳敏军
李红月,王金厢, ,李学鹏, ,励建荣,李婷婷,林 洪,王明丽,郭晓华,于建洋,劳敏军
(1.渤海大学食品科学与工程学院,辽宁锦州 121013;2.大连民族大学生命科学学院,辽宁大连 116600;3.中国海洋大学,山东青岛 266100;4.蓬莱京鲁渔业有限公司,山东烟台 265600;5.山东美佳集团有限公司,山东日照 276815;6.荣成泰祥食品股份有限公司,山东威海 264309;7.浙江兴业集团有限公司,浙江舟山 316120)
竹荚鱼(Trachurus japonicus)属鲈形目,鲹科鱼类,又名马鲭鱼、巴浪鱼,主要分布于中国沿海、日本、朝鲜半岛、越南等西北太平洋地区。竹荚鱼属暖水性中上层鱼类,生产快,捕捞量居全球单一捕捞品种的第三位,在世界海洋渔业中占有极其重要的地位,我国农业农村部也将其列入我国远洋渔业重点捕捞和研究对象[1]。竹荚鱼的蛋白质和血红素含量丰富,且富含多种不饱和脂肪酸、维生素A、E及钙、锌、铁等矿物质,同时因其产量大、价格低、刺少、口感柔中带韧,深受消费者欢迎。
竹荚鱼与大多数海水鱼一样,远洋捕捞之后不易存活,故需立即冷冻以保持其鲜度,实现长途运输和销售[2]。诸多研究表明[3-5],冷冻条件下,肌肉组织中的大部分水分会发生冻结,机体内的生化反应和微生物腐败作用得到有效抑制,故冷冻贮藏相对于其他贮藏方式能够较大程度地延长鱼肉货架期。但在冻藏过程中,肌细胞内形成的冰晶会对肌肉组织造成不可逆的机械损伤,使鱼肉在解冻时出现严重的汁液流失现象[6]。同时,鱼肉中的蛋白质、脂肪会氧化变性,发生一系列不良的物理化学反应,造成鱼肉品质的下降,影响其商品价值[7]。开展竹荚鱼冻藏过程中的品质监控和快速评价具有重要的现实意义。
目前鱼类新鲜度品质评价的方法主要有传统的感官评价、物理评价(色泽、质构、系水力、电特性参数和冰晶等)、化学评价(挥发性盐基氮(TVB-N)、K值、pH、酸价、过氧化物含量、羰基化合物含量、硫代巴比妥酸(TBA)值和组胺值等)和微生物评价(菌落总数(TVC)和特定腐败菌(SSO))。近年来新型的无损检测技术逐渐被研究和应用,如光谱技术(拉曼光谱、荧光光谱、红外光谱、核磁共振氢谱)、光学成像技术(光谱成像、计算机视觉技术)、感官仿生技术(电子鼻、电子舌)和生物传感器技术(酶传感器、抗体传感器、微生物传感器)等[8-11]。尽管当前大多数新型评价技术都是基于水产品品质变化规律和传统新鲜度品质评价指标发展而来的[12-16],但目前在冷冻水产品上的应用仍较少,新型评价技术的适用性仍有待提高。因此研究鱼类冻藏过程中的品质与蛋白质理化性质变化规律,可为其品质特征指标的筛选、监测模型的构建以及新型品质评价技术的开发提供理论依据。本研究采用真空包装(VP)、空气包装(AP)两种方式,以L*、a*、b*、白度值、pH、电导率、质构、冰晶大小及形态、K值和总蛋白二级结构、肌原纤维蛋白的Ca2+-ATP酶活性、总巯基含量、活性巯基含量等为指标,研究竹荚鱼在冻藏过程中(-18 ℃,90 d)的品质变化规律,并通过相关性分析挖掘新鲜度品质的特征指标,以期为冷冻海水鱼的品质监测与货架期预测提供参考。
1 材料与方法
1.1 材料与仪器
速冻竹荚鱼(Trachurus japonicus) 2020年9~10月购于广东省潮州市饶平县三百门码头,体重(100±5) g,体长(19±2) cm,体宽(5±0.5) cm;三羟甲基氨基甲烷(Tris)、乙二胺四乙酸(EDTA)、5,5'-二硫代双(2-硝基苯甲酸)(DTNB)、甲醇(色谱级)、Ca2+-ATPase测试盒 北京索莱宝科技有限公司;磷酸二氢钠、磷酸氢二钠、氢氧化钠、硫酸铜、酒石酸钾钠、盐酸胍、尿素、无水乙醇、氯化钠、戊二醛、磷酸氢二钾、磷酸二氢钾 天津市福晨化学试剂厂,以上药品均为分析纯。
JA4103分析天平 上海舜宇恒平科学仪器有限公司;CR-400色彩色差计 日本Konica-Minol-ta公司;E-1045镀金仪 日本日立公司;S-4800场发射扫描电镜 日本Minolta公司;FE30电导率仪上海梅特勒-托利多仪器有限公司;TA-XT Plus质构仪 英国Stale Micro System公司;LabRAM HR Evolution拉曼光谱仪 HORIBA公司;RCD-1A高速分散均质机 常州越新仪器制造有限公司;Biofuge Stratos台式高速冷冻离心机 美国Thermo公司;DK-8D电热恒温水槽 上海一恒科技有限公司;AF-10全自动雪花制冰机 上海斯科茨曼制冰机系统有限公司;UV-2550紫外可见光分光光度计苏州岛津仪器有限公司。
1.2 实验方法
1.2.1 前处理 对冷冻的竹荚鱼进行单条真空包装(VP)、空气包装(AP)后,置于常用冻藏温度-18 ℃恒温冰箱中冷冻贮藏。样品到达实验室当天记为0 d,以10 d为间隔周期,流水解冻样品、测定相关指标。
1.2.2 色泽 取竹荚鱼背部肌肉,去皮去红肉,切成10 mm×10 mm×8 mm的小块,发色30 min,采用CR-400色彩色差计CIELab系统测量其色泽变化。CIELab系统中,L*(lightness) 称为明度指数,L*=0表示黑色,L*=100表示白色,中间有100个等级;a*(redness/greenness)、b*( yellowness/blueness)表示不同的色彩方向,a*表示红绿方向,b*表示黄蓝方向[17]。按照公式计算其白度:
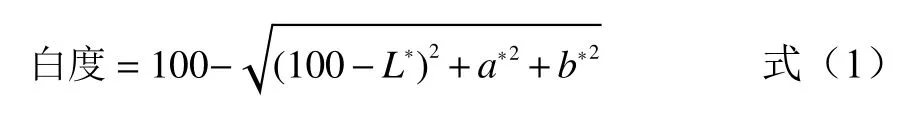
1.2.3 电导率 准确称取绞碎的去皮去红肉的竹荚鱼背部肉5 g于洁净烧杯中,加入45 mL蒸馏水,充分搅拌后静置30 min,用中速定性滤纸过滤,取滤液15 mL,在室温(20±2)℃下采用1413 μs/cm标准液校准后的电导率仪(FE30)测定滤液的电导率。
1.2.4 冰晶大小及形态 利用扫描电镜(SEM)测试。取冻结的竹荚鱼背部中间肌肉,将其切成8 mm×8 mm×3 mm的鱼块,用体积分数2.5%的戊二醛溶液(含50% 0.2 mol/L,pH 7.2的磷酸盐缓冲液)固定24 h后,用上述磷酸盐缓冲液漂洗15 min,重复3次,蒸馏水漂洗1 h,再依次用50%、60%、70%、80%、90%和100%的梯度乙醇溶液脱水15 min,每个梯度重复3次,室内放置12 h,置于干燥皿内保存待测。样品测试时,离子溅射镀金,在电压1 kV、电流10 μA和放大300倍的条件下观察鱼肉样品的微观结构[1]。
1.2.5 质构特性 参考Utreram等[18]的方法并略作调整:取竹荚鱼背部中间肌肉,将其切成10 mm×10 mm×5 mm的鱼块,采用两次咀嚼测试(TPA),采用5点取样法和P/50探头对鱼块进行测定。参数设定:测前速度1.00 mm/s,测试速度1.00 mm/s,测后速度1.00 mm/s,压缩比50%,触发力5.0 g,探头两次测定间隔时间5.0 s。得到样品的硬度(hardness,指样品第一次压缩时的最大峰值)、内聚性(cohesiveness,指样品内部的粘合性)、咀嚼度(chewiness,指咀嚼固体食品到可吞下状态过程中所做的功)和回复性(resilience,样品在第一次压缩过程中回弹的能力,是第一次压缩循环过程中返回样品所释放的弹性能与压缩时探头的耗能之比),各参数的计算方法参考文献[17]中的方法。
1.2.6 K值 参考Choi等[19]的方法并略作改动。取5 g碎鱼肉加入25 mL预冷的5%高氯酸后均质(7000~8000 r/min,1.5 min),4 ℃、3000 ×g离心10 min,取上清液10 mL,用KOH溶液(10 mol/L)调节pH至6.5~6.8,静置20 min后再次离心(条件同上),取上清液,用预冷的超纯水定容至25 mL,0.22 μm的水相滤膜过滤,-80 ℃冰箱中保存待测。
检测参数:色谱柱BDS C18(250×4.6 mm),流动相磷酸二氢钾(0.04 mol/L)和磷酸氢二钾(0.06 mol/L)的混和液,流速0.8 mL/min,检测波长254 nm,柱温35 ℃,上样量20 μL。K值计算公式如下:
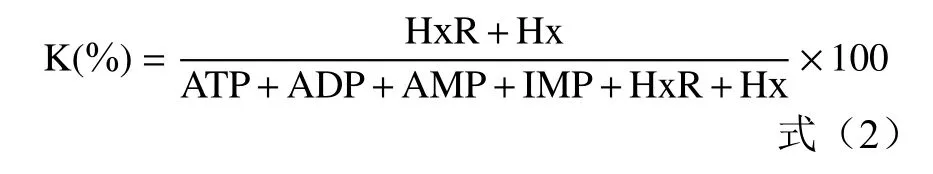
式中:HxR表示肌苷;Hx表示次黄嘌呤;ATP表示三磷酸腺苷;ADP表示二磷酸腺苷;AMP表示一磷酸腺苷;IMP表示肌核苷酸。
1.2.7 硫代巴比妥酸值(TBA值) 参考周明珠等[20]的方法:称取8 g碎鱼肉,加入20 mL蒸馏水,均质(8000 r/min,30 s),再加入20 mL 5% TCA(三氯乙酸)溶液,搅拌均匀后,静置30 min,过滤。取5 mL上清液,加入5 mL 0.02 mol/L TBA溶液,80 ℃水浴40 min,冷却至室温后,在波长532 nm处测定吸光度,计算TBA值。
1.2.8 拉曼光谱 取适量解冻后的竹荚鱼背部肌肉置于载玻片中央,使用拉曼光谱仪的LabSpec6软件在50倍物镜下进行测定,采用氩离子激光器作为光源。参考李文协等[21]设定参数:功率120 mW,激发波长532 nm,曝光时间60 s,扫描次数为3次,扫描范围400~4000 cm-1。拉曼图谱处理采用PeakFit和LabSpec软件。二级结构计算使用Alix公式。
1.2.9 肌原纤维蛋白的提取 参考Benjakul等[22]的方法并略作改动。将切碎的竹荚鱼背部肌肉与4倍质量的缓冲液A(10 mmol/L Tris-HCl,pH7.2)匀浆(13000 r/min,匀浆三次,每次匀浆1 min、停1 min),经冷冻离心(4 ℃,1500 g,20 min)后弃上清,重复洗涤一次后,将沉淀物与5倍质量的缓冲液B(10 mmol/L Tris-HCl,0.6 mol/L NaCl,pH7.2)匀浆(条件同上),冷冻离心(条件同上)后,使用4层滤布过滤上清液,即得肌原纤维蛋白溶液。将其置于4 ℃冰箱保存,并于2 d内完成各指标的测定。
1.2.10 Ca2+-ATPase活性 用缓冲液B将肌原纤维蛋白溶液稀释至5 mg/mL,再用Ca2+-ATPase测试盒测定其Ca2+-ATPase活性。
1.2.11 总巯基与活性巯基含量 采用5,5'-二硫代双(2-硝基苯甲酸)(简称DTNB)法[23]进行测定。用缓冲液B将肌原纤维蛋白溶液稀释至5 mg/mL。
总巯基的测定:取0.5 mL蛋白溶于4.5 mL 缓冲液C(1% Tris,4 mmol/L EDTA,92 mmol/L甘氨酸,8 mol/L 尿素,pH8.0)中,充分振荡,加入0.5 mL DTNB(10 mmol/L,以50 mmol/L pH7.0的磷酸缓冲液为溶剂配制),将混合液在25 ℃保温30 min。于412 nm波长处测定吸光度。空白组为0.5 mL 缓冲液B+4.5 mL缓冲液C+0.5 mL DTNB。
活性巯基的测定:取1 mL蛋白溶于9 mL缓冲液D(含1% Tris,4 mmol/L EDTA,92 mmol/L甘氨酸,pH8.0)中,充分震荡,加入1 mL DTNB(同上),将混合液在4 ℃保存1 h,再在5000 g,4 ℃条件下离心10 min,取其上清液于412 nm波长下测定吸光度,空白组为1 mL 缓冲液B+9 mL 缓冲液D+1 mL DTNB。
肌原纤维蛋白中总巯基/活性巯基含量按照如下公式计算:
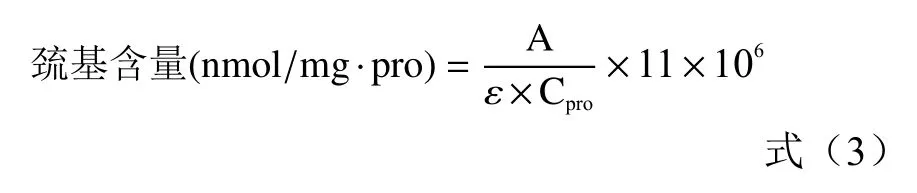
式中:A表示吸光值;ε表示巯基摩尔消光系数,为13600 L/(mol·cm);11表示稀释倍数;Cpro表示取样蛋白质的浓度,mg/mL。
1.3 数据处理
每组数据生物学重复测定3次,质构数据生物学重复测定6次,实验数据使用IBM SPSS 22.0软件(美国IBM公司)进行ANOVA差异显著性分析、独立样本T检验和Pearson相关性分析,以Duncan’s法进行检验,取95%置信度(P<0.05),结果以“均值±标准差”表示。利用Origin 2018 (美国OriginLab公司)、LabSpec 5(日本HORIBA公司)、PeakFit 4.12(美国Systat Software公司)、Tbtools 1.89.0.0(中国CJchen)等软件作图。
2 结果与分析
2.1 竹荚鱼冻藏过程中色泽的变化
在冻藏过程中,鱼肉色泽会由于脂肪氧化、色素降解等反应而发生一定的变化,使得消费者的可接受性降低[24-25]。从表1中可以看出,随着冻藏时间的延长,两组样品L*值和白度值均显著增加(P<0.05),a*值和b*值均显著减少(P<0.05)。其中,样品初始的L*值、a*值、b*值和白度值分别为40.73、2.48、7.32和40.23,经过90 d的冷冻贮藏,AP组的L*值和白度值分别增至50.77、50.71,分别增长了19.78%、20.67%,a*值和b*值分别降至-0.49、2.39,分别下降了119.76%和67.35%,VP组的L*值和白度值分别增至50.95、50.93,分别增长了20.06%、21.01%,a*值和b*值分别降至-0.73、1.30,分别下降了129.44%和82.24%。说明鱼肉冻藏期间,亮度逐渐增加,样品色泽由鲜红转变为黄绿,这可能是肌球蛋白逐渐变性导致的[26]。通过显著性分析可知,在90 d的冻藏过程中,两组样品的L*值并无显著性差异,a*值和白度值在冻藏70 d时组间差异显著,b*值在冻藏70和90 d时组间差异显著,这可能是因为后期的冰晶大小及形态不一、蛋白氧化程度略有不同[27-28],导致两组样品的色泽参数有所差异。
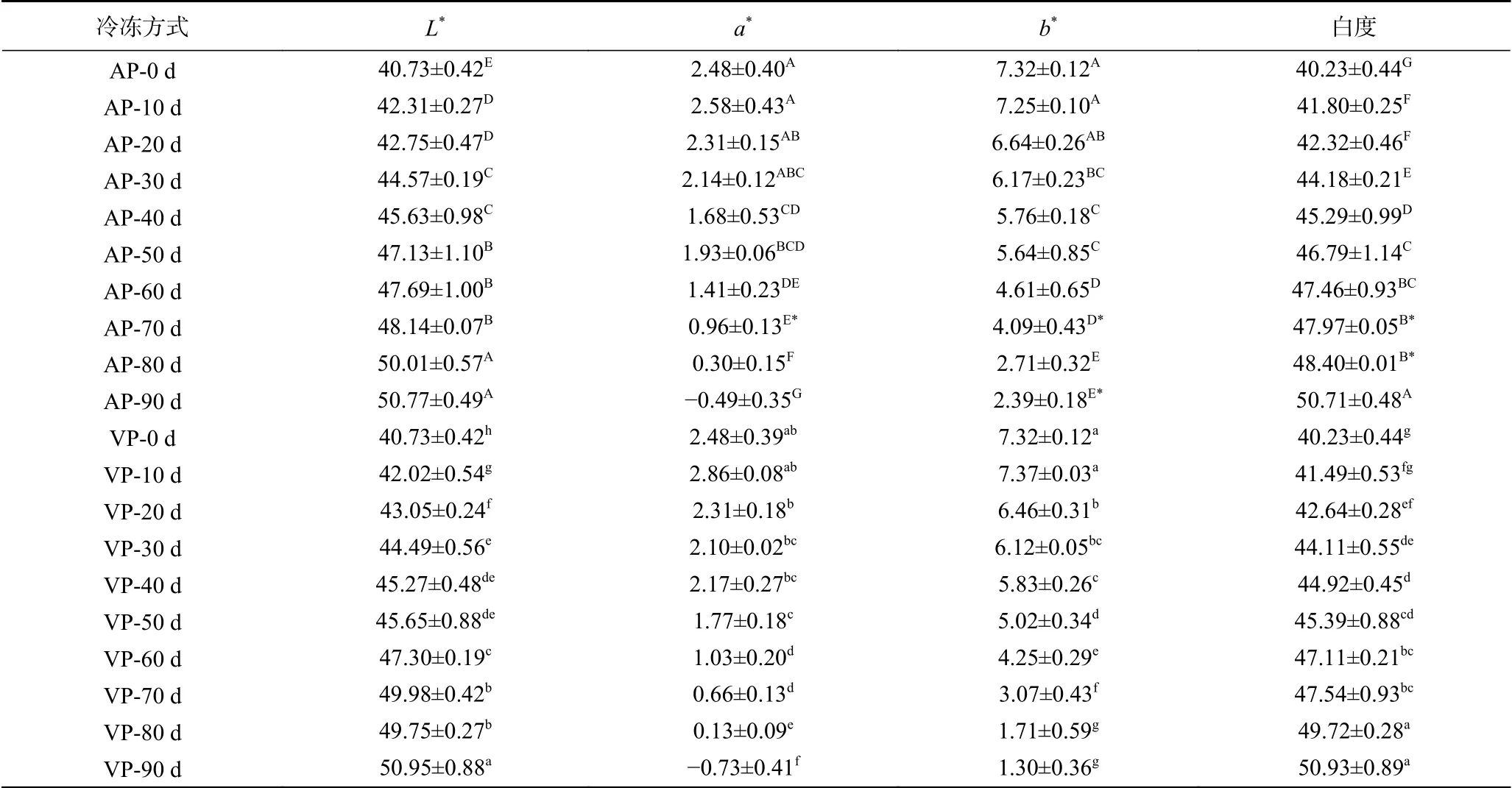
表1 竹荚鱼冻藏期间色泽的变化Table 1 Changes of color of T. japonicus during frozen storage
2.2 竹荚鱼冻藏过程中电导率的变化
鱼肉的电特性(电阻、电导率和电容)是评价鱼肉品质的一个参考指标[29]。一般情况下,随着贮藏时间的延长,鱼体内的自溶酶、消化酶与细菌繁殖过程中生成的胞外酶协同作用,分解肌肉组织中的蛋白质、脂肪等大分子物质,生成氨基酸、有机酸、短链脂肪酸等带电小分子物质,使鱼肉溶液中的电解质增多,电导率增大,鱼肉品质降低[30-31]。图1为竹荚鱼肉溶液的电导率随冻藏时间的变化。由图1可知,冻藏0 d时,竹荚鱼肉电导率较低,为1561.67 μs/cm;随着贮藏时间的增加,两组样品电导率均呈先增大(P>0.05)后减小(P<0.05)的整体变化趋势,且均在50 d时达到最大值1924.83 μs/cm。冻藏前期(0~30 d)电导率缓慢增加,甚至略有减少,这可能是因为竹荚鱼死后体内糖原消耗较少,进入僵硬期较迟,也可能是因为冻藏初期酶和微生物的活性被抑制,催化反应进行得较为缓慢。冻藏50 d后,电导率持续下降,可能是因为贮藏过程中鱼肉汁液流失,带走了部分电解质。80~90 d时,电导率有些许回升,可能是因为鱼肉组织结构遭到破坏、细胞内溶物溢出造成的[32-33]。两组样品在统计学上无显著性差异(P>0.05),说明空气、真空两种包装方式对竹荚鱼肉的电导率影响不大。

图 1 竹荚鱼冻藏期间电导率的变化Fig.1 Changes of electrical conductivity of T. japonicus during frozen storage
2.3 竹荚鱼冻藏过程中冰晶大小与形态的变化
在冻藏过程中,鱼肉组织中的冰晶会逐渐生长且发生重结晶,使肌肉组织结构受到机械损伤、蛋白质发生变性,造成样品持水力的下降,不仅使鱼肉汁液损失严重,还会使其营养价值降低、风味变差,严重影响鱼肉品质。图2为不同包装处理的竹荚鱼背部肌肉横切面扫描电镜(SEM)图(图中空洞可反映冰晶大小和形态)。如图所示,不同包装方式竹荚鱼肉的冰晶形态随冻藏时间的不同而发生改变。可以看出,随着冻藏时间的延长,两组样品的冰晶孔隙均有不同程度的增大,说明冰晶体积在不断增大,并不断对鱼肉造成机械损伤[34]。相同冻藏时间内,VP组样品冰晶直径较小,形态较为圆润,排布均匀而规则。直到冻藏90 d后,VP组样品的肌肉组织结构被严重破坏,冰晶结构发生极明显变化,冰晶边缘变得参差不齐。而AP组的冰晶形态从冻藏初始即大小不一,且从图中可知,冻藏80 d后,其肌肉纤维开始断裂,冰晶结构变得不规则、发生明显变化。SEM结果表明,在样品冻藏过程中,真空包装处理可以更好地保持鱼肉组织结构的完整性。
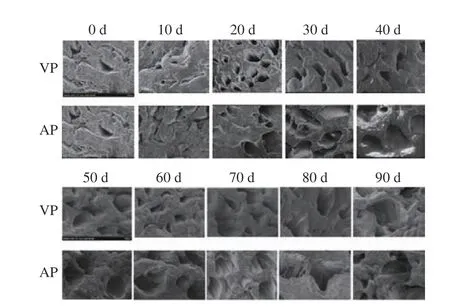
图 2 竹荚鱼冻藏期间的肌肉横切面微观结构扫描电镜图(300×)Fig.2 Scanning electron microscope view of transverse section microstructure of T. japonicus muscle during frozen storage (300×)
2.4 竹荚鱼冻藏过程中质构的变化
质构特性能够在一定程度上反映鱼肉的感官品质。表2中记录了不同包装方式的竹荚鱼背部肌肉在冻藏期间的硬度、内聚性、咀嚼度和回复性的变化。硬度是鱼肉贮藏过程中较易发生变化的指标之一。大多样品的硬度值出现在最大变形处,能够反映鱼肉在受到压力时的抵抗力大小。从表2可以看出,冻藏初始时,竹荚鱼的硬度为2156.79 g,内聚性0.53,咀嚼度799.35,回复性0.17,该结果与王雪松等[35]研究的流水解冻的竹荚鱼硬度为3128.45 g、内聚性0.367、咀嚼度724.07的结果相似。经过了90 d的冷冻贮藏,VP组、AP组的样品硬度分别降至257.00和309.26 g,分别下降了85.66%(P<0.05)和88.08%(P<0.05)。两组样品的内聚性呈先升高后降低的趋势,咀嚼度均随冻藏时间的延长而显著下降(P<0.05),VP组的回复性整体呈现下降趋势(P<0.05),AP组则波动较大,下降趋势不明显(P>0.05)。综上来看,冻藏期间的竹荚鱼肉质构不断劣变,究其原因,可能是肌肉蛋白的变性使二硫键含量降低,疏水相互作用减弱,冰晶的重结晶作用也会使肌肉的组织结构不断被破坏[24,36]。这也与总蛋白二级结构和扫描电镜的测试结果相吻合。许多研究得出了类似的结论。杨永安等[37]探究了不同温度波动对冻藏三文鱼质构的影响,发现随着冻藏时间的延长,各处理组(-50±0.1、-18±0.5、-18±1、-18±2 ℃)的三文鱼肉硬度、弹性、咀嚼度均在降低。唐佳楣等[38]在研究不同冻结方法对大黄鱼冻藏期间的品质影响时发现,不同冻结速率处理组(普通慢冻、酒精速冻和液氮速冻)的大黄鱼在冻藏过程中,硬度、弹性、胶着度和回复性均呈现下降的趋势。可见,冻藏会降低鱼肉的硬度、弹性、咀嚼度、胶着度、回复性等质构特性,且冻藏时间越长,降低程度越大。
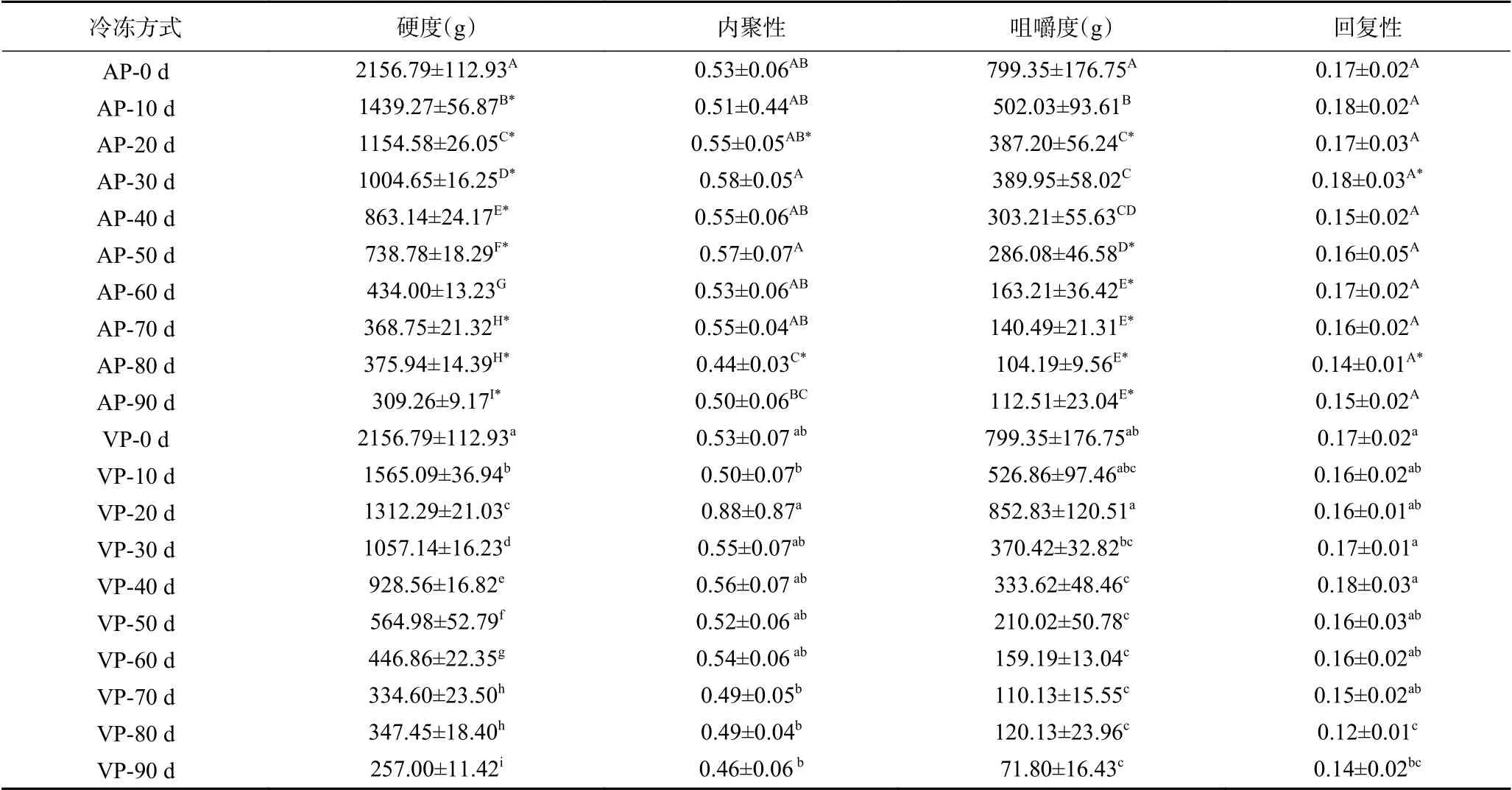
表2 竹荚鱼肉质构特性随冻藏时间的变化Table 2 Changes of texture characteristics of T. japonicus muscle with frozen storage time
2.5 竹荚鱼冻藏过程中K值的变化
K值是ATP降解产物(HxR和Hx)与ATP关联物(ATP、ADP、AMP、IMP、HxR和Hx)总量的比值,是反映冷冻水产品新鲜度品质的重要指标。一般认为,鱼肉K值小于20%时,是一级鲜度,可用于生食,20%~40%时为二级鲜度,可在加工、烹饪后食用,当鱼肉K值介于40%~60%之间时,为三级鲜度,此时濒临腐败,当K值大于60%时,鱼肉即达到腐败标准[39-40]。由图3可知,随着冻藏时间的延长,两组鱼肉的K值均显著性升高(P<0.05),且呈现前期增长缓慢,后期增长迅速的趋势。冻藏初始时,鱼肉K值为29.93%,即大于20%,处于二级鲜度的水平,这可能是因为鱼在捕获、速冻、运输过程中,ATP降解较多,新鲜度略有降低。一般情况下,在初期生化变化阶段,糖原的酵解(生成1 mol葡萄糖的同时可生成2 mol ATP)和ATP的降解同时进行,ATP含量可基本不变,而HxR和Hx等ATP降解产物增多,K值即呈现上升趋势。冻藏10 d时,VP组K值稍有降低,而AP组几乎没有变化,这可能是因为VP组样品的ATP降解缓慢,生成的HxR和Hx含量较少导致的。冻藏60 d时,两组鱼肉K值分别为62.42%、52.82%;冻藏70 d时,分别为70.38%和80.06%,表明两组鱼肉在冻藏60~70 d后已经腐败变质。冻藏90 d时,VP、AP组样品K值分别升高至95.76%和96.37%,已经达到严重腐败的程度。相较于前人研究[41],本研究中鱼肉K值同期增长较快,这可能与鱼内脏和微生物有关,微生物会导致HxR转变为Hx,进而使K值升高。总体上看,真空、空气两种包装方式对竹荚鱼肉K值的变化没有显著影响。
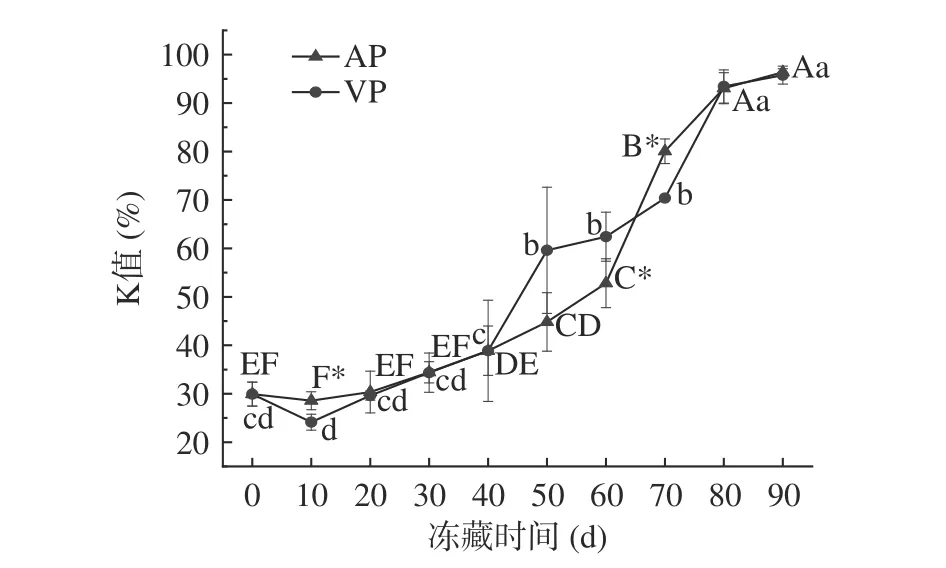
图 3 竹荚鱼冻藏期间K值的变化Fig.3 Changes of K value of the muscle of T. japonicus during frozen storage
2.6 竹荚鱼冻藏过程中TBA值的变化
动物性食品中含有大量的脂肪和蛋白质,在储存过程中容易氧化,影响其质量。作为一种富含脂肪的鱼类,脂质氧化对竹荚鱼冻藏品质变化影响较大。TBA值与鱼类脂肪氧化程度有较强的正相关性,已被许多国家公认为评价脂肪氧化程度的指标,其限值主要取决于样品中不饱和脂肪酸的含量[36,42]。由图4可知,样品初始TBA值为0.201 mg MDA/kg,随着冻藏时间的延长,AP组、VP组样品的TBA值均显著升高(P<0.05),且均于70 d后达到最大值,分别为2.16、1.57 mg MDA/kg。有研究表明,当鱼肌肉中的TBA值达到1~2 mg时,即会产生难以接受的气味[42];也有报道称,TBA值的最大限制为2 mg MDA/kg[43]。本研究中,AP、VP组样品冻藏70 d后表现出腐败,其TBA值分别达到2.16和1.57 mg MDA/kg,与刘璘等[44]研究的冷藏竹荚鱼菌落总数超过国家限定标准时,其TBA值为1.70~1.75 mg MDA/kg的研究结果相一致。两组样品之间具有显著性差异(P<0.05)。鱼肉TBA值在冻藏前期和中期(0~70 d)均上升,后期(80~90 d)略有下降,与Aubourg等[45]、Hematyar等[46]的研究结果的趋势相同,这可能是由于脂肪氧化分解的二次产物丙二醛与肌肉中的氨基发生反应,形成NH=CH-CH2-CHO,降低了反应底物浓度,导致TBA值降低[24,47-48]。此外,也可能是因为丙二醛不稳定,容易分解为有机醇和有机酸[24,48]。
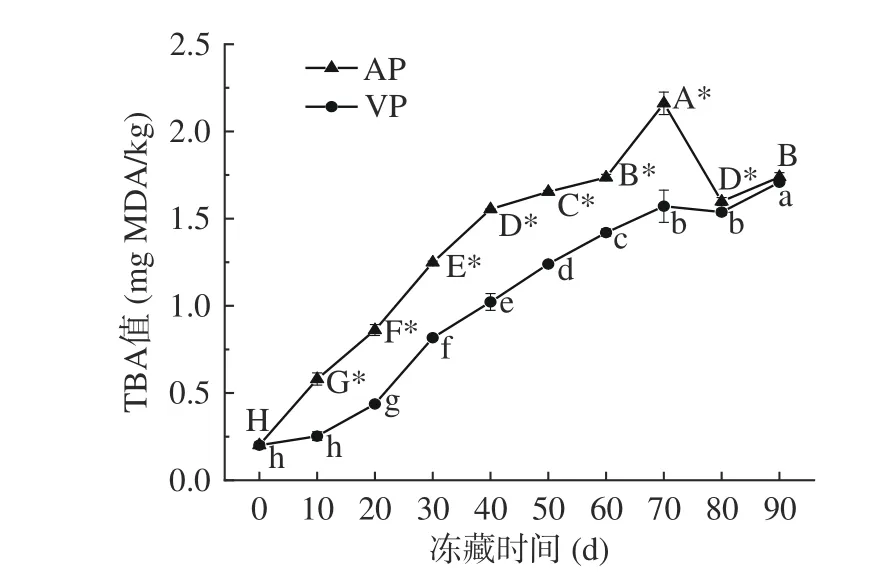
图 4 竹荚鱼冻藏期间TBA值的变化Fig.4 Changes of TBA value in T. japonicus during frozen storage
2.7 竹荚鱼冻藏过程中拉曼光谱及总蛋白二级结构的变化
拉曼光谱可以有效地表征蛋白多肽链的骨架结构、侧链微环境等,进而获取蛋白质空间构象的信息。图5为经平滑、去基线后的竹荚鱼肉冻藏过程中的拉曼图谱(800~1800 cm-1)变化示意图,其中酰胺I带(1645~1685 cm-1)的振动主要来自于酰胺C=O伸缩和N-H弯曲,其主要归属峰的位置和对应的构象为:α-螺旋(1654 cm-1)、β-折叠(1666 cm-1)、β-转角(1683 cm-1)和无规则卷曲(1662 cm-1),可用来分析测试样品肌原纤维蛋白的二级结构[49]。从图5中可以看出,随着冻藏时间的不断增加,两组样品酰胺I带的特征峰均蓝移,且AP组先于VP组,说明AP组的鱼肉样品变性更快。
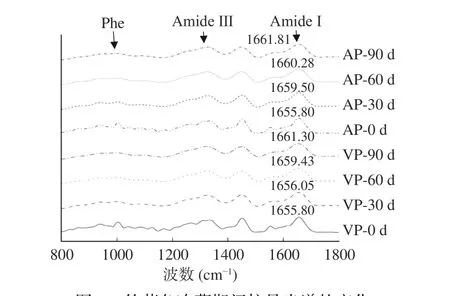
图 5 竹荚鱼冻藏期间拉曼光谱的变化Fig.5 Changes of Raman spectra of the muscle of T. japonicus during frozen storage
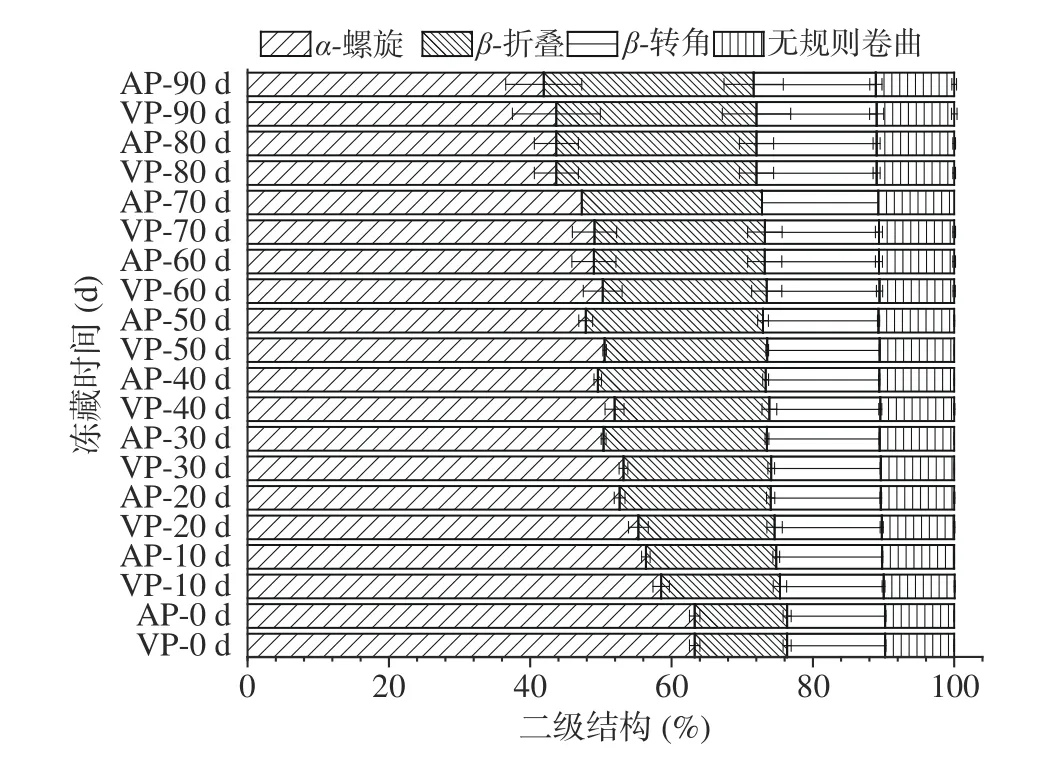
图 6 竹荚鱼冻藏期间酰胺I区蛋白质二级结构百分含量分布图Fig.6 Distribution map of protein secondary structure percentage content in amide I domain of T. japonicus during freezing storage
图6是经Alix公式计算得出的冻藏期间两组样品酰胺I区蛋白质二级结构的百分含量变化示意图。随着冻藏时间的延长,两组样品的α-螺旋百分含量显著降低(P<0.05),β-折叠、β-转角和无规则卷曲的百分含量均显著升高(P<0.05)。具体来看,在0~90 d的冻藏期内,VP组、AP组样品的α-螺旋含量由63.28%分别减少到43.70%、41.91%,同比降低了30.94、33.77个百分点;β-折叠含量由13.07%分别增加至28.31%、29.71%,同比升高了53.83、56.01个百分点;β-转角含量由13.89%分别增加至17.01%、17.29%,同比升高了18.34、19.66个百分点,无规则卷曲由9.76%增加到10.98%、11.09%,同比增加了11.11和11.99个百分点。结果表明,竹荚鱼肉在冻藏过程中,肌原纤维蛋白逐步变性、变得无序化,可能是因为冰晶的生长和重结晶破坏了肌原纤维蛋白的空间构象,也可能是因为蛋白酶的作用,使得肌原纤维蛋白中Z线脆弱、断裂,组织中胶原分子结构改变,结缔组织发生变化[24,50]。经过90 d的冻藏期,VP组比AP组样品的α-螺旋百分含量高4.10%,β-折叠、β-转角和无规则卷曲的百分含量分别低4.71%、1.62%和0.99%,这可能是因为真空包装有效隔绝了样品与空气之间的接触,降低了组织蛋白酶对肌原纤维蛋白氧化作用的程度,一定程度上稳定了肌原纤维蛋白的构象,减缓了肌原纤维蛋白的变性。
2.8 竹荚鱼冻藏过程中肌原纤维蛋白Ca2+-ATPase活性的变化
ATP酶是生物膜上的一种蛋白酶,可分解ATP生成ADP和无机磷,存在于组织细胞及细胞器的膜上。Ca2+-ATPase活性与肌球蛋白的头部结构密切相关,已被广泛用来表征肌球蛋白的完整性和蛋白变性程度[51-52]。由图7可知,随着冻藏天数的增加,两组鱼肉的肌原纤维蛋白Ca2+-ATPase活性显著降低(P<0.05)。冻藏0 d时,肌原纤维蛋白Ca2+-ATPase活性为0.939 mmol Pi/mg Pro/hour,冻藏90 d后,VP组、AP组的Ca2+-ATPase活性分别为0.342、0.258 mmol Pi/mg Pro/hour,分别下降了63.58%、72.52%。该结果与马超锋[28]研究的罗非鱼片在-20 ℃条件下贮藏90 d后Ca2+-ATPase活性下降了约75%、周果等[53]研究-20 ℃冻藏30 d后的鲐鱼Ca2+-ATPase活性下降了约70%、Jiang等[54]研究遮目鱼的Ca2+-ATPase活性在冻藏8周后相对初始值0.62 μmol(Pi)/mg/10 min下降了79%的变化结果较为一致。两组样品的Ca2+-ATPase活性均在40 d前(冻藏前期)快速下降,40 d后(冻藏后期)缓速下降,与钱攀[55]研究的液体快速冻结(-18、-25 ℃)对鳙鱼品质的影响中所得结果相似。Ca2+-ATPase活性的降低可能是因为,鱼肉组织中冰晶的生长导致体系离子强度升高,使得肌球蛋白头部区域的微观结构遭到破坏,酶功能区减小甚至消失[28],也可能是因为巯基分子间生成了二硫键,导致蛋白质发生聚集造成的[29],还可能是因为贮藏过程中,肌球蛋白之间的氢键或疏水键增强导致肌浆球蛋白功能障碍,进而使Ca2+-ATPase活性下降[30]。

图 7 竹荚鱼冻藏期间肌原纤维蛋白Ca2+-ATPase活性的变化Fig.7 Changes in Ca2+-ATPase activity of T. japonicus myofibrillar protein during frozen storage
2.9 竹荚鱼冻藏过程中肌原纤维蛋白总巯基及活性巯基含量的变化
巯基反应活性极强,被认为是蛋白质中最具功能性的基团,在鱼肉贮藏过程中易被氧化成二硫键,对于蛋白质的空间结构有重要意义[21,56]。许多研究学者认为,巯基氧化形成二硫键,是引起蛋白质分子间交叉、联结、聚合的主要原因,故通过测定巯基的含量能够了解竹荚鱼肉在冻藏过程中的肌原纤维蛋白空间结构的变化情况[57-58]。图8为不同包装方式竹荚鱼冻藏期间总巯基和活性巯基含量的变化,可以看出,两组样品的总巯基和活性巯基含量均随冻藏时间的延长而显著降低(P<0.05),与Ca2+-ATPase活性、α-螺旋百分含量的变化趋势一致,也与钱攀[59]研究的冻藏鳙鱼总巯基含量随时间延长显著下降的结果相一致。说明巯基不断被氧化成二硫键,使肌原纤维蛋白的变性程度不断加深,且巯基氧化生成二硫键与肌球蛋白变性存在一定联系[29]。VP组样品在冻藏前期(0~60 d)的总巯基、活性巯基含量均显著高于AP组(P<0.05),冻藏后期(60~90 d)均显著低于AP组(P<0.05),与质构、K值的结果类似。表明冻藏前期隔绝氧气有利于竹荚鱼新鲜度品质的保持。
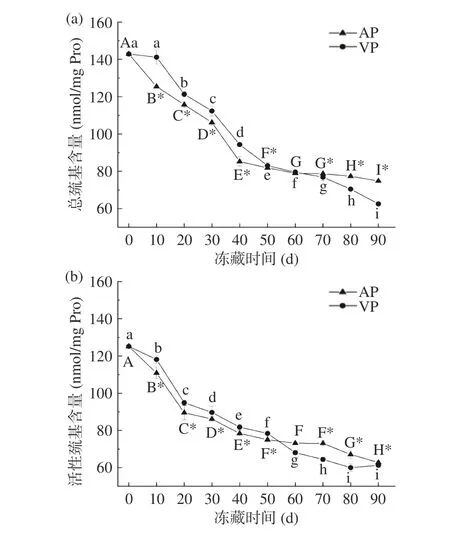
图 8 竹荚鱼冻藏期间肌原纤维蛋白(a)总巯基和(b)活性巯基含量的变化Fig.8 Changes of (a) total and (b) active sulfhydryl content of myofibrillar protein in T. japonicus during frozen storage

图 9 竹荚鱼冻藏过程中肌肉品质指标和蛋白质理化指标的相关性分析Fig.9 Correlation analysis between muscle quality indexes and protein physiochemical indexes of T. japonicus during frozen storage
2.10 相关性分析
为了进一步探究两种包装方式的竹荚鱼在冻藏过程中的品质变化规律,对上述品质指标和蛋白质理化指标进行了相关性分析,结果见图9。由分析结果可知,两组鱼肉的K值、L*值、a*值、b*值、白度值、硬度、咀嚼度、总巯基、活性巯基、TBA值、Ca2+-ATPase活性、α-螺旋、β-折叠、β-转角和无规则卷曲百分含量均与冻藏时间呈极显著性相关(P<0.01),回复性显著性相关(P<0.05),电导率、内聚性无显著相关性(P>0.05)。这主要是因为在冻藏过程中,鱼体中的蛋白质、脂肪、ATP等大分子物质不断地被氧化、降解,肌肉的组织结构逐渐松散、结合力下降,所以总巯基、活性巯基、Ca2+-ATPase活性、总蛋白二级结构、色泽参数、TBA值、K值、硬度、咀嚼度、回复性均呈现线性变化趋势,与冻藏时间极显著(P<0.01)或显著性相关(P<0.05),而电导率、内聚性因为受到诸多因素如细胞液浓度、蛋白质变性程度、肌肉组织间结合力等[24,33]的影响,在冻藏过程中呈现非线性变化趋势,且与冻藏时间无显著相关性(P>0.05)。
分析理化指标之间的相关性可知,冻藏竹荚鱼的K值、色泽、硬度、咀嚼度、TBA值、巯基含量、Ca2+-ATPase活性和蛋白二级结构百分含量之间均呈极显著(P<0.01)或显著(P<0.05)相关性,而电导率、粘聚性、回复性与其他理化指标之间均无显著相关性(P>0.05)。表明鱼肉色泽、硬度的变化与蛋白质氧化变性、脂肪氧化降解、ATP降解密切相关,原因可能是蛋白质中的巯基氧化成二硫键,导致α-螺旋相对百分含量下降,进而导致蛋白内部结构变得无序,蛋白质分子之间发生交叉、联结、聚合,从而ATP酶活性区减小甚至消失,再加之脂肪氧化程度逐步加深,所以肌肉品质逐渐劣变[57-59](本研究中表现为鱼肉色泽由鲜红转变为黄绿、硬度逐渐下降)。且蛋白质氧化指标(巯基含量、Ca2+-ATPase活性和蛋白二级结构百分含量)和脂肪氧化指标(TBA值)之间极显著相关(P<0.01),也从侧面验证了脂肪氧化降解的同时可能也会诱导蛋白质氧化[24]。因硬度的测量误差较大,故可将K值、色泽、TBA值、巯基含量、Ca2+-ATPase活性、二级结构百分含量作为评价竹荚鱼冻藏过程中品质变化的有效指标。
虽然,目前关于鱼肉贮藏期间的品质指标之间的相关性分析已经有一些报道[60-61],如徐晓蓉等[2]研究得出冷链马鲛鱼的TVB-N、组胺、感官评分与时间、pH值、菌落总数等呈极显著(P<0.01)或显著(P<0.05)相关性,而TBA值与pH值、菌落总数之间无显著相关性(P>0.05)。石钢鹏等[62]研究了大口黑鲈鱼肉冻藏过程中蛋白特性地变化,结果表明盐溶性蛋白与Ca2+-ATPase活性、羰基、表面疏水性、最大荧光强度呈极显著相关(P<0.01),与48 kDa Ac、MLC-3电泳条带呈显著相关(P<0.05)。蓝蔚青等[63]研究了模拟冷链流通过程中大目金枪鱼的品质变化,发现鱼肉的高铁肌红蛋白质量分数、TVB-N、组胺、菌落总数之间互呈显著正相关(P<0.01,P<0.05)。但是,诸位学者研究结果不尽相同[2,25,31,59,64],这可能是因为鱼的种类、致死方式、贮存条件和样品处理、分析仪器等的不同而导致的,故还需大量研究数据加以支撑,以完善相关评价方法。今后研究可以公认度较高的品质指标为基础进行相关性分析,如冷藏水产品以TVB-N或组胺为指标,冷冻水产品以K值或Ca2+-ATPase活性为指标。
3 结论
随着冻藏时间的延长,真空和空气包装竹荚鱼肉的K值、L*值、白度值、TBA值均逐渐升高,其中K值冻藏90 d后分别增加了65.83%和66.44%。鱼肉的冰晶孔隙在冻藏过程中逐渐增大,a*值、b*值、硬度、咀嚼度、回复性逐渐下降,内聚性和电导率先升高后降低。从蛋白质理化指标看,α-螺旋百分含量由63.28%分别降低到43.70%、41.91%,β-折叠、β-转角、无规则卷曲百分含量逐渐升高,肌原纤维蛋白的总巯基、活性巯基含量逐渐下降,Ca2+-ATPase活性逐渐降低,分别下降了63.58%和72.52%。两种包装方式对竹荚鱼冻藏期间的肌肉品质影响差异不大,但从蛋白理化特性看,真空包装略优于空气包装。相关性分析结果表明,竹荚鱼肉的K值、L*值、a*值、b*值、白度值、硬度、咀嚼度、总巯基、活性巯基、TBA值、Ca2+-ATPase活性、二级结构含量均与冻藏时间呈极显著性相关(P<0.01),且这些指标两两之间也均呈极显著(P<0.01)或显著(P<0.05)相关。因此除常用指标K值外,色泽、TBA值、巯基含量、Ca2+-ATPase活性、总蛋白二级结构含量等指标也可作为评价竹荚鱼冻藏过程中品质变化的有效指标。后续研究中,可结合这些特征指标,尝试开发新型的新鲜度品质评价技术,进而实现冻藏鱼类新鲜度的快速判别与监测。
