基于网络药理学探讨山楂叶抗高脂血症的作用机制及初步验证
2022-06-11刘学贵李知明刘长风周静瑶王瑶瑶高品一李丹琦
刘学贵,李知明,刘长风,周静瑶,王瑶瑶,高品一, ,李丹琦
(1.沈阳化工大学功能分子研究所,辽宁沈阳 110142;2.硼镁资源开发与精细化工技术国家地方联合工程实验室,辽宁沈阳 110142;3.沈阳化工大学制药与生物工程学院,辽宁沈阳 110142;4.沈阳化工大学环境与安全工程学院,辽宁沈阳 110142;5.辽宁省绿色功能分子设计与开发重点实验室,辽宁沈阳 110142)
高脂血症(hyperlipidaemia,HLP)是由本身血脂代谢异常而引起的疾病,常表现为血清高密度脂蛋白胆固醇(HDL-C)降低或总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)升高[1]。高脂血症不仅仅是肥胖和2型糖尿病等疾病的致病因素,还与高血压、脂肪肝、动脉粥样硬化等代谢型疾病密切相关[2]。目前,高脂血症的治疗药物以西药辛伐他汀、普伐他汀、非诺贝特、氯贝特等为主[3-4],这类药物具有明确效果,但靶点单一,长期使用常伴有副作用,如胃肠道不良反应、肝肾功能损害等,并且停药后反弹几率高[5]。因此,植源性药物的研究成为人们关注的热点[6]。相关研究发现许多天然产物中的黄酮类和皂苷类等化学成分能够对肝脏脂质代谢系统进行调节,从而达到降血脂的目的[7]。
山楂(Crataegus pinnatifidaBunge),又名山里红,蔷薇科山楂属,落叶乔木。山楂具有降血脂、血压、强心、抗心律不齐等作用[8]。大多数山楂属植物具有深绿色的叶子,白色的花和深红色的果实[8]。山楂叶是山里红的干叶,三角卵形或宽卵形,无毛,锯齿在边缘处,具有3~7片裂片,味涩,微苦[9-11]。山楂叶作为药用植物有着悠久的历史,其已用于癌症、心血管疾病和糖尿病的治疗[12-16]。刁婷婷等[17]以高脂血症大鼠为研究对象,发现经过山楂叶总黄酮灌胃处理的大鼠肝脏组织中的(AMPK)表达增加,脂肪酸合成速度减缓,脂质代谢能力加强,并且脂肪变性程度有所减轻。肖峰等[18]研究发现,山楂叶总黄酮可以调节血脂水平,降低游离脂肪酸含量,进而起到抗炎抗氧化损伤的作用。
网络药理学是一个综合性的概念,是在当前环境下将网络生物学、化学生物学和系统生物学相互结合而衍生出来的一门新兴学科。2007年英国科学家Hopkins为了研究多组分药物之间的协同性和规律性,以寻找低毒性和高效性的药物,提出了网络药理学这一概念[19]。网络药理学主要是通过网络构建、网络分析和实验验证的方式将网络信号靶点和传统实验相结合,不但为寻找中药和方剂的作用机制提供了新的方法,而且还可以加快药物的研发进程[20]。本文运用网络药理学的方法,探究了山楂叶有效成分对高脂血症疾病网络的作用机制,进而预测出山楂叶中抗高脂血症的良好化合物以及对应的靶点蛋白,为山楂叶中活性化合物的开发与利用提供支持。
1 材料方法
1.1 材料与仪器
荭草苷 阿拉丁生化科技股份有限公司;齐墩果酸、毛蕊花糖苷、芦丁、牡荆素、4%多聚甲醛、油酸、异丙醇、阿托伐他丁 上海麦克林生化科技有限公司;牡荆素-2"-O-鼠李糖 由作者课题组分离、纯化和制备得到;ERK2激酶 日本Carna公司;Staurosporine(星形孢菌素) 美国Med Chem Express公司;DMSO、MgCl2、DTT、Triton X-100、Brij-35、ATP
美国Sigma公司;Peptide 8 岛津GL公司;HEPES、EDTA、10%胎牛血清 澳洲Gibco公司;人体肝癌HepG2细胞株 上海富衡生物科技有限公司;MEM培养基、胰蛋白酶 美国Hyclone公司;油红O染液、苏木素染液、PBS缓冲液、甘油三酯( TG )试剂盒、BCA蛋白测定试剂盒 南京建成科技有限公司;4% 组织细胞固定液 北京索莱宝科技有限公司。
CLM-170B-8-NF酶标仪、二氧化碳恒温培养箱
美国Thermo公司;TS-1恒温培养摇床 上海一恒科学仪器有限公司;AE31E倒置显微镜 美国Motic公司;BS 224 S电子分析天平 瑞士梅特勒托利多公司;HH-ZK2恒温水浴锅 郑州予仪器制造有限公司;TGL-16医用离心机 湘仪集团;LX-B35 L自动电热压力蒸汽灭菌器 华泰医疗设备有限公司。
1.2 实验方法
1.2.1 化合物的收集和结构处理 经过对山楂叶化学成分文献的调研和本实验组前期工作,共整理出116个以黄酮类化合物为主的化合物[21-27],使用Chem Biodraw Ultra 14.0软件绘制其化学结构,并以MOL2格式进行保存。
1.2.2 高脂血症潜在靶点的收集 以“Hyperlipidemia”、“Hyperlipemia”、“High cholesterol”等为关键词,利用GeneCards数据库、Therapeutic Target Database、DrugBank以及Uniprot数据库进行检索,查找筛选出40个分辨率不高于3.0 Å且拥有原始配体的人源靶点蛋白。
1.2.3 “化合物-靶点”网络的构建 利用Sybyl-X(version 2.0,Tripos,Inc.)对靶点蛋白进行修饰,将修饰好的蛋白和保存好的MOL2格式的化合物进行半柔性分子对接,将对接得分大于8的化合物和靶点蛋白共同导入Excel表格,利用Cytoscape v3.7.1软件构建化合物-靶点蛋白网络。
1.2.4 蛋白相互作用网络的构建 将1.2.3得到的山楂叶活性成分和高脂血症交集的靶点导入到STRING数据库,群种定义为人类,最小交互阈值设置为0.4,其他参数默认。将得到的结果导入Cytoscape v3.7.1软件中,生成PPI网络。
1.2.5 GO生物过程和KEGG信号通路富集分析
将需要分析的基因提交到DAVID平台中,选定人的全基因作为背景,对疾病的相关靶点进行GO和KEGG富集分析,得到生物过程、细胞成分、分子功能和关键信号通路的富集信息,利用R软件对富集P值小于0.05的功能进一步分析。
1.2.6 “化合物-靶点-信号通路”构建 将化合物、信号通路和靶点之间的联系利用Cytoscape v3.7.1软件建立,即构建化合物-靶点-信号通路网络以识别他们之间的关系。网络特征分析由软件中的“network analyzer”程序完成以此来初步得出化合物与靶点蛋白之间的作用情况和靶点蛋白在相关通路之间的联系。
1.2.7 ERK2激酶抑制活性实验 丝裂原活化蛋白激酶MAPK,是一组高度保守的丝氨酸/苏氨酸蛋白激酶,包括细胞外信号调节激酶(ERK)、c-Jun氨基端激酶(JNK)、p38MAPK、ERK5[28],MAPK的激活是脂肪形成的重要组成部分[29]。ERK是MAPK主要的通路之一,位于MAPK通路的下游,MAPK的所有突变和扩增最终都会导致ERK的异常激活[30-31]。细胞中脂滴的形成依赖于ERK2的激活,抑制ERK2能显著降低VLDL脂解后的脂滴积累[32]。同时,一些体内实验表明一些促脂肪剂抑制MEK/ERK活性可以阻止脂肪细胞的生成,降低体内整体血脂水平以治疗高脂血症[33]。因此,抑制ERK2被认为是治疗高脂血症的潜在途径。
本文以ERK2为靶酶,STS(星形孢菌素)为阳性对照药,基于网络药理学的预测结果,结合实验组前期从山楂叶中分离得到的代表性和量大的化合物,选取6个(牡荆素、齐墩果酸、毛蕊花糖苷、芦丁、荭草苷、牡荆素-2-O鼠李糖苷)委托上海睿智化学研究有限公司采用迁移率改变法[34]进行活性验证实验:
制备激酶液(50 mmol/L HEPES,pH7.5,0.01%Triton X-100)和停止液(100 mmol/L HEPES,pH7.5,0.015% Brij-35,0.2 % 涂层试剂 #3,50 mmol/L EDTA)。
将待测化合物在DMSO中制备成10 mmol/L的储备液。随后再用DMSO稀释至5000 μmol/L。取100 μL,添加到96孔板中。利用梯度稀释的方法将化合物配制成100、10 μmol/L和1 μmol/L的稀释液。
取5 μL的稀释液加入到混合有10 μL DMSO和90 μL的1×激酶缓冲液的检测板中。在1×激酶基缓冲液中加入激酶,配成2.5×酶溶液。在检测板上每孔加入10 μL 2.5×酶液,在室温条件下孵育10 min。孵育完成后向每个孔中加入10 μL的2.5×肽溶液(在1×激酶缓冲液中含有FAM标记的肽、ATP以及MgCl2的肽溶液)以开始反应,并在28 ℃的环境中孵育30 min。加入25 μL停止液,反应结束。
使用EZ ReaderⅡ(Caliper Life Sciences,Waltham,MA,USA)(下游电压-500 V,上游电压-2250V,基础压力-0.5 PSI,屏幕压力-1.2 PSI)对所有样品进行分析,以读取转换值,抑制率百分比如式1所示。

注:max代表DMSO对照的转换值;min代表无酶对照的转换值;conversion代表给定化合物剂量下的转换值。
1.2.8 分子对接 本文利用Auto Dock vina 1.1.2软件基于ubuntu 20.04系统进行对接。蛋白被设定一个分子口袋后,小分子以半柔性对接的方式与其对接。对接完成后对小分子和蛋白之间的结合能力进行打分。根据得分高低判断其相互作用力。
本文将阳性对照药(STS)、牡荆素、齐墩果酸、芦丁、荭草苷、牡荆素-2 O鼠李糖苷和毛蕊花糖苷分别与ERK2(4QTA)对接。
1.2.9 高脂HepG2细胞模型建立与甘油三酯含量测定 作为检测组织内油脂的常用试剂,油红O能够使脂肪组织及细胞内的脂滴着色[35],而被广泛用于临床和科研病理的工作中[36]。本文采用油红O对油酸处理的HepG2细胞进行染色。HepG2细胞用含10% 胎牛血清的培养液培养,并在培育箱中孵育。待生长密度达80%~90%时吸取2 mL的细胞接种于六孔板内(约15万个/孔),置于37 ℃,5%的CO2条件下培养24 h,设置空白组、油酸模型组和药物处理组,如表1所示。

表1 细胞加药方法Table 1 Operation method of cell administration
将六孔板中的培养液吸出,用PBS和60%异丙醇分别将细胞漂洗两次,避光条件下加入1 mL油红O染液,在37 ℃恒温箱下保持15 min,用60%异丙醇和蒸馏水分别进行漂洗,之后加入0.5 mL苏木素,复染30 s。用显微镜观察,采集清晰图像,并用100%异丙醇提取染色脂滴,在490 nm处测定其吸光度。
有研究发现,阿托伐他汀(ATS,一类降低人体内胆固醇水平的药物)可以有效降低体内的血脂水平[37]达到降血脂的目的。本文为检验牡荆素对脂质的抑制作用效果,在油酸存在的情况下,用100 μmol/L阿托伐他汀处理油酸组HepG2细胞作为阳性对照组,然后用油红O进行染色,在显微镜下观察,并在490 nm处测定其吸光度。另取一块培养条件相同的六孔板去除其上的培养液,用胰蛋白酶对细胞进行消化。然后在室温条件下,将细胞悬液放入离心机,以1000 r/min离心10 min,去除上清液,将0.5~1 mL的PBS加入进细胞沉淀中混匀,重复操作1~2次,并在冰上加入裂解液进行裂解。裂解后按照说明书操作TG试剂盒,用酶标仪检测波长510 nm处的吸光度,用BCA试剂盒检测蛋白浓度,计算甘油三酯含量(如式2所示)。
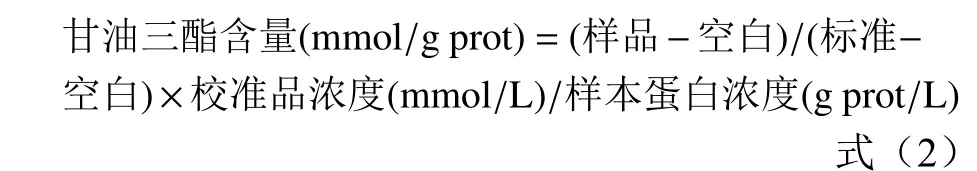
2 结果与分析
2.1 有效成分-作用靶点网络图分析
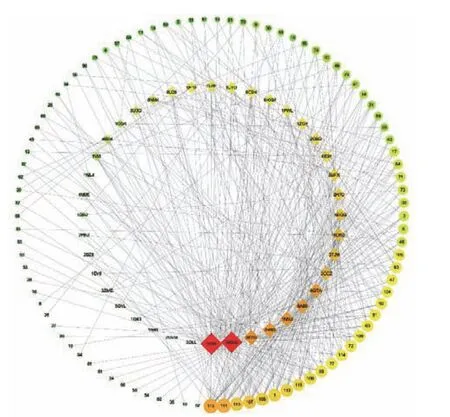
图 1 化合物-靶蛋白网络图Fig.1 Network of compound-target protein
通过网络药理学分析山楂叶中116个活性成分和40种高脂血症相关蛋白靶点的相互作用,分析结果表明山楂叶中有93种化合物分别与这40种高脂血症的蛋白可以相互结合。将对接得分大于8的化合物与蛋白汇总到Excel表格中并导入Cytoscape v3.7.1中(如图1所示)。整个网络以网络拓扑结构表示,其中正方形代表高血脂的靶点蛋白,圆形代表山楂叶中的活性化合物。通过Network Analysis分析,结果如下:该网络由133个节点和441条边组成,网络异构性为1.167,网络密度为0.050,网络的半径和直径分别为4和6,网络中心度为0.349,特征路径长度为2.793,相邻平均数目为6.632。其中,Erythro-1-(4-O-β-D-Glucopyranosyl-3-methoxyphenyl)-2-[4-(3-hydroxypropyl)-2,6-dimethoxyphenoxy]-1,3-propanediol(112)、Verbascoside(111)、(7S, 8R)-5-Methoxydihydrodehydrodiconiferyl alcohol 4-O-β-Dglucopyranoside(113)、Acernikol-4''-O-β-D-glucopyranoside(107)、(2,3-Dihydro-2-(4-O-β-D-glueopyranosyl-3-methoxy-Phenyl)-3-hydroxymethyl-5-(3-hy droxypropyl)-7-methoxybenzofuran)(108)、Rutin(1)等为山楂叶抗高脂血症的潜在化合物,靶点蛋白3V99(Arachidonate 5-lipoxygenase)、3WEG(Squalene synthase)、3E7G(Nitric-oxide synthase inducible)、1N5U(Serum albumin)、6A93(Hydroxytryptamine receptor 2A)、4QTA(Mitogen-activated protein kinase 1)、3CCZ(HMG-CoA reductase)、3TJM(Fatty acid synthase)等为治疗高脂血症的关键靶点蛋白。
2.2 PPI网络结果分析
将分子对接得到的40个潜在基因靶点导入到STRING数据库中以构建PPI网络,用Cytoscape v3.7.1进行可视化处理(如图2所示)。由图2可知,该网络平均节点度为13.2,平均局部聚类系数为0.791。图中共计包含40个节点,263条边。节点的颜色及大小和高脂血症蛋白靶点的度成正相关,在PPI网络中颜色越深代表他们之间的相互作用关系越强。从图2可以看出,PPARG、GAPDH、ALB、AKT1、INS直至MAPK1等节点颜色深且较大,说明这些靶点可能在高血脂症的发展中起关键作用。

图 2 蛋白相互作用(PPI)网络图Fig.2 Network of protein-protein interaction
2.3 GO和KEGG富集分析
将40个基因导入DAVID数据库进行GO生物富集和KEGG信号通路富集分析。GO分析结果表明与生物过程(BP)有关的项目为163个,与分子功能(MF)相关的项目为48个,与细胞成分(CC)相关的项目为30个。挑选出前15个绘制条形图(如图3所示)。多靶点在BP中对胆固醇生物合成过程、脂质代谢过程、脂蛋白代谢过程、类固醇激素介导的信号通路、胆固醇体内平衡等有较大影响;在CC中对小腔影响较为突出,对高尔基体、胞质、细胞外空隙、核浆等都有影响;在MF中对药物结合、类固醇激素受体活性、RNA聚合酶Ⅱ转录因子活性和配体活化序列特异性DNA结合、酶结合、一致的蛋白质结合等均有重要影响。
在KEGG富集分析中将前20个有明显统计学意义的通路(P<0.01)绘制成气泡图(如图4所示)。在气泡图中,气泡越大代表着所在通路富集的基因越多,同时气泡颜色越深代表基因靶点在此通路上的富集程度越高。由图4可知,与高脂血症较为密切的靶点信号通路主要涉及代谢通路、AMPK信号通路、HIF-1信号通路、胰岛素抵抗、甲状腺激素信号通路、PPAR信号通路、卵巢类固醇生成。
脂质代谢是细胞将营养物质转化为能量的关键过程,是膜生物发生和信号分子产生的基础。在代谢活跃的细胞中,来自线粒体的活性氧过量,细胞外介质作用和细胞内应激都可以启动炎症通路从而启动炎症。Song 等[38]研究发现黑米花色苷能通过调节肥胖小鼠脂代谢和肠道菌群缓解高脂血症、肝脏脂肪变性和胰岛素抵抗。缺氧诱导因子(HIF)是细胞适应缺氧的主要转录因子,普遍存在于哺乳动物的细胞内,一般情况下会被细胞内的酶迅速降解,只有在缺氧的情况下才可稳定表达。研究发现缺氧诱导因子的上调能够增强高脂大鼠缺血后的心脏保护作用[39]。丝裂原活化蛋白激酶(AMPK),即AMP依赖的蛋白激酶,其在各种与代谢相关的器官中均有表达,并且能被机体以各种方式刺激激活。药理学和遗传学研究表明,AMPK能使机体内的葡萄糖维持一个相对稳定的平衡。孙乐[40]研究发现粗壮女贞总苷能够通过促进肝脏中LKB1磷酸化来激活AMPK调节代谢,降低高脂金黄地鼠血脂水平。综上,山楂叶中活性成分可能是通过以上通路为主其他多信号通路相互协调发挥抗高血脂症的效用。
2.4 化合物-靶点-信号通路网络分析
如图5所示,在化合物-靶点-信号通路网络分析中圆形代表山楂叶中化学成分,菱形代表高血脂相关靶点,箭头代表KEGG富集筛选出的信号通路。该网络根据链接值排序,链接值越大,节点面积越大、颜色越深,该网络包括153个节点、1747条边、20个箭头型节点代表的信号通路和40个菱形节点代表的高脂血症靶蛋白以及93个圆形节点代表的山楂叶化学成分,该网络半径和直径分别为3和4,多边缘节点对为263,相邻平均条目为17.294,特征路径长度为2.134,异构性为0.915,中心度为0.585,网络密度为0.114,聚类系数为0.260。由图5可知:化合物112(erythro-1-(4-O-β-D-glucopyranosyl-3-methoxyphenyl)-2-[4- (3-hydroxypropyl)-2,6-dimethoxyphenoxy]-1,3-propanediol)、111(verbascoside)、108((2,3-Dihydro-2-(4-O-β-D-glueopyranosyl-3-methoxy-Phenyl)-3-hydroxymethyl-5-(3-hydroxypropyl)-7-methoxybenzofuran))、107(acernikol-4''-O-β-Dglucopyranoside)、95(norhawthornoid A)、113((7S,8R)-5-methoxydihydrodehydrodiconiferyl alcohol 4-O-β-D-glucopyranoside)、110((7S,8R)-urolignoside)、1(rutin)、115((+)-lariciresinol-4-O-β-D-glucopyranoside)、63(linarionoside B)等在整个网络中起重要的调控作用。有可能抗高血脂的关键靶点为ALOX5、FDFT1、MAPK1、NOS2、CYP7A1、ALB、HTR2A、SLC2A1、HMGCR、FASN,关键信号通路为Metabolic pathways、Pathways in cancer、Toxoplasmosis、HIF-1 signaling pathway、Ovarian steroidogenesis、PPAR signaling pathway、AMPK signaling pathway、Thyroid hormone signaling pathway、Insulin signaling pathway、Serotonergic synapse等。
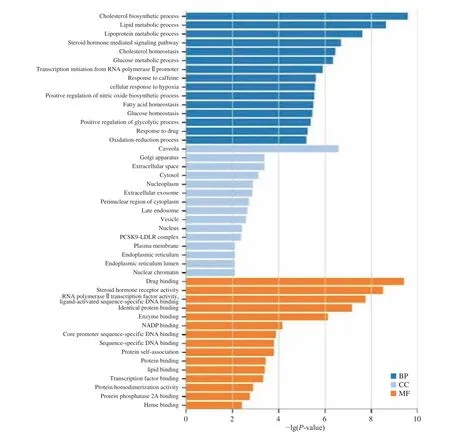
图 3 靶蛋白的GO富集分析图Fig.3 GO enrichment analysis of target proteins

图 4 高脂血症相关潜在靶点的KEGG分析图Fig.4 KEGG analysis of potential targets related to hyperlipidaemia

图 5 化合物-靶点-信号通路网络图Fig.5 Network of compound-target-signal pathway
2.5 激酶验证试验结果
激酶实验结果如表2和图6所示。由表2和图6可知,样品浓度和抑制率呈正相关关系。当化合物测试浓度为100 μmol/L时,牡荆素对ERK2抑制率最高为84%,牡荆素-2"-O-鼠李糖抑制率最弱,抑制率仅为3%。阳性对照药IC50值为0.470 μmol/L,牡荆素IC50值为20.422 μmol/L,其值虽高于阳性对照药,但其仍表现出对ERK2激酶较好的抑制活性。所以,可以认为牡荆素通过对ERK2的抑制以达到降血脂的目的。牡荆素是山楂叶中含量较高的代表性化合物,有报道称其含量可达到31.39%[41],由此,表明在山楂叶抗高脂血症的过程中,牡荆素可能通过与高脂血症的关键靶蛋白相互作用以达到降血脂的目的。

表2 化合物酶抑制活性测试结果Table 2 Test results of enzyme inhibitory activity of the compounds
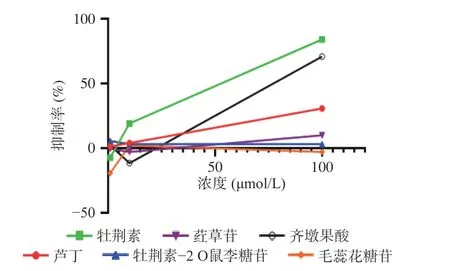
图 6 化合物的ERK2激酶抑制活性Fig.6 Inhibitory ERK2 kinase activity of the compounds
2.6 分子对接模式验证
本文利用分子对接模式来验证六种化合物和阳性对照药(STS)与靶点蛋白的结合能。分子对接的结合能越低,说明配体与受体之间相互作用的可能就越大;一般情况下,当结合能小于-5 kcal/mol时代表两者之间具有良好的结合性[42]。将阳性对照药(STS)、牡荆素、齐墩果酸、芦丁、荭草苷、牡荆素-2 O鼠李糖苷和毛蕊花糖苷分别与ERK2(4QTA)对接,结合能分别为:-9.8、-9.6、-9.4、-8.8、-4.6、-3.9和-3.1 kcal/mol。将对接结果小于-5 kcal/mol的化合物进行分析,STS与ERK2的GLU-33、LYS-54、TYR-36等残基结合(如图7A);牡荆素与LYS-54、SER-153、TYR-36等残基结合(如图7D);齐墩果酸与SER-153、LYS-151、TYR-36等残基结合(如图7B);芦丁为与LYS-151、SER-153、LYS-54和TYR-36相互结合(如图7C)。
对接结果表明,在实验组中牡荆素与ERK2的结合能最低,所得实验结果与激酶实验测定的活性结果相一致。从另一角度验证了激酶活性实验结果的准确性。并且从对接结果可以推测,残基LYS-54和TYR-36可是抑制ERK2激酶活性的主要残基。
2.7 油红O染色及定量试验结果
将处理后的细胞用油红O进行染色,在显微镜下观察,脂滴显示为鲜红色。并在490 nm处测定其吸光度。实验结果表明,浓度为100 μmol/L的阿托伐他汀可减少12.2%的脂滴堆积;分别加入100、50 μmol/L和25 μmol/L的牡荆素后,脂滴聚集分别减少5.4%、2.2%和2.1%,说明牡荆素对脂滴的聚集有一定的抑制作用,且随着浓度增大,抑制作用逐渐增强如图8和图9所示。
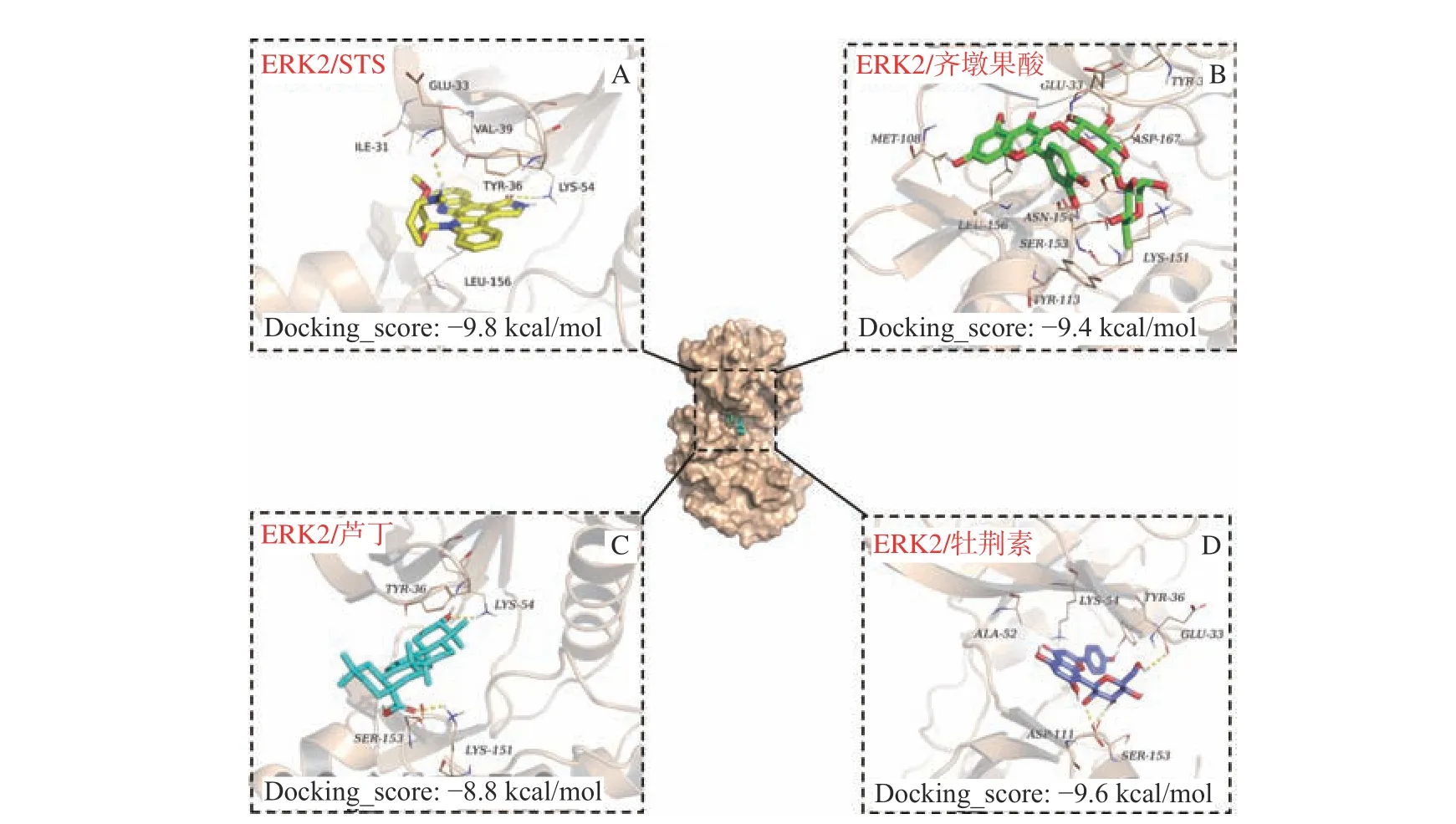
图 7 结合能最低的分子对接模式Fig.7 Docking mode with lowest binding energies

图 8 油红O染色图Fig.8 Oil red O staining chart

图 9 油红O染色定量分析结果Fig.9 Quantitative analysis results of oil red O staining
2.8 甘油三酯(TG)含量测试结果
牡荆素对高脂HepG2细胞甘油三酯含量的影响如表3所示。与空白组相比较,油酸模型组内的TG含量明显增加。当牡荆素浓度为25、50 μmol/L和100 μmol/L时,其处理的细胞的TG含量相比于模型组都有一定程度的降低,并且呈现浓度依赖,浓度为100 μmol/L的效果最好。因此,牡荆素有望作为一种降低细胞内血脂含量的潜在治疗化合物。
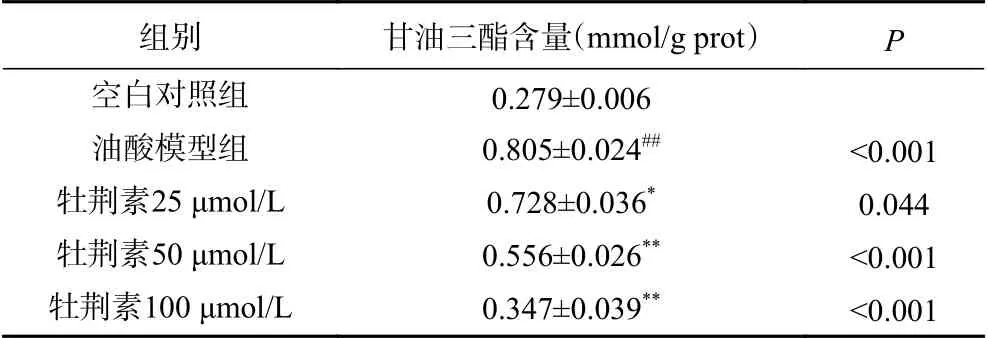
表3 牡荆素对高脂HepG2细胞甘油三酯含量的影响Table 3 Effect of vitexin on triglyceride content in high-fat HepG2 cells
3 结论
本文基于网络药理学的方法对山楂叶所含有的化合物进行了活性筛选、靶点分析和相关靶点通路预测,筛选得到93个活性化合物和40个潜在的高脂血症靶点蛋白以及20个相关靶蛋白的信号通路。在ERK2激酶活性验证实验中,以STS为阳性对照药,齐墩果酸、荭草苷、毛蕊花糖苷、芦丁、牡荆素、牡荆素-2"-O-鼠李糖为待测化合物。上述化合物对激酶都有一定的抑制活性,牡荆素效果最好,其抑制率达到84%,IC50值为20.422 μmol/L。通过分子对接模式,以结合能为指标对激酶结果进行验证,结果表明牡荆素与ERK2蛋白的LYS-54、SER-153、TYR-36等残基能相互结合,结合能最低为-9.6 kcal/mol,与激酶实验结果一致。以HepG2细胞建立高脂血症模型,阿托伐他汀为阳性对照药,当浓度为100 μmol/L时,牡荆素脂滴减少了5.4%,说明牡荆素对脂滴的聚集有一定的抑制作用,且随着浓度增大,其抑制作用逐渐增强。甘油三酯试剂盒测定实验中,甘油三酯含量随着牡荆素增加而减少。以上实验结果证实了网络药理学预测山楂叶中牡荆素对高脂血症具有较好抑制作用。
