浅渍豇豆复合功能发酵剂制备关键技术
2022-06-11范琳琳施亚萍刘小莉
王 英,张 会,范琳琳,施亚萍,傅 青,王 帆,刘小莉,
(1.南京农业大学食品科技学院,江苏南京 210095;2.江苏省农业科学研究院农产品加工研究所,江苏南京 210014;3.南京脆而爽蔬菜食品有限公司,江苏南京 211225)
豇豆因其营养价值高、适应性强、产量高等特性,成为我国南北方广泛栽培的大众化蔬菜之一。但是嫩荚采收后容易产生腐烂变质,因此要提高其商业价值必须采取相应的保鲜或加工手段。其中腌制是长期贮藏蔬菜的主要加工方法之一。接种发酵具有发酵时间短、易控制等优点而逐渐代替自然发酵。目前发酵剂主要有单一菌种和复合菌种两种形式,其中复合菌制剂是将两种或两种以上的菌株混合制成,具有更加全面的发酵效果[1]。Sun等[2]利用复合菌制剂发酵香肠,结果显示复合菌制剂能够充分利用原料,提高产品的营养价值、改善产品的风味品质。李思宁等[3]利用传统发酵剂与动物双歧杆菌、植物乳杆菌共培养对发酵乳抗氧化特性的影响的结果显示,益生菌共培养可以提高发酵乳的抗氧化能力,这种作用主要源于益生菌的蛋白水解特性。曹余等[4]利用库德里阿兹威毕赤酵母、单孢酵母、植物乳杆菌、短乳杆菌、布氏乳杆菌等7株混合发酵搓菜,混合发酵菜种的醇类、酮类、酯类、酸类等风味物质的种类数和相对含量都多于自然发酵。武旭[5]利用纳豆芽孢杆菌与乳酸菌复合发酵全豆豆乳的结果也显示,复合菌剂能够提高全豆豆乳中的粗蛋白、粗脂肪和一些风味物质的含量;郑静芳[6]利用来源于自净能力强鱼塘中菌制备复合发酵剂,复合菌制剂能有效地改善养殖水体质量。以上研究表明,复合发酵剂能够在一定程度上提高发酵产品的品质。
对豇豆的营养功能研究显示,豇豆富含粗纤维、碳水化合物、维生素等,且蛋白质含量高[7]。豇豆具有延缓衰老、促进大肠蠕动、促进胰岛素分泌等功效[8-9]。豇豆嫩荚采收后容易产生腐烂变质,会降低其商业价值。利用复合功能发酵剂,通过浅渍化发酵加工豇豆获得低盐化的功能化发酵产品的研究目前还未见报道。本文以来源于传统发酵食品中的8株乳酸菌为资源,通过菌株间生物相容性、生物功能活性影响及发酵豇豆的特性研究,制备浅渍豇豆的复合功能发酵剂,以降低发酵豇豆的亚硝酸盐含量,同时提升发酵豇豆产品的益生功能。研究结果将为豇豆浅渍发酵工业化生产提供可靠复合功能发酵剂和应用技术指导。
1 材料与方法
1.1 材料与仪器
新鲜采摘嫩豇豆 购于孝陵卫菜场;泡菜盐、花椒、姜片、干红辣椒、冰糖 购于当地苏果超市;氯化钙、柠檬酸、异抗坏血酸 国产食品级;MRS液体培养基、MRS固体培养基 青岛海博生物科技有限公司,按照说明配制固体和液体培养基,121 ℃灭菌20 min;8株乳酸菌 详细信息见表1,均保存于江苏省农业科学院农产品加工研究所食品生物工程研究室;金黄色葡萄球菌(Staphylococcus aureusATCC25923)、Salmonella(ATCC 51812)大肠杆菌、Escherichia coli(ATCC25922) 南京市食品质量监督与检测院。
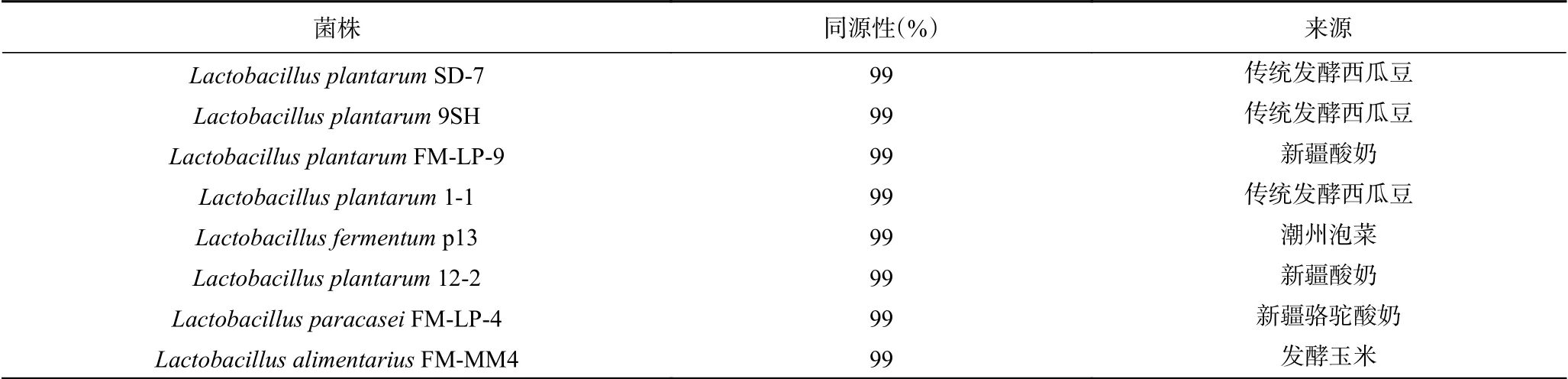
表1 菌株16S rDNA系统发育分析Table 1 Phylogenetic analysis of 16S rDNA of strains
UV-P5紫外分光光度计 上海美普达科技有限公司;雷磁ZD-2型自动点位滴定仪 上海精密科学仪器有限公司;TOMY SX500自动灭菌锅 日本Tomy Digital Biology公司;SW-CJ-1C型双人单面净化工作台 苏州净化设备有限公司;YS6060色差计 深圳市三恩时科技有限公司;TMWS-TOUCH质构分析仪 美国FTC。
1.2 实验方法
1.2.1 豇豆浅渍发酵 从-80 ℃取出甘油管保藏的8个菌种,分别划线接种至MRS培养基平板上,28~30 ℃条件下培养72 h,挑取单菌落接种至MRS液体试管中,28~30 ℃条件下培养,以5%的接种量接种到MRS液体三角瓶中,28~30 ℃条件下培养18~20 h,离心(4 ℃,5000 r/min,5 min)收集菌体,用无菌生理盐水洗菌体2次后并重悬,调整菌体密度为5.02×108CFU/mL,作为豇豆发酵的发酵剂。
浅渍发酵液制备:在1 L水加入50 g泡菜盐、5 g花椒,15 g姜片,10 g 干红辣椒和冰糖30 g,煮沸后保温10 min,降至室温备用。降温后的浅渍液中加入0.15%的氯化钙作为保脆剂,加入0.05%的柠檬酸和0.03%的异抗坏血酸作为护色剂。
浅渍发酵:豇豆挑选洗净晾晒至表面无水后,加入到浅渍发酵液中,25~28 ℃发酵,每天测定pH,当pH达到3.5左右时[10],结束发酵并记录发酵时间,并对发酵豇豆品质和感官进行评定。
1.2.2 浅渍豇豆品质测定 硬度和咀嚼性测定[11]:利用TMWS-TOUCH质构分析仪对浅渍豇豆进行硬度和咀嚼性测试。选取250 N的力量感应单元,直径为8 mm的圆柱型探头,硬度测试条件设置:测前速率1 mm·s-1,测试速率0.5 mm·s-1,测后速率1 mm·s-1,压缩量50%。测试结果选取测试的硬度最大力Fmax和咀嚼性为参数进行分析。
色度测定[12]:取100 g浅渍豇豆,加入100 g蒸馏水,用打浆机打浆。在反射模式下,采用3nh色差仪分别测定浅渍豇豆的L*、a*、b*值。对每种样品取8次样,取平均值。L*表示光泽亮度,值越大,亮度越高;a*值表示红绿色程度,“+”代表红色,“-”代表绿色;b*值表示黄蓝色程度,“+”代表黄色,“-”代表蓝色;浅渍豇豆色泽程度用饱和度(C)来表示,根据公式C=(a*2+b*2)1/2计算饱和度(C)。
1.2.3 感官评价 选择对浅渍豇豆味道有一定识别能力的食品专业16名研究生为感官评定小组成员。对参加评定的成员进行训练,明确评分标准,最终选择10人为感官评定员(男女比例为1:1)。每个样品品尝后,用37 ℃温水漱口后再品尝下一个样本。每一个样本进行三次重复评定。感官评分标准见表2。

表2 浅渍豇豆感官评分表Table 2 Mark of organoleptic evaluation rating of low-salt curing cowpeas
1.2.4 乳酸菌间生长相容性的考察 将活化好的乳酸菌按照总接种量为3%(v/v),比例为1:1分别接种至MRS液体试管中,以接种量为3%单独接种为对照,30 ℃静止培养36 h,采用梯度稀释平板计数的方法测定菌体生长情况,结果以lg (CFU/mL)表示。比较单独培养和混合培养的菌体密度,研究菌株间的生长相容性。
1.2.5 共培养对菌株功能的影响
1.2.5.1 共培养对菌株Lactobacillus plantarumSD-7降解亚硝酸盐功能的影响 将Lactobacillus plantarumSD-7、Lactobacillus plantarumFM-LP-9和Lactobacillus alimentariusFM-MM4 3株乳酸菌按照接种量比例为3:1:1、3:1:2、3:2:1、3:2:2 和1:1:1进行复配,接种于含200 mg/L NaNO2,pH7.0的50 mL MRS液体培养基中,于30 ℃培养箱中培养48 h后测定培养液中NaNO2的含量。以单独接种Lactobacillus plantarumSD-7为对照,总接种量为5%,每个处理三次重复。
亚硝酸盐含量测定:利用盐酸萘乙二胺法测定泡菜的亚硝酸盐含量,具体操作方法参照GB/T 5009.33.2003中的格里斯比色法对亚硝酸盐进行测定。以亚硝酸盐含量(x)为横坐标,吸光度值(y)为纵坐标,绘制标准曲线,得到标准曲线回归方程:Y=0.042x+0.009,决定系数R2=0.999。
1.2.5.2 共培养对Lactobacillus plantarumFM-LP-9菌株抗氧化能力的影响 将Lactobacillus plantarumFM-LP-9、Lactobacillus plantarumSD-7和Lactobacillus alimentariusFM-MM4 3株乳酸菌按照接种量比例为3:1:1、3:1:2、3:2:1、3:2:2 和1:1:1进行复配,30 ℃培养箱中培养48 h后,将不同混合接种的培养好的菌体离心(8000 r/min 3min),用生理盐水洗涤2次后再用生理盐水重悬,调整菌液密度OD600值为均2.00±0.02。测定上述处理好菌体的DPPH自由基、ABTS+自由基清除率和还原力。以单独接种为对照,总接种量为5%,每个处理三次重复。
a. DPPH自由基清除率的检测。参考文献[13]方法并略作修改。取2 mL待测乳酸菌的生理盐水悬浮液,加入2 mL DPPH·溶液(用无水乙醇溶解配制DPPH,终浓度为0.4 mmol/L),混合均匀后,室温下遮光反应30 min后在转速8000 r/min下离心10 min,取上清,测定样品在波长517 nm处的吸光度。对照组样品以等体积蒸馏水代替样品溶液,并以等体积蒸馏水和无水乙醇混合液空白调零。DPPH自由基清除率(%)=[1-样品吸光值/对照吸光值]×100。
b. ABTS+自由基清除率的检测。参考文献[13]方法并略作修改。将7 mmol/L ABTS溶液与2.45 mmol/L过硫酸钾混匀,于4 ℃放置16 h制备ABTS+·溶液。用无水乙醇将ABTS+·溶液稀释直至其波长在734 nm处的吸光度为0.70±0.02。取2 mL菌悬液,加入2 mL ABTS+·溶液,摇匀后于室温下放置10 min,测量波长734 nm处的吸光值,计算样品的自由基清除率。ABTS+自由基清除率(%)=[1-样品吸光值/对照吸光值]×100。
c.还原活性的测定。参照文献[14]方法并略有修改。取0.5 mL菌悬浮液,加入1.5 mL PBS溶液(0.2 mol/L,pH6.6)中混匀后加入1.5 mL 1%铁氰化钾溶液,混匀,50 ℃水浴保温20 min,冰水中迅速冷却至室温,加入1.5 mL 10%三氯乙酸溶液,混匀,8000 r/min离心10 min,取2 mL上清液,加入2 mL生理盐水,同时加入1 mL 0.1% FeCl3溶液,充分混匀,静置孵育10 min后在波长700 nm处测定反应体系的吸光值。其结果采用L-半胱氨酸作标准物来表述乳酸菌的还原力。分别配制不同浓度(0~400 μmol/L)的L-半胱氨酸标准溶液,按照上述步骤进行测定,绘制标准曲线。根据测定结果,L-半胱氨酸盐酸盐的标准工作曲线,Y=0.0012x-0.0026,R2=0.996。
1.2.5.3 共培养对Lactobacillus alimentariusFM-MM4抑菌功能的影响 将Lactobacillus alimentariusFMMM4、Lactobacillus plantarumFM-LP-9和Lactobacillus plantarumSD-73株乳酸菌按照接种量比例为3:1:1、3:1:2、3:2:1、3:2:2和1:1:1进行复配,30 ℃培养箱中培养48 h后测定菌体的抑菌情况。以单独接种为对照,总接种量为5%,每个处理三次重复。
参考Liu等[15]的琼脂孔扩散法(Well-diffusion Agar Assay)方法:将含1%致病菌(金黄色葡萄球菌、沙门氏菌和大肠杆菌)悬液(108CFU/mL)倾倒入灭菌的平皿中,待其凝固后,用灭菌的打孔器在平皿内打孔,孔径为5 mm,每个平皿打4个孔。供试乳酸菌培养液5000 ×g,4 ℃ 离心10 min得上清,每孔中加入100 μL的上述上清液,同时以MRS培养基作为阴性对照,4 ℃扩散2~4 h后,37 ℃培养24~48 h。用游标卡尺测量并记录抑菌圈的大小,每个样品做3个平行。
1.2.6 复合接种比例对浅渍发酵豇豆品质的影响将具有不同功能特性的乳酸菌Lactobacillus plantarumFM-LP-9、Lactobacillus plantarumSD-7和Lactobacillu salimentariusFM-MM4三者混合接种,三株乳酸菌按照接种量比例为3:1:1、3:1:2、3:2:1、3:2:2 和1:1:1,总接种量为5%,25~28 ℃发酵,每天测定pH,当pH达到3.5左右时,结束发酵并记录发酵时间,测定浅渍豇豆的色泽、硬度、咀嚼性,并对发酵豇豆进行感官评分。
1.3 数据处理
试验结果采用SPSS 13.0和One-Way(ANOVA)进行统计和显著性分析。采用LSD多重性比较分析显著性,显著水平P<0.05,以不同字母表示。用Excel 2016处理作图。
2 结果与分析
2.1 不同菌株发酵豇豆的特性
研究表明不同菌株其发酵特性及其对发酵产品的品质影响不同,刘宗敏等用不同乳酸菌发酵萝卜干,发现不同菌株发酵能力不同,其产品的总酸、挥发酸、游离氨基酸和挥发性物质种类及含量都不同[16]。杨丽娜等用9种乳酸菌进行发酵蔬菜研究显示,不同发酵菜及汤汁中的氨基酸、总酸、总糖等多种成分及感官评价不同[17]。本研究中对传统发酵食品来源的8株乳酸菌发酵豇豆的特性进行了研究,结果见表3,从表中可以看出,不同菌株发酵能力不同,6株菌可以在120 h内pH达到3.5左右,其他2株菌需要发酵144 h pH才能达到3.5。不同菌株对发酵豇豆的色泽的影响也不同,Lactobacillus plantarumSD-7和Lactobacillus plantarumFM-LP-9发酵的豇豆色泽饱和值最高,Lactobacillus plantarumFM-LP-4和Lactobacillus plantarum12-2发酵豇豆的色泽饱和值最低。不同菌株对发酵豇豆的硬度影响结果显示,Lactobacillus plantarumSD-7、Lactobacillus plantarumFM- LP-9、Lactobacillus plantarum1-1、Lactobacillus paracaseiFM-LP-4和Lactobacillus alimentariusFM-MM4发酵豇豆的硬度显著高于其他几株菌发酵豇豆的硬度(P<0.05)。感官评分显示,Lactobacillus plantarumSD-7、Lactobacillus plantarum9SH、Lactobacillus plantarumFM-LP-9、Lactobacillus paracaseiFM-LP-4和Lactobacillus alimentariusFM-MM4显著高于其他几株的发酵豇豆感官评分值(P<0.05)。综合发酵时间、色泽、硬度、感官评分结果及复合功能发酵研究目的,选择Lactobacillus plantarumSD-7、Lactobacillus plantarumFM-LP-9和Lactobacillus alimentariusFMMM4进行后续的复合发酵剂的复配研究。
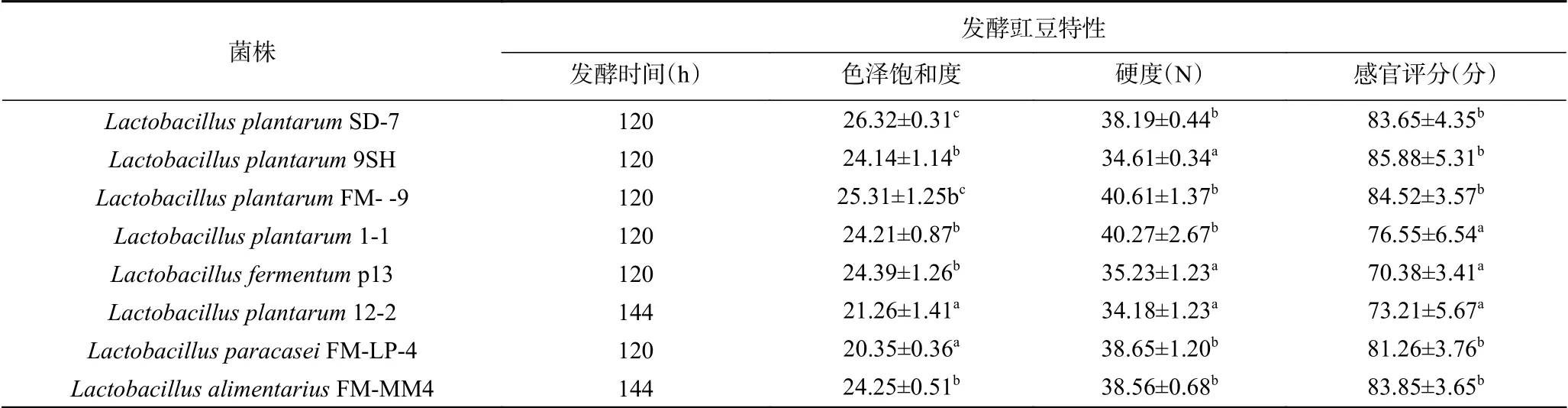
表3 8株菌在浅渍发酵豇豆中的发酵特性Table 3 Fermentation characteristics of eight strains in low-salt curing cowpea
2.2 共培养对菌株间生长的影响
传统发酵食品是通过多种微生物共同协同发酵,主要包括乳酸菌、酵母和醋酸菌。研究表明,在初期,多种微生物共存,由于体系的改变及微生物之间的协同及拮抗作用,随着发酵进程微生物群体组成发生改变[18]。共培养(Co-culture)是指在无菌条件下,将一些不同的特别指定的微生物在厌氧或好养条件下的混合培养[19]。研究还表明,由于共培养系统内存在更为丰富的酶系统和生物诱导效应利用了中间代谢物,从而有利于生物量的快速增长[20],Kumari等[21]将佛罗里达平菇Pleurotusflorida和立枯丝核菌Rhizoctoniasolani混合培养,与单独培养相比,混合培养生物产量更高。Li等[22]报道,在牛乳中,Lactobacillus plantarum和Bifidobacterium animalis存在明显的共生关系,且能够改善发酵乳的风味和质构。本研究通过对比Lactobacillus plantarumSD-7、Lactobacillus plantarumFM-LP-9和Lactobacillus alimentariusFM- MM4 3株菌单独培养和共培养的菌体密度,来解析共培养对菌体生长的影响,结果见表4,从表4中可以看出,共培养菌体密度lg值和单独培养菌体密度相lg值比较,lg值都有升高,升高倍数在0.02~0.1之间,虽然从lg值看,升高倍数不大,但是从菌体密度lg值对应科学计数结果(数据为列出)来看,单独培养时Lactobacillus alimentariusFM-MM4的lg值为8.51,科学计数结果为3.21×108,当和Lactobacillus plantarumSD-7混合培养时,混合体系中的lg值为9.37,科学计数结果为2.35×109,混合体系的菌体密度提高6.32倍;Lactobacillus plantarumSD-7单独培养时,lg值为9.16,科学计数结果为1.45×109,该菌株与其他菌株混合培养体系最低lg值为9.33,科学计数结果为2.14×109,菌体密度升高0.48倍。以上结果表明3株菌之间共同培养不存在拮抗作用,且表现出协同增效的结果。

表4 3株乳酸菌间生长相容性Table 4 Growth compatibility among three strains of lactic acid bacteria
2.3 共培养对菌株Lactobacillus plantarum SD-7降解亚硝酸盐功能的影响
目前对微生物功能的研究多集中于纯培养菌株,事实上微生物共培养存在着巨大的研究潜力。研究表明,在共培养体系中,共培养微生物之间有着较为复杂的生态学关系,主要涉及协同代谢、相互拮抗、互利共生、细菌素、信号分子之间的相互作用等,不同种属的微生物能够产生截然不同的作用,而这些作用在一定程度上都影响着共培养体系中物质的产量和新物质的产生[23-26]。另外,通过改变细胞间交流、物种代谢作用以及空间结构等方式进行调控微生物间的相互作用,从而实现对合成群落的改造[27]。Chen等[28]在大米培养基上共培养土曲霉Aspergillus terreus与枯草芽抱杆菌Bacillus subtilis或蜡质芽抱杆菌Bacillus cereus,与单一的土曲霉培养相比,其产生的天然产物积累增加了34倍。本研究通过对比Lactobacillus plantarumSD-7、Lactobacillus plantarumFM-LP-9和Lactobacillus alimentariusFM-MM4间不同比例混合的共培养体系和Lactobacillus plantarumSD-7单独培养对亚硝酸盐降解能力,来解析共培养对Lactobacillus plantarumSD-7亚硝酸盐降解能力的影响,结果见图1。从图1中可以看出,不同比例混合的共培养体系的降解亚硝酸盐的能力不同,接种比例为3:2:2和1:1:1的共培养体系中的亚硝酸盐降解能力无显著差异,但显著高于1:0:0(Lactobacillus plantarumSD-7单独培养)、3:1:1、3:1:2和3:2:1组(P<0.05),本结果表明,共培养体系中的3株间以合适的比例共存能够促进体系降解亚硝酸盐的能力。
2.4 共培养对菌株Lactobacillus plantarum FM-LP-9抗氧化能力的影响
将不同种类微生物在液体培养基中的共培养也被称为混合发酵。研究表明通过混合发酵,可以增加天然产物库,有助于发现新的次级代谢产物,而且还有助于激活已知的微生物生产力[29]。Oh等[30]将海洋真菌Emericellasp和Salinispora arenicola共培养,缩酚酸肽的产量增加了100倍。本研究通过对比Lactobacillus plantarumFM- LP-9、Lactobacillus plantarumSD-7、Lactobacillus alimentariusFM-MM4不同比例混合的共培养体系和Lactobacillus plantarumFM-LP-9单独培养(1:0:0)对DPPH自由基清除能力、ABTS+自由基清除能力及还原力的比较,来解析共培养对Lactobacillus plantarumFM-LP-9菌株抗氧化能力的影响,结果见图2。从图2中可以看出,不同比例混合的共培养体系的中菌体的抗氧化能力不同,单独培养、3:1:1、3:1:2和3:2:1共培养体系中菌体的DPPH自由基清除能力、ABTS+自由基清除能力及还原力没有显著差异(P>0.05),接种比例为1:1:1的共培养体系中菌体的DPPH自由基清除能力、ABTS+自由基清除能力及还原力显著提高(P<0.05)。因此本研究结果表明,在合适的接种比例条件下,混合发酵能够促进Lactobacillus plantarumFM- LP-9的抗氧化能力。

图 1 共培养对菌株Lactobacillus plantarum SD-7降解亚硝酸盐功能的影响Fig.1 Effect of co-culture on nitrite degradation capacity of Lactobacillus plantarum SD-7

图 2 共培养对菌株Lactobacillus plantarum FM-LP-9抗氧化能力的影响Fig.2 Effect of co-culture on antioxidant capacity of Lactobacillus plantarum FM-LP-9
2.5 共培养对菌株Lactobacillus alimentarius FM-MM4抑菌能力的影响
本研究通过对比Lactobacillus alimentariusFMMM4、Lactobacillus plantarumSD-7和Lactobacillus plantarumFM-LP-9不同比例混合的共培养体系和Lactobacillus alimentariusFM- MM4单独培养对金黄色葡萄球菌、沙门氏菌和大肠杆菌的抑菌能力,来解析共培养对Lactobacillus alimentariusFMMM4抑菌功能的影响,结果见表5。从表5中可以看出,不同比例混合的共培养体系的发酵液对金黄色葡萄球菌、沙门氏菌抑制能力不同,与单独培养(1:0:0)相比,混合接种比例为3:2:1、3:2:2和1:1:1的共培养体系中菌液对金黄色葡萄球菌和沙门氏菌的抑菌能力显著提高(P<0.05),比例为3:1:2的共培养体系中菌液对沙门氏菌的抑菌能力显著提高(P<0.05);比例为3:2:1和1:1:1的共培养体系中菌液对大肠杆菌的抑菌能力显著提高(P<0.05),因此,在合适的接种比例条件下,混合培养能够促进Lactobacillus alimentariusFM-MM4的抗菌能力。Mellefont等[31]对单增李斯特菌与大肠埃希式菌、荧光假单胞菌、乳酸杆菌分别进行共培养的研究也显示出混合体系中的协同增长的作用差异与混合培养浓度比例有一定关系,当混合浓度相当时,协同作用最显著。
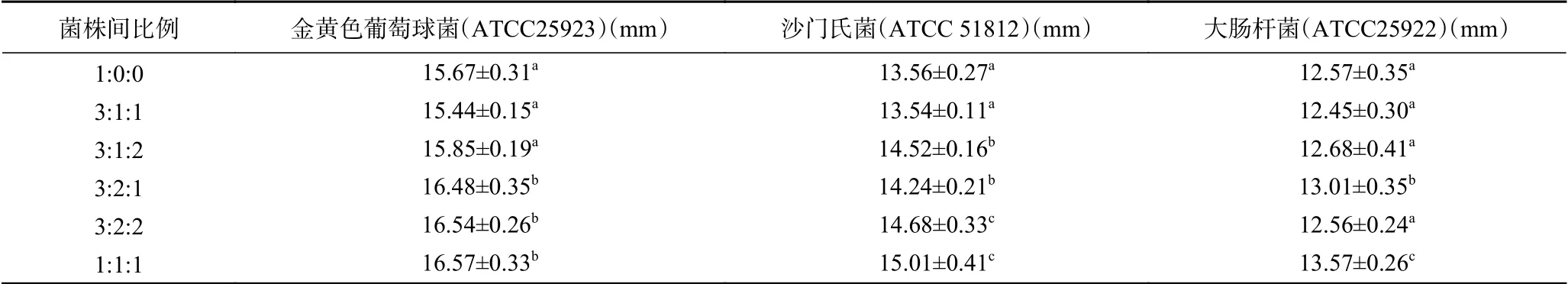
表5 共培养对Lactobacillus alimentarius FM-MM4抑菌功能活性的影响Table 5 Effect of co-culture on bacteriostasis activity of Lactobacillus alimentarius FM-MM4
2.6 共发酵对豇豆泡菜品质的影响
利用共培养技术可以改造传统的发酵工艺,使发酵周期缩短且产品质量提高,Yan等[32]利用肠膜明串珠菌和戊糖乳杆菌共培养生产泡菜,在降低泡菜中腐败菌数目的同时还可以改善泡菜的风味。本研究通过对比自然发酵组(CK)和接种不同比例复合发酵剂的豇豆色泽饱和度、硬度、咀嚼性及感官评分来分析复合发酵剂对浅渍豇豆品质的影响,结果见表6。从表6中可以看出,不同接种比例条件下发酵的豇豆品质表现不同,与自然浅渍豇豆CK相比,接种发酵的色泽饱和度值、发酵豇豆的硬度、产品的咀嚼性及感官评分显著提高(P<0.05)。在不同接种比例中,接种比例为3:2:1、3:2:2和1:1:1的浅渍豇豆的总体品质表现较优。综合测定的4个指标,接种比例为3:2:2和1:1:1的共发酵的豇豆品质最好。
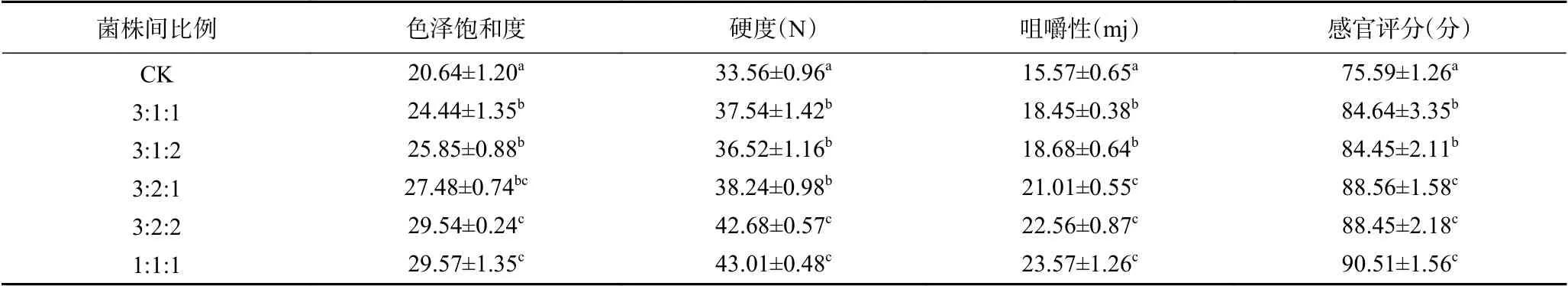
表6 混合发酵对浅渍豇豆品质的影响Table 6 Effect of mixed-fermentation on quality of low-salt curing cowpea
3 结论
将具有不同功能的微生物进行复配制备复合功能发酵剂是食品发酵加工的一个热点,而组成复合发酵剂的微生物之间必须具有良好的相容性。本研究对具有不同功能的乳酸菌间的生长相容性研究发现,亚硝酸盐降解菌Lactobacillus plantarumSD-7、抗氧化功能Lactobacillus plantarumFM-LP-9和抑菌功能Lactobacillus alimentariusFM-MM4之间具有良好的生长相容性,混合培养菌体密度可以提高0.49~6.31倍。共培养对菌株功能的影响的结果表明,Lactobacillus plantarumSD-7、抗氧化功能Lactobacillus plantarumFM-LP-9和抑菌功能Lactobacillus alimentariusFM-MM4之间共培养接种比例为1:1:1时,混合培养菌体的DPPH自由基清除能力、ABTS+自由基清除能力、还原力和抑菌能力都显著提高(P<0.05)。与自然发酵相比,接种发酵的豇豆品质明显提高,且在当Lactobacillus plantarumFM-LP-9、Lactobacillus plantarumSD-7和Lactobacillus alimentariusFM-MM4 3株菌接种比例为1:1:1时,豇豆的色泽饱和度、硬度、咀嚼性和感官评分表现出最大值。综合研究结果,发现三株菌间以1:1:1复合制备功能发酵剂,功能特性及浅渍豇豆的品质都表现最优。研究成果将为浅渍发酵豇豆的品质、缩短浅渍发酵周期和工业化生产提供复合功能发酵剂,同时为豇豆接种浅渍发酵工业化提供理论依据和应用指导。
