人参皂苷Rg1对寡聚态Aβ1-42增加p38丝裂原活化蛋白激酶活性诱导神经元损伤的可能影响
2022-06-06何饶丽林楠方丽君黄天文
何饶丽, 林楠, 方丽君, 黄天文,
阿尔茨海默病(Alzheimer’s disease, AD)是一种以进行性认知障碍为主要临床特征的神经系统退行性疾病,常见于老年人。调查显示,目前全球约有5 000万AD患者,我国老年人的AD患病率为3%~7%[1],给家庭和社会带来了巨大负担。寡聚态β-淀粉样蛋白1-42(amyloidβ-protein 1-42, Aβ1-42)作为AD发病机制的Aβ瀑布学说中毒性最大的片段,在AD的发病中起重要的作用。在AD患者的脑组织及Aβ的毒性机制中发现,p38丝裂原活化蛋白激酶(p38 mitogen-activated protein kinase, p38 MAPK)的功能异常激活是其重要的病理生理机制。因此,p38 MAPK被认为是治疗AD的重要潜在靶点之一[2]。
近年来,传统中医药在AD防治中的作用备受关注。人参作为我国传统的名贵中药,具有悠久的应用历史,包含多种成分,其主要成分之一是人参皂苷Rg1,属三醇苷,具有较强的生物学活性。本课题组前期研究证实,人参皂苷Rg1可能通过多种途径减轻Aβ1-42诱导的神经元凋亡,从而达到防治AD的作用[3-4]。在此基础上,本研究在Aβ1-42诱导的AD细胞模型进一步探讨人参皂苷Rg1对p38 MAPK信号转导通路的分子作用机制,以期为人参皂苷Rg1防治AD提供更多的实验依据。
1 材料与方法
1.1 材料
1.1.1 动物 清洁级C57BL/6孕鼠(孕龄15~16 d,上海西普尔-必凯实验动物有限公司)。
1.1.2 主要试剂和仪器 寡聚态Aβ1-42(美国康萨斯大学严世都教授惠赠);人参皂苷Rg1(纯度>98%,吉林大学基础医学院有机化学教研室);β-actin单克隆抗体(美国NeoMarkers公司);磷酸化神经丝多克隆抗体(MAB1592,美国Millipore公司);多克隆抗体p38 MAPK、鼠单克隆抗体phospho-p38 MAPK(Thr180/182)(美国Cell Signaling Technology公司);胎牛血清(杭州江滨生物技术有限公司);Neurobasal培养基(美国Gibco公司);Western-blot化学发光检测试剂盒(美国KPL公司);TUNEL测定试剂盒(美国Trevigen公司);caspase-3活性检测试剂盒(美国Clontech Laboratories公司)。细胞裂解液:Tris(pH值7.4,10 μmol/L)+ Na4P2O7(20 μmol/L)+ Na3VO4(2 μmol/L)+ NaCl (100 μmol/L)+乙二胺四乙酸 (EDTA)(1 μmol/L)+乙二醇双四乙酸(EGTA)(1 μmol/L)+NaF(1 μmol/L)+SDS(0.1%)+PMSF(1 μmol/L)+Sodium deoxycholate(0.5%)+Triton-X 100(1%)+抑酶肽(60 μmol/L)+亮抑酶肽(10 μmol/L)+胃蛋白酶抑制剂(1 μmol/L)。解剖小鼠脑组织的溶液:Neurobasal培养基+2 mol/L的L-谷氨酰胺+2%的B27+4.4 mmol/L的NaHCO3;皮质神经元基础培养基:Neurobasal培养基+0.1 IU/L的青霉素G+0.1 IU/L的链霉素+1.19 g/L的HEPES+2 g/L的NaHCO3;皮质神经元生长培养基:Neurobasal培养基+50 U/mL的青霉素+50 U/mL的链霉素+2 mol/L的L-谷氨酰胺+2%的B27。倒置显微镜(CK40型,日本Olympus公司);CO2细胞培养箱(3110型,美国Forma Scientific公司)。
1.2 方法
1.2.1 皮质神经元培养 具体方法参考文献[5],简要步骤如下:取孕龄为15~16 d的C57BL/6小鼠,无菌条件下取出胎鼠,分离出全脑,去除脑组织中的脑干、小脑、桥脑及脑膜,分离出皮质,再用胰蛋白酶进行适时消化后,以含20%胎牛血清的解剖液终止消化,分离出小鼠皮质神经元,进行计数、接种培养,体外培养3~5 d后,分离出来的皮质神经元稳定生长,以此进行后续实验。
1.2.2 分组 (1)空白对照组:未给予任何干预处理。(2)Aβ1-42单独作用组(模型组):仅给予5.0 μmol/L的寡聚态Aβ1-42作用于体外培养的皮质神经元。(3)人参皂苷Rg1处理组:体外培养的小鼠皮质神经元,给予不同浓度的人参皂苷Rg1预先孵育24 h,然后加入5.0 μmol/L的寡聚态Aβ1-42共同孵育48 h。(4)SB203580(p38抑制剂)处理组:予20 μmol/L的SB203580以及5.0 μmol/L寡聚态Aβ1-42共同孵育。(5)人参皂苷Rg1单独作用组:仅给予10.0 μmol/L的人参皂苷Rg1作用于体外培养的皮质神经元。
1.2.3 神经元的免疫细胞化学鉴定 把神经元特异的磷酸化神经丝抗体作为神经元的特异性识别标志,采用免疫细胞化学技术(ABC法)检测培养的皮质神经元的神经丝。主要步骤如下:培养成熟的神经细胞经3.7%甲醛固定30 min,加入过氧化氢甲醇溶液灭活内源性的过氧化氢物酶,予PBS洗涤后,通过动物血清封闭非特异性抗原,经PBS洗涤后,加入磷酸化神经丝抗体(MAB1592)孵育,经PBS洗涤后,加入链亲和素-过氧化物酶溶液孵育,经PBS洗涤后,予新鲜配制的DAB溶液显色、封片、显微镜下拍照。
1.2.4 Western-blot检测 皮质神经元经处理后,用预冷的磷酸盐缓冲溶液清洗残余的细胞培养液,加入适量的细胞裂解液,神经元在冰上裂解 20 min,用细胞刮刀收集细胞后进行离心(14 000×g,4 ℃,10 min),取上清液,用Bradford法对蛋白浓度进行定量,并以10% SDS-聚丙烯酰胺凝胶进行电泳分离,转膜,在室温下使用封闭液进行封闭,一抗[p38/MAPK、p-p38/MAPK(Thr180/182),1∶1 000稀释],4 ℃下孵育,洗涤,辣根过氧化物酶耦联的抗鼠IgG二抗(1∶1 000稀释)作用2 h,采用化学发光法显色、曝光。以5、15、30和60 min为寡聚态Aβ1-42作用于皮质神经元细胞的观察时间点,采用Western-blot方法检测细胞内p38在Thr180和Thr182位点的磷酸化水平,以p-p38/p38的比值表示p38活性的变化,以β-actin为内参照,实验重复3次。
1.2.5 TUNEL染色 参考文献[6],采用原位末端标记法检测培养神经元的凋亡情况。简要步骤如下:经干预处理后的神经元经多聚甲醛等进行固定,先后用NeuroPore试剂、淬链溶液(quenching solution)、末端脱氧核苷酸转移酶(TdT)标记缓冲液进行处理,再用标记反应混合物进行作用,使用1×TdT停止缓冲液停止反应;接着使用Streptavidin-HRP处理、DAB显色、细胞核复染、氨水返蓝、中性树脂封片处理。最后对染色区域内5个视野下的TUNEL阳性细胞进行计数。
1.2.6 caspase-3活性测定 参考文献[6],并根据说明书检测caspase-3活性。简要步骤如下:用人参皂苷Rg1或寡聚态Aβ1-42按不同的时间处理原代皮质神经元。将神经元刮下、离心、弃上清,按照50 μL溶液含2×105个细胞的比例裂解细胞、分离上清液,加入2×反应缓冲液/二硫苏糖醇(DTT)混合物孵育1 h后,用荧光酶标仪(激发波波长380 nm/发射波波长460 nm)检测荧光强度以评估caspase-3的活性。
2 结 果
2.1 神经元纯度 体外培养5 d的神经元中绝大多数为磷酸化的神经丝抗体染色阳性细胞,胞体多呈椭圆形,有≥2个的突起;胞质和突起内神经丝呈棕黄色,胞核不着色(图1)。
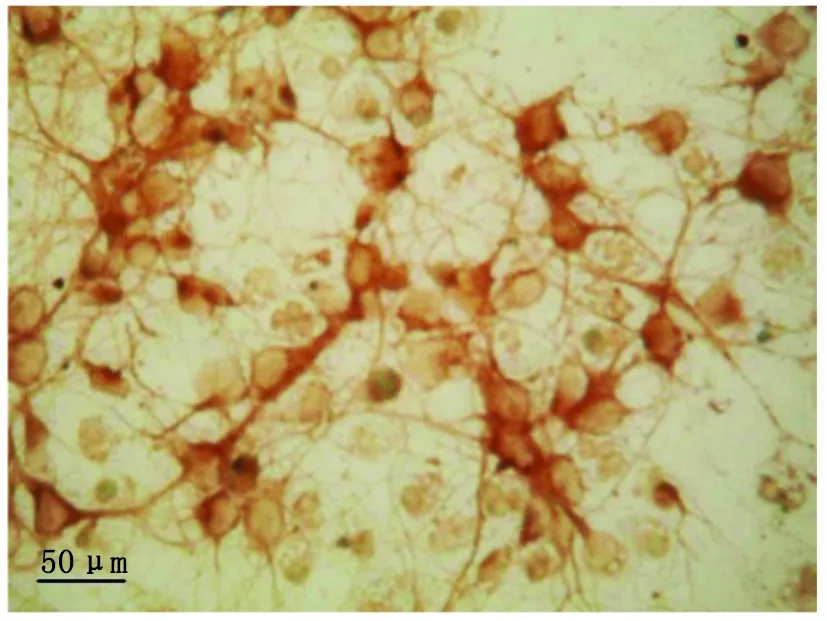
图1 神经元纯度鉴定(免疫化学染色 ×400)Fig.1 Identification of neuron purity (immunochemical staining ×400)
2.2 寡聚态Aβ1-42作用不同时间对皮质神经元p-p38和p38蛋白水平的影响 与空白对照组比较,在寡聚态Aβ1-42作用于原代皮质神经元5和15 min时,p-p38蛋白水平及p-p38/p38比值均明显升高,差别均有统计学意义(P<0.05),且在作用5 min时最为明显(P<0.005)。但皮质神经元内p-p38/p38的比值随着时间延长在组间呈下降趋势(图2)。
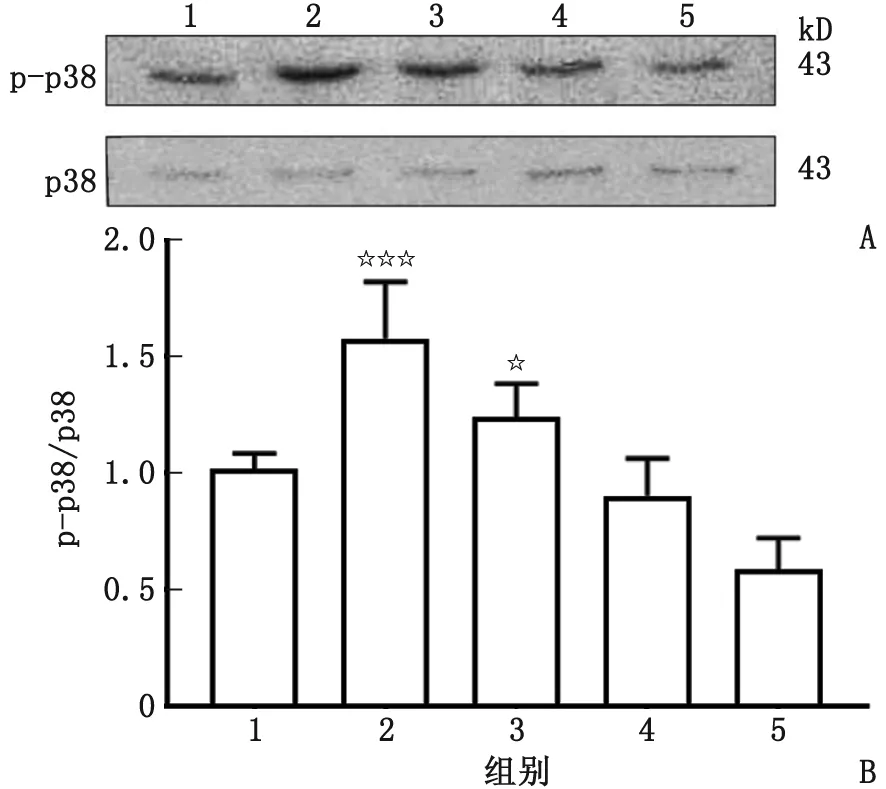
p-p38:磷酸化p38。1:空白对照组;2~5分别为5、15、30和60 min Aβ1-42单独作用组。A:Western-blot条带;B:Western-blot定量分析图。与空白对照组比较,☆:P<0.05;☆☆☆:P<0.005。图2 寡聚态Aβ1-42不同作用时间点对皮质神经元细胞p-p38、p38及p-p38/p38水平的影响Fig.2 Protein level of p-p38, p38 and p-p38/p38 in cortical neurons treated with oligomeric Aβ1-42 at different time points
2.3 人参皂苷Rg1减轻寡聚态Aβ1-42诱导的皮质神经元p38磷酸化 与模型组比较,不同浓度(2.5、5.0和10.0 μmol/L)的人参皂苷Rg1处理组可不同程度降低p-p38/p38的比值水平,差别均有统计学意义(P<0.001),其中10.0 μmol/L处理组皮质神经元细胞中p-p38/p38水平低于2.5 μmol/L(P<0.005)及5.0 μmol/L处理组(P<0.01)。同时,SB203580处理组及10.0 μmol/L人参皂苷Rg1单独作用组的p-p38/p38的比值低于Aβ1-42单独作用组(P<0.001)。10.0 μmol/L人参皂苷Rg1单独作用组p-p38/p38水平也低于空白对照组(P<0.001,图3)。
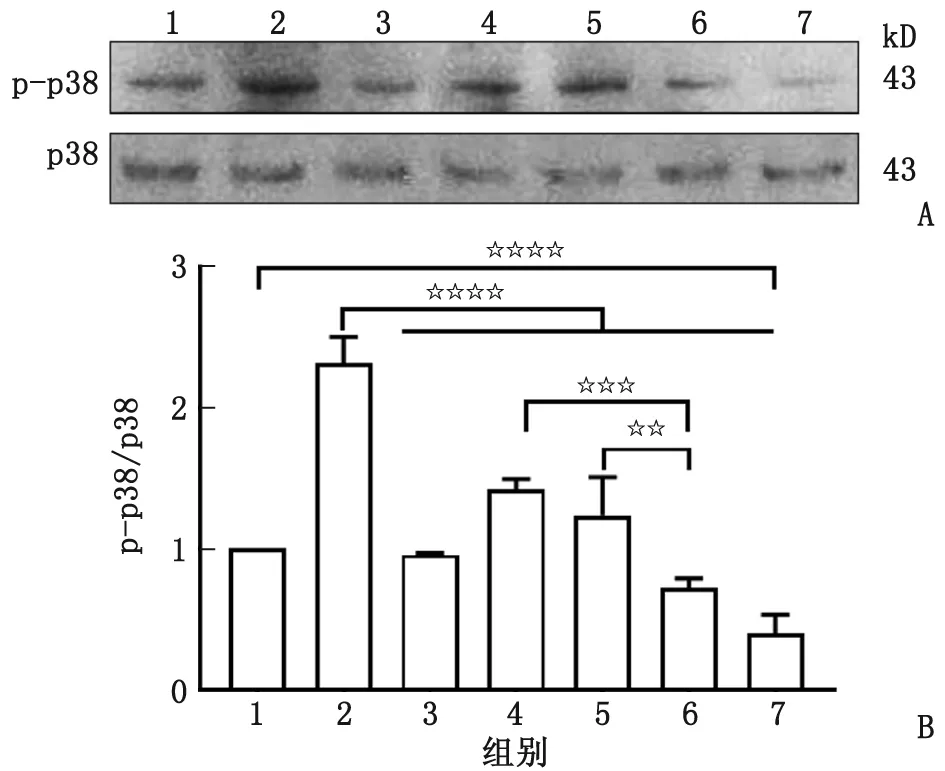
p-p38:磷酸化p38;1:空白对照组;2:Aβ1-42单独作用组;3:SB203580处理组;4~6:2.5、5.0和10.0 μmol/L人参皂苷Rg1处理组;7:10.0 μmol/L人参皂苷Rg1单独作用组。A:Western-blot条带;B:Western-blot定量分析图。组间比较,☆☆☆☆:P<0.001;☆☆☆:P<0.005;☆☆:P<0.01。 图3 不同浓度的人参皂苷Rg1对寡聚态Aβ1-42诱导皮质神经元细胞p-p38及p38水平的影响Fig.3 Effects of ginsenoside Rg1 at different concentrations on p-p38 and p38 in cortical neurons induced by oligomeric Aβ1-42
2.4 人参皂苷Rg1减轻寡聚态Aβ1-42诱导的皮质神经元凋亡 空白对照组的皮质神经元细胞及神经元间突触形态及结构正常、完整,呈均匀分布,突触间联系光滑、完整、流畅(图4A)。Aβ1-42单独作用组皮质神经元明显减少,神经元突触形态屈曲、粗糙,结构不完整(图4B)。10.0 μmol/L人参皂苷Rg1处理组皮质神经元细胞数目和突触完整性、流畅性较Aβ1-42单独作用组明显改善(图4C)。TUNEL染色结果显示,与空白对照组皮质神经元细胞比较,Aβ1-42单独作用组TUNEL阳性细胞/总细胞的比值明显增高(P<0.001);与Aβ1-42单独作用组皮质神经元细胞比较,10.0 μmol/L人参皂苷Rg1处理组TUNEL阳性细胞/总细胞的比值明显降低(P<0.001,图5A)。皮质神经元的caspase-3的活性检测结果显示,在相同条件下,Aβ1-42单独作用组皮质神经元的caspase-3活性较空白对照组显著增加(P<0.001);与Aβ1-42单独作用组比较,10.0 μmol/L 人参皂苷Rg1处理组皮质神经元的caspase-3活性显著降低(P<0.001,图5B)。
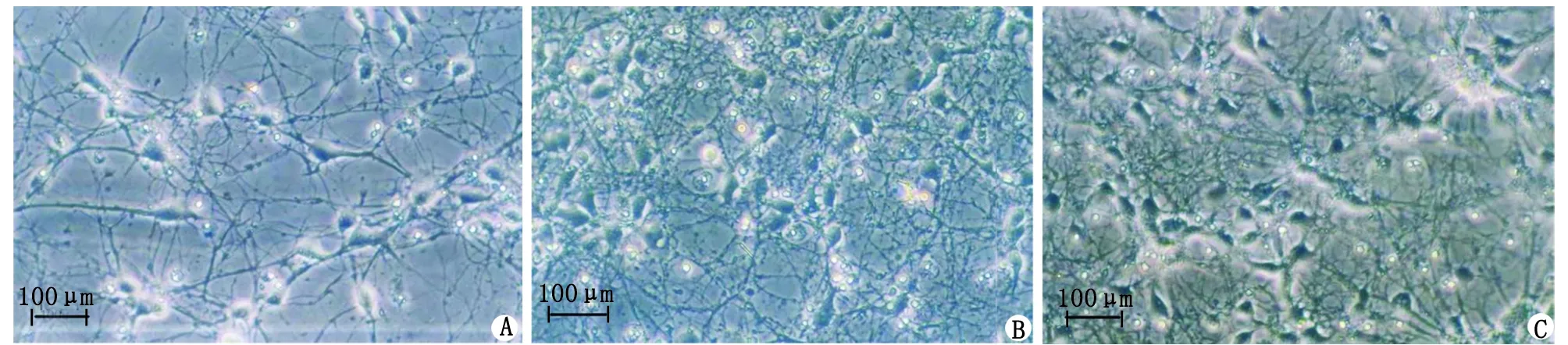
A:空白对照组;B:Aβ1-42单独作用组;C:10.0 μmol/L人参皂苷Rg1处理组。图4 10.0 μmol/L人参皂苷Rg1对寡聚态Aβ1-42诱导的皮质神经元凋亡具有神经保护作用(倒置显微镜)Fig.4 10.0 μmol/L ginsenoside Rg1 has neuroprotective effect on apoptosis of cortical neuronsinduced by oligomeric Aβ1-42 (observed by inverted microscope)
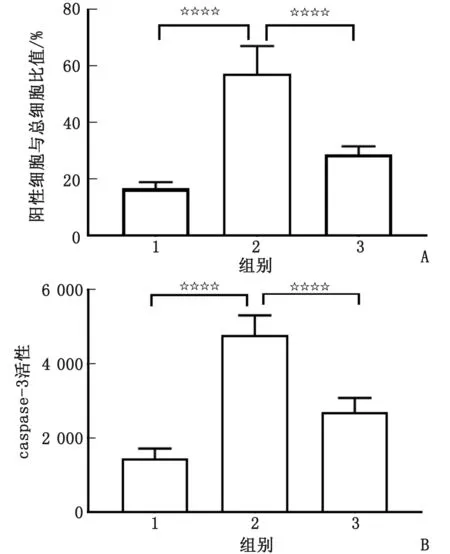
1:空白对照组;2:Aβ1-42单独作用组;3:10.0 μmol/L人参皂苷Rg1处理组。A:TUNEL染色阳性细胞与总细胞的比值;B:caspase-3活性检测,指每毫克蛋白质中含量。组间比较,☆☆☆☆:P<0.001。图5 10.0 μmol/L人参皂苷Rg1减少Aβ1-42诱导的皮质神经元凋亡Fig.5 10.0 μmol/L ginsenoside Rg1 has neuroprotective effect on apoptosis of cortical neurons induced by oligomeric Aβ1-42
3 讨 论
AD是中老年人中最为常见的痴呆类型,但其病因至今尚不明确,其治疗方法也有待进一步研发。在AD的病理学进展中,Aβ的瀑布学说仍为大多数学者所接受。该学说认为,Aβ可通过氧化应激、线粒体功能障碍等途径引起神经元损伤和死亡、突触缺失、神经炎症和tau蛋白过度磷酸化,是触发AD病理改变的一个中心环节。这些病理过程同时也促进了Aβ沉积[7-8],从而进一步加速AD的病理损害和疾病的发展。在Aβ的毒性片段中,寡聚态Aβ1-42是细胞毒性最强的物质,也是研究AD病理生理的重要物质。本研究及课题组的前期研究[6,9]都通过神经元形态观察、TUNEL染色技术和caspase-3活性检测验证了寡聚态Aβ1-42毒性对神经元的损害作用。因此,本研究选择寡聚态Aβ1-42作为模拟AD病理生化的物质,并在前期以5.0 μmol/L Aβ1-42寡聚体诱导原代皮质神经元细胞损伤,成功制备了体外AD模型。
MAPK家族受广泛的细胞外刺激影响,参与细胞增殖、分化和凋亡等一系列生理病理过程,其中c-Jun氨基末端激酶/应激活化蛋白激酶(JNK/SAPK)与p38 MAPK均是MAPK家族的主要成员[10]。本课题组前期研究发现,具有神经毒性的寡聚态Aβ1-42(5 μmol/L)可诱导皮质神经元内的JNK磷酸化,活化的JNK/SAPK可参与介导线粒体损伤[3,6],与文献[11]的报道一致。而另一重要通路p38 MAPK激活后,可通过调控下游多种酶及转录因子的表达活性,从而对细胞功能进行调节。在AD模型中,p38 MAPK可同时作为氧化应激的下游因子被磷酸化激活,改变caspase-9的构象,并启动caspase级联反应,激活下游的caspase-3,通过蛋白水解作用,诱发过度的氧化应激,促进神经元的凋亡,加快AD的发病进程,其磷酸化程度与AD发病时间正相关[12]。同时,有研究认为,在与学习记忆相关的脑区中,高表达的p38 MAPK是海马中代谢性谷氨酸受体(metabotropic glutamate receptor,mGluR)和N-甲基-D-天冬氨酸受体依赖性长时程抑制(long-term depression,LTD)形成的信号转导途径,参与了突触可塑性调节[13-15]。在AD模型中,Aβ增多可通过p38 MAPK依赖性方式诱导mGluR-LTD,造成树突棘损失,与记忆减退密切相关[16]。因此,p38 MAPK在AD的病理学进展中具有重要作用。本研究对不同作用时间(5、15、30、60 min)下Aβ1-42诱导皮质神经元p38蛋白磷酸化的情况进行探索,发现5.0 μmol/L寡聚态Aβ1-42作用5和15 min后,p38 MAPK在Thr180和Thr182位点的磷酸化水平明显增高,且p38磷酸化水平在作用5 min后升高最为明显,提示Aβ1-42介导的p38蛋白磷酸化是AD的早期病理生理过程中的关键环节,p38可能是研究AD治疗的重要靶点之一。
人参皂苷Rg1在抗炎、抗氧化、延缓衰老等方面具有重要作用[17]。因此,本研究在AD的细胞模型中,以人参皂苷Rg1为干预手段,通过p38 MAPK探讨其在AD早期氧化应激中的保护作用,观察人参皂苷Rg1对寡聚态Aβ1-42诱导的神经元细胞p-p38和p38蛋白水平的影响,结果发现,人参皂苷Rg1可下调p38磷酸化水平。相对于未经Aβ1-42干预的空白对照组及10.0 μmol/L人参皂苷Rg1处理组,10.0 μmol/L人参皂苷Rg1单独作用组的p-p38/p38水平明显减低。一方面说明空白对照组(体外培养的皮质神经元)中也可能存在一定的应激反应和p38 MAPK信号通路,这与既往文献[18-19]的相关研究结果一致,当然其具体机制仍需进一步研究,笔者也将在未来的研究中关注这一变化,探索其中的机制。另一方面论证了寡聚态Aβ1-42可增加p38磷酸化水平,组间差别也进一步说明了人参皂苷Rg1对p38 MAPK信号通路具有抑制作用。本研究发现,p38磷酸化水平随人参皂苷Rg1浓度的增加而降低,其中10.0 μmol/L处理组中的p-p38水平及p-p38/p38比值最低,推测人参皂苷Rg1可能通过剂量依赖性方式抑制p38 MAPK,减少Aβ1-42诱导的神经元毒性。本研究还从形态学和凋亡两方面探索了人参皂苷Rg1对皮质神经元的影响,结果发现,与模型组比较,10.0 μmol/L人参皂苷Rg1可有效保护神经元、维护突触结构,检测caspase-3的活性也得到相同的结果,进一步论证了人参皂苷Rg1在AD早期的应激反应中对神经元起保护作用。
本研究也存在一定局限性,虽然p38的异常磷酸化是AD早期病理生理过程中的重要环节,但AD的发病机制复杂,仅通过抑制p38活性并不能完全实现AD的治疗目标。此外,本课题组进行的系列研究也发现,人参皂苷Rg1可能具有多靶点作用,后期将继续探讨人参皂苷Rg1的作用机制。
综上所述,本研究发现寡聚态Aβ1-42可诱导p38磷酸化,激活p38活性;而人参皂苷Rg1可减轻p38磷酸化,具有保护神经细胞作用。因此,p38 MAPK信号通路可能参与人参皂苷Rg1保护神经元,减轻寡聚肽Aβ1-42诱导的神经元损伤。
