胸腔镜右上肺叶切除手术流程优化临床实践
2022-06-06黄建源陈文树潘小杰陈艺勇林兴
黄建源, 陈文树, 潘小杰, 陈艺勇, 林兴
肺叶切除术是肺部良、恶性疾病的主要手术方式之一。常规胸腔镜右上肺叶切除(right upper lobectomy, RUL)术中对于右上肺门结构的处理顺序,通常是先离断右上肺动静脉及其分支,而后处理右上叶支气管。由于上肺血管分支多变异,逐一游离、离断血管分支,使手术过程相对繁复,亦增加术中误伤肺血管致大出血风险。此外,融合肺裂处理不良带来术中视野渗血、术后肺漏气、延长住院时间等诸多问题。笔者总结长期胸腔镜手术的经验,提出一种优化胸腔镜RUL的方法,现报道如下。
1 对象与方法
1.1 对象 回顾性分析2019年1月—2021年6月笔者科室187例行胸腔镜RUL患者的临床资料,98例施行优化手术方案者为优化组,89例施行非优化手术方案者为对照组。纳入标准:(1)术前疑诊或诊断为cTNM分期T1-3N0M0的周围型非小细胞肺癌;(2)无术前放、化疗及胸部疾病手术史;(3)术前评估无手术禁忌证,心、肺功能均耐受手术。排除标准:(1)中央型肺癌,需行支气管成形或袖状切除;(2)胸腔镜探查见胸腔明显粘连或全胸腔粘连;(3)临床资料不完整。本研究经福建省立医院伦理委员会批准(伦理号:K2021-05-027)。所有患者术前均签署手术知情同意书。
1.2 手术方法 均采用双腔气管插管,左侧90°卧位,左侧单肺通气。取右侧腋中线第7肋间1.2 cm切口为胸腔镜观察孔,右侧腋前线间第4肋间3 cm切口为单操作孔。首先观察胸腔粘连、胸膜病变、肺裂发育情况,并探查病变位置。术前疑诊肺癌且病灶位于周边者,先行局部楔形切除,待术中快速冰冻病理结果明确诊断后行肺叶切除;术前已明确肺癌或病灶非周边、不适宜行局部楔形切除者,直接行RUL。常规清扫纵隔第2、4、7、9组淋巴结。在血管的处理上,使用超声刀离断、丝线结扎、动脉夹夹闭或腔镜直线切割闭合器切断。根据术中情况,灵活使用操作孔或观察孔进腔镜切割闭合器离断支气管、血管结构。手术操作结束后,经观察孔放置22 Fr 硅胶引流管至胸顶高位排气,于腔镜直视下置入12 Fr猪尾巴型引流管至后肋膈角低位排液。
1.2.1 优化组
1.2.1.1 “支气管先行”“血管一并离断” 按照以下优化流程处理右上肺门结构:(1)打开上肺门奇静脉弓下的纵隔胸膜,显露右上叶支气管的后壁;(2)打开水平裂与斜裂交界区脏层胸膜,至肺动脉干鞘膜层面,以第11组淋巴结为标志,寻找回升支动脉(A2b),清扫叶间淋巴结,离断回升支;(3)打开上叶后段与下叶背段间的后斜裂,显露右上叶支气管前壁,游离上叶支气管,清扫气管周围肺门淋巴结,试夹闭、鼓肺,确认无误后予离断;(4)打开上叶前段与中叶间的前水平裂;(5)清扫上肺静脉与尖前段动脉间隙内淋巴结,确认无淋巴结残留后,于右上肺各血管根部将之一并离断。即按照“A2b-右上叶支气管-右上肺余动静脉”的顺序处理肺门结构(图1)。
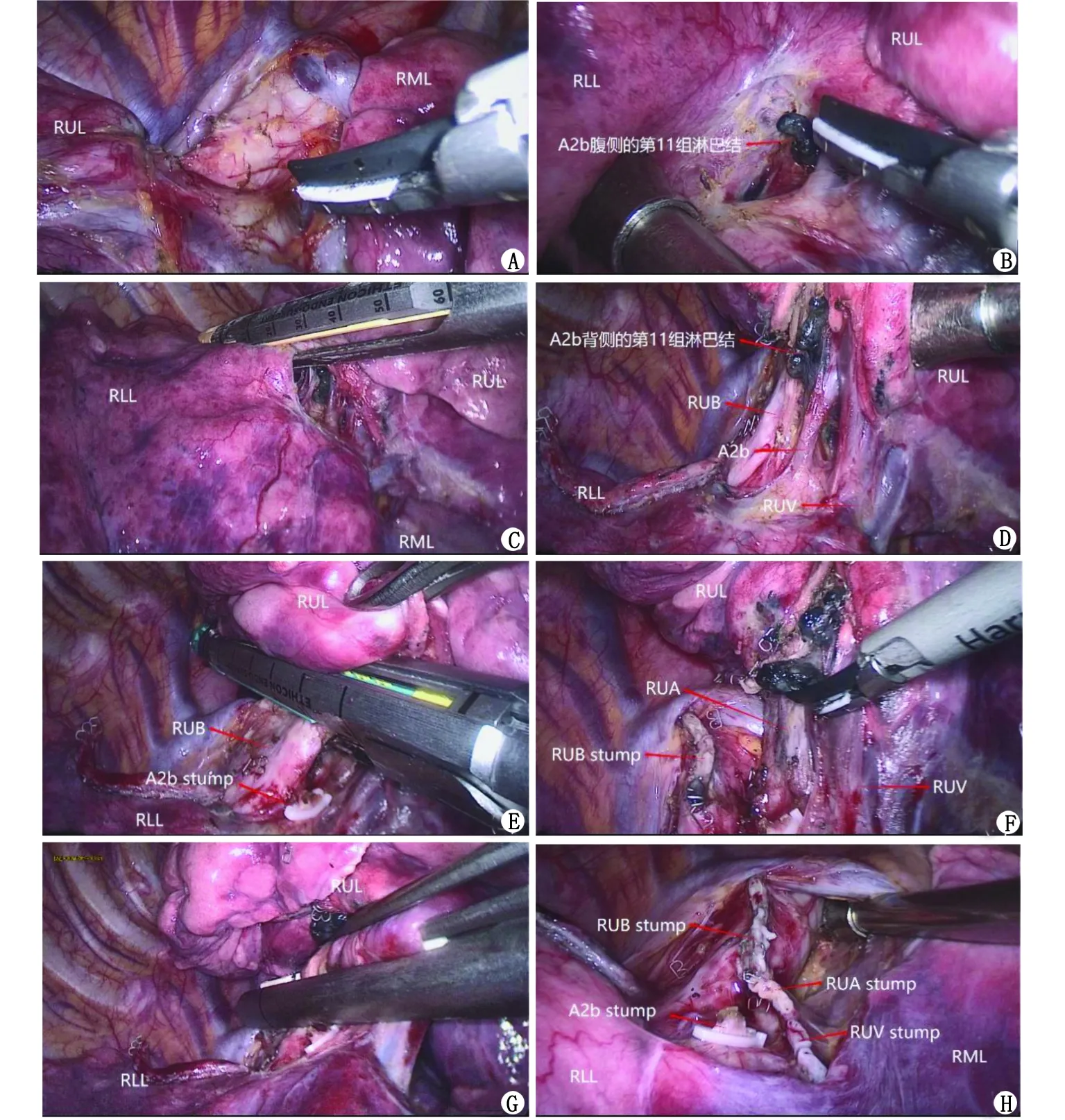
RUL:右上肺叶;RML:右中肺叶;RLL:右下肺叶;RUB:右上叶支气管;RUV:右上肺静脉;RUA:右上肺动脉。A:打开上肺门纵隔胸膜,游离右上叶支气管后壁;B:以叶间第11组淋巴结作为打开后肺裂的标识;C:“隧道式”打开融合后肺裂;D:打开后肺裂后的解剖结构;E:夹闭A2b后,以闭合器离断RUB;F:清扫右上肺动静脉间隙的淋巴结;G:将右上肺动静脉一并离断;H:右上肺叶切除术后术区情况。图1 优化的右上肺叶切除手术过程Fig.1 Optimized right upper lobectomy procedure
1.2.1.2 “隧道式分离肺裂”
1.2.1.2.1 前水平裂的处理 先向背侧牵拉右上肺前段肺组织,打开前纵隔胸膜,清扫前肺门淋巴结,使用胸腔镜器械撑开右上肺静脉与右中肺静脉之间、A4上方的疏松间隙,至与前述水平裂与斜裂交界区肺动脉干鞘膜层面汇合,即可以腔镜直线切割闭合器打开(图2)。

RMV:右中肺静脉;RUV:右上肺静脉。A:经前肺门打开RUV与RMV之间、A4上方间隙,即建立隧道;B:腔镜直线切割闭合器贯穿隧道打开肺裂。图2 “隧道式分离肺裂”处理融合水平裂Fig.2 “Tunnel separation of lung fissure” to deal with fusion horizontal fissure
1.2.1.2.2 后斜裂的处理方法 同前水平裂,先向腹侧牵拉右上肺后段肺组织,打开后肺门纵隔胸膜,需要贯穿的是A6上方、右上叶支气管与中间干支气管之间的间隙。
1.2.2 对照组 首先游离、离断右上肺静脉或尖前干动脉,而后根据术中情况,分别处理后升动脉、右上叶支气管及叶裂。处理顺序及方法依照手术者习惯进行。
1.3 随访方案 术后每3个月进行1次胸部及上腹部CT、血清肿瘤标志物检测,持续2 a;其后每6~12个月进行1次复查。术后每年进行 1次颅脑MRI及全身骨显像检查。主诉转移部位临床症状者,即时进行相应器官复查。随访截至2021年12月 31日。

2 结 果
2.1 临床病理资料 两组患者的年龄、性别、吸烟史、合并基础疾病比较,差别均无统计学意义(P>0.05)。肺癌组织学分型依据2015年世界卫生组织肺肿瘤分类,腺癌为最主要组织学类型;病理分期依据2017年UICC/AJCC第8版TNM分期标准。两组患者的肿瘤类型、术后病理分期分布上比较,差别均无统计学意义(P>0.05,表1)。
2.2 术中及术后情况 所有患者均顺利完成手术,无手术死亡病例。优化组较对照组手术时间短、出血少、中转开胸率低(P<0.05)。两组患者均无术后严重出血,无围术期死亡。优化组术后胸腔硅胶引流管留置时间少于对照组(P=0.009);术后住院时间低于对照组,差别无统计学意义(P=0.103)。两组患者术后并发症包括肺部感染、肺不张、持续肺漏气>7 d、心律失常及乳糜胸,总并发症发生率及除持续肺漏气外的各并发症发生率比较,差别均无统计学意义(P>0.05)。对照组术后持续肺漏气的发生率较优化组高(P=0.034,表2)。
2.3 随访结果 随访6~36个月,36例(19.3%)发生术后复发转移情况。两组患者复发、转移发生率比较,差别无统计学意义(20.4%vs18.0%,P=0.674,表3)。
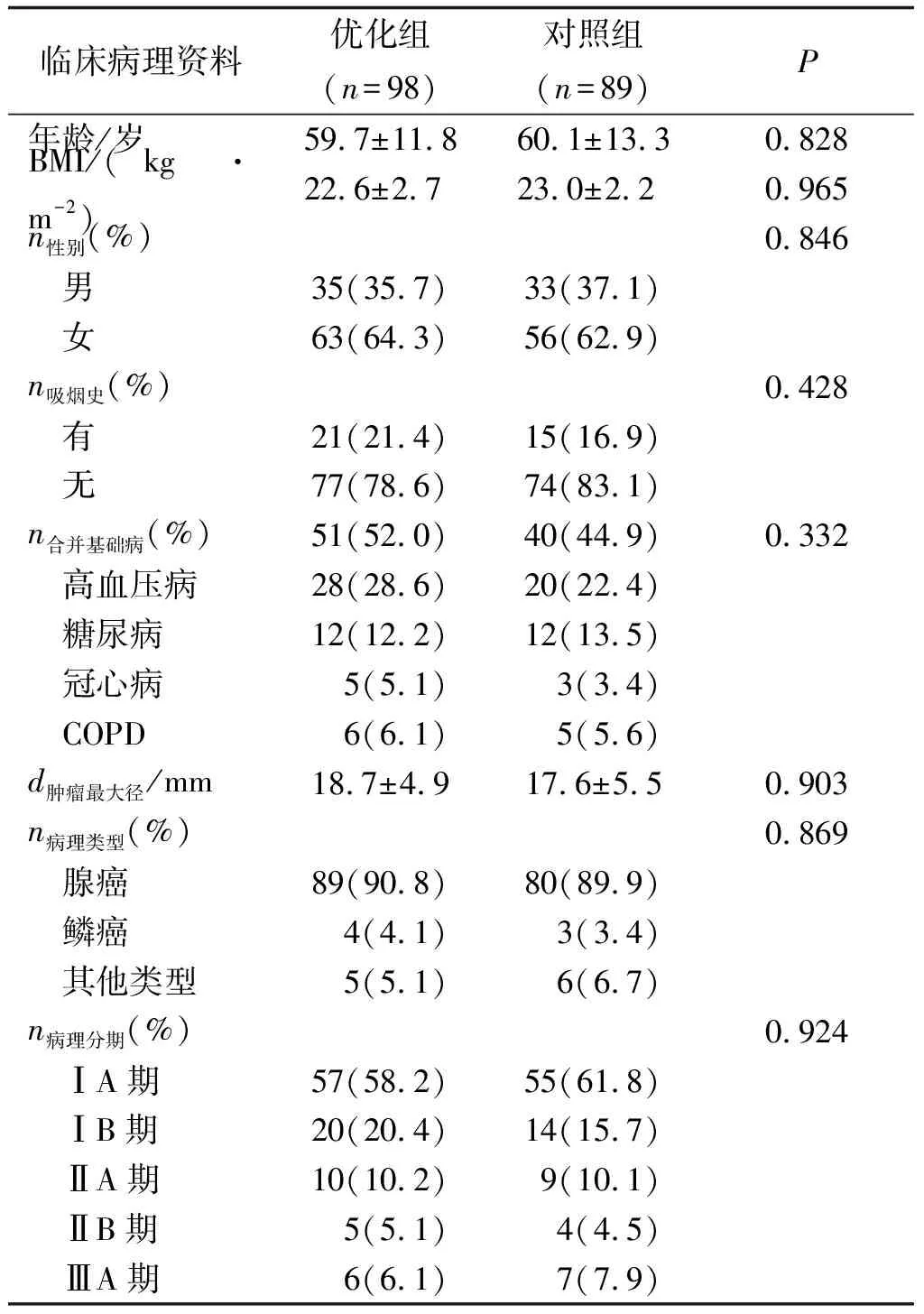
表1 两组患者的临床病理资料比较
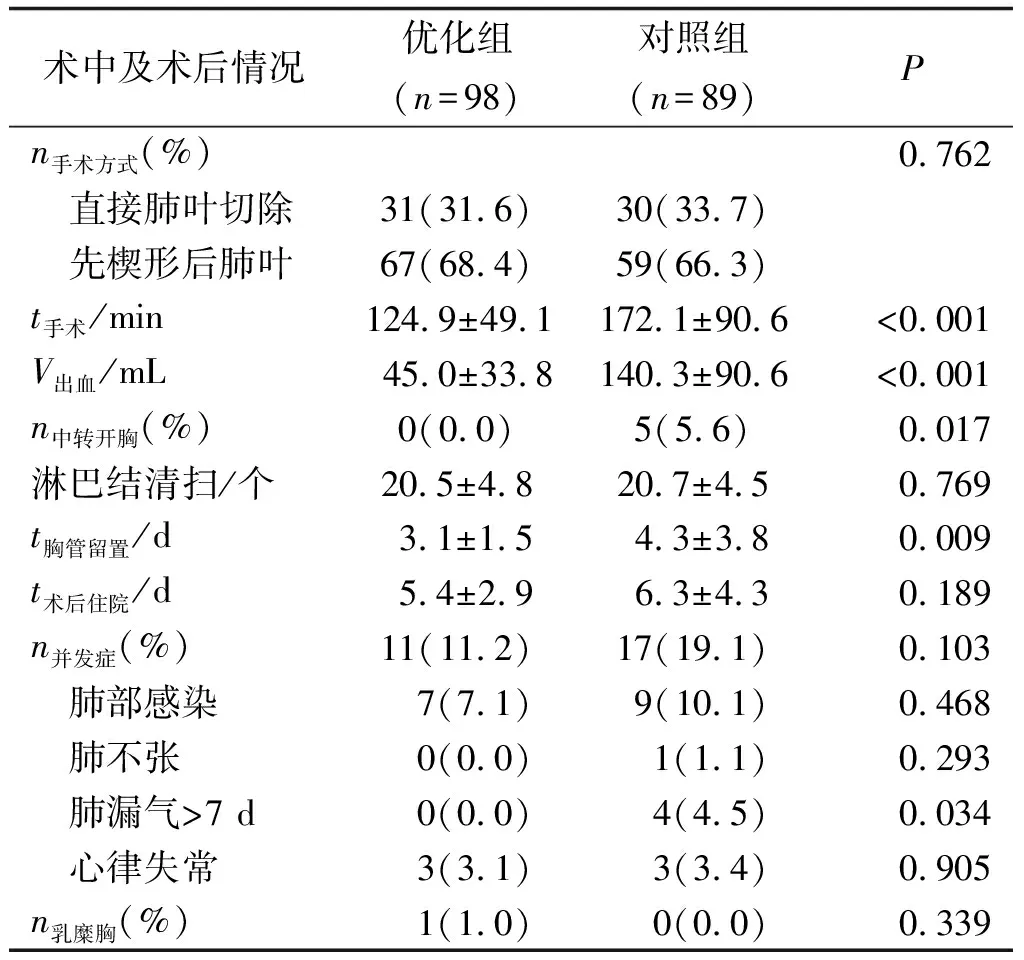
表2 两组患者术中及术后情况比较
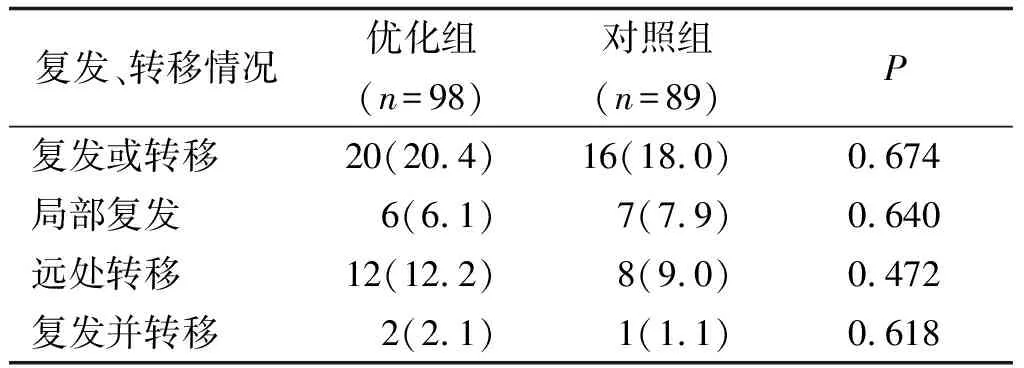
表3 两组患者肿瘤复发、转移情况比较
3 讨 论
自1992年首例胸腔镜解剖性肺叶切除手术报道以来,微创胸外科的发展已近30 a[1]。2012版NCCN指南推荐将胸腔镜手术作为早期肺癌治疗的标准治疗方法[2],胸腔镜手术得到了外科医生和患者的青睐[3]。随着腔镜设备的发展及手术技术的成熟,越来越多的肺癌患者得到了创伤小、恢复快、效果好的手术治疗。文献[4-5]报道,原发性肺癌发生在右上肺的比例最高(29.2%~37.2%),而在RUL中,其肺门解剖及手术流程较为复杂。为切除右上肺叶,需对右上肺动静脉分支血管进行逐一游离、离断,手术过程相对繁复,且增加术中出血风险,不利于患者安全和年轻医生学习。
实践证明,基于循证医学的诊疗技术、有效的精细化手术流程管理和手术质量控制,有助于提高治疗水平,使患者最大化受益。基于这样的初衷,笔者单位在长期单操作孔胸腔镜肺叶切除手术的临床实践中,对RUL存在的问题进行深入分析,总结出一套行之有效的手术优化方案。与常规RUL比较,该手术优化有3个核心,即“支气管先行”“血管一并离断”“隧道式分离肺裂”,其理论依据及手术要点总结如下。
(1)“支气管先行”是指优先于肺血管首先离断右上叶支气管,主要理论依据在于右上叶支气管位置固定,解剖变异少,故其处理相对简单、安全;更重要的是,在支气管离断之后,右上肺活动度明显增大,可以将剩余右上肺动静脉一并离断,避免了在逐一分离肺血管过程中出血的风险,使RUL更加安全。此外,先离断支气管,减少肺泡中残留的空气存储,消除可能由肺充血引起的支气管黏膜的非炎性反应,减少可能产生的痰液以及之后肺部感染的机会[6]。
为了首先离断右上叶支气管,在打开上肺门纵隔胸膜之后,应游离右上叶支气管后壁,并将气管与尖前干动脉之间的间隙打开,避免从腹侧至背侧置入腔镜切割闭合器困难甚至撕裂尖前干动脉。通常在A2b腹背侧都会有叶间的淋巴结,腹侧的第11组淋巴结是打开肺裂至肺动脉鞘膜层面的标记;背侧的淋巴结位于右上叶支气管与中间干支气管之间,需清扫后方可离断上叶支气管。
(2)“血管一并离断”的含义及其所带来的好处不言而喻。无需对右上肺血管分支逐一解剖,简化手术步骤,降低手术时间、术中出血风险及出血中转开胸率;多支血管一并离断,减少一次性钉仓用量,降低手术耗材及成本。它是“支气管先行”和“隧道式分离肺裂”的直接成果。手术过程应当注意将拟离断的肺动静脉血管根部的淋巴结切除或者游离后推向远端,确认血管间隙内无淋巴结残留后方可一并离断。得益于手术器械的改良,目前大多数的腔镜切割闭合器都是可转头的,术中可将闭合器上转25°~30°,保证血管切面平整。
(3)“隧道式分离肺裂”。肺裂发育的差异决定了手术方式的入路,如肺裂发育良好,可从叶间直接游离右上肺动静脉分支;但当肺裂发育不良甚至肺裂完全融合时,经肺裂入路游离往往较为困难,并常导致术中视野渗血甚至出血、术后肺漏气时间延长等情况。单向式肺叶切除已被证实为处理肺裂发育不良时行之有效的手术方式[7]。笔者从单向式肺叶切除的手术方式中获得启发(对肺动静脉及其分支的处理层面均在肺实质外),在肺血管鞘膜表面游离可不进入肺实质,从而建立起肺实质之下、血管鞘膜之上的一个类似隧道的空间。
下斜裂的发育一般较好,在3个肺叶的交界区的肺组织往往较为薄弱,可以作为首先突破点来协助建立前后隧道。前述A2b腹侧的第11组淋巴结即是作为交界区解剖的一个重要标记。操作过程中,笔者习惯先用直角钳或平头钳贯通前后,再用小头卵圆钳扩大间隙,而后使用腔镜切割闭合器打开肺裂。如此在血管表面上操作,出血的风险低,可以保证手术视野清晰,手术技巧易于掌握,加深年轻术者对肺门解剖结构的认识,降低术后持续肺漏气的发生率。
此外,笔者也从理论及实践经验中总结优化手术方案可能存在的问题:
(1)“支气管先行”而非肺静脉先行,是否更易引起肿瘤的播撒,导致术后的复发及远处转移?由于在手术过程中肿瘤病灶可能被挤压,肿瘤细胞释放入血,从而增加了术后微转移的风险[8],故传统手术过程建议先阻断肺静脉。但既往国内外学者的研究结果也有所不同[9-11]。本研究中,无论是总复发、转移发生率还是复发、转移类型,优化组与对照组间均无明显差异。笔者认为,无论先离断支气管还是肺静脉,术中都应该避免反复翻动肺叶及挤压肿瘤。按照优化的手术策略,在血管离断之前,右上肺叶均在原位;术中也不需要反复翻动肺叶进行暴露。
是否不同手术方式会对肺癌患者的复发转移率、复发转移类型及总生存时间产生影响,需要更大的样本、更长时间的临床随访数据来验证。目前血液循环肿瘤细胞的检测技术已相对成熟,但因成本较高,临床主要应用于术后微转移灶的监测。如果将来可以通过检测手术前后血液循环中肿瘤细胞的丰度,那么不同手术方式的肿瘤学效益的评估就能更加明了。
(2)“血管一并离断”是否可能导致肺动静脉交通而产生咯血的症状,或增加新的并发症?本研究的回顾性数据中并未在术后及随访过程中发现此类并发症。理论上,如果在术后短期,肺动静脉断端的间隙内因为炎症等原因腐蚀血管并形成包裹,可以形成动静脉交通,但此时已无供应的肺组织,故也不会出现咯血的症状。由于个体差异,每个患者的血管厚度可能稍有不同,所以在术中使用统一钉长的闭合钉离断肺血管后,常出现血管断端渗血的现象;对多支血管一并离断,闭合钉对更多的组织连续施加压力,使得血管闭合更好,故而术中血管断端渗血现象较少,术野相对干净、清楚。
(3)“血管一并离断”“隧道式分离肺裂”是否会导致N1淋巴结的清扫不足?在手术过程中,笔者非常重视N1淋巴结的清扫。在血管一并离断之前,肺动静脉根部的淋巴结必须首先切除或者充分游离后推向远端。必须确认淋巴结不会因闭合器的切割而残留在血管间隙内,方可执行操作。另外,因为叶间的淋巴结总是与血管、支气管伴行并存在于鞘膜内,故“隧道式分离肺裂”理论上不会将淋巴结残留在肺组织上。
综上所述,本研究构建了一种胸腔镜RUL手术方式的优化理论,并详细阐述了手术操作的流程及技术细节与要点。以“支气管先行”“血管一并离断”“隧道式分离肺裂”为核心的胸腔镜RUL安全、有效,值得临床推广应用。
