中风胶囊对脑缺血/再灌注损伤模型鼠脑组织自噬相关蛋白表达的影响*
2022-06-02吕栋辉安方玉颜春鲁李海龙王嘉玉袁灵青赵延真杨建新颉旺军
吕栋辉,安方玉,颜春鲁,李海龙,王嘉玉,石 瑶,袁灵青,赵延真,杨建新,郭 丹,颉旺军
(1.甘肃中医药大学中西医结合学院,兰州 730000;2.甘肃中医药大学教学实验实训中心,兰州 730000;3.甘肃中医药大学第一临床医学院,兰州 730000;4.甘肃中医药大学基础医学院,兰州 730000;5.天水市中医院,天水 741000;6.甘肃省中医药研究中心,兰州 730000;7.甘肃中医药大学针灸推拿学院,兰州 730000)
脑缺血/再灌注损伤(cerebral ischemia/reperfusion injury,CI/RI)是脑组织在发生缺血后重新得到血液的过程中伴随发生的脑功能障碍和结构损伤现象。由于发病率高、致残率高和致死率高等“三高”的特点,严重威胁着人类的生命健康[1]。已有研究发现,CI/RI的主要病机涉及氧化应激损伤[2]、炎症反应[3]、神经细胞凋亡[4]等。其中,有关CI/RI引发的神经细胞凋亡备受关注。自噬作为一种特殊的细胞凋亡形式,相关研究已经证实,细胞自噬参与调控了CI/RI阶段的神经细胞损伤与凋亡[5]。也有研究表明[6],抑制CI/RI模型大鼠的PI3K/Akt信号通路后,可进一步调控其下游自噬相关靶蛋白的表达来加重脑损伤。提示,PI3K/Akt通路可能是导致CI/RI发生神经细胞损伤与凋亡的关键。反之,激活CI/RI模型大鼠的PI3K/Akt信号通路可以发挥脑损伤的保护作用,但具体分子机制未明。
近年来,中医复方在CI/RI中以多靶点、多途径、整体调节的优势对其神经元损伤发挥明显的保护作用[7]。中风胶囊由三七、水蛭、红参、土鳖虫、穿山甲、大黄、丹参组成,全方具有补气行血,化瘀通络之功,可能对CI/RI的神经损伤具有防护作用。为此,本研究采用改良线栓法构建CI/RI模型,通过观察中风胶囊对CI/RI模型大鼠PI3K/Akt/Beclin1信号通路的自噬相关基因及蛋白表达的影响,初步从细胞自噬角度揭示中风胶囊干预的分子机制,为其临床应用提供实验依据。
1 材料与方法
1.1 动物
选取体质量为(180±20)g的SPF级健康雄性SD大鼠60只,购自甘肃中医药大学科研实验动物中心,动物质量合格证号:SYXK(甘)2015-0005,本实验动物及条件符合甘肃中医药大学科研中心实验动物伦理委员会要求。
1.2 实验药物
中风胶囊(河南省中医药研究附属医院,产品批号:20180901)。阳性药物丁苯酞(石药集团恩必普药业有限公司,产品批号:118190343)。
1.3 主要试剂
10%水合氯醛(天津市光复精细化工研究所,批号:20170318);反转录试剂盒(上海翊圣生物科技有限公司,批号为:11141-C);实时荧光定量PCR试剂盒(上海翊圣生物科技有限公司,批号为:11201ES08);实时荧光定量PCR引物由TaKaRa公司设计并合成,引物序列为:Beclin1上游:5′-ATTGAAACTCGCCAGGATGGT-3′,下游:5′-CTGGTCTTCACAGGGTGCTA-3′;LC3上游:5′-TTGGTCAAGATCATCCGGCG-3′,LC3下游:5′-AGATGTCAGCGATGGGTGTG-3′;GAPDH上游:5′-AGTGCCAGCCTCGTCTCATA-3′,GAPDH下游:5′-TTGTCACAAGAGAAGGCAGC-3′。大鼠血清雌二醇(E2)ELISA试剂盒(江苏菲亚生物科技有限公司,批号为:1812R);大鼠血清卵泡刺激素(FSH) ELISA检测试剂盒(江苏菲亚生物科技有限公司,批号为:1903R);Rabit Anti-PI3K Polyclonal Antibody(Affinity,AF6242);Rabit Anti-pPI3K Polyclonal Antibody(Immunoway,B2401);Rabit Anti-Akt Polyclonal Antibody(Immunoway,B8501);Rabit Anti-pAkt Polyclonal Antibody(Genetex,41766);Rabit Anti-Beclin1 Polyclonal Antibody(Immunoway,B2601);Rabit Anti-LC3 Polyclonal Antibody(Immunoway,B8101);RabitGAPDH Polyclonal Antibody(Immunoway,B1501)。
1.4 仪器
iMark型酶标仪(美国Bio-Rad公司);5424R型高速冷冻离心机(德国Eppendorf);ABI-9700型PCR扩增仪(Applied biosystems公司);Quantstudio3型荧光定量PCR仪(Thermofisher公司);Minichemi610型化学发光成像仪(北京六一生物科技有限公司);BX53型光学显微镜(日本奥林巴斯公司)。
1.5 实验药物的给药剂量
按照体表面积换算法,计算大鼠所用中风胶囊的中剂量(临床人用剂量为6 g/d),其具体计算方法为:6 g×0.018×5=0.54 g/(kg·d)。则中风胶囊高、中、低剂量分别为1.08、0.54、0.27 g/(kg·d)。
1.6 动物分组、给药及造模
60只SPF级雄性SD大鼠饲养1周后,随机分为假手术组(sham operation group)、模型组(model group)、丁苯酞组(butylphthalide group)、中风胶囊高、中、低剂量组,每组 10 只。模型组及各干预组均采用改良线栓法建立大鼠右侧大脑中动脉闭塞(middle cerebral artery occlusion,MCAO)模型。10%水合氯醛(0.3 ml/100 g)腹腔麻醉后,将大鼠颈部正中皮肤切开,结扎颈外动脉远端,于近端插入直径0.25 mm的尼龙线,将尼龙线缓慢向颅内推进,进线18 mm左右,略感阻力即到大脑中动脉起始部阻断右侧大脑中动脉,2 h后将尼龙线拔至颈外动脉残端,实现血流再灌注,缝合皮肤切口,成功构建MCAO模型。假手术组除不插尼龙线闭塞大脑中动脉之外,其余步骤同造模组。术后各组大鼠均在相同条件下,自由饮水,摄食。缺血/再灌注24 h后,假手术组、模型组大鼠均给予等体积 0.9%氯化钠溶液灌胃,丁苯酞组灌服丁苯酞0.054 g/(kg·d) ,中风胶囊高、中、低剂量组分别按1.08、0.54、0.27 g/(kg·d)灌胃,给药10 d,每天1次。干预结束后留取血清,处死各组大鼠,摘取脑组织备用。
1.7 各组大鼠神经功能损伤评分
各组大鼠末次给药24 h后,观察其神经系统症状。参考经典的ZeaLonga 评分法对MCAO大鼠进行神经功能评分:0分:无神经功能障碍;1分:瘫痪侧前肢伸展不完全,轻度神经功能障碍;2分:爬行时,大鼠向瘫痪侧转圈,中度神经功能缺损;3分:爬行时,大鼠身体向瘫痪侧倾斜,重度神经功能缺损;4分:意识障碍,甚至处于昏迷状态。
1.8 各组大鼠体重及脑指数的测定
各组大鼠干预结束后24 h,称取各组大鼠体重,然后立即断头取脑,在冰台上剥离出大鼠全脑,称脑湿重。脑指数(mg/g)=脑质量(mg)/体质量(g)。
1.9 各组大鼠脑组织病理形态变化观察
4%甲醛溶液固定脑组织,常规石蜡包埋,行厚5 μm冠状切片,经二甲苯、乙醇、蒸馏水洗脱后,苏木精染色5 min,然后水洗,0.5%伊红液染色3 min,蒸馏水冲洗、脱水、干燥后封片,光镜下观察脑组织结构改变。
1.10 各组大鼠血清中雌二醇(E2)和卵泡刺激素(FSH)的含量
各组大鼠干预结束后24 h,采集外周血,3 500 r/min,离心15 min,取上清液。按照ELISA试剂盒说明书测定血清E2、FSH水平,具体步骤按试剂盒说明书进行。
1.11 各组大鼠脑组织Beclin1、LC3的基因表达测定
用Trizol试剂提取各组大鼠脑组织总RNA。反转录试剂盒合成cDNA,根据实时荧光定量PCR扩增试剂盒进行PCR扩增,扩增条件如下:预变性95℃、5 min,变性95℃、10 s,退火60℃、20 s,延伸72℃、20 s,共40个循环。用实时荧光定量试剂盒定量Beclin1、LC3mRNA表达,数据经2-ΔΔCt处理后进行Beclin1、LC3mRNA相对表达量分析。
1.12 各组大鼠脑组织PI3K、p-PI3K、Akt、p-Akt、Beclin1、LC3的蛋白表达测定
采用RIPA裂解液提取大鼠缺血区域脑组织总蛋白,蛋白质含量的测定用 BCA 法,并调整点样的蛋白质浓度为50 μg /10 μl,10 μl/well,作SDS-PAGE、转膜、封闭、滴加一抗(PI3K、pPI3K、Akt、pAkt、Beclin1、LC3和GAPDH),4℃孵育过夜,TBST 洗涤5 min×4次后,滴加山羊抗兔IgG 37℃孵育1 h,TBST漂洗5 min×3次,将ECL超敏发光液的A和B溶液等体积混匀后滴加于山羊抗兔IgG孵育过的PVDF 膜上,暗室静置反应1 min 后Image J6.0进行曝光,然后进行灰度值的分析。
1.13 统计学处理
2 结果
2.1 中风胶囊对各组大鼠体质量、脑指数及神经功能缺损评分的影响
与假手术组比较,模型组大鼠体质量显著降低,脑指数和神经功能缺损评分显著升高(P<0.05);与模型组比较,中风胶囊高剂量组大鼠体质量显著升高、神经功能缺损评分显著降低,中风胶囊各干预组大鼠脑指数均显著降低(P<0.05,表1)。

Tab. 1 Effects of Zhongfeng capsule on body weight,brain index and neurological injury score in rats of each n=10)
2.2 中风胶囊对各组大鼠血清雌二醇(E2)和卵泡刺激素(FSH)含量的影响
与假手术组比较,模型组大鼠血清E2和FSH含量均降低,但无统计学意义(P>0.05);与模型组比较,中风胶囊各干预组大鼠血清E2和FSH含量均升高,但无统计学意义(P>0.05,表2)。

Tab. 2 Effects of Zhongfeng capsule on serum levels of estradiol (E2) and follicle stimulatihormone(FSH) in rats of each n=10)
2.3 中风胶囊对各组大鼠脑组织病理形态变化的影响
假手术组的脑组织细胞结构完整,神经元细胞形态正常,未见炎性细胞浸润;模型组脑组织结构排列疏松,间隙变宽,间质水肿,神经细胞呈三角形,核固缩深染;中风胶囊高剂量组和阳性对照组神经细胞排列较整齐,间质水肿明显减轻,变性和坏死的神经元数量明显减少(图1)。
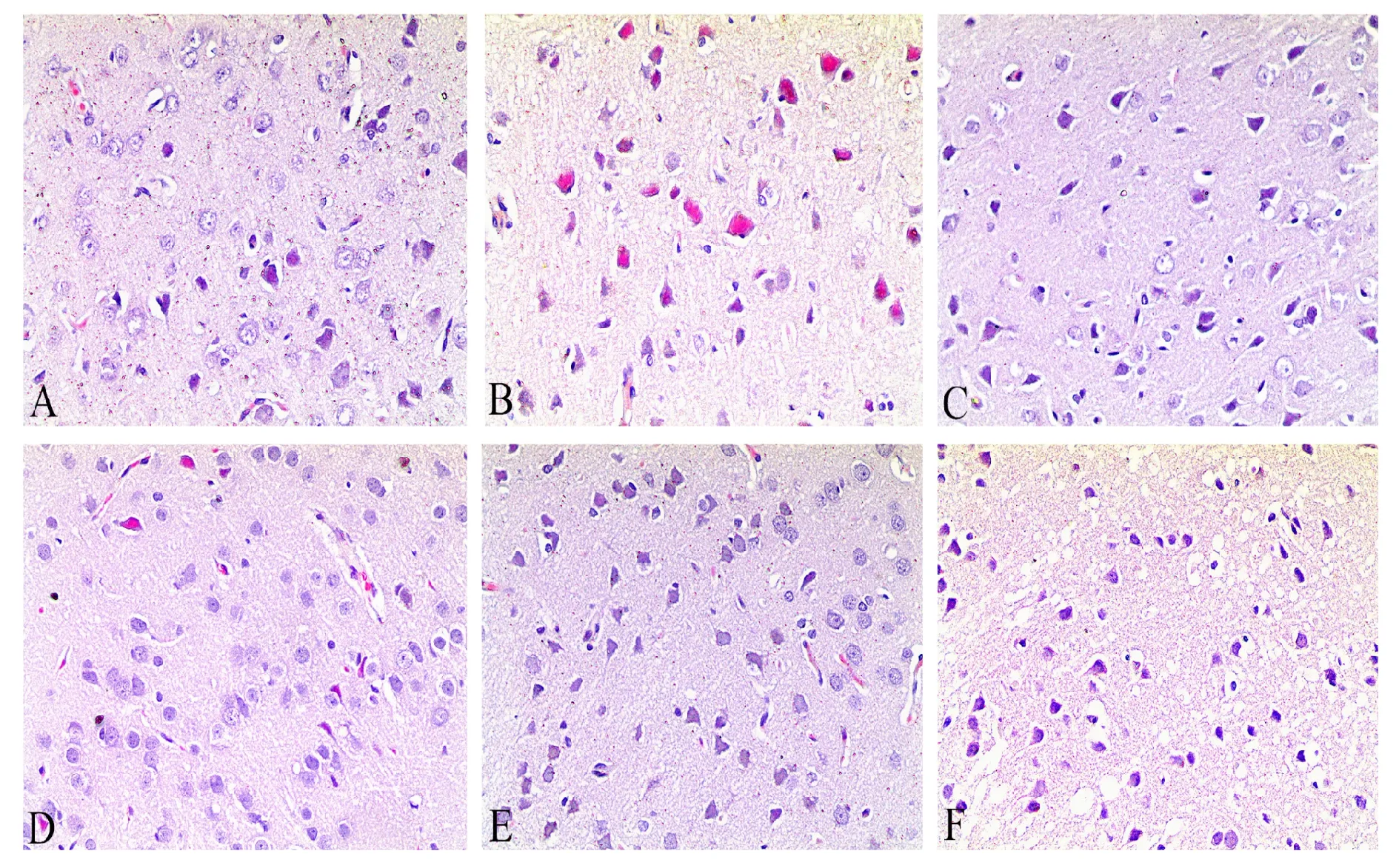
Fig. 1 Effects of Zhongfeng capsule on pathomorphological changes of brain tissue in rats of each group(HE ×20)
2.4 中风胶囊对各组大鼠自噬相关基因Beclin1、LC3表达的影响
与模型组比较,中风胶囊各干预组大鼠脑组织LC3和Beclin1的基因表达均显著降低(P<0.01,表3)。

Tab. 3 Effects of Zhongfeng capsule on gene expressions of Beclin1 and LC3 in rats of each n=6)
2.5 中风胶囊对各组大鼠PI3K、p-PI3K、Akt、p-Akt、Beclin1、LC3蛋白表达的影响
与假手术组比较,模型组大鼠脑组织p-PI3K和p-Akt的蛋白表达均显著降低,LC3和Beclin1的蛋白表达均显著升高(P<0.01);与模型组比较,中风胶囊各干预组大鼠脑组织p-PI3K和p-Akt的蛋白表达均显著升高,LC3和Beclin1的蛋白表达均显著降低(P<0.01,表4,5,图2)。
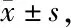
Tab. 4 Effects of Zhongfeng capsule on protein expression gray values of PI3K,p-PI3k,Akt and p-Akt in rats of each group(OD, n=6)
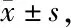
Tab. 5 Effects of Zhongfeng capsule on protein expression gray values of LC3 and Beclin1 in rats of each group(OD, n=6)
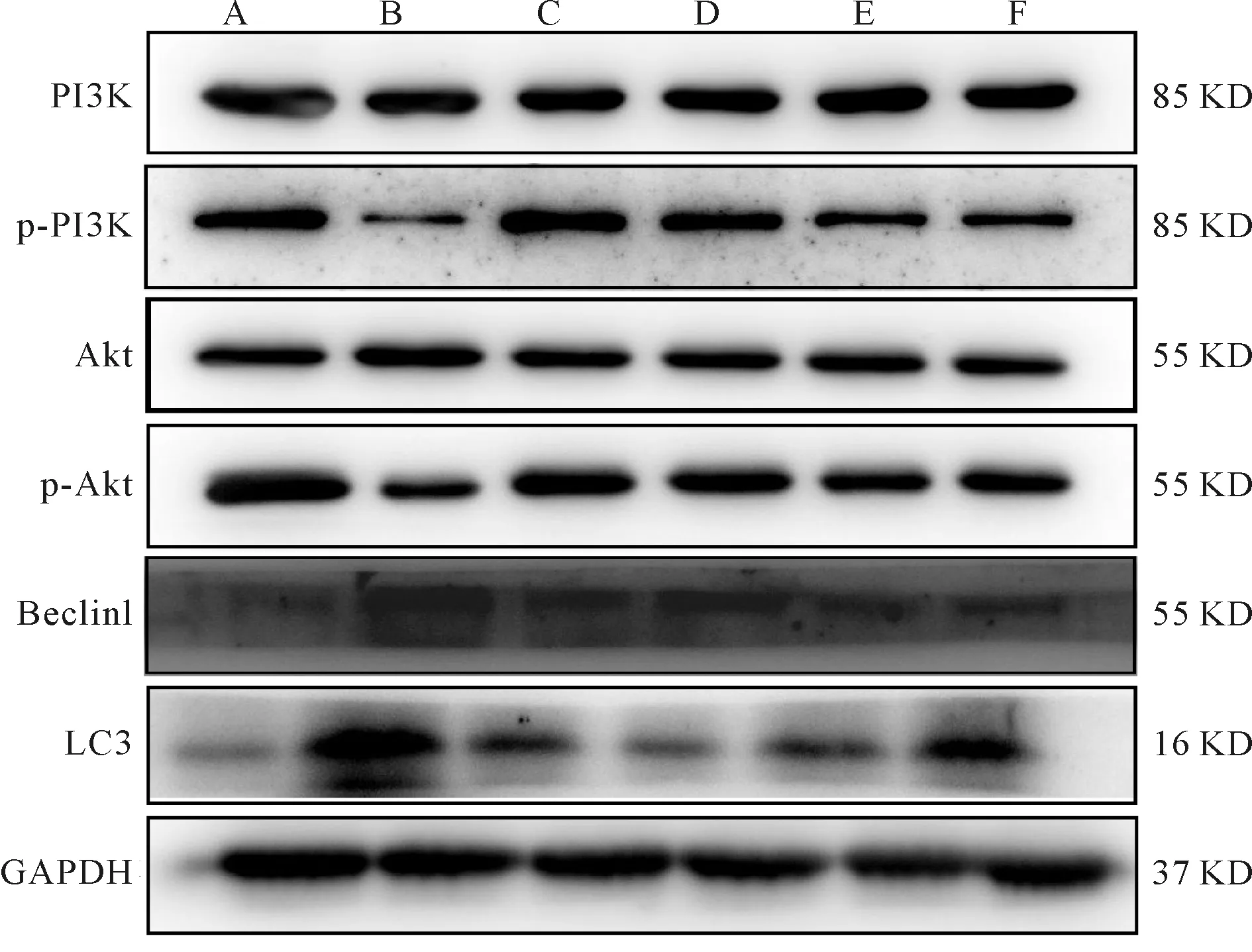
Fig. 2 Effects of Zhongfeng capsule on PI3K,p-PI3K,Akt,p-Akt,LC3 and Beclin1 protein expressions in rats of each group(Western blot)
3 讨论
缺血性脑卒中在中医学中属于本虚标实之证,以气虚为本,血瘀为标[8]。因此以“益气活血通络”为主要治法。中风胶囊由三七、水蛭、红参、土鳖虫、穿山甲、大黄、丹参组成。方中红参大补元气,气旺以促血行为君药;水蛭、土元、穿山甲三药合用破血逐瘀通络是为臣药;三七、丹参加强臣药活血化瘀之功效,且有化瘀不伤正的特点为佐药;大黄逐瘀通经,导瘀血下行亦为佐药,全方攻补兼施,标本兼治,具有补气行血,化瘀通络之功。依据组方分析,可能对CI/RI具有防护作用,但是其具体治疗机制未明。
近年来研究发现[9,10],大鼠脑缺血/再灌注损伤24 h后,其神经功能缺损评分明显上升,脑梗死体积显著增加,缺血神经元的结构和功能严重受损,神经元大量丢失。提示,CI/RI 导致机体的神经功能缺损,神经元脱失、变性及功能改变,同时也是影响神经信息传递和神经功能恢复的关键病机[11]。本实验研究结果显示,脑缺血/再灌注损伤模型鼠体重显著降低,脑指数及神经功能缺损评分显著升高,其脑组织结构排列疏松,间隙变宽,间质水肿,神经细胞呈三角形,核固缩深染。提示脑缺血/再灌注加重了脑组织病理损伤和脑神经功能缺损。给予中风胶囊干预后,其高剂量组大鼠体重显著升高,神经功能缺损评分显著降低,其神经细胞排列较整齐,间质水肿明显减轻,变性和坏死的神经元数量明显减少,但未完全恢复正常;中风胶囊各剂量脑指数显著降低。提示中风胶囊可能通过降低脑缺血/再灌注损伤模型鼠神经功能评分来改善其脑组织的病理损伤,但具体通过何种分子机制来发挥作用,目前尚未研究。
PI3K是一种细胞内磷脂酰肌醇激酶,其下游的Akt为丝氨酸/苏氨酸激酶,二者参与调控细胞的生存、增殖和凋亡,维持细胞的正常功能[12]。PI3K/Akt信号通路是细胞内经典的保护性通路[13],在多种脏器缺血/再灌注损伤中发挥着抗炎、抗氧化应激、抗凋亡等多种保护作用[14]。近年来,越来越多的研究表明[15],PI3K/Akt信号通路可通过调控Beclin1和LC3的表达来参与脑缺血/再灌注损伤的自噬调控。其激活途径是:多种细胞因子和神经因子与酪氨酸激酶受体结合激活PI3K,活化的PI3K能够使下游的Akt发生磷酸化反应,p-Akt可以进一步抑制下游分子Beclin1和LC3的表达,从而抑制神经元的自噬反应,保护脑缺血/再灌注损伤[16]。Beclin1作为PI3K/Akt信号通路的下游靶基因,被认为是反映细胞自噬特异性的标志蛋白,主要功能是参与自噬体的形成,促进自噬体的成熟[17];LC3作为PI3K/Akt信号通路的下游的另一靶基因,也被认为是反映细胞自噬特异性的标志蛋白,其中LC3Ⅱ是成熟自噬体的标志分子,且随着自噬体膜的增加而增加[18]。研究已经证实[19,20],脑缺血/再灌注损伤后p-PI3K、p-Akt的表达是下调的,自噬蛋白Beclin1、LC3的表达是上调的。说明脑缺血/再灌注损伤可以激活机体自身的自噬水平,从而进一步加重缺血脑组织的神经元损伤。本研究结果也发现,脑缺血/再灌注损伤模型组鼠脑组织p-PI3K、p-Akt表达水平明显下降,Beclin1、LC3的表达水平显著上升,与上述研究报道一致。另有研究发现[21],一些复方制剂如加味涤痰汤可明显下调 LC3Ⅱ、Beclin1表达,上调p62表达来抑制脑缺血/再灌注损伤模型鼠脑组织自噬,进一步减轻脑缺血/再灌注损伤鼠脑神经元损伤,发挥其神经保护作用。陈琰琰等[22]的研究也进一步证实,通络清脑注射粉针剂通过下调Beclin1、LC3的表达来抑制大鼠海马和皮质区过度自噬,减少自噬体数量,减轻神经元凋亡,保护MCAO诱导的脑损伤。本研究显示,中风胶囊干预后,显著上调脑缺血/再灌注损伤鼠脑组织p-PI3K、p-Akt蛋白表达,下调Beclin1、LC3的基因和蛋白表达。由此可见,中风胶囊通过抑制PI3K/Akt信号通路中的Beclin1、LC3的表达来抑制脑缺血/再灌注损伤鼠神经元的自噬,从而发挥保护其脑神经细胞功能的作用。
综上所述,中风胶囊对脑缺血/再灌注损伤鼠具有明显的脑保护作用,其机制可能是通过上调PI3K/Akt/信号通路中p-PI3K、p-Akt表达和下调PI3K/Akt信号通路中Beclin1、LC3表达来抑制神经元过度自噬(图3)。但本文仅从细胞自噬的角度研究中风胶囊对脑缺血/再灌注损伤模型鼠的脑保护机制,鉴于PI3K/Akt信号通路调控靶点的复杂性,中药复方的多靶点、多途径、整体协调的特点,对中风胶囊干预脑缺血/再灌注损伤模型鼠的脑保护机制将进一步从炎症和凋亡等双向调控的分子机制展开,作为后续研究的重点。
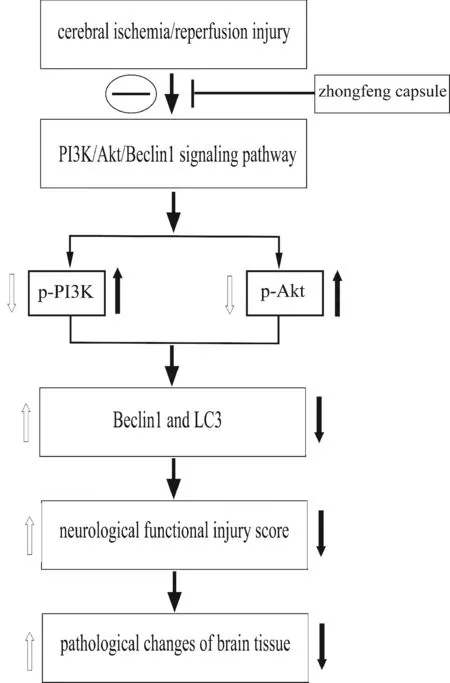
Fig. 3 Molecular mechanisms of Zhongfeng capsule protecting cerebral ischemia/reperfusion injury in rats
