不同频率的振动训练对大鼠早期膝骨关节炎关节软骨的修复作用及其JNK/NF-κB、SOX9机制*
2022-06-02汪宗保柳奇奇杨永晖李斯亮姚长风
汪宗保,王 连,柳奇奇,杨永晖,刘 攀,李斯亮,姚长风
(1.安徽中医药大学康复医学院,合肥 230038;2.安徽中医药大学第三附属医院,合肥 230031;3.上海体育学院运动科学学院,上海 200438)
膝骨关节炎(knee osteoarthritis,KOA)是一种慢性、退行性和致残性膝关节疾病,以关节软骨破坏、滑膜炎、关节周围结构和软骨下骨改变为特征,表现关节逐渐僵硬、阵发性疼痛和功能逐渐衰退,严重影响患者的日常生活[1],合理训练可改善KOA的相关症状,振动训练(vibration exercise,VE)近些年试用于本病的临床康复治疗,表现出有效、安全、舒适、方便、依从性好,易长期坚持。据报道[2]振动训练可对KOA患者关节的骨性结构、软组织和神经功能显著改善,但作用机制可能存在具体发挥作用的多种信号通路机制。
JNK(c-Jun N-termianl kinase,JNK)是一种c-Jun氨基末端激酶,在细胞炎症和凋亡相关基因表达中起重要作用,有报道[3]称c-Jun n端激酶(JNK)在内的丝裂原活化蛋白激酶(MAPKs)可调节KOA,其信号在细胞分化、凋亡和增殖中的作用可通过三个保守的酶级联激活转录因子调控基因表达。而肿瘤坏死因子-κB(nuclear factor kappa B,NF-κB)是涉及骨关节炎的重要转录因子,在炎症发生中也起着关键作用,其抑制效应有望成为KOA治疗的一种思路[3]。另有研究[4]表明SOX9与NF-κB有关联,它们可以调节软骨形成。SOX9又是软骨形成的主要调节因子,COL2A1的表达在体内直接受到SOX9蛋白调控[5]。
因此,本研究试图从上述关联信号探讨不同频率的振动训练对早期KOA关节软骨细胞凋亡相关蛋白JNK及NF-κB通路表达的影响分析其可能作用机制,为振动训练影响骨关节炎软骨修复完善理论实验依据。
1 材料与方法
1.1 实验动物
从合肥安徽医科大学实验动物中心购买健康雄性SD大鼠(生产许可证scxk(皖)2017-001),数量多于本研究最低要求48只以备用,均为8周龄,体重在(250±25)g,大鼠分笼饲养环境:安徽中医药大学实验中心SPF级动物房,动物房温度设置于22~25℃,湿度设置40%~70%,光照时间满足12 h/d,食物为国内标准啮齿类动物饲料,饮自来水。
1.2 实验分组
SD大鼠在动物房标准环境适应性饲养一周,所有大鼠编号标记,实际使用中随机数字表法选出48只条件好的大鼠,随机分为6组(n=8):NC组,MC组,GP1(频率60 Hz),GP2组(频率40 Hz),ZP组(频率20 Hz),DP组(频率10 Hz),参照以往文献设置[6,7]。除NC组外,各组均建立膝关节骨关节炎模型,6周后造模完成进行振动训练。
1.3 实验试剂与仪器
主要试剂:乙醇、三氯甲烷、异丙醇、甲醇(上海苏懿化学试剂有限公司20180410),二甲苯(上海苏懿20180310),番红O软骨染色液(中国索莱宝20171031),逆转录试剂盒(美国Thermo Scientific),荧光定量PCR试剂盒(Qiagen,中国),RIPA细胞裂解液(强)(中国碧云天生物技术研究所Beyotime,货号P0013B),Western一抗二抗去除液(Beyotime,011918180129);NF-κB p65(北京中杉金桥,B2317);JNK(美国Bioworld Technology公司,AA34142),SOX9(中国博奥森Bioss公司,AG10233229),ECL超敏发光试剂盒(美国Thermo公司,SF249607),SOX9(兔抗大鼠多克隆抗体)(Bioss,AG10233229),NF-Kbp65(兔抗大鼠多克隆抗体)(Bioss公司,131225W),JNK(兔抗大鼠多克隆抗体)(Bioworld公司,AA34142),PVDF膜(Millipore公司,R7JA4305G),PBS缓冲液粉末(无锡傲锐东源生物科技有限公司,WK172110-1),苏木素(BA-4041)、伊红(BA-4024)(珠海贝索生物技术有限公司,716092、716101)
主要仪器:Y-DC-20电磁振动试验台(无锡市翼搏凡环境试验设备有限公司),高速台式冷冻离心机(安徽嘉文仪器装备有限公司,JW-3021HR),电子天平(日本岛津AUY120),石蜡包埋机(孝感亚光医用电子技术公司,YB-7LF),OLYMPUS显微镜,徕卡切片机(德国Leica,RM2016);P-MIDI 3D数字切片扫描仪(匈牙利),荧光定量PCR仪(美国Thermo Scientific),PVDF膜(美国Millipore公司),VE-186型转膜仪和电泳仪(Tanon,上海天能)。
1.4 膝骨关节炎造模方法
按照手术无菌原则,将木瓜蛋白酶、L-半胱氨酸分别与生理盐水配成2%、0.03 mol/L的浓度,储存于4℃恒温冰箱,实验前4 h放置于室温。将2%木瓜蛋白酶和0.03 mol/L的L-半胱氨酸以2∶1混匀,静置0.5 h对大鼠双后腿的膝关节腔注射。实验前麻醉大鼠采用腹腔注射药物2%的戊巴比妥钠(40 mg/kg)后,将大鼠仰卧位固定于木板上,剃去大鼠左右膝关节腔周围1 cm区域的腿毛,络合碘消毒,75%乙醇脱碘。将大鼠膝屈曲,角度以方便注射为宜,髌骨下极可见白色髌腱,在其外缘的膝眼作为注射药物进针点,先针破皮下后,将注射针头拐弯再穿刺皮下组织入关节腔保证有落空感后向髁间窝方向进针,抵达股骨髁后再回撤2 mm,将新配静置的0.15 ml 2%木瓜蛋白酶溶液和L-半胱氨酸混合液注入双膝关节腔。共注射三次,时间分别在第1、4、7日以相同的方案进行,6周后完成相对早期OA造模[8],该方案为OA药物造模通用方法之一。
1.5 振动训练方案
振动训练在固定的Y-DC-20电磁振动试验台上给大鼠设置上下垂直振动模式,训练组振动每周5 d,每次40 min,参考了持续4周的运动时间[9]。大鼠采用直立方式:两前足不着平面,两后足站立在振动平台上,平台上的自制装置同时可以训练多只,每只大鼠均为空间较小的圆柱状间室隔开,模拟人体站立姿势振动,振幅2~5 mm。实验结束按上述麻醉取样双侧后腿股骨,剥离股骨内侧髁表面关节软骨,编号放置-80℃液氮中保存待测;切下股骨外侧髁置于甲醛溶液固定。
1.6 HE、番红O染色及Mankin评分
大鼠膝关节股骨外侧髁经4%甲醛溶液固定后,10% EDTA 液脱钙,梯度酒精脱水,二甲苯透明,浸蜡过夜,石蜡包埋,4 μm厚度连续切片,HE染色,中性树胶封片。番红O染色入Safranin O stain 内浸染1~2 min,蒸馏水洗1 min;分别采用梯度95%、无水酒精脱水,经过二甲苯透明,以光学树脂封固。随机从切片选取 4~5个区域摄像显微镜观察软骨切片的结构,参照Mankin(改良Mankin)软骨病理评分标准评分。
1.7 RT-qPCR检测mRNA的表达
收集大鼠股骨内侧髁关节软骨组织匀浆后,Trizol法提取总RNA,根据反转录试剂盒说明书进行反转录成cDNA,以β-actin为内参,再以cDNA为模板进行扩增,反应体系为:95℃预变性2 min,95℃变性5 s,60℃退火10 s,共40个循环。引物序列如表 1。
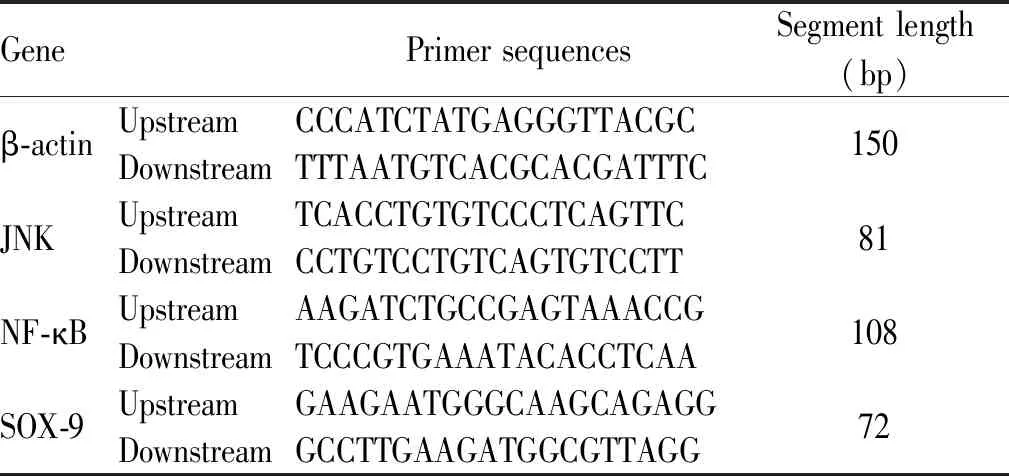
Tab. 1 Primer sequences of each gene
1.8 Western blot检测蛋白表达
取各组关节软骨组织,匀浆后加入RIPA 裂解液提取总蛋白,BCA试剂盒测定浓度,上样等质量的蛋白,电泳、转膜、封闭、孵育一抗、4℃过夜、孵育二抗、PBST清洗、ECL显影,β-actin作为内参蛋白计算相对表达量。
1.9 统计学处理
2 结果
2.1 振动训练对大鼠KOA关节软骨组织形态学的影响
建模成功后各组四周的HE染色见图1。结果显示:正常对照NC组染色保持均匀,软骨表面平整,未见破坏,层级结构清晰,软骨细胞排列整齐,潮线清晰完整;未干预的大鼠膝骨关节炎MC组关节软骨表面粗糙,断裂,见不规则软骨,排列紊乱,潮线不完整;振动训练各组(GP1、GP2、ZP、DP)失染或浅染,软骨表面不平整程度不一,细胞数量相对正常组减少,密度不均一,潮线不连续或消失情况不同程度存在,但是振动训练各组之间比较,频率较低的训练组软骨形态学改善相对较好,10 Hz频率的DP组(图1F)形态学表现最佳。
改良Mankin评分结果(图2)显示,各组均显著高于NC组(P<0.01);GP1组、GP2组、ZP组、DP组显著低于MC组(P<0.01);GP2组、ZP组、DP组显著低于GP1组(P<0.05,P<0.01,P<0.01);ZP组、DP组显著低于高频GP2组(P<0.05,P<0.01,图2)。表示Mankin评分在所有造模后及模型训练各组中的评分均显著高于NC组,但振动训练的频率越低评分表现越低。
2.2 振动训练对KOA大鼠关节软骨JNK、NF-κBp65、SOX9mRNA表达的影响
4周振动训练后,JNK mRNA表达:与NC组比较,MC、GP1、GP2组显著升高(P<0.01);与MC组比较,GP1、GP2、ZP、DP组显著降低(P<0.01);与GP1组比较,GP2、ZP、DP组显著降低(P<0.05,P<0.01,P<0.01);DP组显著降低于GP2组(P<0.01)。
NF-κB p65mRNA表达:与NC组比较,MC、GP1、GP2、ZP组显著升高(P<0.01);与MC组比较,GP1、GP2、ZP、DP组显著降低(P<0.01);与GP1组,GP2、ZP、DP组显著降低(P<0.01,P<0.05,P<0.01)。SOX9 mRNA表达:与NC组比较,MC、GP1、GP2、ZP、DP组显著低(P<0.01);ZP、DP组显著高于MC、GP1、GP2组(P<0.01),DP组显著高于ZP组(P<0.01 ,表2)。
Tab. 2 JNK,NF-κB p65 and SOX9 mRNA levels in knee cartilage of each group rats after 4 weeks of different frequencies VE n=8)
2.3 振动训练对KOA大鼠关节软骨JNK、NF-κB p65、SOX9蛋白表达的影响
4周干预后,JNK蛋白表达水平:MC、GP1、GP2、ZP、DP组显著高于NC组(P<0.01);GP1、GP2、ZP、DP组显著低于MC组(P<0.01);GP2、ZP、DP组显著低于GP1组(P<0.01);ZP、DP组显著低于GP2组(P<0.05,P<0.01);DP组显著低于ZP组(P<0.01)。NF-κB p65蛋白水平:MC、GP1、GP2、ZP、DP组显著高于NC组(P<0.01);GP1、GP2、ZP、DP组显著低于MC组(P<0.01);GP2、ZP、DP组显著低于GP1组(P<0.01);ZP、DP组显著低于GP2组(P<0.05,P<0.01);DP组显著低于ZP组(P<0.01)。SOX9蛋白水平:MC、GP1、GP2、ZP、DP组显著低于NC组(P<0.01);GP1、GP2、ZP、DP组显著高于MC组(P<0.01);ZP、DP组显著高于GP1组(P<0.01),DP组显著高于GP2、ZP组(P<0.01,表3,图3)。
Tab. 3 Protein expressions of NF-κB p65,JNK and SOX9 in knee cartilage of each group rats after 4 weeks of different frequencies VE n=8)

Fig.3Protein expression levels of JNK,NF-κB p65 and SOX9 in knee cartilage of each group rats
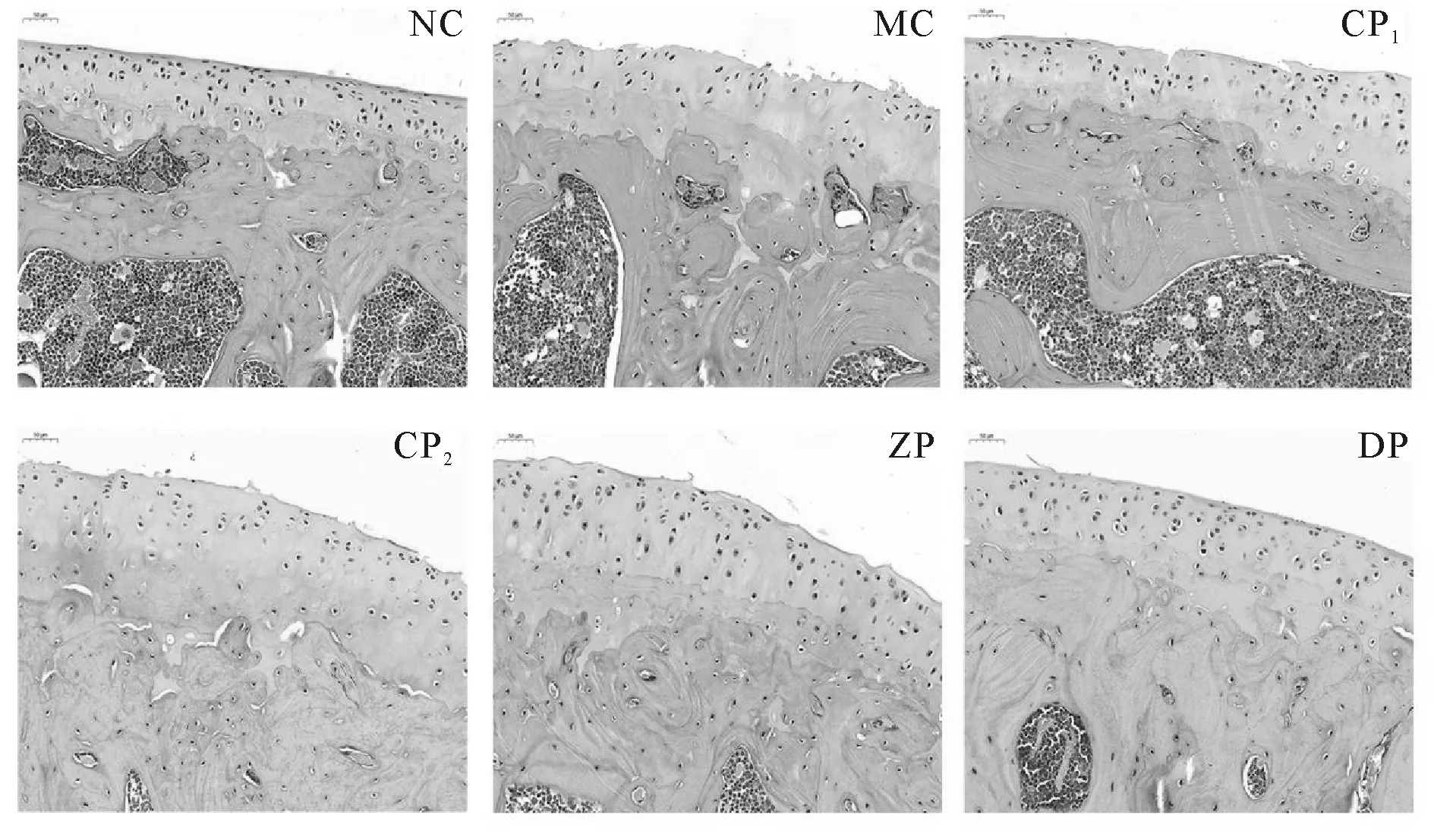
Fig. 1 HE staining section of knee joints articular cartilage in rats of each group(×300)
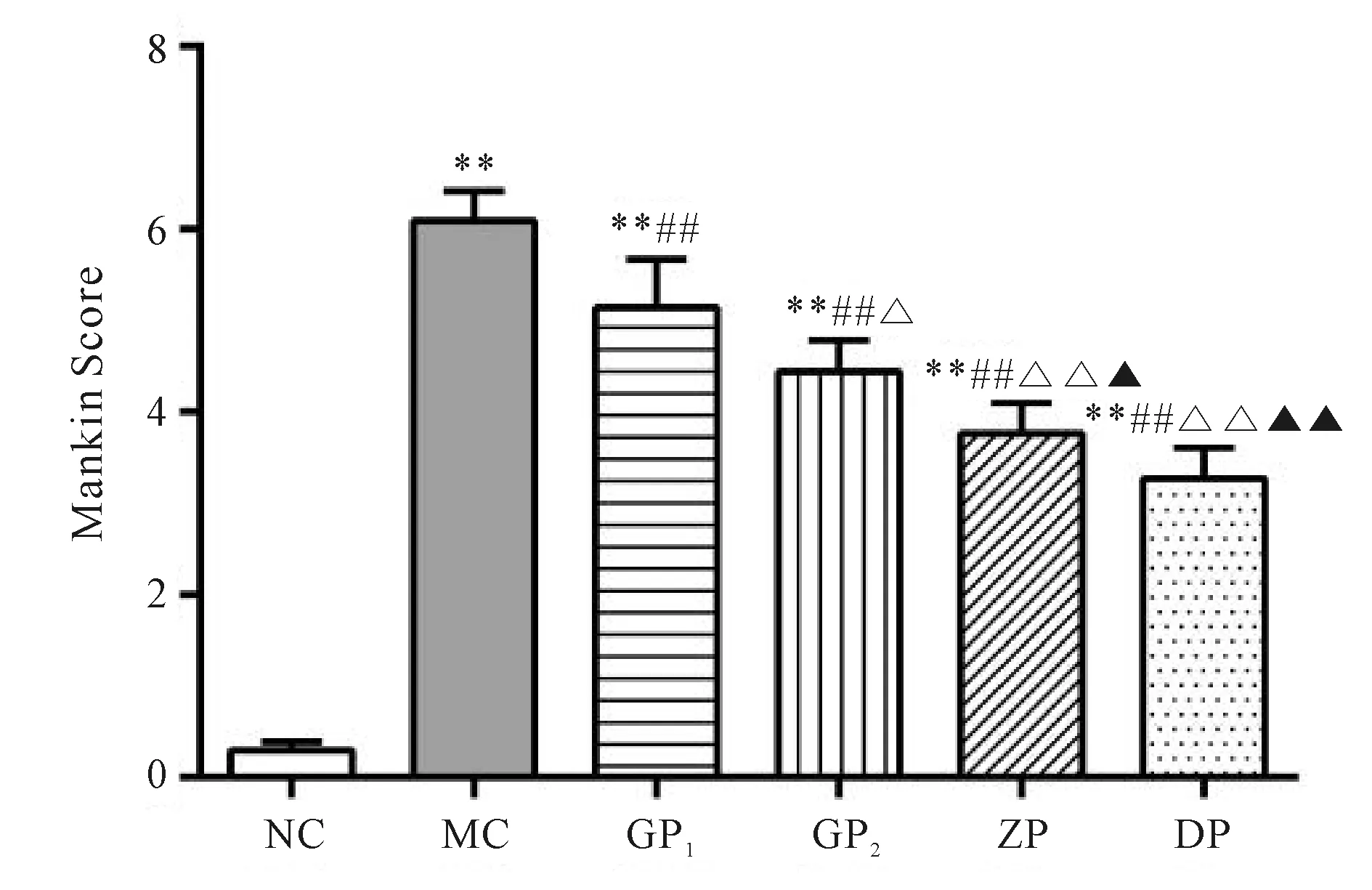
Fig. 2 Mankin scores of each group n=8)
3 讨论
膝骨关节炎是一种给社会和家庭带来沉重负担的中老年常见疾病。由于关节软骨无血管,给药途径治疗有一定的局限性,而且长期药物治疗可产生副作用,引发其他器官并发症。临床运动治疗可明显改善膝骨关节炎的症状,缓解疼痛,增强下肢肌力,提高患者日常生活活动能力、生活质量。运动疗法被认为是KOA二级预防无副作用的有效手段。动物实验研究表明合适的运动除了对KOA有一定的关节软骨修复效应[9],还有抗炎、抗凋亡[10,11]等作用。魏晓霏等[12]研究早期应用振动训练可有效改善兔KOA软骨下骨微结构的异常重构,减轻软骨损伤。
本研究试图从JNK和NF-κB信号通路探讨不同频率振动训练对KOA软骨的影响阐述其可能的作用机理以完善治疗KOA的非药物干预机制研究,参照以往国内外研究方法我们设置低频10 Hz、中频20 Hz、高频40 Hz、高频60 Hz四种,观察其效果来推测其作用机制。本研究结果显示:经过四周振动训练后,软骨病理形态学HE可见正常对照NC组染色保持均匀,软骨表面平整,未见破坏,层级结构清晰,软骨细胞排列整齐,潮线清晰完整;未干预的大鼠膝骨关节炎模型MC组关节软骨表面粗糙,见软骨断裂和不规则软骨,排列紊乱,潮线不完整;对KOA振动训练各组出现不同表现的失染或浅染,软骨表面不平整程度不一,软骨细胞数量稀少,密度不均,潮线不连续或消失亦有不同程度存在。而不同频率振动训练各组之间比较,频率较低的训练组软骨形态学改善相对积极,10 Hz频率的DP组(图1F)形态学表面平整程度最佳,软骨Mankin 评分也相应从高频到低频振动训练组呈现递减趋势,提示从形态学上较低频率振动可表现良好的软骨修复作用,也反映周而复始的振动应力适当负荷刺激对关节软骨代谢的维持是必要的。
本实验JNK和NF-κB p65蛋白质表达结果显示模型组及其不同频率干预各组JNK和NF-κB p65蛋白质表达量均显著高于正常对照组,但是,各振动训练组与骨关节炎模型组相比:均表现出下降趋势,其中中频20 Hz和低频10 Hz组明显较低,低频10 Hz组JNK和NF-κB p65蛋白质表达最低。由此表明,振动训练可以使得JNK和NF-κB p65活性下降,低频率振动训练抑制作用明显。以往Chen等[13]研究发现跑台和车轮运动可以降低IL-1b、IL-6和TNF-α的水平,并伴有p-P65、p-JNK和p-IkBa的下降。说明合理运动可减少JNK/NF-κB信号的激活。而JNK信号通路在细胞炎症和凋亡相关基因表达增加中起到重要作用,通过一定运动刺激来抑制JNK激活是有积极作用的。有研究表明[14]NF-κB可抑制JNK的持续激活可能会增强某些因子如TNF-α诱导的炎症反应。作为重要的转录因子NF-κB,在软骨细胞中生理范围内的生物力学信号可以抑制NF-κB的激活和促炎软骨细胞反应,在炎症中扮演着关键作用,本实验结果NF-κB p65的抑制提示振动可降低NF-κB信号及其炎症反应。此外,本研究中所反映软骨细胞外基质II胶原(COL2Al)的调控因子SOX9通过振动训练后表现出不同程度的增加,结果表现出所有频率的振动训练组显著高于模型对照组,越低频率组SOX9蛋白质表达量愈高。而Bell 等[15]研究已证实COL2Al是SOX9强有力的靶目标,关节软骨基质II型胶原COL2A1在体内表达直接受SOX9蛋白调控,并提示COL2A1在软骨形成过程中的异常调节是导致软骨发育不良相关骨骼异常的原因之一[16]。
从本研究结果可以看出我们所设置的不同频率振动训练具有不同程度抑制JNK、NF-κB和增加SOX9表达作用,相对较低频率振动训练在软骨形态学上修复效应较好,越低频率呈现JNK、NF-κB较强抑制和SOX9的较强活性。Rockel等[17]也证明SOX9的活性和软骨基质基因的表达受到NF-κB和RARs共激活的限制,SOX9、NF-κB等之间的串扰(Crosstalk)是协调调节软骨细胞基质基因表达的关键机制。大量但不完全的证据表明,在多步骤软骨形成通路中,复杂的分子网络控制着SOX9的活性,SOX9分子网络可能远比目前所认识到的复杂[18]。
综上,本研究提示振动训练对大鼠早期KOA模型关节软骨具有一定程度的修复作用、低频振动训练软骨修复效应相对优于高频振动,JNK/NF-κB、SOX9的变化机制可能是软骨作用的途径之一:通过抑制JNK/NF-κB信号通路途径来促进SOX9表达上调完成。未来研究除继续需完善振动作用机制的基础性研究,还要为更好的高质量物理康复疗法深入探索最佳的振动方案来达到软骨优化治疗效果。
