长链非编码RNA Linc00673过表达对胃癌MGC-803细胞增殖与凋亡的影响*
2022-06-02郭红艳徐亚茹李耕慧孙晓杰赵正林
郭红艳,徐亚茹,李耕慧,孙晓杰,赵正林,吴 琦,刘 波
(1.齐齐哈尔医学院生化教研室,2.齐齐哈尔医学院附属第一医院检验科,3.齐齐哈尔市第一医院老年科,4.齐齐哈尔医学院临床生化教研室,5.齐齐哈尔医学院附属第二医院办公室,齐齐哈尔 161006)
胃癌(gastric cance,GC)是严重威胁人类健康的恶性肿瘤之一,其在中国的发病率呈逐年递增的趋势。越来越多的证据显示,长链非编码RNA(long non-coding RNA,LincRNA)参与胃癌的发生发展,与胃癌细胞的生长、侵袭和转移等相关[1,2]。Linc00673于2015年被鉴定为胰腺癌易感基因,可作为胰腺癌的预后诊断标志物[3,4]。最近研究显示,Linc00673在多种人类肿瘤组织中高表达,其在胃癌组织中的表达程度与胃癌的TNM分期、淋巴结转移和远处转移等呈正相关[5-7]。本文利用基因克隆技术构建过表达Linc00673重组慢病毒载体,通过慢病毒包装和基因转染技术建立过表达Linc00673的胃癌MGC-803细胞系,探讨Linc00673过表达对胃癌细胞增殖和凋亡的影响及其作用的分子机制。
1 材料与方法
1.1 主要材料与试剂
人肾细胞293T、人胃粘膜细胞GES-1和胃癌细胞系MGC-803、BGC-823、AGS由本室冻存;本研究所用重组慢病毒过表达质粒pLVX-Puro-Linc00673由上海捷瑞生物工程有限公司构建并测序鉴定,对照空载体质粒pLVX-NC和慢病毒包装质粒pMD2.G、psPAX2由中国医学科学院肿瘤医院黄常志教授惠赠;RPMI 1640、DMEM、胎牛血清(FBS)和胰酶购自Gibco公司;嘌呤霉素、MTT和碘化丙啶(PI)购自Sigma-Aldrich公司;RT-qPCR试剂盒为翊圣生物公司产品;细胞凋亡检测试剂盒为4A Biotech公司产品;所用抗体均为Cell signaling公司产品。
1.2 RT-qPCR检测胃癌细胞中Linc00673基因的表达
细胞用含10% FBS的RPMI 1640(GES-1、MGC-803和BGC-823)或DMEM(AGS和293T)培养基于37℃、5%CO2、饱和湿度条件下培养,0.25%的胰酶消化传代。采用Trizol试剂提取总RNA,逆转录生成cDNA,用QuantStudioTM7 Flex 系统(ABI,美国)进行实时荧光定量PCR反应,以甘油醛-3-磷酸脱氢酶(GAPDH)为内参,检测上述细胞系中Linc00673的表达。引物由Invitrogen公司合成,引物序列见表1,反应条件如下:95℃,30 s预变性;95℃,10 s变性、60℃,30 s退火及延伸,循环40次,3个复孔/样品,2-ΔΔCt计算基因的相对表达量。
1.3 慢病毒包装与细胞转染
利用慢病毒包装质粒pMD2.G和psPAX2,由PEI介导,将重组质粒pLVX-Linc00673和空载体质粒pLVX-NC分别转染293T细胞,获得过表达Linc00673的慢病毒和对照空载体病毒。常规培养MGC-803细胞,待细胞密度达到20%~30%左右,分别用上述病毒感染细胞,48 h后用2 μg/ml嘌呤霉素筛选,获得稳定表达Linc00673的MGC-803细胞系和对照空载体细胞系,RT-qPCR方法鉴定Linc00673基因的表达。
1.4 MTT法检测细胞增殖
0.25%胰酶消化细胞,将转染pLVX-Linc00673和pLVX-NC的MGC-803细胞分别接种于96孔板,每孔1 000个细胞,6个复孔/组,常规培养,每天取一块培养板,弃细胞培养液,PBS清洗,加110 μl MTT染液培养4 h,弃上清后加150 μl DMSO溶解沉淀,测492 nm吸光度值(OD492),连续5 d。
1.5 克隆形成实验
消化对数生长期细胞,制备各组单细胞悬液,细胞计数后将细胞分别以200个/孔和500个/孔分散均匀接种于6孔板,常规培养18 d,甲醇固定30 min,结晶紫染液染色15 min,拍照、计数细胞集落的形成。
1.6 细胞周期与凋亡检测
各组细胞培养48 h,0.25%无EDTA的胰酶消化后PBS洗涤,Annexin V-FITC/PI双染,上机检测细胞凋亡(BD FACSCalibur流式细胞仪,USA),CellQuest软件分析结果;PI染色检测细胞周期,ModFit软件分析结果。
1.7 细胞周期相关调控基因表达检测
消化对数生长期细胞,采用Trizol试剂提取总RNA,RT-qPCR试剂盒检测细胞周期相关调控因子基因表达。引物序列(5'→3')见表1,PCR反应条件同前所述。

Tab. 1 Primer sequences of RT-qPCR
1.8 免疫印迹实验检测信号转导通路关键因子
采用RIPA裂解细胞提取总蛋白,测蛋白浓度,取各组40 μg总蛋白进行SDS—聚丙烯酰胺凝胶电泳分离蛋白,将蛋白转到PVDF膜上,5%脱脂奶粉常温封闭1.5 h,TBST洗膜3次,每次10 min,分别以1∶1 000稀释一抗Bcl-2、pAkt、NF-κB、EZH2、β-catenin以及GAPDH,4℃孵育过夜,加二抗(1∶ 5 000),37℃孵育1 h,ECL显色后化学发光成像分析系统检测目的条带,蛋白表达以靶蛋白/GAPDH积分光密度表示。
1.9 统计学处理
2 结果
2.1 胃癌细胞中Linc00673基因的表达增高
RT-qPCR检测结果显示:Linc00673基因在三种胃癌细胞株AGS、MGC-803和BGC-823中的相对表达量分别为4.384±0.501、4.551±0.214和4.510±0.278,在正常人胃粘膜GES-1细胞中的表达量为1.043±0.341,即Linc00673在胃癌细胞株中的表达高于正常胃粘膜细胞(P<0.05),本文选择胃低分化粘液腺癌细胞株MGC-803进行过表达实验研究。
2.2 RT-qPCR方法鉴定MGC-803细胞中Linc00673基因的过表达
RT-qPCR检测结果显示,转染pLVX-Linc00673和pLVX-NC的MGC-803细胞,其Linc00673基因的相对表达量分别为0.999±0.019和200.096± 54.527,即后者Linc00673的表达比pLVX-NC组增加了200倍(P<0.01)。表明成功建立稳定过表达Linc00673的MGC-803细胞系。
2.3 Linc00673过表达促进MGC-803细胞生长
如表2所示,Linc00673过表达的MGC-803 细胞与转染空载体pLVX-NC细胞相比,细胞增殖速度加快,细胞生长第3、4、5日,pLVX-Linc00673组OD492均高于pLVX-NC组(P<0.05)。

Tab. 2 MTT assay was performed to assess cell viability of MGC-803 cells
2.4 Linc00673过表达促进MGC-803细胞克隆增殖
克隆形成实验结果显示,在分别接种200和500个细胞培养18 d后,转染空载体pLVX-NC组细胞的克隆数分别为73.33±12.67和190.67±26.16,而转染pLVX-Linc00673组分别形成127.00±24.33和338.67±38.14细胞克隆,二者比较差异具有统计学意义(P<0.05,P<0.01,图1)。
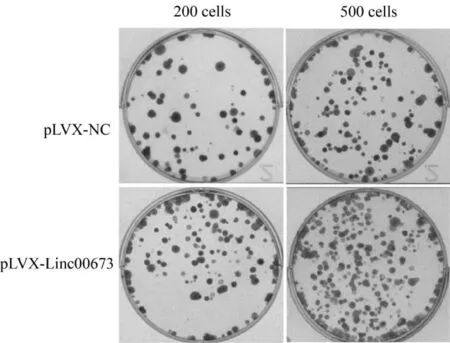
Fig. 1 Overexpression of Linc00673 promoted cell proliferation Cell colony formation assay was performed to assess cell proliferation after transfection with pLVX-NC and pLVX-Linc00673 in MGC-803 cells
2.5 Linc00673过表达对MGC-803细胞周期与凋亡的影响
经流式细胞仪检测,pLVX-Linc00673组G0/G1期、S期、G2/M期占比分别为67.52%±1.63%、28.87%±0.30%和3.62%±1.72%;pLVX-NC组G0/G1期、S期、G2/M期占比分别为69.72%± 2.88%和25.82%±1.41%和4.46%±1.54%。两组间比较S期占比差异有统计学意义(P<0.05,图2A )。细胞凋亡检测结果显示,pLVX-Linc00673组细胞早期凋亡率(LR)和总凋亡率(LR+UR)分别为 0.52%±0.02%和4.09%±0.36%,而对照组分别为 3.90%±0.39%和5.52%±0.29%,即Linc00673过表达的胃癌细胞早期凋亡和总凋亡率均低于对照组细胞,差异均有统计学意义(P<0.01,图2B)。
2.6 Linc00673过表达对细胞周期调控基因表达的影响
RT-qPCR检测结果显示,Linc00673过表达使MGC-803细胞周期调节基因CCNG2和p19的表达量降低,而CDK1的表达量显著增高,与对照组相比,差异均有统计学意义(P<0.05,P<0.01,表3)
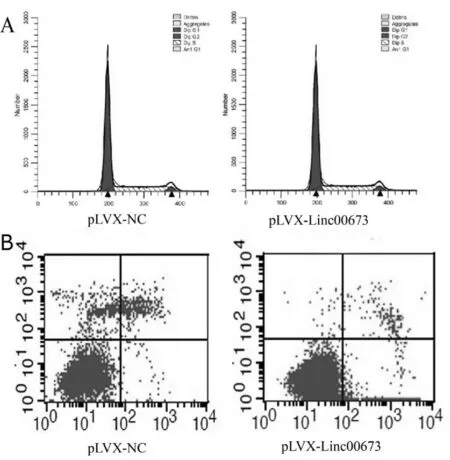
Fig. 2 The effects of Linc00673 overxpression on MGC-803 cell cycle and apoptosis
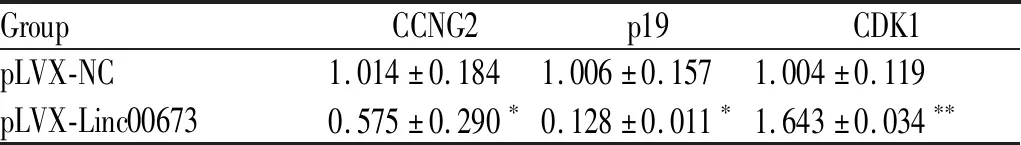
Tab. 3 Overexpression of Linc00673 affected the expressions of cell cycle regulators in MGC-803 cells
2.7 Linc00673过表达影响细胞增殖与凋亡的机制
Western blot方法在蛋白水平检测各组转染细胞PI3K/Akt信号通路关键分子pAkt及其下游靶因子NF-κB和Bcl-2蛋白的表达,同时还检测细胞增殖相关因子β-catenin和EZH2蛋白的表达,结果显示,过表达Linc00673的细胞中上述因子的表达量均明显增高(P<0.01,图3,表4)。
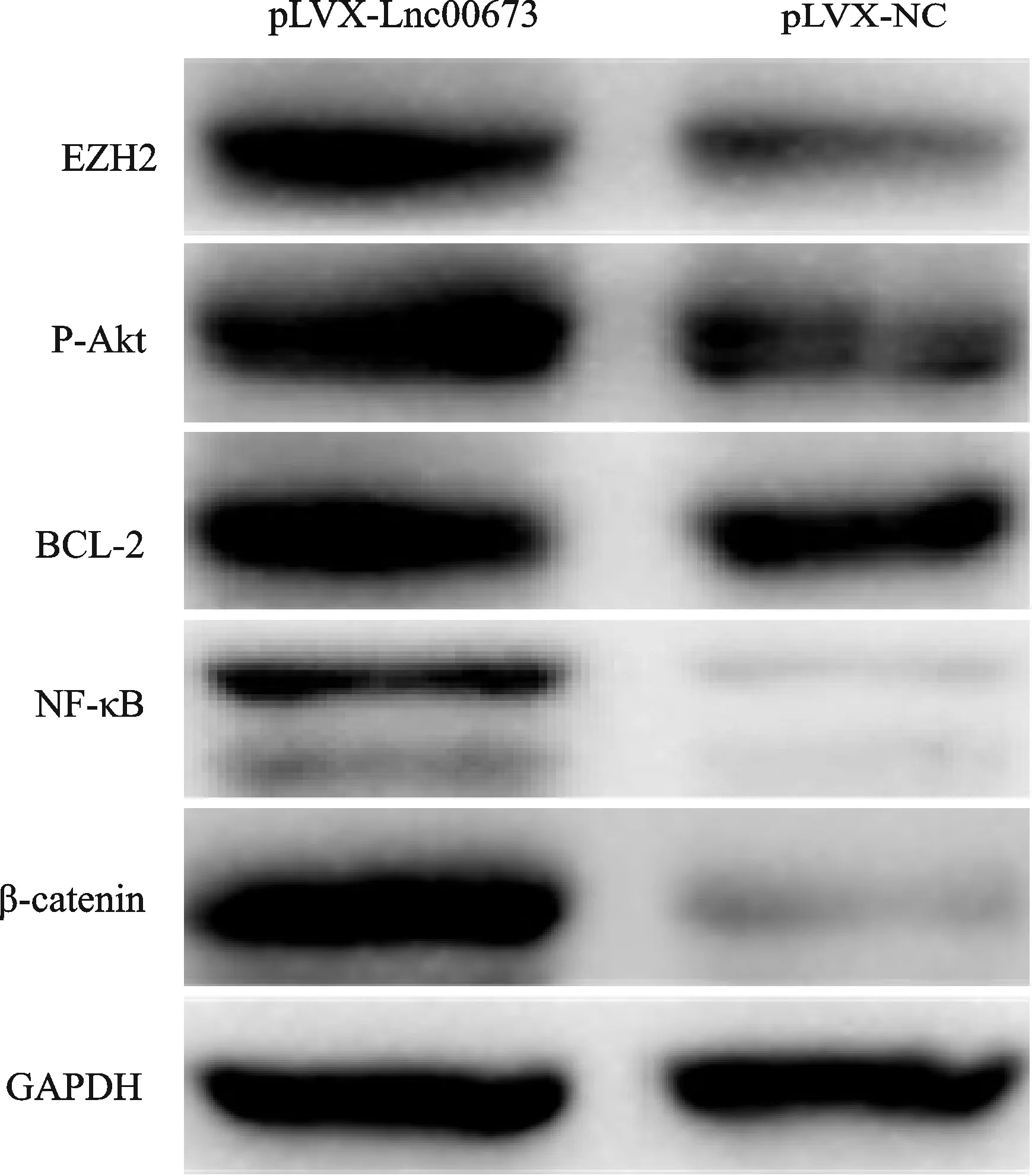
Fig. 3 The expressions of PI3K/Akt signaling pathway-related molecules were detected by Western blot in cells of each group

Tab. 4 Effects of Linc00673 overexpression on PI3K/Akt signal pathway
3 讨论
胃癌是全球常见癌症之一,给患者带来极大困扰。多年来,学者们一直致力于对该病发病机制、诊疗方面进行研究[8,9],近年来LncRNA在胃癌中的作用逐渐引起关注,Linc00673定位于人染色体17q24.3,最初被证实为胰腺癌易感基因,具有抑癌基因的作用[10]。随后的研究发现,Linc00673在肺癌、乳腺癌等多种人类肿瘤中表达增高,属于癌基因,细胞水平实验证实其过表达可促进肺癌、肝癌、乳腺癌以及甲状腺癌等多种肿瘤细胞的增殖、迁移和侵袭[11-15],本课题组前期研究显示,Linc00673在胃癌患者血清中的表达明显高于正常人,但其过表达对胃癌细胞的调控作用及相关分子机制却鲜有报道。
本研究发现,Linc00673在MGC-803、BGC-823以及AGS等多种胃癌细胞系中的表达量均显著高于正常胃粘膜细胞,因此推测Linc00673的异常表达与胃癌的发生和发展可能存在相关性。进而通过细胞水平实验证实,胃癌细胞MGC-803中过表达Linc00673导致细胞生长和克隆增殖加快;流式细胞术检测显示,MGC-803细胞过表达Linc00673产生S期比例增高、细胞早期凋亡及总凋亡比率降低等生物学改变,上述结果提示其在GC的发生发展过程中起到一定的致癌、促癌作用。
多种LincRNA通过PI3K/Akt信号通路途径发挥对肿瘤细胞的调控作用,如沉默STXBP5-AS1和Linc00673基因均可抑制该通路,进而影响GC、胶质瘤细胞的增殖、迁移等一系列生物学行为[16,17]。为了探讨Linc00673过表达影响MGC-803细胞增殖与凋亡的分子机制,本研究在蛋白水平对PI3K/Akt信号通路关键分子Akt及其下游靶标NF-κB和Bcl-2进行检测,结果显示,过表达Linc00673的细胞中不仅PI3K下游分子磷酸化Akt(pAkt)表达增高,而且NF-κB和Bcl-2的表达量亦显著增高,NF-κB蛋白促进细胞增殖,而Bcl-2则是细胞凋亡抑制蛋白,这些蛋白表达增加将导致PI3K/Akt信号通路活性增强。
细胞周期进程有一系列正负性调节因素,如Cyclin 家族中的CDKs 起正性调节作用,而 CCNG2 、p19则起负性调节作用,过表达Linc00673后,胃癌细胞上述细胞周期相关调控基因表达均发生了变化。此外,本研究还发现,Linc00673过表达导致β-catenin和EZH2蛋白表达量也显著上调,二者均与细胞增殖相关,其中EZH2还与细胞的运动迁移相关。因此,Linc00673过表达可能通过PI3K/Akt信号通路影响细胞增殖和凋亡相关基因、蛋白的表达,进而影响胃癌细胞的生物学行为。
值得一提的是,本研究显示Linc00673在GC中表达较高,也有报道持其他观点,此外,β-catenin是Wnt信号通路的关键分子,多种癌基因、抑癌基因以及LincRNA可通过Wnt/β-catenin信号通路调控肿瘤的发生发展,例如LincRNA CASC11可通过Wnt/β-catenin信号通路促进宫颈癌的迁移和侵袭[18],最近有文献报道Linc00673通过该信号通路促进肺腺癌的进程[19]。细胞内信号传导网络复杂,信号通路之间亦存在着相互调节和关联,Linc00673是否可能也通过其他信号通路对GC的发生发展进行调控,其机制如何?尚需进一步的研究证实。
综上所述,LincRNA 00673在GC中表达较高,且其过表达可通过PI3K/Akt信号通路促进胃癌细胞增殖、抑制细胞凋亡,可能是GC患者的分子诊断中的生物标志物和治疗靶点。
