PTK2B与Aβ、Tau和LRP-1在APP/PS1小鼠海马组织和血液中的表达随月龄变化的分析*
2022-06-02郝凯敏王浩玉祁文秀
郝凯敏,刘 镇,王浩玉,祁文秀
(山西医科大学汾阳学院,汾阳 032200)
阿尔茨海默病(Alzheimer disease,AD)是以进行性认知功能障碍和脑组织中的β淀粉样多肽(amyloid-beta,Aβ)和Tau蛋白的异常加工,尤其是Aβ1-42是淀粉样斑块的主要成分导致细胞外老年斑的形成和Tau蛋白的病理性高磷酸化所致的细胞内神经纤维缠结(nerve fiber entanglement,NFT)为主要病理学特征的慢性神经退行性疾病[1,2]。正常机体内,淀粉样前体蛋白(amyloid precursor protein,APP)被β分泌酶和γ分泌酶裂解成多种不同片段的Aβ多肽,大部分由组织排出到血液进而排出到体外[3]。其中,在脑组织中的Aβ1-42,除部分排出到血液外,有些则会聚集成老年斑,而形成AD样病理学变化[4]。可溶性Aβ1-42寡聚体可通过血脑屏障清除系统和脑脊液循环系统等多种方式从大脑被清除到血液[5]。研究证明,Aβ1-42在脑组织中的增多,不仅涉及其过度产生,而且还涉及由大脑向外周循环清除失败等多个环节[6]。临床病例显示,AD患者血脑屏障的转运功能受到干扰,表现为大脑对外周循环清除Aβ的能力下降[5]。在AD模型鼠也发现,脑内转运Aβ流出的蛋白-低密度脂蛋白受体相关蛋白 1(low density lipoprotein receptor-related protein-1,LRP-1)在AD早期即出现较明显的下调[7];同时也发现,在AD脑中Aβ与LRP受体之间具有负性相关性[8]。
研究发现,ptk2b基因的表达产物PTK2B蛋白(protein tyrosine kinase 2 beta)也称为Pyk2(proline-rich protein kinase 2,Pyk2),可能是AD的风险因素[9,10]。PTK2B作为Tau毒性的早期标记物和体内调节剂,从而影响AD的发生[11]。前期研究结果表明,在Aβ诱导的认知功能障碍大鼠海马PTK2B表达升高,且伴随有Aβ1-42和Tau蛋白磷酸化的升高[12]。但是,在AD转基因动物模型脑组织中ptk2b基因及其表达产物PTK2B蛋白与脑组织中,Aβ1-42和Tau蛋白磷酸化含量及转运Aβ流出的LRP-1之间的关系,随着年龄的增加呈现什么样的变化规律,以及AD模型鼠早期脑组织和血液中Aβ1-42水平变化与LRP-1的关系,目前都鲜有报道。
为了探讨以上问题,本研究利用5月龄、10月龄和15月龄的APP/PS1转基因小鼠为研究对象,观察小鼠海马组织中ptk2b基因及其PTK2B蛋白表达水平与Aβ1-42、Tau蛋白磷酸化与总Tau蛋白的比值(p-Tau/Tau)和LRP-1的变化随着年龄增加的变化规律,以探讨ptk2b基因与AD病理学变化的关系,从而为临床早期诊断AD提供依据。
1 材料与方法
1.1 实验动物
15只雄性APP/PS1 小鼠(22 g~25 g),由卡文斯百格(苏州)模式动物研究有限公司提供,合格证号:SCXK(苏)2018-0002。15只雄性C57BL/6J 小鼠、15只雌性C57BL/6J 小鼠(22 g~25 g),由山西医科大学动物实验中心提供,合格证号:SCXK(晋)2015-0001。动物放置于SPF清洁级动物房分笼饲养,每笼2只,温度(24±2)℃,湿度(50±10)%,光照自然。动物自由进食、饮水,每日定时清扫笼舍换气。将雄性APP/PS1小鼠与雌性C57BL/6J小鼠通过交配进行保种、繁衍后代。
1.2 动物分组及鉴定
雄性APP/PS1 小鼠与雌性C57BL/6J小鼠交配所生的子代雄性小鼠,于10周龄时,采用PCR法进行基因型鉴定。小鼠做好标记,剪取鼠尾约0.5 cm,采用基因组DNA小剂量抽提试剂盒(离心柱式)(D0063,碧云天生物技术公司),进行DNA抽提。APP/PS1小鼠APP和PSl基因受启动子朊病毒蛋白(PrP)同时控制,因此,扩增出APP或PS1中任意一基因即可认为所获小鼠同时转入APP和PS1两个基因。本实验扩增的PS1基因序列为:F 5'-AAT AGA GAA CGG CAG GAG CA-3';R 5'-GCC ATG AGG GCA CTA ATC AT-3'。PCR反应体系10 μl(ddH2O 3.9 μl、2×Taq Mastar Mix 5 μl、Temple DNA 1 μl、PS1 Reverse Primer 0.05 μl、PS1 Forward Primer 0.05 μl),95℃预变性、5 min,94℃变性、30 s,63℃复性、35 s,72℃延伸、45 s,72℃延伸、3 min,共35个循环。琼脂糖凝胶电泳:制备1 %的琼脂糖凝胶加EB替代物3 μl,将6×Loading Buffer和10 μl PCR反应产物混匀加入。110 V电压电泳25 min后,进行光密度扫描,用凝胶成像分析系统观察分析。
PCR检测结束后,按照鉴定结果将符合APP/PS1基因型的小鼠按其年龄分为5月龄(APP/PS1-5 month)、10月龄(APP/PS1-10 month)、15月龄(APP/PS1-15 month)等3个实验组,以及同月龄的C57BL/6J(C57-5 month、C57-10 month、C57-15 month)雄性小鼠作为对照组,共计6组,每组均8只。
1.3 小鼠认知行为学功能检测
Morris水迷宫实验装置为直径120 cm、高90 cm的圆形水池(Smart 3.0,Panlab公司,西班牙;淮北正华生物仪器有限公司,中国),根据东南西北四个方向将水迷宫分为四个象限,隐蔽站台放入第一象限,水位高于站台1 cm,水温保持在(20±2)℃,加入钛白粉以便与小鼠毛色形成对比。在实验开始前1 d,将小鼠分别于上午和下午各自由游泳120 s以便熟悉环境。
根据以往的实验方法[13],分别进行以下测试:(1)定位航行试验:随机选取某一象限的中心入水,将小鼠面朝池壁放入水中,以小鼠从入水开始直至找到水下隐蔽站台所用时间作为潜伏期,若60 s内小鼠没有找到站台,则将其放置于平台上停留10 s,潜伏期为60 s;若小鼠在60 s内找到站台,在站台上停留10 s后停止试验。随后将小鼠随机放入其他象限,直到完成所有象限的检测。连续进行5 d,每日2次。通过记录小鼠的潜伏期来检测其空间学习行为学能力。(2)空间探索试验:撤去水下站台,将小鼠分四次随机放入不同的象限,让小鼠自由游泳60 s,记录其在原站台所在象限停留的时间以及穿越站台的次数,分别在上、下午各进行一次测试,取其平均值以判断小鼠的记忆行为学能力。
1.4 组织处理
水迷宫检测结束后,1 %戊巴比妥钠,35 mg/kg经腹腔麻醉小鼠,用1 ml注射器经心脏进行采血 0.4 ml,经离心后保留血清,以备ELISA检测。之后,用生理盐水灌注心脏,待血液全部排出后,断头、剪开小鼠头皮,取出脑组织置于冰上,拨开大脑皮层,暴露其底部的海马组织,快速分离出海马。将右侧海马放入-80℃冻存,以备Western blot和qRT-PCR检测;将左侧海马放置于4 %的多聚甲醛固定24 h,按照以往的实验方法[13],对组织进行梯度脱水、透明、浸蜡和包埋等处理,蜡块放于4℃保存,以进行免疫组织化学和HE染色。
1.5 ELISA检测血清中Aβ1-42含量
取梯度浓度标准品以及10 μl待测血清和40 μl样品稀释液分别加入包被有Aβ1-42抗体的微量酶标板(MM-44561M1,酶免,江苏)内,按照试剂盒说明书进行相关检测。15 min后,用酶标仪在450 nm波长处读取光密度(optical density,OD)值,用空白孔调零,根据标准品建立标准曲线,据方程计算出血清中Aβ1-42的浓度。
1.6 Western blot检测海马PTK2B和LRP-1、Aβ1-42、p-Tau/Tau含量
取海马组织,以100∶1∶1比例加入哺乳动物蛋白抽提液、PMSF和广谱磷酸酶抑制剂(均为博士德,武汉),提取海马组织中的蛋白。按照说明书,用BCA试剂盒(AR0146、博士德,武汉)测定蛋白浓度。SDS-PAGE凝胶电泳、转膜、封闭等处理;按照蛋白分子量大小裁剪条带,加入Aβ1-42小鼠抗大鼠单克隆一抗(1∶1 000,NBP2-13075,Novus Biologicals)、LRP-1兔抗大鼠多克隆抗体(1∶40 000,ab92544,Abcam)、PTK2B兔抗大鼠多克隆抗体(1∶1 000,ab-402,Sigma-Aldrich)、磷酸化Tau蛋白(Ser416)兔抗大鼠单克隆抗体(1∶5 000,15013S,Cell Signaling Technology,Boston,USA)、Tau蛋白兔抗大鼠单克隆抗体(1∶1 000,46687S,Cell Signaling Technology,Boston,USA)或β-actin(1∶5 000,AP0060,Bioworld Technology Inc),4℃孵育过夜,洗膜;加入对应的二抗,室温下孵育 2 h,洗膜;免疫复合物和超敏发光液(博士德,武汉)进行混合、反应后,进行曝光。用Image J 1.46 进行积分光密度(integral OD,IOD)测定,用目的蛋白与β-actin比值作为目的蛋白的相对表达含量。
1.7 免疫组织化学检测海马LRP-1-LI和PTK2B-LI水平
将海马组织蜡块用切片机(RM2135,Feica,Germany)进行连续冠状切片,片厚 4 μm,摊片至载玻片上,经烤箱烘干备用。将切片进行脱蜡、梯度脱水、灭活内源性过氧化物酶,并进行抗原微波修复,加BSA进行封闭等处理后,分别滴加PTK2B兔抗大鼠多克隆抗体(1∶100)或LRP-1兔抗大鼠多克隆抗体(1∶100)于 4℃ 过夜,PBS洗3 次;加对应的二抗、37℃ 孵育30 min,PBS 洗 3 次;加SABC、37℃ 孵育 30 min,PBS 洗 3 次;用 DAB (博士德,武汉)显色 13 ~ 15 min,蒸馏水终止反应;进行脱水、透明和封片等处理。将切片置于光学显微镜下进行观察,PTK2B(PTK2B-like immunoreactivity,PTK2B-LI)和 LRP-1(LRP-1like immunoreactivity,LRP-1-LI)的免疫阳性反应物均显示棕黄色颗粒,主要表达在细胞质或细胞膜。每张切片用低倍视野(10 ×)进行观察后,在高倍视野(40 ×)下随机选取海马 CA3 区的 5 个视野,用捷达成像分析系统(JD801,江苏捷达)和 Image-pro plus 6.0 软件分析LRP-1-LI和PTK2B-LI的IOD值,计算其平均值。
1.8 qRT-PCR检测海马ptk2b mRNA表达含量
参考PrimerBlast数据库(NCBI,Bethesda,MD),针对靶基因ptk2b设计引物和内参,引物序列如下:ptk2b:上义序列5′-CACAGTGCAGACAGAGATCCA-3′,下义序列5′-CCCTATTCGCCCACTCAG-3′;内参GAPDH:上义序列5′-TGAACGGGAAGCTCACTGG-3′;下义序列5′-TCCACCACCCTGTTGCTGTA-3′。
取冻存的海马组织,用Trizol法,提取海马中的RNA。按照逆转录cDNA试剂盒说明书(D7168S,碧云天,上海),将RNA反转录成cDNA,-20℃保存。使用QuantiNova SYBR Green PCR Kit试剂盒(208054,Qiagen,Germany)进行实时定量PCR(qRT-PCR)检测。分别经预变性94℃、5 min,变性94℃、30 s,退火延伸60℃、60 s,共40个循环的反应。溶解曲线65℃~95℃,毎增高0.5℃收集荧光1次。用Bio-Rad CFX Manager(Bio-Rad,USA)软件对结果进行分析。
1.9 统计学处理
2 结果
2.1 APP/PS1转基因小鼠基因表型鉴定
对所有子鼠进行基因鉴定,结果如图1显示,雄性APP/PS1小鼠与雌性C57BL/6J小鼠交配所生的子代小鼠基因型PCR反应产物在608 bp处出现PS1的条带,野生型C57小鼠则无条带显示,表明APP/PS1转基因小鼠模型成功。
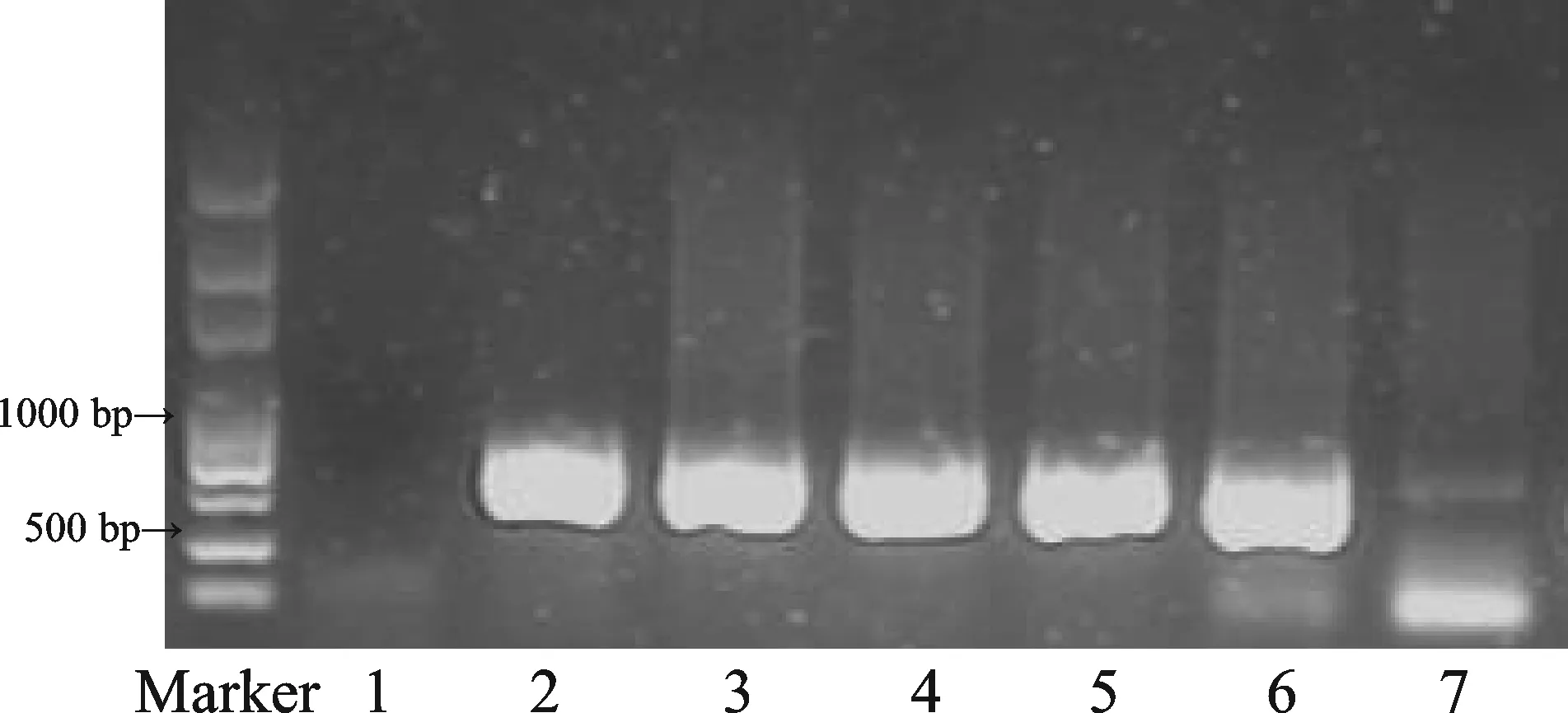
Fig. 1 The results of DNA PCR from the mice
2.2 小鼠认知行为学功能
水迷宫行为学检测结果显示,定位航行试验寻找平台的平均潜伏期(表1),各实验组的APP/PS1小鼠与其同月龄的C57小鼠比较均明显延长(第3~5日,P<0.05或P<0.01);实验组各月龄之间比较,APP/PS1小鼠10月龄明显比5月龄延长(第4~5日,P均<0.01),而15月龄则比10月龄延长(第4~5日,P均<0.01)。各组空间探索试验的穿越平台次数(表2)结果可见,各实验组的APP/PS1小鼠与其相同月龄的对照组C57小鼠比较均明显减少(P<0.05或P<0.01),并且随着APP/PS1小鼠月龄的增加,穿越平台的次数也越少(APP/PS1-10 month比APP/PS1-5 month减少,P<0.05;APP/PS1-15 month比APP/PS1-10 month减少,P<0.01);穿越平台所在象限的时间(表2),各实验组与其对照组比较也均明显减少(P均<0.01),同时,随着月龄的增加,APP/PS1小鼠穿越平台的时间也越少(APP/PS1-10 month比APP/PS1-5 month减少,P<0.01;APP/PS1-15 month则比APP/PS1-10 month减少,P<0.05)。在各对照组之间比较上述指标均没有统计学差异(P>0.05)。各组小鼠在空间探索试验中游泳的轨迹图(图2)显示,各实验组的APP/PS1小鼠其在目标象限探索的倾向比较少,且随着月龄的增加,在目标象限探索的倾向也越少。
以上结果表明,APP/PS1转基因小鼠随着年龄的增长,其空间认知行为学能力呈现进行性降低。
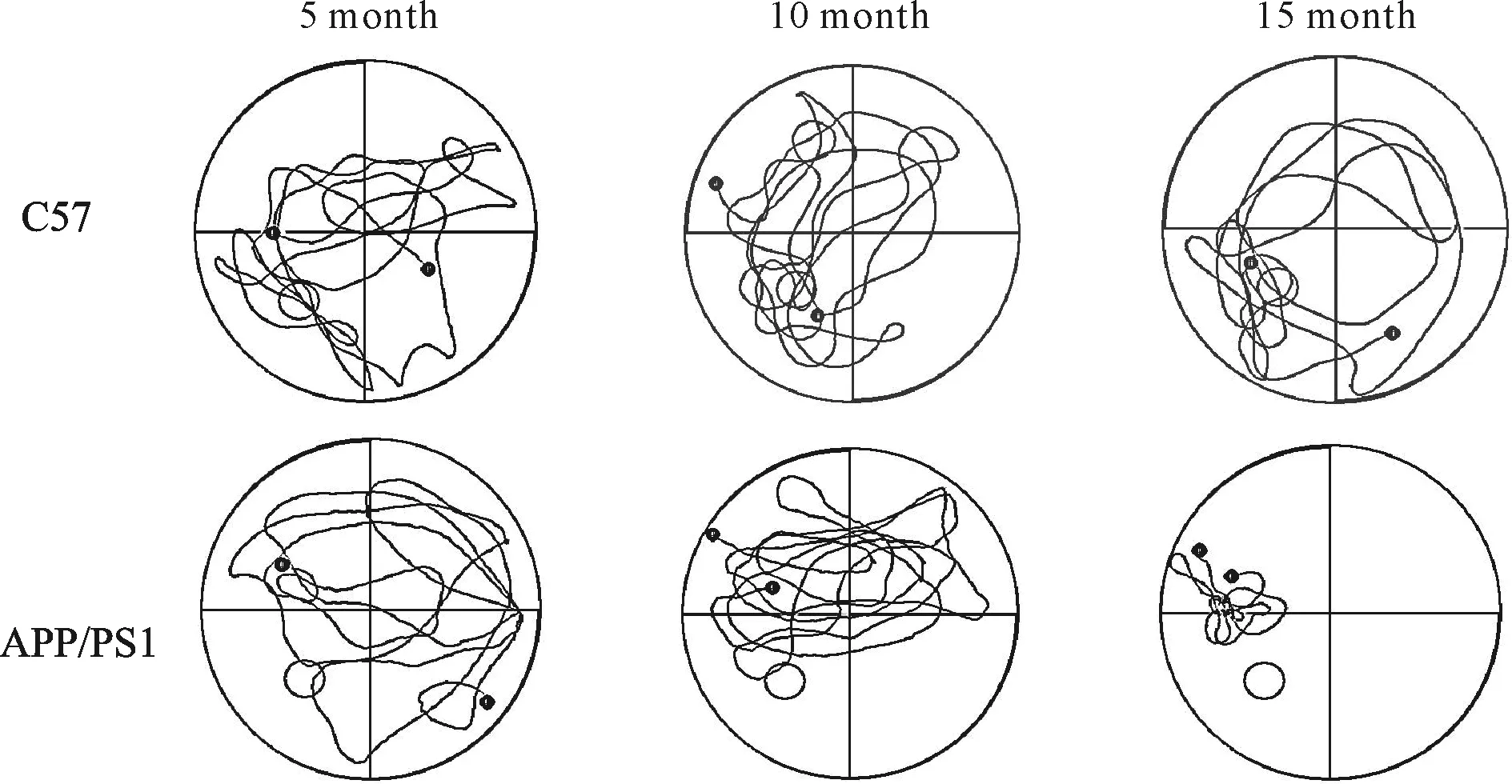
Fig. 2 Results of the Morris water maze of mice in six groups
Tab. 1 The average of escape latency (second) of the mice in six groups in hidden platform trials n=8)

Tab. 2 The crossings of platform and time spent in platform zone of the mice in six groups n=8)
2.3 小鼠血清中Aβ1-42含量
小鼠血清中Aβ1-42含量在各月龄的APP/PS1转基因小鼠与其同月龄的C57小鼠比较均明显降低(5 month(μg/L):124.97±9.97vs151.20± 11.10,P<0.05;10 month(μg/L):103.26±8.30vs147.47±15.10,P<0.01;15 month(μg/L):79.01±10.23vs153.96±15.37,P<0.01);同时,随着转基因小鼠月龄的增加,血清中Aβ1-42含量则越降低(P<0.05)。对照组的各月龄C57小鼠之间比较,小鼠血清中Aβ1-42含量均没有统计学差异(P均>0.05)。
可见,随着年龄的逐渐增高,APP/PS1小鼠血液中的Aβ1-42水平呈现逐渐降低的现象。
2.4 小鼠海马组织PTK2B和Aβ1-42、p-Tau/Tau以及LRP-1表达含量
Western blot检测结果(图3,表3)表明,在各月龄的APP/PS1小鼠较其同月龄的C57小鼠海马组织中PTK2B和Aβ1-42含量以及p-Tau/Tau比值均明显增高(P<0.01) ,LRP-1则均降低(P均<0.01)。同时,随着APP/PS1小鼠月龄的增加,PTK2B、Aβ1-42和p-Tau/Tau比值呈现越来越高的现象(P<0.05,P<0.01);LRP-1则表现为逐渐降低的趋势(P<0.05)。各对照组之间比较,除LRP-1在C57小鼠10月龄较5月龄降低(P<0.05)、15月龄较5月龄降低(P<0.01)以外,上述其他指标均没有统计学差异(P>0.05)。
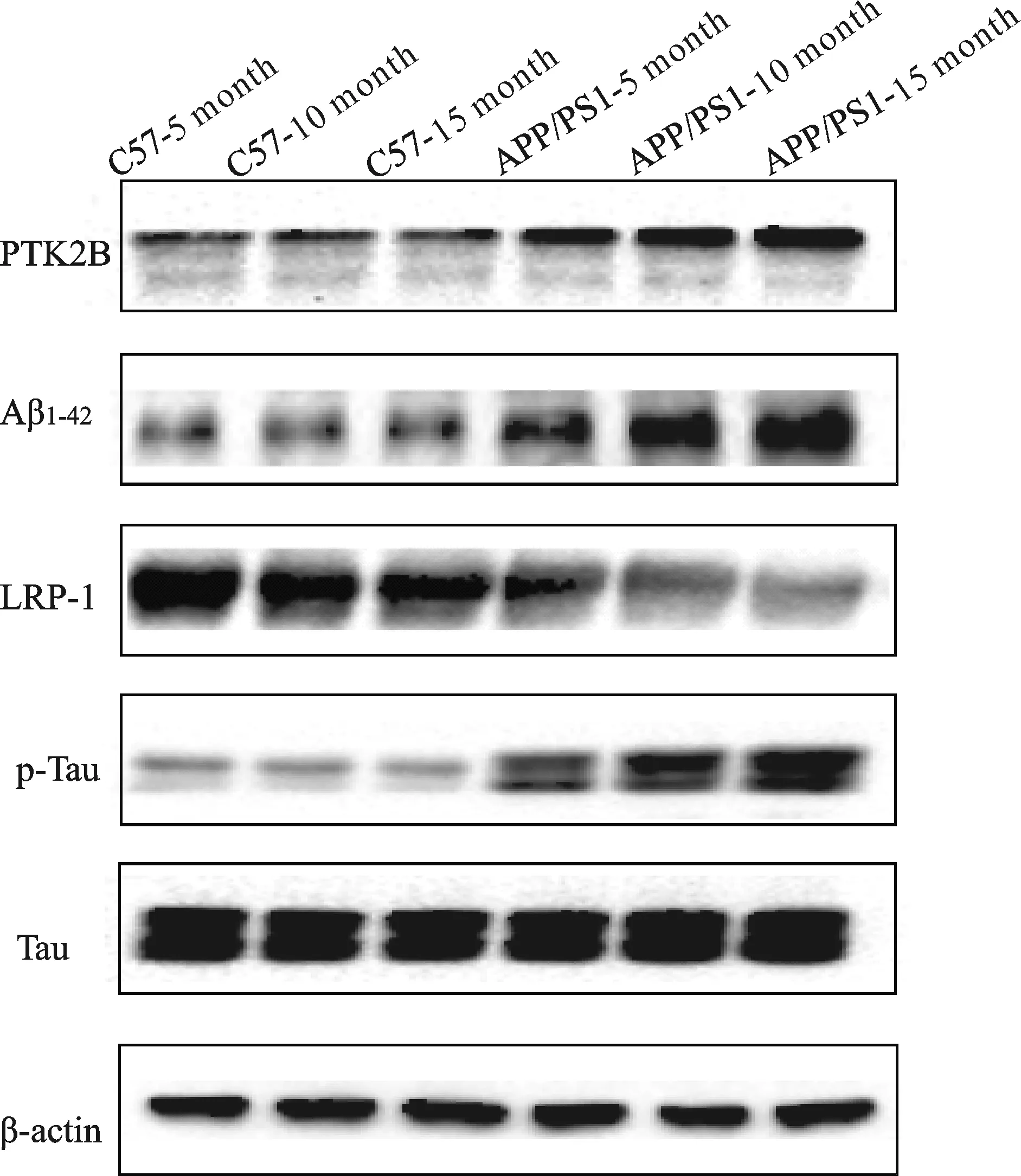
Fig. 3 Western blot images of PTK2B,Aβ1-42,p-Tau,Tau and LRP-1 in hippocampus in six groups
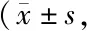
Tab. 3 Levels of PTK2B,Aβ1-42,p-Tau/Tau and LRP-1 in hippocampus in six groups detected by Western blot n=6)
2.5 小鼠海马PTK2B-LI和LRP-1-LI阳性细胞水平
各组小鼠海马组织中PTK2B(图4A,表4)和LRP-1(图4B,表4)免疫阳性细胞的显微照相和IOD值,在各月龄的APP/PS1小鼠与其同月龄的C57小鼠比较,其海马组织中PTK2B-LI的IOD值均明显升高(P<0.05或P<0.01),而LRP-1-LI的IOD值则明显降低(P均<0.01);各实验组之间比较,随着月龄的增加,APP/PS1小鼠海马组织中PTK2B-LI的IOD逐渐升高(P<0.01),LRP-1-LI的IOD值则逐渐降低(P<0.05,P<0.01)。在各对照组C57小鼠之间比较,小鼠海马组织中PTK2B-LI没有统计学差异(P均>0.05);LRP-1-LI则在10月龄低于5月龄(P<0.05),15月龄低于5月龄(P<0.01),而15月龄与10月龄比较,则没有差异(P>0.05)。

Fig. 4 Immunohistochemical images of PTK2B-LI and LRP-1-LI in mouse hippocampus CA3 area in six groups
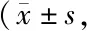
Tab. 4 Immunohistochemistry staining IOD of PTK2B-LI and LRP-1-LI in mouse hippocampus in the six groups n=8)
2.6 小鼠海马组织ptk2b mRNA表达水平
各组海马组织中的ptk2bmRNA表达结果显示,各月龄的APP/PS1小鼠海马组织ptk2bmRNA明显较其同月龄的C57小鼠升高(5 month:5.02±0.66vs1.03±0.32;10 month:9.35±1.99vs1.34±0.59;15 month:14.71±1.80vs1.61±1.37,P均<0.01);随着月龄的增加,海马组织ptk2bmRNA水平在10月龄APP/PS1小鼠比5月龄升高(P<0.01),15月龄APP/PS1小鼠则比10月龄升高(P<0.01)。各对照组之间比较,小鼠海马组织中ptk2bmRNA则没有统计学差异(P均>0.05)。
3 讨论
AD有着多种的致病因素,是一种多基因、多环节、多因素控制的神经退行性疾病。前文所述,Tau蛋白的病理性高磷酸化导致细胞内神经的纤维缠结是AD后期病理学变化的主要特征[1]。在AD病人或转基因Tau小鼠中发现AD的易感基因ptk2b表达产物PTK2B与Tau蛋白超磷酸化具有共定位作用[14]。前期研究结果表明,在Aβ诱导的认知功能障碍大鼠海马PTK2B表达升高,且伴随有Tau蛋白磷酸化的升高[12]。本研究结果显示,在5月龄的APP/PS1小鼠脑组织中PTK2B和ptk2bmRNA即明显增加了,并且随着年龄的增加,海马组织中PTK2B和ptk2bmRNA表达均呈现时间依赖性增加,这与海马组织中p-Tau/Tau比值的递增变化是一致的,同时也与转基因小鼠的认知行为学功能进行性下降一致。可见PTK2B与Tau之间具有相互促进作用,PTK2B促进Tau的毒性可能是AD Tau 病理学早期重要的毒性调节剂[11]。早期模型鼠脑组织中PTK2B表达的上调,导致AD小鼠海马神经细胞Tau过度磷酸化,随着月龄的增加,PTK2B进一步上调,致使过度磷酸化的Tau蛋白增多并进一步形成神经纤维缠结,从而在后期诱导神经元死亡[15];Tau 蛋白的过度磷酸化还会导致其从微管结构上解离出来,使细胞骨架的稳定性下降,促进神经元纤维缠结,进一步导致AD脑组织的病理变化[16]。因此,结合前期的研究可推测,早期APP/PS1小鼠脑组织中PTK2B表达的升高,可能是导致转基因小鼠脑组织中病理学变化和认知行为学功能进行性下降的基础。
AD的另一个主要病理特征是由大量聚集的Aβ多肽组成的斑块在大脑中的聚集和积累[17]。据报道,减少海马脑区Aβ寡聚体的生成,可有效地缓解APP/PS1转基因鼠的学习和记忆等行为学能力[18]。本研究可见,APP/PS1小鼠海马组织中Aβ1-42表达升高,而其血液中Aβ1-42含量则降低;同时,海马转运Aβ流出的蛋白LRP-1也明显降低了。本实验结果还显示,在C57小鼠海马组织中LRP-1也随着年龄的增加而降低了,这可能是由于脑组织中LRP-1表达随着年龄的增长而下降所致[7]。由本实验结果可知,APP/PS1小鼠海马中LRP-1的降低则更明显,并且,在APP/PS1小鼠脑组织中转运Aβ1-42流出的LRP-1转运体表达呈现出随着月龄增加进行性降低的变化,此变化与小鼠脑组织中Aβ1-42聚集和血液中含量降低的变化趋势是一致的。研究发现,在AD模型鼠脑内LRP-1受体与Aβ之间具有负性相关性[8]。随着月龄的增加,AD脑组织中的LRP-1进行性下调,可能使脑组织中过多的Aβ排出到血液中的含量逐渐减少[5,7],或因血脑屏障的结构和功能障碍,使排出到外周的逐渐减少,进而使过多的Aβ聚集在脑组织中[19]。脑组织中逐渐增多的Aβ聚集可能会引起细胞间隙的形成,破坏细胞钙平衡,引起膜电位的变化;Aβ聚集也能促进细胞凋亡,引起突触和神经元丢失,破坏细胞骨架等多种病理变化。这些病理变化进一步导致模型鼠认知行为学功能的进行性下降[20]。
本研究发现,随着年龄的增长,APP/PS1小鼠认知行为学功能进行性下降的同时,海马组织中的ptk2b基因mRNA和PTK2B蛋白升高,与上文所述海马组织中LRP-1表达降低均呈现出时间依赖性变化是一致的。但是,在AD模型中ptk2b基因表达上调是否会导致LRP-1的降低,目前尚不十分清楚。有文献报道,缺氧可诱导Pyk2持续磷酸化,进而调控LRP-1的表达[21];非受体酪氨酸激酶Src可通过调控LRP活性及信号通路,从而在疾病中发挥作用[22]。也有研究应用小干扰RNA技术,敲除LRP-1可影响缺氧诱导的Pyk2磷酸化水平[23]。因此,PTK2B与 LRP-1的相互作用在AD的发生中可能具有重要作用。同时,异常的Pyk2信号通路能促进Aβ诱导的淀粉样变性和沉积[24];或者因血-脑屏障功能的病理学变化,LRP-1水平下调[25],导致Aβ1-42清除障碍,均可导致AD的发生。
综上所述,APP/PS1转基因小鼠海马组织中PTK2B、Aβ1-42、p-Tau的表达在早期即出现上调和LRP-1下调,且与其认知功能降低均呈现时间依赖性变化。由此推测,ptk2b基因在AD模型早期表达上调可能是AD模型小鼠海马Tau过度磷酸化和Aβ聚集等病理学和认知行为学功能变化的基础。但是,在AD模型小鼠脑组织中ptk2b基因是否是通过血脑屏障转运蛋白LRP-1影响Aβ清除机制进而导致Aβ在脑组织和血液中的变化;或者是通过Tau蛋白磷酸化途径,从而导致小鼠认知功能的进行性下降,仍需要进一步的研究。同时,进一步的证据还需要在临床上对AD病人进行分析和研究,从而为临床早期诊断AD提供依据。
