GSK3β/eEF2K信号通路对小鼠肺纤维化过程的影响*
2022-06-02覃超群王昌明莫艳菊
覃超群,黄 斌,阳 芳,王昌明,肖 影,莫艳菊,廖 艺,高 枫
(桂林市人民医院呼吸与危重医学科,广西 桂林 541002)
肺纤维化(pulmonary fibrosis,PF)是一种以进行性和损害肺功能为特征的慢性疾病,是因肺脏中纤维生成和纤维溶解之间出现失衡,导致基质蛋白在组织内积累而引起的[1]。肺泡上皮细胞大量转化为成纤维细胞,然后再形成肌成纤维细胞是肺纤维化形成的一个重要过程[2]。其中特发性肺纤维化(idiopathic pulmonary fibrosis,IPF),是一种致死性进行性纤维化间质性肺炎,常引起呼吸困难和肺功能下降[3]。其预后比许多癌症更为严重,5年生存率为20%至40%,中位生存时间仅为2至5年[4],其发病机制尚不清楚。因此寻找PF的发病机制及治疗手段备受关注。
真核延伸因子2激酶(eukaryotic elongation factor 2 kinases,eEF2K)是一种具有Ca2+/CaM依赖性且高度保守的蛋白激酶,几乎在所有哺乳动物中均广泛表达,属于特殊的丝氨酸(Thr)/苏氨酸(Ser)/酪氨酸(Tyr)小家族蛋白α-激酶[5]。糖原合成酶激酶3β(glycogen syntheses kinases 3β,GSK3β)是磷脂酰肌醇3-激酶(PI3K)通路下游一个重要的效应分子,是一种Thr/Ser蛋白激酶,在各种细胞中均有表达。有研究发现,在肺动脉高压的大鼠模型中,活化的eEF2K可以增加肺动脉血管重塑,肺动脉纤维灶形成增多[6]。GSK3β也参与PF的发展,Gurrieri等[7]在小鼠的PF模型中发现,GSK3β在PF小鼠的肺组织中高表达,抑制GSK3β后可抑制肺组织炎症的产生及纤维化的发生。但尚未见GSK3β是否通过调节eEF2K上的磷酸化位点对PF进程影响的相关研究报道。因此本课题探讨GSK3β-eEF2K信号通路是否可以通过磷酸化而调控PF进程,从而揭示eEF2K在PF发生发展过程中的作用机制,为PF的诊断及治疗提供新的思路及靶点。
1 材料与方法
1.1 实验动物
SPF级C57BL/6雄性小鼠,6~8周龄,体重(23±2)g,饲养阶段小鼠情况良好,由成都达硕实验动物有限公司提供,生产许可证号:SCXK(川)2020-030,使用许可证号:SYXK(川)2019-189。
1.2 实验试剂
注射用盐酸博莱霉素购自日本化药株式会社(每支15 mg、生产批号:74042);TDZD-8购自MCE(上海)公司;羟脯氨酸(Hyp)测定试剂盒购自南京建成生物工程研究所;胶原蛋白Ⅰ(Col Ⅰ)、胶原蛋白Ⅲ(Col Ⅲ)、α-平滑肌蛋白(α-SMA)、GSK3β、p-GSK3β、eEF2K、p-eEF2K(Ser70)、p-eEF2K(Ser392)、p-eEF2K(Ser470)、基质金属前体蛋白酶-2(pro-MMP-2)、基质金属蛋白酶-2(MMP-2)、β-actin和羊抗兔二抗均购自艾博抗(上海)贸易有限公司。
1.3 仪器
酶标仪(美国Thermo公司)、显微镜(日本Olympus公司)、多功能凝胶成像仪(美国Bio-Rad公司)、蛋白质电泳仪(美国Bio-Rad公司)。
1.4 构建小鼠肺纤维化模型及给药
小鼠经适应性喂养一周后,腹腔注射3%戊巴比妥钠(10 ml/kg)进行麻醉,取仰卧位进行固定,使用75%乙醇消毒颈部皮肤后于颈中部做一长约为1 cm的切口,钝性分离皮下组织,暴露气管,动物按2 mg/kg(每只100 μl)的剂量于气管内缓慢注射博莱霉素,另取5只小鼠作为空白对照组注射等量生理盐水,注射后立即直立匀速旋转小鼠,使药物在肺内均匀分布,缝合颈部皮肤,苏醒后正常饮食饮水。造模14 d后,按体重随机分为模型组、阴性抑制组与抑制组,每组5只,抑制组每3 d一次给予腹腔注射4 mg/kg TDZD-8溶液(用10%DMSO助溶,溶于生理盐水),阴性抑制组在注射博莱霉素后,每3 d一次给予腹腔注射生理盐水(含等体积10%DMSO),空白对照组与模型组腹腔注射等体积生理盐水,给药15 d后处死各组小鼠,采集指标进行后续测定。
1.5 小鼠肺脏中羟脯氨酸的测定
将肺脏组织按羟脯氨酸试剂盒说明书进行水解处理,使用酶标仪测定肺脏中羟脯氨酸(Hyp)的质量分数(μg/mg)。
1.6 肺脏病理学检测
将采集的肺脏在4%多聚甲醛中固定24 h以上,将固定好的各组标本脱水处理后用石蜡进行包埋切片,然后使用苏木精与伊红染色液进行染色,使用光学显微镜在400倍放大下进行病理学观察分析,根据Szapiel标准[8]对肺组织进行病理评分:0分,无病变;1分,轻度炎性细胞浸润和纤维化,范围小于20%;2分,中度肺炎和纤维化,肺泡间隔增厚20%~50%;3分,重度肺炎和纤维化,病变范围大于50%。
1.7 免疫组织化学
将采集的肺脏在4%多聚甲醛中固定24 h以上,将固定好的各组标本脱水处理后用石蜡进行包埋切片,使用免疫组化法进行染色,检测肺脏组织中MMP-2、Col Ⅰ、Col Ⅲ、α-SMA的含量,每张切片选取4个视野,用图像分析软件计算平均光密度。
1.8 Western blot
将采集的肺脏组织使用生理盐水清洗干净后在冰上水解并进行蛋白质提取,同时进行蛋白质定量计算,然后以每个样本20 μg蛋白量加入泳道进行凝胶电泳,完成电泳后进行转膜、封闭,置于稀释好的GSK3β(1∶500)、eEF2K(1∶500)、p-eEF2K(Ser70)(1∶500)、p-eEF2K(Ser392)(1∶500)、p-eEF2K(Ser470)(1∶500)、pro-MMP-2(1∶500)、MMP-2(1∶500)、β-肌动蛋白(β-actin)(1∶1 000)一抗中4℃进行过夜孵育,孵育完成后使用TBST漂洗3次后置于二抗(1∶3 000)中在室温下孵育2 h,最后使用ECL试剂盒发光显影后在凝胶成像系统中观察分析,以β-actin作为内参,采用灰度值(Int)反映蛋白表达水平,采用Image Lab 3.0软件分析各条带的灰度值,将目的蛋白条带的灰度值与内参蛋白(β-actin)条带灰度值之比表示蛋白表达的相对水平。
1.9 统计学处理
2 结果
2.1 GSK3β抑制剂TDZD-8对小鼠肺纤维化的影响
病理学检测发现,空白对照组肺脏层胸膜结构较为正常,壁薄,无结缔组织增生、增厚;各级支气管结构完整清晰,上皮细胞形态正常,无明显变性坏死或脱落;Ⅰ型和Ⅱ型肺泡上皮细胞形态较为正常,未见明显变性、坏死,间质未见明显炎性细胞浸润及纤维增生;模型组肺脏各级支气管结构较为正常,肺泡间质内少量炎性细胞浸润,主要包括核圆形深染的淋巴细胞,局部区域纤维增生,见多量核呈卵圆形的成纤维细胞和长梭形纤维细胞增生,聚集呈结节状;阴性抑制组:肺脏各级支气管结构较为正常,支气管纤毛上皮排列整齐,未见明显细胞脱落;肺泡上皮细胞较为正常,肺泡间质内少量炎性细胞浸润,主要包括淋巴细胞,局部区域纤维增生,见纤维细胞(如成纤维细胞)增生,聚集呈结节状;抑制组:肺脏各级支气管结构较为正常,支气管纤毛上皮排列整齐,未见明显细胞脱落;肺泡上皮细胞较为正常,肺泡间质内少量炎性细胞浸润,主要以淋巴细胞为主,少量区域纤维增生,见成纤维细胞和纤维细胞增生(图1)。
与空白对照组相比,模型组与阴性抑制组肺脏纤维化评分与羟脯氨酸含量显著性升高(P<0.01);与模型组相比,抑制组的病理评分与羟脯氨酸含量显著性降低(P<0.01,表1)。免疫组化结果显示,与空白对照组相比,模型组与阴性抑制组肺脏中MMP-2、Col Ⅰ、Col Ⅲ、α-SMA的表达水平显著性升高(P<0.05);与模型组相比,抑制组肺脏MMP-2、Col Ⅰ、Col Ⅲ、α-SMA表达量显著性下降(P<0.05,表1,2,图2)。WB结果显示,与空白对照组相比,模型组与阴性抑制组肺脏中MMP-2与pro-MMP-2蛋白表达含量均显著性升高(P<0.01);与模型组相比,抑制组肺脏中MMP-2与pro-MMP-2蛋白表达含量均显著性降低(P<0.01,图3),说明GSK3β激活能促进肺纤维化形成。

Tab. 1 The levels of pulmonary fibrosis indexes in 4 groups n=5)
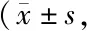
Tab. 2 The levels of pulmonary fibrosis indexes in 4 groups n=5)
2.2 GSK3β抑制剂TDZD-8对小鼠肺脏组织中eEF2K、磷酸化位点及MMP-2表达的影响
Western blot结果显示,与空白对照组相比,模型组与阴性抑制组肺脏中GSK3β、p-GSK3β、p-eEF2K(Ser70、Ser392、Ser470)的表达水平均显著升高,eEF2K的表达水平显著降低(P<0.01);与模型组相比,抑制组肺脏中GSK3β、p-GSK3β、p-eEF2K(Ser70、Ser392、Ser470)的表达水平均显著降低,eEF2K的水平显著升高(P<0.01),说明GSK3β能通过Ser70、Ser392、Ser470三个磷酸化位点激活eEF2K(表3,图4)。
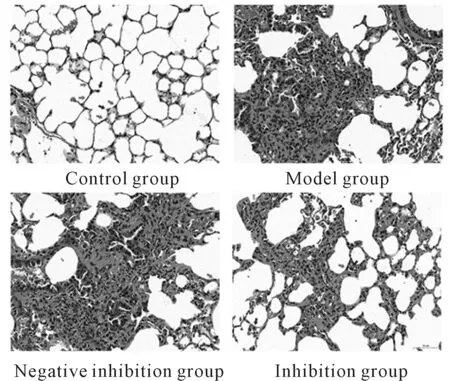
Fig. 1 Pathological changes of lung tissues of mice (HE ×400)
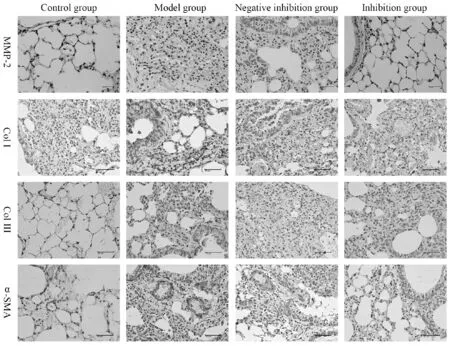
Fig. 2 Detection the expressions of MMP-2,Col Ⅰ,Col Ⅲ,and α-SMA in lung tissues of mice by immunohistochemistry(×400)
Fig. 3 Western blot method was used to detect the expressions of pro-MMP-2 and MMP-2 in lung tissues of mice
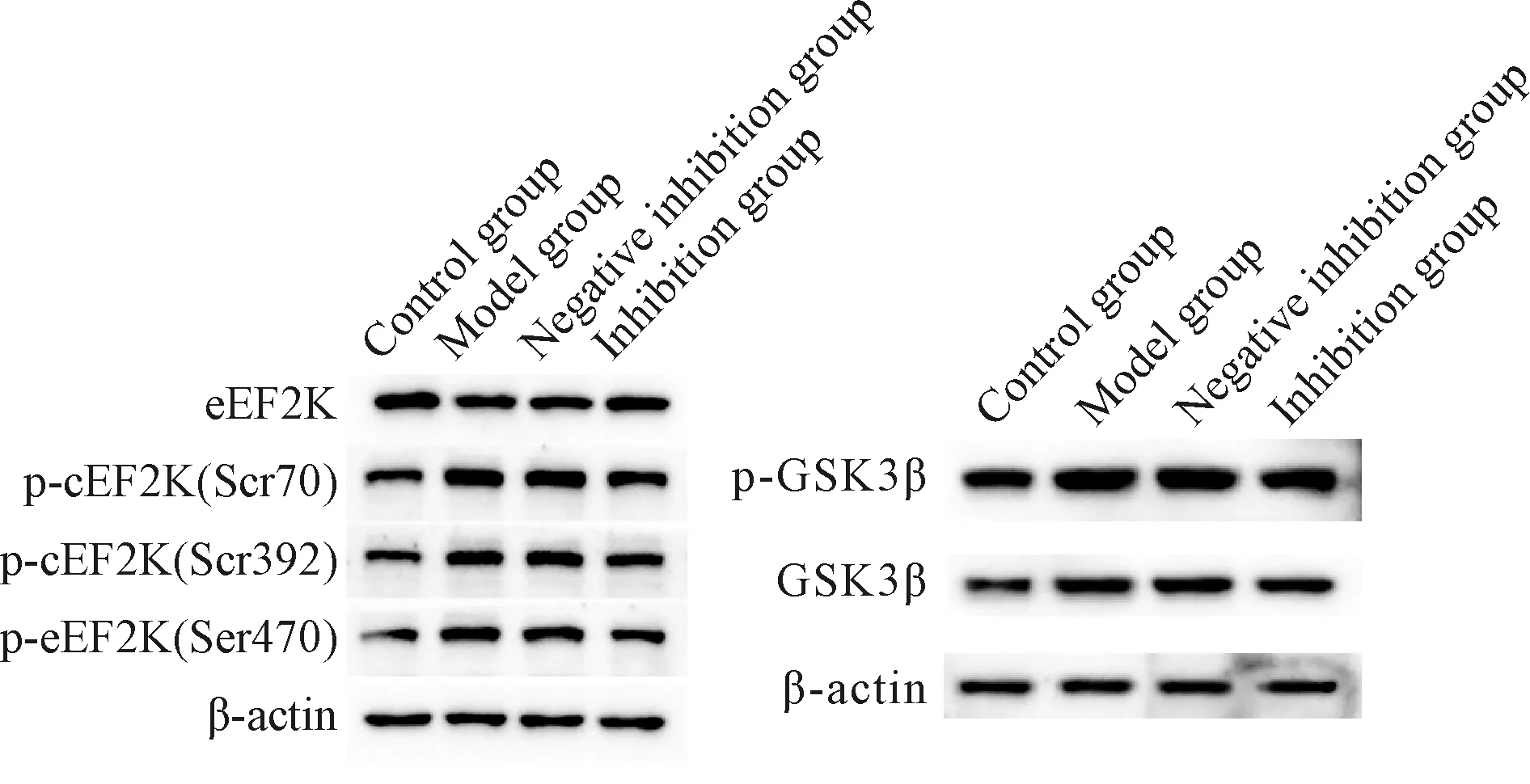
Fig. 4 Western blot method was used to detect the expressions of eEF2K,phosphorylation sites and MMP-2 in lung tissues of mice
3 讨论
肺纤维化是一种致命疾病,其组织病理学特征包括肺组织细胞外基质过度沉积、肺组织出现片状慢性间质性炎症、肺纤维母细胞增殖和肺泡变形,使Hyp水平异常升高并促进胶原蛋白积累,最终发生进行性纤维化导致肺功能丧失[9]。目前已知,肺纤维化产生的原因是大约30%的肺泡上皮细胞肺转化为成纤维细胞,而在IPF中,细胞外基质也可能是促进成纤维细胞灶和纤维化形成的原因之一[10]。Hyp是人类蛋白组中最丰富的翻译后修饰氨基酸,其主要成分为胶原蛋白[11]。有数据证实,肺脏中Hyp含量可作为定量纤维化的可靠标准,有助于评估肺纤维化的程度[12,13]。Hyp是稳定胶原蛋白的基础,如Col I、Col Ⅲ等,很多疾病都与Hyp代谢异常相关,其中包括胃病和肺病[14]。本研究中发现,模型组小鼠肺脏组织纤维增生较多,肺泡或细支气管壁增厚且出现严重纤维化样,组织内Hyp,Col I、Col Ⅲ、α-SMA含量明显增多,与卢林明等[15]研究结果基本一致。使用TDZD-8后,肺脏组织纤维化程度减弱,Hyp,Col I、Col Ⅲ、α-SMA含量降低,说明肺脏纤维化得到缓解,也证明TDZD-8对于治疗肺纤维化有一定应用前景,但是否通过GSK3β/eEF2K信号通路起作用尚不十分清楚。

Tab. 3 The expression levels of eEF2K,phosphorylation sites and MMP-2 in lung tissues of mice n=5)
MMPs是一类具有破坏细胞外基质能力的锌依赖性内肽酶[16]。大多数MMPs以pro-MMPs或酶原的形式分泌,在细胞外环境中被激活,恶性促进细胞增殖。基质金属蛋白酶-2(MMP-2)是一种IV型胶原蛋白酶[17],当肺上皮细胞发生间质性转化时,MMP-2表达异常升高,然后过度累计肺组织中胶原纤维,重塑肺结构,降低肺功能[18]。而eEF2K过度激活会导致MMP-2表达增加,有诱导细胞增殖,促进肺纤维化进程的作用[19]。因此,本实验检测肺组织中MMP-2与pro-MMP-2的蛋白表达量来反映纤维化的程度。结果显示,模型组中MMP-2与pro-MMP-2的蛋白表达量均明显升高,而抑制GSK3β表达后,MMP-2与pro-MMP-2的表达量均呈明显降低,说明抑制GSK3β表达能抑制肺纤维化进程。
EEF2K是蛋白激酶家族的一个成员,是一种具有钙/钙调蛋白依赖性酶,通过磷酸化其唯一的底物eEF2(Thr56)来调节蛋白合成,在乳腺癌、胰腺癌和胶质母细胞等多形性细胞中均过表达[20,21]。EEF2K可被多种条件激活,如缺氧、生长因子失衡、营养或能源枯竭及细胞自噬[22],这种反馈性激活对平衡但高度磷酸化有利于恶性细胞进行快速增殖[23],也能加速纤维化疾病进程,因为eEF2K过度磷酸化会导致正常肺纤维化细胞发生异常增殖与分化,影响细胞正常自噬与凋亡功能,进一步加速肺组织纤维化的形成[21]。在一项研究中发现,eEF2K磷酸化激活是由Ser70、Ser392、Ser470三个位点控制的[24]。GSK3β作为PI3K/Akt通路的下游蛋白,与细胞生长分化关系密切。有研究发现,在肾小管上皮细胞纤维化组织中,GSK3β的表达异常增多,说明GSK3β蛋白是纤维化疾病的一个干预靶点,而GSK3β抑制剂可以用于纤维化疾病[25]。由于GSK3β能与Ser特异性结合,同时也是钙通路调节因子,eEF2K作为一种钙/钙调蛋白依赖性激酶,会特异性结合钙离子磷酸化激活[26]。因此推测GSK3β能通过Ser70、Ser392、Ser470这3个位点磷酸化激活eEF2K,促进肺纤维化的形成。结果显示,模型组中eEF2K(Ser70)、(Ser392)、(Ser470)三个位点及GSK3β的磷酸化水平均有不同程度的升高,其中eEF2K(Ser70)磷酸化水平最高,说明GSK3β主要通过Ser70这个位点激活eEF2K。使用TDZD-8后磷酸化蛋白表达趋势发生改变,3个位点的磷酸化程度均降低,说明GSK3β可以通过激活Ser70、Ser392、Ser470这3个位点对eEF2K进行调控,是影响肺纤维化发生的关键。
综上所述,本研究探讨GSK3β通过eEF2K磷酸化位点影响肺纤维化进程的可能性,结果表明GSK3β能通过Ser70、Ser392、Ser470这3个磷酸化位点激活eEF2K,促进肺纤维化形成,eEF2K在PF发生发展过程中起到重复作用,为PF的诊断及治疗提供新的思路及靶点。
