蛋白种类对大豆皂苷-蛋白W/O/W型乳液稳定性的影响
2022-06-02许杨杨朱力杰刘秀英
许杨杨,朱力杰,*,刘秀英,李 赫,刘 军,刘 贺
(1.渤海大学食品科学与工程学院,生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁 锦州 121013;2.北京工商大学 国家大豆加工产业技术创新中心,北京 100048;3.山东禹王生态食业有限公司,山东 德州 251200)
多重乳液由Seifriz于1925年首次提出,被称为“乳液中的乳液”,即乳液以细小液滴的形式存在于另一不相溶的液滴之中。常见的多重乳液主要分为两类:水包油包水(W/O/W)、油包水包油(O/W/O)。W/O/W乳液是目前常见的一种乳液体系,其分散相本身为油包水(W/O)乳液,内水相W和外水相W因具有相同的极性易相溶。两步乳化法是制备多重乳液最普遍的方法。与常见的水包油(O/W)乳液相比,W/O/W乳液因具有输送和控释生物活性成分、掩盖不良气味、降低脂肪含量等优点被广泛地应用于食品、药品、化妆品等领域。
大豆中的皂苷与蛋白质是大豆油加工的两类主要副产物,其在脱脂饼粕中含量丰富。大豆皂苷(soyasaponin,Ssa)是由三萜苷元和低聚糖链组成的五环三萜类齐墩果烷型皂苷,含有苦涩味,其在大豆中的含量为0.6%~6.2%,具有皂苷一般性质。有研究表明,Ssa除具有抗氧化、降低血糖、抗炎、抗病毒、增强免疫调节等生理功能外,还具有作为乳化剂、起泡剂的潜能。大豆蛋白是一种多组分混合蛋白,主要由-伴大豆球蛋白(-conglycinin,7S)、大豆球蛋白(glycinin,11S)组成,二者含量占大豆总蛋白含量的80%左右,而大豆分离蛋白(soy protein isolate,SPI)是目前用量最大、应用最为广泛的大豆蛋白产品。大豆蛋白含有大量的亲水性和疏水性基团,可吸附到油水或者气-水界面上,降低其表面张力,形成具有粘弹性的蛋白界面膜,阻止其乳化状态被破坏,表现出良好的乳化性。目前关于SPI、11S、7S三种蛋白乳化性的研究较为广泛。Liu Fu等将SPI进行95 ℃、15 min加热处理,发现SPI能暴露出更多的疏水基团,形成的乳液更加的稳定。Keeratiurai等研究了7S、11S的乳化行为,发现蛋白质可在油水界面上形成30~40 nm的膜,7S比11S表现出更高的乳化活性。陈硕等的研究结果表明11S在油水界面扩散、展开和重排速率大于7S,调整二者在大豆蛋白中的含量可以改变蛋白在乳液界面上的吸附行为。
综上所述,以SPI、11S、7S为主要研究对象,探究蛋白质种类对W/O/W乳液稳定性的影响,表征乳液的整体稳定性、粒径特性、电位特性、微观结构,并对其流变学特性和长期稳定性的变化情况进行分析,以期达到遮蔽皂苷苦味、运输生物活性的目的,旨在为皂苷-蛋白稳定W/O/W乳液提供一定的理论基础,提高大豆副产物的应用范围和利用率。
1 材料与方法
1.1 材料与试剂
Ssa(>80%) 西安通泽生物科技有限公司;聚甘油蓖麻醇酯(polyglycerol polyricinoleate,PGPR)山东优索化工科技有限公司;低温脱脂豆粕、SPI(蛋白>90%) 山东禹王生态食业有限公司;尼罗红、proclin 950、Florisil分子筛(60~100 目) 美国Sigma公司;长寿花玉米油 市购;其他化学药品均为分析纯,实验用水为去离子水。
1.2 仪器与设备
HH-2J数显恒温磁力搅拌水浴锅 常州双瑞仪器制造有限公司;Biofuge Stratos高速冷冻离心机 美国Thermo公司;FJ200-SH高速分散均质机 上海标本模型厂;FB-110S高压均质机 上海励途机械设备工程有限公司;Turbiscan稳定性分析仪 法国Formulaction公司;BT-9300激光粒度分析仪 丹东百特仪器有限公司;DiscoveryHR-1流变仪 美国TA公司;OCA-20视频光学接触角测量仪 德国Data-physics公司;FV-1000激光共聚焦显微镜 日本Olympus公司;Nano-ZS90电势分析仪 英国马尔文公司。
1.3 方法
1.3.1 7S、11S球蛋白的制备
参考Xu Jing等的方法,略有改动。将粉碎好的大豆脱脂豆粕与去离子水以1∶15的比例混合,搅拌豆粕至完全溶解,之后再加入2 mol/L的NaOH溶液,pH值调至8.5后在45 ℃低速搅拌1 h,过180 目尼龙网。将收集好的过滤液9 000×离心20 min,保留上清液。将亚硫酸氢钠(0.98 g/L)加入上清液中进行搅拌至完全溶解,之后再加入2 mol/L HCl溶液,将其pH值调节至6.4。将上述溶液放入4 ℃的冰箱中过夜后6 500×离心20 min,取出底部沉淀即为11S组分。在离心后的上清液中加入0.25 mol/L NaCl溶液,其目的是调节溶液的离子浓度,之后再加入2 mol/L HCl溶液,pH值调至5。静置1 h后,溶液4 ℃、9 000×离心30 min,保留上清液。将相同体积的冰水加入上清液中,再用2 mol/L HCl溶液调pH值至4.8,之后4 ℃、6 500×离心20 min,取出沉淀即为7S组分。经计算可知11S、7S的提取率分别为15.51%、9.46%,蛋白质量分数分别为93.9%、96.2%。
1.3.2 W/O/W乳液的制备
参考Zhu Qiaomei等的方法,略有改动。在去离子水中溶解1%(/)Ssa制备成为内水相W;在玉米油中加入3%(/)PGPR,之后在50 ℃加热搅拌30 min后制成油相O。将内水相W、油相O二者以30∶70进行混合,先使用高速剪切机在18 000 r/min均质4 min,随即在60 MPa高压均质得到W/O乳液。在去离子水中溶解1%(/)SPI、11S、7S制备成为外水相W,将外水相W、初乳W/O以50∶50进行混合,先使用高速剪切机7 000 r/min均质2 min,随后在10 MPa下高压均质获得W/O/W乳液。在制备好的W/O/W乳液中加入0.05% proclin。
1.3.3 W/O/W乳液整体稳定性测定
Turbiscan 稳定分析仪能在不破坏乳液的情况下,通过测量脉冲近红外光的透散射光和背散射光(backscattering,BS)表征W/O乳液的稳定性。该仪器对样品进行静置垂直扫描,透过率探测器接收相对于光源180°通过色散的光,背散射探测器接收以45°向后散射的光,经多次扫描获得能够对乳液絮凝、上浮等状态进行分析的扫描图谱。采用BS表征乳液的稳定性的原因是本实验制备的W/O乳液不透光。实验时在机器专用测试瓶中加入20 mL的W/O乳液,之后将其放入多重光机器中开始进行扫描模式,每30 min扫描一次,总共扫描12 h。乳液经过不同储藏时间后再将其放入仪器中进行连续扫描1 h,以探究乳液的长期稳定性。
BS由式(1)得到:

*由式(2)得到:
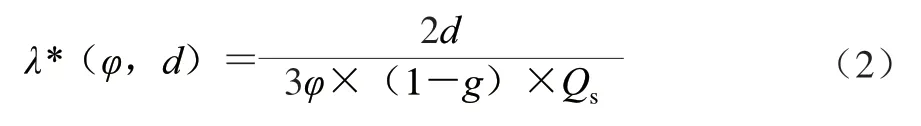
式中:为粒子的体积分数/%;为粒子平均直径/μm;、为米氏理论的光学参数。
通过样品的稳定性动力指数(turbiscan stability index,TSI)评价乳液稳定性,TSI曲线斜率越低、TSI值越低,乳液越稳定。TSI由式(3)得到:
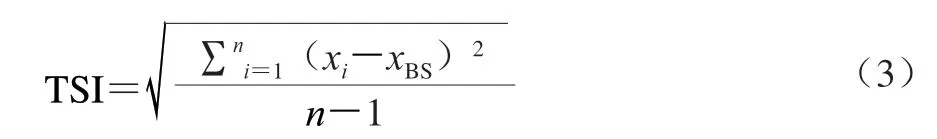
式中:x为每次背射光强的平均值;为x的平均值;为扫描次数。
1.3.4 W/O/W乳液粒径的测定
参考Ma Lulu等的方法,略有改动。采用激光粒度分布仪测定W/O/W乳液的粒径及宽度值。仪器参数设定为:颗粒折射率1.470,吸收指数0.002,水为分散剂,折射率1.330,测定温度25 ℃。乳液粒径用体积平均直径(=∑nd/∑nd)和表面积平均直径(=∑nd/∑nd)表示,其中n、d分别表示乳液液滴的数量和直径。乳液液滴尺寸分布的相对宽度用宽度值(Span=(-)/)表示,其中,、、分别为累积分布百分数达到90%、50%和10%处的乳液液滴的体积直径。每个样品至少重复测定3 次。
1.3.5 W/O/W乳液流变的测定
采用TA流变仪测定W/O乳液的流变学特性。实验参数设定为:温度25 ℃,锥板2°、40 mm,间隙0.1 mm。稳态扫描模式:剪切速率0.1~100 s;振荡频率模式:在线性弹性内应变0.5%,频率0.1~10 Hz。每个样品至少测定3 次平行。采用幂律模型对数据进行拟合,由式(4)得到:

式中:为剪切应力/Pa;为稠度系数/(Pa·s);为剪切速率/s;为幂律指数。
1.3.6 W/O/W乳液激光共聚焦的测定
参考Velderrain-Rodríguez等的方法略加改动。取新鲜制备的W/O/W乳液1 mL,加入50 μL 0.1 g/100 mL尼罗红(丙酮溶解)溶液进行染色。吸取成功染色的溶液(10 μL)滴于载玻片上,盖上盖玻片,用指甲油封片,之后将其放于激光共聚焦×63油镜进行观察。荧光样品的激发波长为488 nm的氩/氪离子,扫描密度为512×512,采用LASAF Lite软件对图像进行处理。
1.3.7 W/O/W乳液电位的测定
采用电势分析仪测定W/O/W乳液的电位,将W/O/W乳液样品稀释30 倍,测定温度为25 ℃,测定过程中要缓慢加入样品防止产生气泡。每个样品至少测定3 次。
1.3.8 动态界面张力测定
去除食用油中少量表面活性剂和杂质是玉米油进行纯化的目的。具体方法为:玉米油与Florisil分子筛按照100∶4(mL/g)的比例混合均匀,采用磁力搅拌器搅拌2 h,之后10 000 r/min离心20 min除去沉淀。离心处理3 次,至其与去离子水界面张力30 min内保持恒定值为止。经测试,纯化后的玉米油密度为0.916 4 g/cm,油水界面张力为(26.16±0.13)mN/m,测试温度为25 ℃。
采用滴形张力法测定了蛋白质在油水界面吸附过程中界面张力()值的变化情况。实验过程中应注意避免外界环境振荡对测试结果产生影响。实验时将蛋白质水溶液加入注射针(针的外径为1.83 mm),平衡30 min使其温度达到25 ℃后向盛有纯化玉米油(含0.01% PGPR)的光学玻璃比色杯中注射10 μL的样品,测定时间为150 min。液滴外形图像用CCD摄像系统采集,利用系统SCA20软件进行分析。根据Young-Laplace方程计算在吸附时间()内蛋白质溶液的界面张力()变化情况。
1.4 数据统计分析
2 结果与分析
2.1 W/O/W乳液的整体稳定性分析
TSI值可以用来衡量乳液的稳定性,一般来说TSI曲线斜率和数值越大表示乳液发生分离的速度越快,乳液稳定性越低。结果表明,W/O/W乳液的TSI值随着时间的延长呈现不断增加的趋势(图1),说明在12 h内乳液的稳定性不断下降。在放置12 h后,外水相添加SPI、11S、7S的W/O/W乳液,相应TSI值分别为2.12、3.13、3.38,此结果表明SPI构建的W/O/W乳液的稳定性最好,7S乳液稳定性最差。图2是蛋白质种类对W/O/W乳液整体稳定性的影响。ΔBS的绝对值越小,乳液越稳定。光谱图的左侧、中侧、右侧分别代表乳液瓶的底部、中部、顶部。从图2可以看出,所有乳液底部的ΔBS随时间呈现下降趋势,顶部的ΔBS为上升趋势,表明乳液出现了上浮现象。SPI乳液中间的ΔBS无明显变化,表明乳液粒径大小无明显变化,12 h后顶部的ΔBS值增加至15%;11S、7S乳液中间的ΔBS有明显变化,表明液滴迁移速度加快,粒径大小增加,乳液发生絮凝或聚合现象,顶部的△BS值分别增加至30%、38%,这与图1结果一致。

图1 SPI、11S、7S对W/O/W乳液TSI值的影响(12 h)Fig.1 Effects of SPI,11S and 7S on the TSI value of W/O/W emulsion
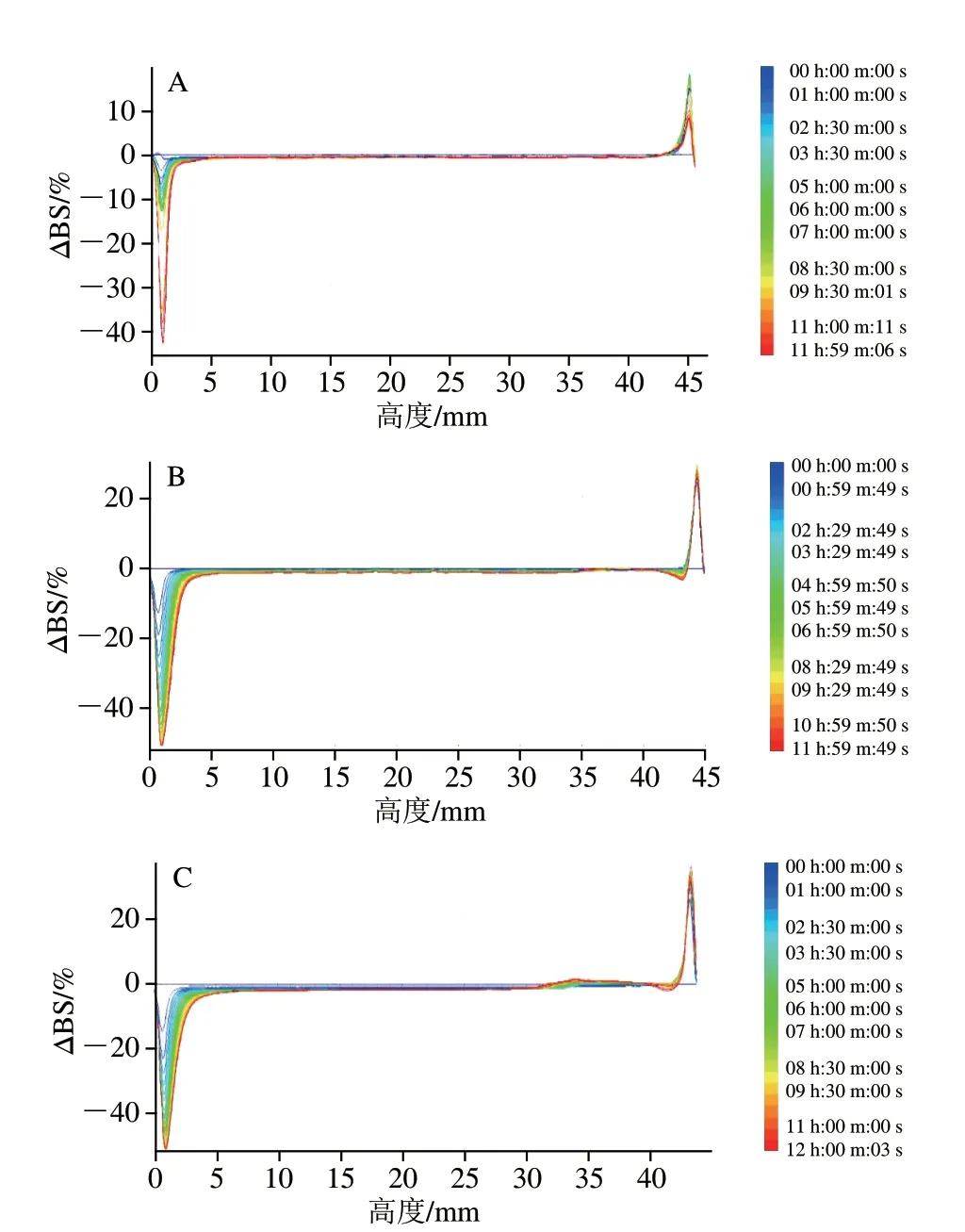
图2 SPI(A)、11S(B)、7S(C)(1%)制备W/O/W的整体稳定性Fig.2 Overall stability of W/O/W emulsion prepared with SPI (A),11S (B) or 7S (C)
2.2 W/O/W乳液的粒径、电位及微观结构分析
粒径是乳液生产工艺中最重要的参数,它影响乳液的外貌、质地、货架期、风味以及稳定性。从表1可以看出,SPI、11S、7S制备的W/O/W乳液的粒径集中在6 μm附近,且大小存在显著性差异。从图3可以看出,液滴中间存在黑色的“小圆圈”,其代表内部小水滴,这与文献的图片一致,表明该体系成功地制备了W/O/W乳液。图片显示视野中乳液液滴大小不均一,其中11S乳液中的大液滴总体数量较多,其次为SPI,最后为7S,这与粒径结果一致。
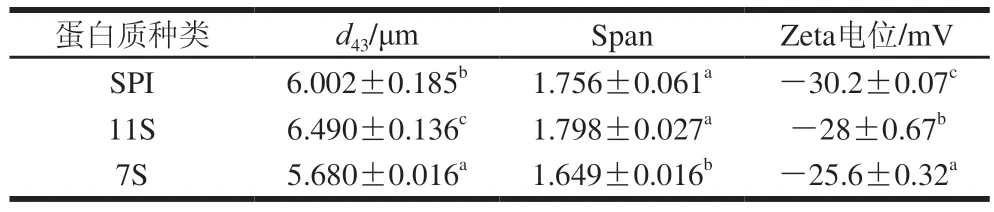
表1 SPI、11S、7S制备的W/O/W乳液的粒径、宽度及电位变化Table 1 Particle size,span value and zeta potential of W/O/W emulsion prepared with SPI,11S or 7S

图3 制备的W/O/W乳液的激光共聚焦图Fig.3 Confocal laser scanning micrographs of W/O/W emulsion
Zeta电位可以反映液滴间的带电性质,是研究乳液物理稳定性的一个重要参数。有研究表明,电位的绝对值越大,表明其稳定性越高。从表1可以看出,SPI、11S、7S制备的W/O/W乳液的电位之间存在显著差异且SPI乳液电位的绝对值最大,说明用SPI制备的W/O/W乳液比11S、7S制备的乳液具有更高的稳定性。
2.3 W/O/W乳液的流变学特性
乳液的流变学性质不仅可以为乳液稳定性和微观结构提供有用的信息,还可以为在乳液的加工、处理、储存和管道运输中对所涉及设备的设计、选择和操作提供重要方向。在0.1~100 s剪切速率下研究了SPI、11S、7S构建的W/O/W乳液的流动行为,如图4所示。随着剪切速率的增加W/O/W乳液黏度不断降低,当剪切速率过高时,黏度趋于平缓,表现为剪切稀化行为。文献中也有类似的结果,如Liu Jinning等的研究表明W/O/W双乳液的流变学测定为剪切稀化行为。表2为采用幂律模型对W/O/W乳液数据进行的非线性回归分析。其中,为稠度系数,与黏度测定值相等;为流动指数,表示流体偏离牛顿流体的程度,当=1时为牛顿流体,当<1时且乳液黏度随剪切速率的增加而降低时,属于非牛顿流体的假塑性流动。从表2可知,SPI、11S、7S制备的W/O/W乳液均为非牛顿流体(<1),黏度值分别为(0.029±0.005)、(0.005±0.000)、(0.003±0.005)Pa·s,SPI黏度显著大于11S、7S。有研究表明,乳液较高黏度可抑制乳液的聚合和沉淀速率,增强其稳定性,这与乳液整体稳定性的研究结果一致。图5为在变频速率下,乳液的储能模量(’)和损耗模量(’’)的变化,其中’代表弹性,’’代表黏性。研究结果表明,随着频率的增加,乳液’、’’呈现上升的趋势,表明乳液的黏弹性增加,且’、’’之间存在交叉点频率,在交叉点之前,’’>’表现为黏性为主,反之则以弹性为主。同时,图5直观地表明了乳液黏弹性大小为SPI>11S>7S。
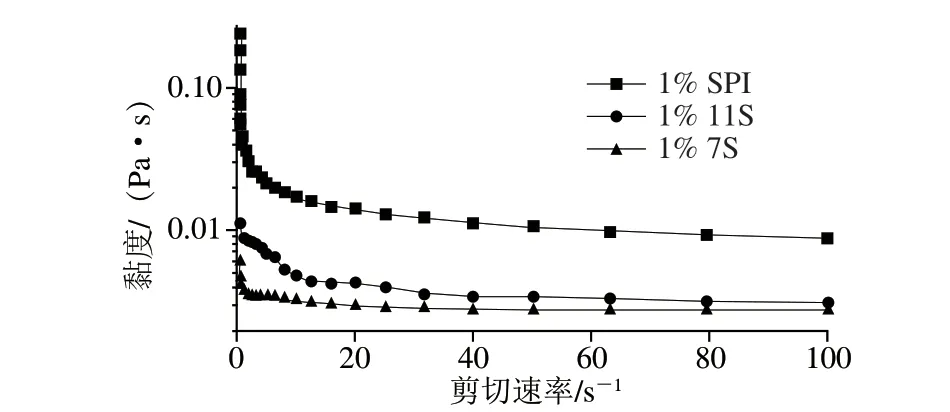
图4 SPI、11S、7S制备W/O/W乳液的黏度变化Fig.4 Changes in viscosity of W/O/W emulsion prepared with SPI,11S or 7S
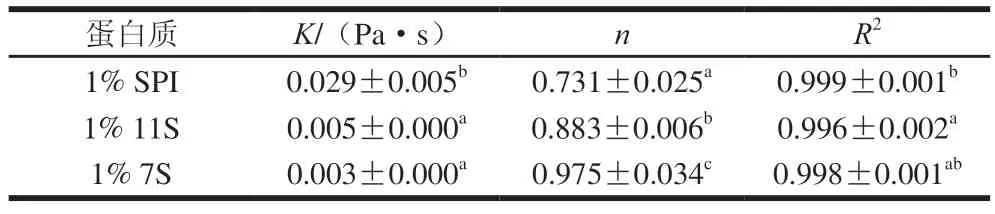
表2 SPI、11S、7S对W/O/W乳液幂律模型拟合参数的影响Table 2 Effects of SPI,11S and 7S on power law model parameters for W/O/W emulsion
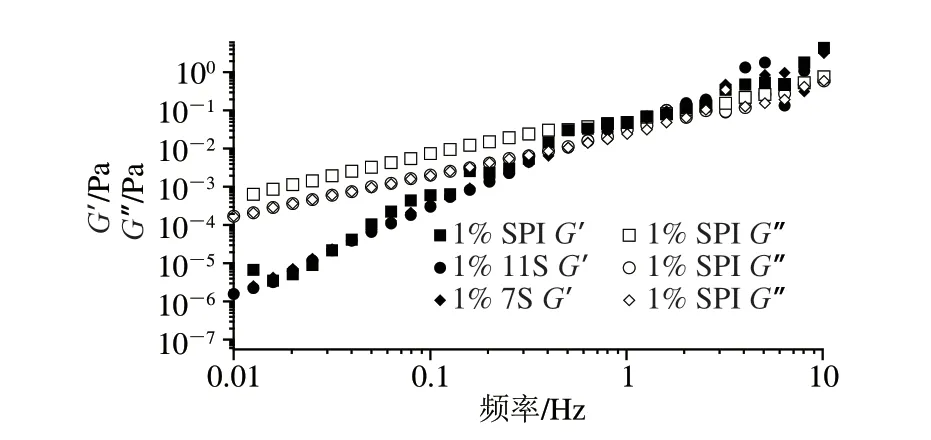
图5 SPI、11S、7S制备W/O/W乳液的G’和G’’随频率的变化Fig.5 Storage (G’) and loss (G’’) modulus versus frequency for W/O/W emulsion prepared with SPI,11S or 7S
乳液黏度可以反映乳液内在形态与粒子间的相互作用,有研究表明多重乳液中水分子的迁移会造成乳液黏度的变化。由图6可得,贮藏时间延长,SPI乳液的黏度呈现下降趋势,7S及11S乳液黏度变化趋势均表现为先降低后增加。结合后续长期稳定性等实验结果可以发现,基于SPI制备的W/O/W乳液其稳定性强于7S及11S乳液,而体系黏度与乳液稳定性存在一定关系。推测7S/11S乳液中的水分子较SPI乳液更易从内向外迁移,进而改变了其连续相和分散相的比例,造成乳液黏度下降,之后双重乳液发生破裂又引起其黏度上升。
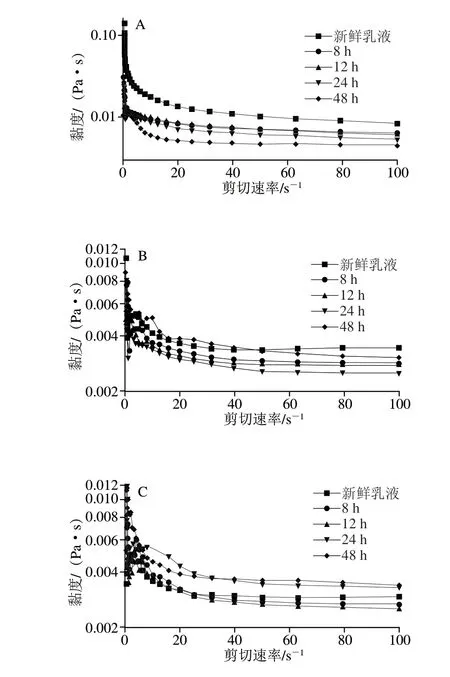
图6 W/O/W乳液黏度在48 h内的变化Fig.6 Changes in W/O/W emulsion viscosity during storage up to 48 h
2.4 W/O/W乳液的界面吸附行为
界面流变学(界面张力、界面黏弹性)与乳液的稳定性存在一定的联系,界面张力值越低,在能量输入过程中破裂乳液液滴所需要的能量越少,形成的乳液粒径越小,其稳定性越好。图7为SPI、11S、7S与PGPR复合体系在油水界面的张力值随吸附时间的变化情况。图7A结果表明,蛋白质与PGPR的界面张力随着时间延长呈显著下降趋势,表明界面上乳化剂的吸附量增加。SPI的界面张力衰减曲线值最小,其次是11S,再次为7S。观察7S的界面张力衰减曲线,发现有曲折点,这可能与蛋白质结构出现了明显的去折叠有关。图7B显示,在吸附150 min后,SPI、11S、7S的界面张力值分别为4.07、5.18、7.18 mN/m,表明在相同的时间下SPI的界面张力最低,界面张力的降低会使得乳液液滴粒径变小,从而有利于乳液的稳定性。由于PGPR与蛋白质均为两亲性分子,在界面上易发生疏水相互作用,进而协同降低界面层的张力值,而界面张力的降低程度主要取决于蛋白质的分子质量与结构。


图7 SPI、11S、7S与PGPR复合体系在油水界面的界面张力(γ)随吸附时间的变化(A)及吸附150 min后复合体系γ的变化(B)Fig.7 Interfacial tension (γ) of composite systems of SPI,11S or 7S with PGPR at the oil-water interface as a function of adsorption time (A) and changes in γ after adsorption for 150 min (B)
2.5 W/O/W乳液的长期稳定性
为探究不同蛋白质构建的W/O/W乳液长期稳定性,将其在室温下放置15 d。如图8A所示,15 d后对乳液外观进行观察,发现所有样品瓶底部均有水分析出,说明此时乳液稳态失衡,顶部出现明显的油析。其中就分层率而言,7S的分层率最高,SPI的最低。测定W/O/W乳液在15 d内TSI变化(图8B),结果表明随着时间的延长,乳液TSI值不断变大,表明乳液在放置过程中稳定性不断降低。其中就曲线斜率而言,SPI的曲线斜率最低,11S和7S相差较小。15 d之后,SPI、11S、7S制备W/O/W乳液的TSI值分别为21.51、24、25.50,表明SPI制备的W/O/W乳液的稳定性优于11S、7S。这与界面张力、流变等结果一致。

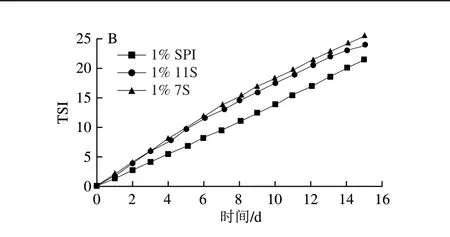
图8 SPI、11S、7S制备W/O/W乳液15 d后的直观图(A)和15 d内TSI的变化(B)Fig.8 Visual appearance of W/O/W emulsion prepared with SPI,11S or 7S after 15 days of storage (A) and changes in TSI during the 15-day storage period (B)
3 结论
采用两步乳化法,基于Ssa及SPI、11S、7S成功构建出较为稳定的W/O/W乳液,发现随着贮藏时间的延长,乳液的TSI值呈上升趋势;SPI构成乳液的上浮率最小,各组乳液粒径集中在6 μm附近;电位绝对值的顺序为SPI>11S>7S;乳液体系表现出假塑性剪切稀化行为,SPI乳液的黏度值最大;在相同蛋白质量分数下(1%),SPI制备的乳液的稳定性优于11S、7S。本研究探索了以Ssa、蛋白为原料构建W/O/W型乳液的可行性,为二者在新型乳液基食品中的进一步应用打下基础。
