一种基于微芯片快速生成双层乳化液滴的方法
2020-07-29白立宽袁会领涂然王钦宏花尔并
白立宽,袁会领,涂然,王钦宏,花尔并
·生物技术与方法·
一种基于微芯片快速生成双层乳化液滴的方法
白立宽1,2*,袁会领2*,涂然2,王钦宏2,花尔并1
1天津科技大学 生物工程学院,天津 300457 2中国科学院天津工业生物技术研究所 中国科学院系统微生物工程重点实验室,天津 300308
体外区室化(compartmentalization,IVC) 是通过制备微液滴反应小室包裹单个基因 (包含表达体系) 或细胞进行反应和培养,从而建立表现型与基因型的偶联,并借助流式细胞仪(Fluorescence-activated cell sorting,FACS) 对液滴进行超高通量检测和筛选,进而快速获得目标基因或细胞的一种方法。IVC-FACS筛选方法已被广泛应用于蛋白质工程、酶工程等定向进化研究。但早期利用机械分散法生成的微液滴大小均一性难以控制,严重影响液滴的定量检测,降低了筛选的效率和准确性。随着微流控芯片制备技术的快速发展,在芯片内快速生成微液滴的技术也愈加成熟。本研究首先利用W/O (Water-in-oil) 单层液滴生成芯片高速制备单分散的W1/O液滴,再将W1/O液滴重注入W/O/W (Water-in-oil-in-water) 双层乳化液滴生成芯片制备均一的W1/O/W2双层乳化液滴。通过对油、水相流速与比值的优化,可以生成直径在15.4–23.2 μm的单乳化微液滴,液滴可在培养数天内保持稳定。将单乳化液滴重注入双层乳化液滴芯片,通过调整油相流速,可以获得生成速度在1 000个液滴/s、直径在30–100 μm的双层乳化液滴。利用双层乳化液滴包埋的大肠杆菌细胞能正常进行培养和目标蛋白的诱导表达,为后续建立基于液滴和流式细胞仪的菌株高通量筛选方法奠定基础。
体外区室化,微流控芯片,高通量,单细胞,流式细胞仪
体外区室化(compartmentalization, IVC) 通过“油-水” (Water-in-oil,W/O) 或“水-油-水” (Water-in-oil-in-water,W/O/W) 形成微液滴,将1 mL的水相轻易制备出超过1010个微液滴,使居于内部的每个水相微液滴小室相当于一个微反应器,用于蛋白质工程、酶工程等定向进化研 究[1-5]。微液滴生成方法最初主要采用机械分散方式[6-7],该方法生成液滴的效率高、操作简便而被大量采用。但由于无法精确控制液滴生成的过程,导致生成液滴的大小分散度很大,严重降低了筛选的效率和准确性[1,8]。
随着微流控芯片制备技术的快速发展,在芯片内进行微液滴的形成、分裂、合并、混合、分选、捕获等操纵技术也愈加成熟[9-11]。尤其是微液滴的分选技术,使得利用很少量的样品进行低成本、高通量的检测和筛选成为可能。基于单乳化液滴的液滴微流控分选已有大量报道,并取得显著成果。2009年Baret等率先报道了将液滴微流体芯片检测分选技术(Fluorescence-activated droplet sorting,FADS) 应用于超高通量的工程酶定向研究中,分析筛选速度可达到2 000个液滴/s,对108突变量文库的筛选工作仅用了约10 h,相关反应试剂消耗量仅为150 μL[12]。2014年Wang等利用FADS技术开发了针对酵母菌株胞外木糖消耗能力和大肠杆菌分泌生产乳酸能力的筛选方法,并为进行其他小分子代谢产物的检测和筛选指明了方向[13]。2016年,Gielen等提出基于吸光度的液滴筛选技术 (Absorbance-activated droplet sorting,AADS),筛选通量达300个液 滴/s[14],进一步拓展了液滴微流控筛选技术的应用范围。
然而,以上基于W/O单乳化液滴的微流控筛选案例中,由于液滴外层为油相,需要自行搭建液滴检测与筛选系统,难以得到广泛应用。相对单乳化液滴,W/O/W双层乳化液滴在单层W/O液滴的基础上,通过引入第2层水相层,形成的双层乳化液滴外层为水相,可以施加电荷,能够与FACS筛选兼容,FACS筛选通量可达105个细胞/s[8,15-18],分选通量得到大幅提高。
双层液滴生成也已有相关报道,2013年Yan等通过对制备双层乳化液滴生成芯片通道表面进行疏水、亲水处理,直接生成W/O/W双层乳化液滴,液滴直径约(84.2±0.8) μm,液滴生成600 Hz,流式细胞仪分析结果表明生成W/O/W液滴直径和内部结构单分散性好[19]。2016年Li等利用环氧树脂胶规定疏水区,通过等离子体处理将软光刻胶处理的含通道PDMS (Polydimethylsiloxane) 层与另一层PDMS键合制备双层乳化液滴生成芯片,该种方法制作的芯片可生成直径55 μm的W/O/W液滴,采用此方法也可制备O/W/O双层乳化液滴[20]。然而,目前这些双层乳化液滴生成芯片制备方式还不太成熟,对没有芯片制备能力的研究者使用更限制。本研究介绍一种利用商业化液滴微流控芯片高速生成均一、稳定的双液滴生成方式,液滴生成更高速和简单。
1 材料与方法
1.1 材料
1.1.1 主要仪器与芯片
双层乳化液滴生成芯片购自英国Dolomite公司;兰格微量注射泵购自兰格恒流泵有限公司;注射器购自碧迪医疗器械 (上海) 有限公司;荧光显微镜购自奥林巴斯公司;PDMS-玻璃单液滴生成芯片,PDMS购自迈图精细高新材料 (深圳)有限公司,玻璃为载玻片购自江苏世泰实验器材有限公司。
1.1.2 主要试剂
油相Pico-Surf (含2% (/) Surfactant的FC40) 购自Dolomite公司;非特殊说明外,其他试剂均购自Sigma-Aldrich公司。
1.1.3 培养基和溶液
LB培养基:蛋白胨10 g/L,氯化钠10 g/L,酵母粉5 g/L。制备固体培养基时添加2% (/)的琼脂。
10×TBS溶液:1 mol/L Tris-HCl (pH 7.5) 5 mL,5 mol/L NaCl 2 mL,ddH2O 2 mL。溶液充分混匀,室温保存。
TBS-T溶液:10×TBS溶液 3 mL,10% (/) Tween20 1.5 mL,ddH2O 25.5 mL。溶液成分混匀,室温保存。
1.2 方法
1.2.1 双层乳化液滴生成流程
双层乳化液滴生成流程如图1所示,该流程分为两个阶段:1) 利用PDMS-玻璃单液滴生成芯片制备均一、稳定W1/O液滴;2) 再将W1/O液滴重注入Dolomite双层乳化液滴生成芯片制备均一、稳定的W1/O/W2双层乳化液滴。
1.2.2 制备W1/O单层乳化液滴
W1/O液滴生成的芯片为自制PDMS-玻璃单液滴生成芯片,芯片结构设计如图2所示,芯片制备参考文献[21],其中通道深度为20 μm。
液滴生成油相O为Pico-Surf油,水相W1为含有5 μmol/L FITC的LB溶液,或者是大肠杆菌LB溶液。
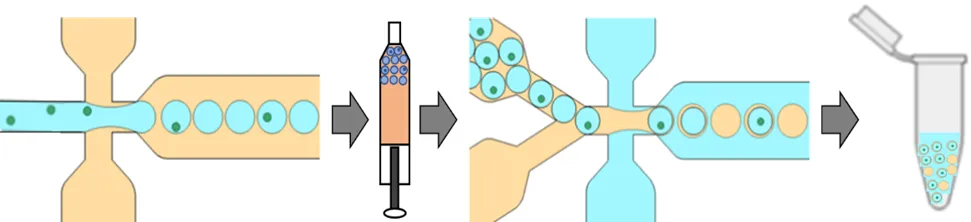
图1 W1/O/W2双层乳化液滴生成流程图

图2 PDMS-玻璃单液滴生成芯片
将分别盛有内层水相W1、中间层油相O的注射器,由微管连接至单液滴生成芯片的水相W1、油相O入口处,通过微量注射泵控制水相W1、油相O的流速,两者的流速分别为50–200 μL/h和50–400 μL/h。制备得到的均一、稳定W1/O单层液滴通过微管经芯片Outlet出口收集至盛有200 μL少量体积的FC40容器 (离心管或者注射器)。由于FC40密度大于水的密度,W1/O单层液滴浮在油相上方。
1.2.3 W1/O/W2双层乳化液滴生成
W1/O单乳化液滴生成后,再利用商品化的Dolomite双层乳化液滴生成芯片生成W1/O/W2双层乳化液滴。Dolomite双层乳化液滴生成芯片结构如图3所示。
外层水相W2为TBS-T溶液。将W1/O液滴经芯片Drop入口重注入芯片,油FC40经芯片Oil入口注入,调整控制W1/O液滴间的间距,外层水相W2经芯片W2入口注入包埋W1/O液滴制备W1/O/W2双层乳化液滴,制备的双层乳化液滴经芯片Outlet出口流出至离心管,利用微量注射泵控制外层水相W2、油相FC40和W1/O液滴的流速,分别是1 000–2 000 μL/h、10–100 μL/h和5–20 μL/h之间。
1.2.4 液滴的稳定性检测
单层液滴稳定性检测:将生成的W1/O单层液滴置于37 ℃培养箱中,分别在0 h、8 h、12 h、24 h、36 h、48 h时取3–5 μL液滴置于血球计数板上,在显微镜下,曝光条件为30 ms时观察液滴,并拍照记录,统计液滴大小,评估液滴的稳定性。

图3 Dolomite双层乳化液滴生成芯片
双层液滴的稳定性检测:将生成的W1/O/W2型液滴置于37 ℃培养箱中,分别在0 h、24 h、48 h时取3–5 μL液滴置于血球计数板上,在显微镜下曝光条件为30 ms时观察液滴,并拍照记录,评估液滴的稳定性。
1.2.5 液滴内FITC荧光信号检测
配制5 μmol/L的FITC溶液为水相W1,制备W1/O/W2双层乳化液滴,取3–5 μL液滴置于血球计数板上,在显微镜下白场曝光时间为30 ms时观察液滴,同时在荧光场曝光时间为50 ms时观察液滴荧光,并拍照记录。
1.2.6 双层液滴内菌体培养和荧光信号检测
分别在0 h、24 h、48 h时取包埋有表达GFP荧光蛋白的大肠杆菌细胞的W1/O/W2液滴3–5 μL置于血球计数板上,在显微镜下白场曝光时间为30 ms时观察液滴,同时在荧光场下曝光时间为10–30 ms时观察液滴内细胞荧光。
2 结果与分析
2.1 W1/O单层液滴制备
利用PDMS-玻璃单液滴生成芯片,通过调整水相和油相的流速,可以快速制备不同大小的液滴。将制备得到的液滴进行显微镜观察和拍照,并借助图像分析软件Image J在每个制备条件下选取100个液滴进行大小测量和统计。
通过调整油、水相流速和对液滴大小的统计,发现生成液滴的大小与油、水相流速比和流速大小均有关系。如图4所示,随着油相︰水相流速的比例提高,液滴直径逐渐变小。根据Image J图像软件统计,每个制备条件下的单乳化液滴大小均一性都大于99.5%。当水相流速固定为50 μL/h、油相流速从50 μL/h增大至200 μL/h、油相和水相的流速比例从1︰1提高至4︰1时,形成的液滴大小从23.2 μm减小至17.4 μm。当水相流速从50 μL/h增加至100或200 μL/h时,油相流速相应增加,随着油相︰水相流速的比例提高,液滴直径也逐渐减小。相同水相︰油相的流速比例条件下,随油、水相流速大小的增加,液滴直径也会相应减少。如流速比为1︰1时,水相和油相速度均为200 μL/h时的液滴大小比水相和油相速度均为50 μL/h的液滴大小减小了12.5%。在其他流速比例条件下,随水相和油相的流速大小增加也存在类似规律。
通过将制备得到的液滴置于37 ℃培养,不同时间取样分析进行了液滴稳定性的研究。实验结果如图5所示,15–24 μm大小的液滴在制备和培养48 h期间,液滴直径变化在1%以内,液滴稳定,无明显破损,可用于后续的液滴重注入、培养和筛选实验。

图4 油相和水相流速对液滴大小的影响
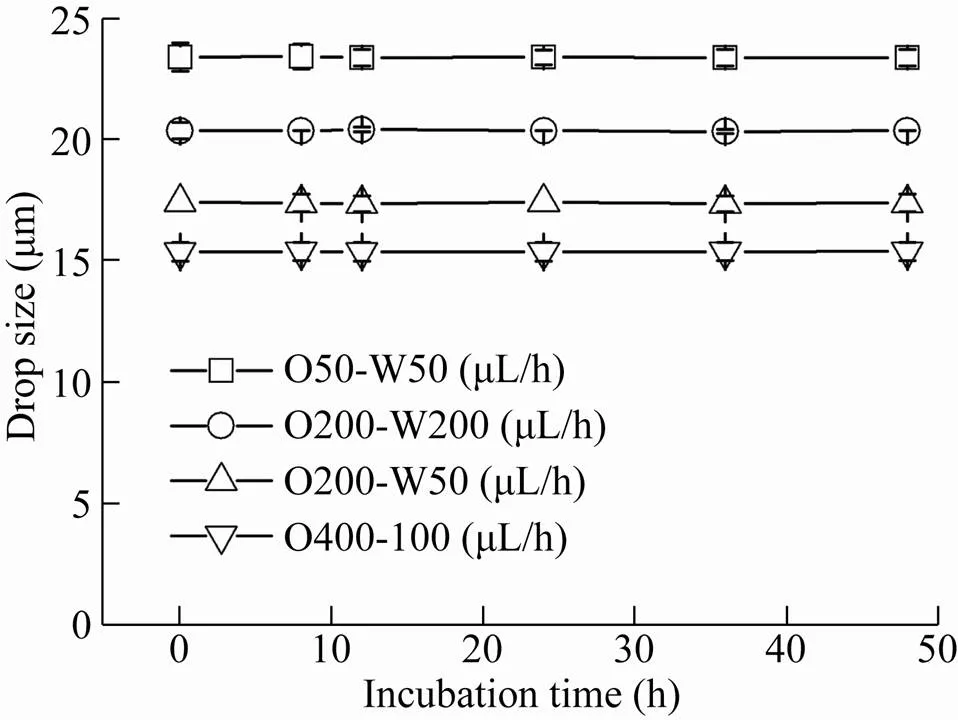
图5 不同大小液滴的稳定性
2.2 W1/O/W2双层乳化液滴制备
由于FACS仪器设备孔径的限制 (FACS仪器的常用喷嘴大小为70 μm或者100 μm),为满足后期FACS检测要求,需要将双层乳化液滴的大小控制在30 μm左右。前期研究结果表明油相400 μL/h、水相200 μL/h时,制备的单层液滴直径约是17.4 μm,该条件下单层乳化液滴生成速度约3 000个液滴/s。本研究在单层乳化液滴的基础上,采用商品化的双层乳化液滴生成芯片,对双层乳化液滴的制备参数进行了优化,用于控制双层乳化液滴大小,并通过双层乳化液滴的显微镜观察拍照,选取100个液滴进行测量评价。
在单乳化液滴大小确定情况下,设定外层水相W2流速和单乳化液滴重注入的流速分别为 1 000 μL/h和8 μL/h,调整油相流速为10–100 μL/h制备W1/O/W2双层乳化液滴。如图6所示,当外层水相和单乳化液滴重注入的流速固定时,制备的双层乳化液滴大小会随着油相流速的改变而改变。当油相流速从10 μL/h增加至40 μL/h和100 μL/h时,双层乳化液滴中的油层部分增大,使得最终的W1/O/W2双层乳化液滴的大小从 32 μm增大至53 μm和88 μm。该实验结果表明随着油相流速逐渐增加,液滴大小逐渐增大,通过调整油相速度可以便捷地控制双层乳化液滴的大小,获得适合FACS检测的液滴。根据FACS仪器对液滴大小的要求,图6A的双层液滴大小约 30 μm,根据Image J图像软件统计结果,该双乳化液滴均一性约98%。其制备条件为最佳条件,可以作为后续包埋细胞的双层液滴制备条件。

图6 双层乳化液滴大小与油相流速关系
液滴生成过程中,单液滴生成技术相对较成熟,与机械分散法获得液滴相比,利用微流控芯片生成液滴具有更好的均一性和稳定性[8,19]。双液滴生成过程中水相W2、油相O和液滴W1/O的流速控制对生成包埋单个W1/O液滴的双层乳化液滴非常重要。不适合的流速会造成双层乳化液滴中含有多个W1/O液滴,或者形成无W1/O的水包油空液滴 (图7)。实验表明,当W1/O/W2双层乳化液滴生成过程中出现包埋多个W1/O液滴的双层乳化液滴时,可通过减少W1/O液滴流速、油相O流速,增加水相W2的流速来调整。当出现无W1/O的水包油空液滴时,可通过增加W1/O液滴流速、减小外层水相W2流速来调整双层乳化液滴生成条件,获得正常的W1/O/W2双层乳化液滴。
2.3 单层和双层乳化液滴的荧光信号检测
为了验证单双层液滴内的荧光信号情况,以5 μmol/L的FITC溶液为水相W1,生成W1/O液滴和W1/O/W2液滴,分别取两种液滴在荧光显微镜下观察其液滴状态和荧光信号。如图8所示,包埋荧光染料FITC的单、双层乳化液滴保持均一、稳定且可正常观察到荧光信号,可用于后期筛选实验。

图7 包埋不同数目单液滴的双乳化液滴生成

图8 单层 (A)和双层(B)乳化液滴的荧光信号
2.4 W1/O/W2双层乳化液滴的稳定性和细胞培养检测
对包埋有表达GFP荧光蛋白的大肠杆菌细胞的W1/O/W2液滴进行培养和荧光观察。如图9所示,在不同条件下制备包埋大肠杆菌细胞的双层乳化液滴后,将液滴置于37 ℃培养箱中进行培养孵育,分别在0 h、24 h、48 h取样进行双层乳化液滴稳定性和细胞生长状态检测。检测结果表明细胞在双液滴内可以增殖和表达GFP荧光蛋白,虽然与常规恒温振荡培养相比液滴内的细胞生长较慢,但依然可以繁殖生长和表达荧光信号,适用于后续的检测分析。不同形态的液滴稳定性存在差异,当制备得到的液滴过大时,液滴稳定性较差,液滴会随着培养时间的增加而变小,在培养后期,出现大量液滴破损的情况。但液滴直径较小时 (图9A,液滴直径约30 μm),液滴表现出良好的稳定性,在培养过程中大小变化在1%以内,液滴均一稳定,为细胞长时间培养和表达提供了条件。
目前稳定、单分散的双乳化液滴生成仍相对困难。表1总结了已报道相对简单的双乳化液滴生成方法。相比基于实验室自制微流控芯片的双乳化液滴制备方法,本研究制备W1/O/W2双层乳化液滴生成方法采用商业化的芯片,液滴生成过程简单、速度快。生成的双乳化液滴在37 ℃培养箱培养48 h保持稳定,且30 μm直径的液滴相对较小,更适用于后期FACS检测筛选。

图9 大肠杆菌细胞液滴的稳定性和菌体生长情况
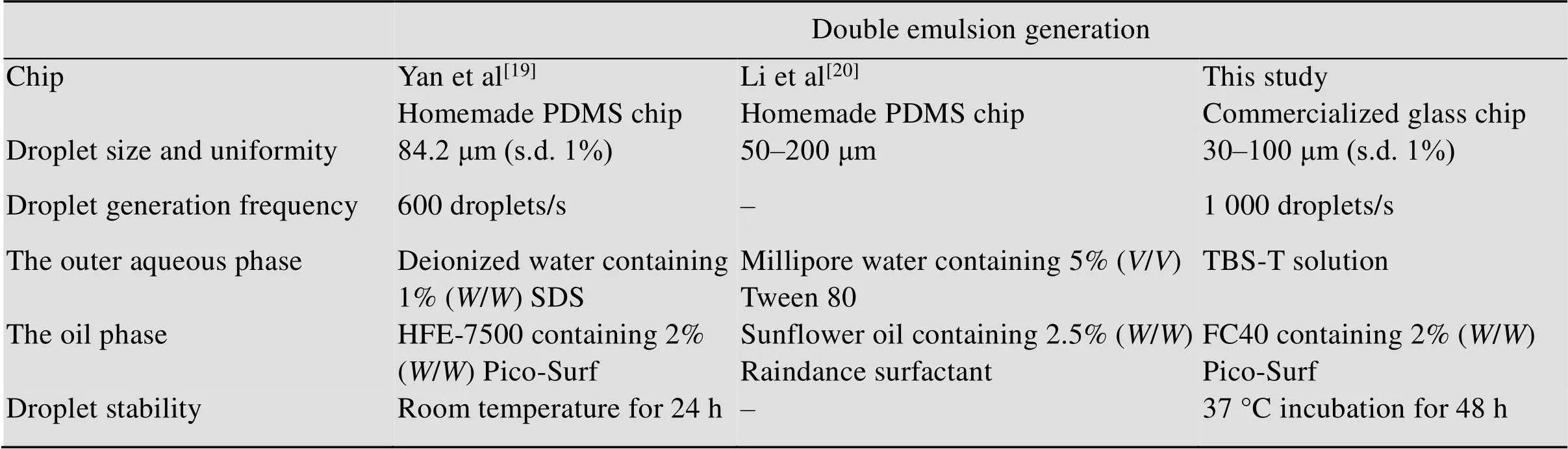
表1 双乳化液滴生成方法比较
3 结论
IVC-FACS结合的筛选方法已成为高通量筛选的理想手段,但传统机械分散法生成的液滴均一性差,严重影响了筛选的效率[8,19]。本文介绍了一种双层乳化液滴生成方式:首先,利用普通易制的PDMS-玻璃单液滴生成芯片生成均一的W1/O液滴,液滴生成速度约3 000个液滴/s,直径在15.4–23.2 μm,液滴培养48 h保持稳定;然后,将生成的W1/O液滴重注入商业化的Dolomite双层乳化液滴生成芯片生成均一的W1/O/W2双层乳化液滴,液滴生成速度约1 000个液滴/s,直径约30 μm。相比已报道的在一个芯片内完成双层液滴制备的方法[16-20],本文制备双乳化液滴不需要复杂的芯片制备和表面修饰处理,操作过程简单,液滴生成速度快,且生成的液滴性能稳定,在液滴内细胞可以繁殖生长和表达外源蛋白,适用于后期的细胞筛选应用。使用的W1/O/W2双层乳化液滴生成芯片为商业化芯片,易于实现和推广。该W1/O/W2双层乳化液滴生成方法与FACS的结合应用,将有利于扩展高通量筛选的应用范围,对开展定向进化等研究具有重要的应用指导价值。
[1] Mastrobattista E, Taly V, Chanudet E, et al. High-throughput screening of enzyme libraries:evolution of a β-galactosidase by fluorescence-activated sorting of double emulsions. Chem Biol, 2005, 12(12): 1291–1300.
[2] Joensson HN, Andersson-Svahn H. Droplet microfluidics—a tool for protein engineering and analysis. Lab A Chip, 2011, 11(24): 4144–4147.
[3] Ma FQ, Feng Y, Yang GY. Ultrahigh-throughput enzymatic screening method based on fluorescence-activated cell sorting and its applications. Progr Biochem Biophys, 2012, 39(4): 299–306 (in Chinese). 马富强, 冯雁, 杨广宇. 基于荧光激活细胞分选技术的超高通量酶活性筛选方法及其应用. 生物化学与生物物理进展, 2012, 39(4): 299–306.
[4] Griffiths AD, Tawfik DS. Miniaturising the laboratory in emulsion droplets. Trends Biotechnol, 2006, 24(9): 395–402.
[5] Taly V, Kelly BT, Griffiths AD. Droplets as microreactors for high-throughput biology. ChemBioChem, 2007, 8(3): 263–272.
[6] Griffiths AD, Tawfik DS. Directed evolution of an extremely fast phosphotriesterase bycompartmentalization. EMBO J, 2003, 22(1): 24–35.
[7] Aharoni A, Amitai G, Bernath K, et al. High-throughput screening of enzyme libraries: thiolactonases evolved by fluorescence-activated sorting of single cells in emulsion compartments. Chem Biol, 2005, 12(12): 1281–1289.
[8] Tu R, Martinez R, Prodanovic R, et al. A flow cytometry-based screening system for directed evolution of proteases. J Biomol Screen, 2011, 16(3): 285–294.
[9] Yang CG, Xu ZR, Wang JH. Manipulation of droplets in microfluidic systems. TrAC-Trend Anal Chem, 2010, 29(2): 141–157.
[10] Chen JS, Jiang JH. Droplet microfluidic technique: mirodroplets formation and manipulation. Chin J Anal Chem, 2012, 40(8): 1293–1300 (in Chinese). 陈九生, 蒋稼欢. 微流控液滴技术: 微液滴生成与操控. 分析化学, 2012, 40(8): 1293–1300.
[11] Xiao ZL, Zhang B. Droplet microfluidics: technologies and applications. Chin J Chromatogr, 2011, 29(10): 949–956 (in Chinese).肖志良, 张博. 基于液滴技术的微流控芯片实验室及其应用. 色谱, 2011, 29(10): 949–956.
[12] Baret JC, Miller OJ, Taly V, et al. Fluorescence-activated droplet sorting (FADS): efficient microfluidic cell sorting based on enzymatic activity. Lab A Chip, 2009, 9(13): 1850–1858.
[13] Wang BL, Ghaderi A, Zhou H, et al. Microfluidic high-throughput culturing of single cells for selection based on extracellular metabolite production or consumption. Nat Biotechnol, 2014, 32(5): 473–478.
[14] Gielen F, Hours R, Emond S, et al. Ultrahigh-throughput-directed enzyme evolution by absorbance-activated droplet sorting (AADS). Proc Natl Acad Sci USA, 2016, 113(47): E7383–E7389.
[15] Okushima S, Nisisako T, Torii T, et al. Controlled production of monodisperse double emulsions by two-step droplet breakup in microfluidic devices. Langmuir, 2004, 20(23): 9905–9908.
[16] Lim SW, Abate AR. Ultrahigh-throughput sorting of microfluidic drops with flow cytometry. Lab A Chip, 2013, 13(23): 4563–4572.
[17] Romanowsky MB, Abate AR, Rotem A, et al. High throughput production of single core double emulsions in a parallelized microfluidic device. Lab A Chip, 2012, 12(4): 802–807.
[18] Zinchenko A, Devenish SR, Kintses B, et al. One in a million: flow cytometric sorting of single cell-lysate assays in monodisperse picolitre double emulsion droplets for directed evolution. Anal Chem, 2014, 86(5): 2526–2533.
[19] Yan J, Bauer WAC, Fischlechner M, et al. Monodisperse water-in-oil-in-water (W/O/W) double emulsion droplets as uniform compartments for high-throughput analysis via flow cytometry. Micromachines, 2013, 4(4): 402–413.
[20] Li SB, Gong XQ, Mc Nally CS, et al. Rapid preparation of highly reliable PDMS double emulsion microfluidic devices. RSC Advances, 2016, 6(31): 25927–25933.
[21] Yuan HL, Dong LB, Tu R, et al. Micro-droplet characterization and its application for amino acid detection in droplet microfluidic system. Chin J Biotech, 2014, 30(1): 139–146 (in Chinese). 袁会领, 董立兵, 涂然, 等. 液滴微流控芯片系统中微液滴特性表征及氨基酸检测应用. 生物工程学报, 2014, 30(1): 139–146.
Rapid generation of double-layer emulsion droplets based on microfluidic chip
Likuan Bai1,2*, Huiling Yuan2*, Ran Tu2, Qinhong Wang2, and Erbing Hua1
1 College of Biotechnology, Tianjin University of Science & Technology, Tianjin 300457, China 2Key Laboratory of Systems Microbial Biotechnology, Tianjin Institute of Industrial Biotechnology, Chinese Academy of Sciences, Tianjin 300308, China
compartmentalization (IVC) links genotype and phenotype by compartmentalizing individual genes (including expression system) or cells into a micro-droplet reaction region. Combined with fluorescence-activated cell sorting (FACS), it can detect and separate single droplets in ultra-high throughput. IVC-FACS screening method has been widely used in protein engineering, enzyme directed evolution, etc. However, it is difficult to control the homogeneity of droplet size by mechanical dispersion method in previous studies, which seriously affects the quantitative detection of droplets and reduces the efficiency and accuracy of this screening method. With the rapid development of microfluidic chip manufacturing technology, the microfluidic chip-based methods for droplet generation are becoming more efficient and controllable. In this study, firstly, the water-in-oil (W/O) single-layer droplet generation chip was used to prepare single-layer monodisperse W1/O droplets at a high generation frequency, and then the W1/O droplets were reinjected into water-in-oil-in-water (W/O/W) double-layer droplet generation chip to prepare uniform W1/O/W2 double-layer emulsion droplets. By optimizing the flow rate and ratio of the oil and water phases, a single-layer micro-droplet can be generated with a diameter range from 15.4 to 23.2 μm and remain stable for several days under normal incubation. Then the single-layer droplets were reinjected into the double emulsion generation chip. By adjusting the flow rate of drop phase, oil phase and water phase, the double-layer emulsion droplets with a diameter range from 30 to 100 μm at a rate of 1 000 droplets/s could be obtained.embedded in the double-layer emulsion droplets could be cultured and induced for protein expression. This study lays a foundation for the establishment of a high-throughput screening method based on the droplet and flow cytometry.
compartmentalization, microfluidic chip, high-throughput, single cell, flow cytometry
10.13345/j.cjb.190525
November 25, 2019;
February 25, 2020
Supported by:Novo Nordisk-Chinese Academy of Sciences (NN-CAS) Research Fund (No. NNCAS-2015-6), Instrument Developing Project of the Chinese Academy of Sciences (No. YJKYYQ20170023), Tianjin Synthetic Biotechnology Innovation Capacity Improvement Project (No. TSBICIP-PTJS-003).
Ran Tu. Tel: +86-22-24828705; Fax: +86-22-84861950; E-mail: tu_r@tib.cas.cn
*These authors contributed equally to this study.
诺和诺德-中科院科学研究经费(No. NNCAS-2015-6),中国科学院科研装备研制项目(No. YJKYYQ20170023),天津市合成生物技术创新能力提升行动 (No. TSBICIP-PTJS-003) 资助。
2020-04-15
http://kns.cnki.net/kcms/detail/11.1998.Q.20200415.0935.001.html
白立宽, 袁会领, 涂然, 等. 一种基于微芯片快速生成双层乳化液滴的方法. 生物工程学报, 2020, 36(7): 1405–1413.
Bai LK, Yuan HL, Tu R, et al. Rapid generation of double-layer emulsion droplets based on microfluidic chip. Chin J Biotech, 2020, 36(7): 1405–1413.
(本文责编 陈宏宇)
