刺参体壁酶促溶性胶原蛋白的热变性
2022-06-02傅宝尚侯红漫张公亮毕景然
傅宝尚,侯红漫,张公亮,毕景然
(大连工业大学食品学院,辽宁 大连 116034)
刺参(),属棘皮动物门(Echinodermata),游走亚门(Eleutherozoa),海参纲(Holothuroidea),木盾手目(Aspidochlrota),刺参科(Stichopodidae),仿刺参属。刺参属于温带参种,是国内典型的海珍产品,产量大、营养价值高,主要分布在北太平洋的浅海区域。2020年,我国刺参养殖产量高达17.17万 t。
体壁是刺参主要可食用部分,由上皮组织、真皮结缔组织以及大量细小的钙质骨片组成。研究发现,刺参体壁在热加工过程中,存在着动态机械特性变化,其硬度和弹性等物理特性变化有着明显的温度-时间效应关系。低温加热时,刺参随着加热温度的升高或时间的延长,硬度继续降低,弹性持续上升;在高温加热时,刺参组织坍塌,最终变得软烂,降解,融化,失去原有形态。
刺参体壁中蛋白质(多肽)含量丰富,约占干刺参体壁质量的90%,其中70%以上为胶原蛋白。刺参体壁胶原蛋白属于I型胶原蛋白,分子质量一般约为300 kDa左右,是由2 条相同的(I)肽链和一条(I)肽链以氢键结合,互相缠绕形成的右手三股螺旋结构,即[(I)](I)。胶原蛋白分子的热变性温度()决定了其热稳定性,且胶原蛋白具有“可逆”或“不可逆”变性的双重特征。“可逆”变性主要表现为,胶原蛋白分子在低强度加热条件下,二级结构虽发生变化,但在冷却后又可复性成天然三螺旋结构,互相交联成网络结构。而“不可逆”变性指胶原蛋白分子多肽链在高强度的加热条件下直接降解,生成明胶,溶解度增大,从而失去原有形态。由此可见,刺参体壁的热力学动态机械变化可能与胶原蛋白的热变性行为有关。
本研究从刺参体壁中提取了酶促溶性胶原蛋白(pepsin-solubilized collagen,PSC),之后分别采用差示扫描量热、傅里叶红外光谱、圆二色谱、高效液相色谱(high performance liquid chromatography,HPLC)、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)技术研究刺参体壁PSC的热稳定性,并探究热处理后PSC的凝胶形成能力及凝胶过程中的分子间作用力,以期揭示刺参体壁胶原蛋白在热处理过程中的变化机理。
1 材料与方法
1.1 材料与试剂
刺参购自辽宁大连当地海鲜市场。
异丙醇、硫酸钠、丙二醇(propylene glycol,PG)、二硫苏糖醇(1,4-dithiothreitol,DTT)、-乙基马来酰亚胺(-ethylmaleimide,NEM) 生工生物工程(上海)股份有限公司;丙烯酰胺、,-亚甲基双丙烯酰胺、,,,-四甲基乙二胺、电泳标准蛋白Marker大连宝生物科技有限公司;乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)、NaCl、DO、盐酸、氢氧化钠、乙酸及其他试剂(均为分析纯) 天津市天河化学试剂厂。
1.2 仪器与设备
差示扫描量热仪 法国塞塔拉姆仪器公司;J-810圆二色光谱仪 日本分光公司;傅里叶红外光谱仪 美国珀金埃尔默公司;SCL-10AVP高效液相色谱仪 日本岛津公司;电泳仪、MF-ChemBIS 2.0凝胶成像仪 日本ATTO公司;TA.XT.plus食品物性测试仪 北京微讯超技仪器技术有限公司。
1.3 方法
1.3.1 刺参体壁PSC的提取
取刺参100 g(去除内脏,清洗干净),加入去离子水后匀浆,13 600 r/min离心10 min,弃去上清液。取得沉淀,加入1 L Tris-HCl缓冲液(0.1 mol/L,pH 8.0,含5 mmol/L EDTA,0.5 mol/L NaCl)搅拌过夜。13 680 r/min离心10 min后取沉淀,加入去离子水清洗至中性后,再加入0.8 L去离子水,搅拌72 h。将悬浮液9 500 r/min离心5 min,得到的上层清液为含粗胶原纤维的混合溶液。17 300 r/min离心30 min取沉淀,按料液比1∶500(g/mL)加入0.1 mol/L NaOH溶液,搅拌72 h(其间每隔24 h换一次溶液)。17 300 r/min再次离心10 min后取沉淀,加去离子水反复清洗至中性后,冻干得粗胶原纤维。
将冻干的粗胶原纤维溶于0.5 mol/L乙酸溶液,料液比1∶500(g/mL),加入胃蛋白酶(加酶量为底物质量的14%),搅拌72 h。17 300 r/min离心20 min,取上清液。向上清液中缓慢加入4 mol/L NaCl溶液,直至浓度达到0.8 mol/L,静置过夜。13 600 r/min离心5 min取沉淀。将沉淀溶于少量0.5 mol/L乙酸溶液中,透析48 h(透析液为0.02 mol/L NaHPO-NaHPO)。13 600 r/min离心20 min后取沉淀,经冻干得到PSC。
1.3.2 刺参体壁PSC变性温度的测定
向0.012 5 g PSC冻干样品中加入250 µL去离子水,以250 µL去离子水为空白,应用差示扫描量热仪对其变性温度()进行测定,升温速率为1 ℃/min。
1.3.3 热处理过程中刺参体壁PSC结构变化分析
1.3.3.1 圆二色谱分析
以0.2 mol/L乙酸溶液配制PSC悬浊液(终质量浓度为0.02 mg/mL),分别于4、20、30、40、50、60、70、80、90、100 ℃保温2 h后进行圆二色谱测定,扫描范围190~260 nm,分辨率2 nm,扫描速率100 nm/min,狭缝宽度2 nm,响应时间0.5 s。
1.3.3.2 傅里叶红外光谱分析
以DO配制PSC悬浊液,终质量浓度为0.5 g/L,注入CaF液体池中加热,以5 ℃为初始温度,1 ℃/min匀速升温,每上升5 ℃恒温10 min,并进行傅里叶红外光谱测定(分辨率2 cm,测定范围4 000~400 cm),直至70 ℃。选取酰胺I带(1 700~1 600 cm)区域进行红外图谱分析。以1 700 cm和1 600 cm两波数点为基点进行基线相互校正。采用Omnic 6.0软件(Thermo Electron Corporation,Madison,WI,USA)对谱图进行平滑(平滑系数为5,峰宽9.642 cm)及傅里叶自去卷积处理(峰宽36.5 cm,分辨增强系数2.6)。
1.3.4 热处理过程中刺参体壁PSC降解作用分析
1.3.4.1 HPLC分析
以0.01 mol/L NaHPO-0.1 mol/L NaSO缓冲溶液(含0.1 g/L SDS)制备终质量浓度为1 mg/mL的PSC溶液,分别于20、40、60、80、100 ℃保温2 h后,13 680 r/min离心30 min,取上清液过0.45 μm水系膜,采用HPLC法确定PSC热处理过程中分子质量的变化规律,以未加热样品作为对照组。TSK-gel G4000-SWxl(7.8 mm×30.0 cm)凝胶过滤色谱柱,进样量10 μL;进样质量浓度1 mg/mL;检测波长220 nm;流动相为0.01 mol/L NaHPO-0.1 mol/L NaSO缓冲溶液(含0.01 g/L SDS);洗脱流速0.7 mL/min。分子质量标准品分别选用肌球蛋白(200 kDa)、-半乳糖苷酶(116 kDa)、磷酸酶b(97.2 kDa)、牛血清蛋白(66.4 kDa)、卵清蛋白(43 kDa),分子质量标准曲线为=-0.081 5+6.170 5(=0.996 9),式中:为保留时间/min,为分子质量的对数值(lg Da)。
1.3.4.2 SDS-PAGE分析
将PSC样品溶于上样缓冲液(8 mol/L尿素,0.5 g/L SDS,0.5 g/L-巯基乙醇,250 mmol/L pH 7.5 Tris-HCl),终质量浓度为1 mg/mL,分别于4、20、30、40、50、60、70、80、90、100 ℃保温2 h后,13 680 r/min离心30 min,取10 μL上清液进行垂直板SDS-PAGE。5%浓缩胶(7.5 mA),7%分离胶(15 mA),采用SDSTris-甘氨酸系统为电极缓冲液,电泳完毕后,加入75%考马斯亮蓝-乙酸-甲醇溶液染色液振荡染色过夜后,SDSPAGE脱色液(50%乙醇、9%冰乙酸)脱色,直至条带清晰,应用Bio-lmaging Systems MF-ChemBIS 2.0的凝胶成像仪成像。
1.3.5 热处理后刺参体壁PSC凝胶强度测定
将0.012 5 g PSC溶于250 μL超纯水,分别于20、30、40、50、60、70、80、90 ℃和100 ℃加热2 h后,4 ℃垂直静置24 h,以未加热样品作为对照组。采用食品物性测试仪TA.XT.plus测定凝胶强度并利用下式计算相对凝胶强度,P/5探头,高度设定为20 mm,下行18 mm,下行速率0.5 mm/s,上行速率10 mm/s。

1.3.6 刺参体壁PSC凝胶过程中的分子间的作用力
将0.012 5 g PSC分别加入到250 μL不同含量NEM、DTT、SDS、PG、尿素及NaCl溶液中。70 ℃加热2 h后,4 ℃垂直静置24 h,采用食品物性测试仪测定凝胶强度并计算相对凝胶强度。
1.4 数据分析
以上实验均至少3 组平行。所得数据采用SPSS 25.0进行显著性分析(<0.01,差异显著),并利用Origin 9.0和Excel 2010软件作图。
2 结果与分析
2.1 刺参体壁PSC的变性温度
刺参体壁中的胶原蛋白为I型胶原蛋白,由-链-异三聚体链接形成的三螺旋结构组成。三螺旋构象的特征在于重复的甘氨酸-脯氨酸-羟脯氨酸(Gly-Pro-Hyp)骨架,其中Pro和Hyp都配备了环状结构,可有效增强胶原结构的稳定性,另外,Hyp的羟基也可提供有助于稳定三螺旋构象的氢键。因此,胶原分子结构的稳定主要靠-链链间和链内氢键维持。但胶原蛋白对热极为敏感,并且会根据温度环境发生不同的结构变化,一般,胶原蛋白在剧烈受热(加热温度高于变性温度)时,氢键易发生断裂,三螺旋结构受损。如图1所示,刺参体壁PSC的变性温度为35.3 ℃,说明刺参体壁PSC在温度高于35.3 ℃受热时,维持其三股螺旋结构稳定性的非共价结合力将减弱,胶原分子解缠绕,分子结构将从有序折叠态变为无规卷曲态,天然构象被破坏。

图1 刺参体壁PSC的差示扫描量热结果Fig.1 Differential scanning calorimetric analysis of PSC from the body wall of sea cucumber
2.2 热处理过程中刺参体壁PSC结构变化
胶原三螺旋结构的圆二色谱特征一般是在225 nm附近有一个正吸收峰,在197 nm附近有一个负吸收峰,但吸收峰的位置会随着氨基酸序列和长度的变化发生偏移。对不同温度处理过的刺参体壁PSC进行圆二色谱测定,结果如图2所示,对照组PSC样品具备完整的三螺旋结构,在220 nm处存在正吸收峰,在197 nm存在强烈的负吸收峰。在低于35 ℃处理条件下加热PSC,样品吸收峰几乎无变化,说明此时刺参体壁PSC三螺旋结构仍保持良好;当温度达到35 ℃后,PSC的三螺旋结构开始解缠绕,从而转变为松散的3 条亚基链,正吸收峰完全消失。这一结果与段蕊等研究链鱼鳞胶原蛋白加热过程中圆二色谱图的变化类似,当加热温度超过变性温度时,胶原蛋白的螺旋分子中不稳定区域的螺旋发生松散,从而引起圆二色谱吸收峰值的变化。
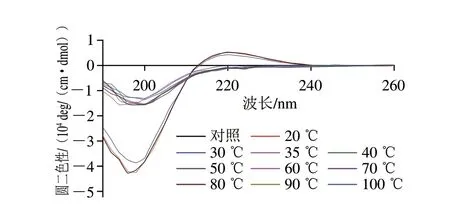
图2 刺参体壁PSC在热处理过程中的圆二色谱Fig.2 Circular dichroism analysis of PSC from the body wall of sea cucumber
如图3A所示,PSC的特征结构吸收峰包括3 305、3 082、1 657、1 559 cm以及1 242 cm,分别归属于酰胺A带N—H伸缩振动(氢键)、酰胺B带N—H非对称和对称伸缩振动、酰胺I带C=O伸缩振动和N—H弯曲振动、酰胺II带N—H弯曲振动和C—N伸缩振动,以及酰胺III带由蛋白酰胺键C—N伸缩振动和N—H变形及甘氨酸中—CH基团和脯氨酸侧链的摇摆振动。
红外谱图中酰胺I带可以良好地表现胶原蛋白三螺旋结构的变化,因此本研究在刺参体壁PSC热处理过程红外谱图数据分析的过程中,只选取了1 700~1 600 cm波段的数据进行了具体分析。如图3B所示,可发现刺参体壁PSC在连续加热过程中酰胺I带吸收强度随温度变化而变化,且峰形随加热温度的增大变得平缓且蓝移,由此推测,随着温度的升高,刺参体壁PSC的三螺旋结构遭到破坏。当加热温度超过35 ℃时,即超过变性温度,胶原蛋白二级结构遭到破坏,其中归属于-螺旋结构伸缩振动的1 656 cm处峰值降低最为剧烈,因温度越高,胶原蛋白变性程度越大,分子内各种次级键被破坏,高度有序的螺旋结构向无规卷曲转变。

图3 PSC的红外光谱图(A)和在连续加热过程中1 700~1 600 cm-1波段红外光谱二阶导图谱(B)Fig.3 FTIR spectra of PSC (A) and second derivative spectra at 1 700-1 600 cm-1 of PSC during heating (B)
2.3 热处理过程中刺参体壁PSC降解作用
采用HPLC对刺参体壁PSC降解规律进行分析发现(图4A),PSC未处理组样品分子质量主要分布范围为362.4~244.4(7.5~9.6 min)、210.3 kDa(10.4 min)及141.8 kDa(12.5 min)。根据文献报道,胶原的基本结构是由分子质量为360 kDa的巨型原胶原蛋白分子组成,该分子由3 条-链组成的三股螺旋构象(即胶原域),每条-链大约有1 000 个氨基酸残基,分子质量约为120 kDa。由此可见,PSC中包含-链、-链(双-链折叠)及链(3 条-链交联)3 种结构。当加热温度为20~40 ℃时,PSC的分子质量几乎无变化,说明PSC仍良好持有原有分子构象。当加热温度升至60 ℃时,HPLC图谱中7.5~12.5 min处吸收峰显著降低,在17.8 min处出现明显吸收峰,说明受热影响,-链和-链逐渐解旋,-链开始降解,生产小分子物质(约5.2 kDa);当温度达到80 ℃时,PSC样品中多链结构已完全解缠绕;100 ℃时,PSC的大分子基本结构特征已不存在,全部降解为7.6 kDa的多肽物质。
如图4B所示,进一步采用SDS-PAGE对刺参体壁PSC进行分析,同样发现PSC结构中包含-链、-链及-链。60 ℃加热时,PSC样品中氢键受热断裂,-链开始解缠绕,条带颜色变浅;当加热温度达到70 ℃时,由双-链折叠形成的-链开始水解;80 ℃时,-链、-链已完全消失,且-链中氢键也受热破坏严重,降解作用显著;加热温度达90 ℃时,与HPLC结果一致,PSC的大分子肽链结构已不存在,推测可能已完全降解为小分子肽,但由于分离胶的浓度较低,所以未能检出。综合以上结果说明,加热温度超过变性温度35.3 ℃时,PSC三螺旋结构开始解旋;当加热温度超过70 ℃时,-肽链逐渐降解成小分子多肽。

图4 PSC在不同加热温度下的降解程度Fig.4 Degradation of PSC during heating
2.4 热处理后刺参体壁PSC的凝胶强度
对刺参体壁PSC经不同温度加热后的凝胶形成能力进行分析(图5)发现,当加热温度低于40 ℃时,PSC的凝胶强度虽显著增强,但增强幅度较小(<20%)。根据文献报道,当加热温度低于变性温度时,可触发胶原单体自发的原纤维生成过程。一般情况下,胶原原纤维的形成是胶原的固有行为,且胶原单体的自组装过程基本符合成核和传播模型理论。核区是由有限数量的胶原分子聚集形成,然后随着长度和直径的增长发展成成熟的原纤维。但这种热驱动的聚集过程与水在胶原分子周围迁移所产生的熵有关,即随温度的升高,胶原蛋白聚集性越强,因此,相邻胶原分子非极性区域之间的疏水相互作用将逐渐受限,凝胶强度难以大幅提高。当PSC经40~70 ℃加热后冷却,凝胶强度显著增强,其中经70 ℃加热处理后的PSC样品凝胶强度达到最大,这可能是因为当加热温度超过变性温度后,胶原蛋白的氢键和共价键被切断,导致三螺旋结构的展开,随着二级结构-螺旋到无规卷曲的转变,胶原蛋白转化为可溶性明胶。通过不断的解聚和延伸,分子位点上的含硫氨基酸逐渐暴露出来。之后,当温度回到变性温度以下时,水解的胶原蛋白通过二硫键的相互作用发生不可逆的聚集,从而形成具有三维网络的稳定凝胶。
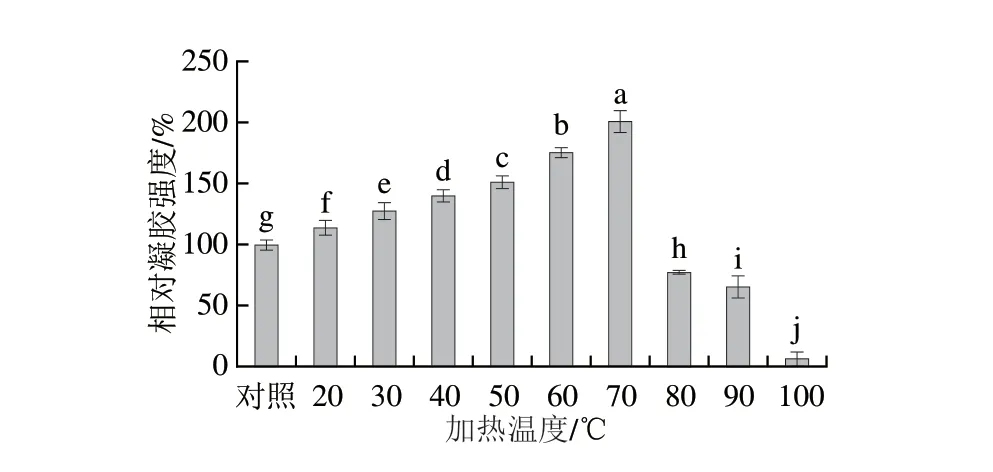
图5 刺参体壁PSC经不同温度加热所制备凝胶的相对凝胶强度Fig.5 Relative gel strength of heat-induced gels of PSC from sea cucumber body wall at different temperatures
2.5 刺参体壁PSC凝胶过程中的分子间作用力
凝胶体系通常靠氢键、离子相互作用、疏水相互作用、二硫键等不同的分子间作用力或组合维系。本研究分别采用尿素破坏PSC凝胶过程中氢键的相互作用,以SDS、PG破坏疏水键的作用,以DTT和NEM还原二硫键,利用NaCl增强离子键作用。如图6所示,在添加了NEM、DTT、尿素及NaCl后,PSC的凝胶强度随显著减弱;而添加SDS和PG的PSC凝胶体系的凝胶强度显著增强,说明在PSC凝胶形成过程中主要依靠疏水键、氢键、二硫键及静电斥力的相互作用。二硫键是胶原蛋白热诱导凝胶形成的主要化学键之一,凝胶化过程中胶原蛋白头部的二硫键在凝胶形成的过程中起重要作用。Zhong Chan等发现胶原蛋白具有由12 个保守半胱氨酸残基形成的6 个二硫键,具备稳定胶原结构的重要作用,而通过内源性基质金属蛋白酶诱导,可引起I型胶原的明胶水解和降解;此外,Omura等利用葡萄糖氧化酶的作用增加鱼糜凝胶中二硫键含量,从而提升凝胶效果。氢键是胶原蛋白凝胶中数量极大且对凝胶强度影响最为重要的弱偶极键。根据王嵬等报道,在受热过程中,PSC肽骨架结构中本用于维持空间结构稳定性的羰-酰胺基团间的氢键可能发生断裂,二级结构被破坏,冷却时,PSC通过广泛的水合作用,重新生成氢键,从而再次建立稳定的蛋白质构象。除此之外,PSC在受热过程中,肽链舒展,大量的非极性基团暴露于水中,而这些疏水结构附近的水分子通过分子间氢键定向排列,使得溶胶体系变得有序化,从而引起胶原分子的凝集,在复冷条件下形成凝胶体系。此外,由于胶凝的聚集过程受疏水作用的影响,静电相互作用在胶原蛋白质聚集过程中通常表现为静电斥力。


图6 PSC在不同溶液中形成凝胶的相对凝胶强度Fig.6 Relative gel strength of gels formed from PSC in different solutions
3 结论与讨论
海参体壁是典型的可变胶原结缔组织,可通过调节加热强度控制肌肉组织的质构特性,因此,探究海参胶原蛋白的热变性及凝胶规律对提升海参加工品质具有重要意义。通过对刺参体壁PSC受热过程中性质变化研究发现,PSC变性温度为35.3 ℃。当加热温度低于变性温度时,PSC仍可保持良好的三螺旋结构。当PSC受热温度为40~70 ℃时,PSC三螺旋结构逐渐解缠绕,二级结构虽然受损,但-肽链仍可在冷却过程中依靠分子间氢键和二硫键的相互作用重新交联,形成强凝胶体系,且凝胶强度随加热温度的升高而增强;当加热温度为80~100 ℃时,PSC三螺旋结构解旋完全,-肽链降解为小分子多肽,且冷却后难以所形成强凝胶体系,凝胶强度随加热温度的升高而下降。由以上结果可知,海参热加工过程中,若加热温度为40~70 ℃时,冷却后的海参仍可保持良好的机械性能;而过高的热处理温度(>80 ℃)极有可能导致海参丧失良好的弹性及咀嚼性。
海参体壁热加工过程中涉及粗胶原纤维的解旋、水解,胶原蛋白分子的降解、聚集及玻璃化转化等多种化学过程。本研究针对刺参体壁酶溶性胶原蛋白的热变性进行研究,并获得了相应的结果,为研究海参热加工提供了有力的依据,但存在科学问题需进一步探索:1)海参体壁结构中除具有胶原蛋白外,还存在大量的黏多糖成分,可利用红外光谱、圆二色谱等技术,原位探究黏多糖-胶原蛋白动态互作关系;2)在胶原蛋白溶胶-凝胶过程中,水合作用的消减及增强起到了重要影响,因此,亟需探究胶原蛋白凝胶形成过程中水分子的动态分布规律。
