响应面法优化替考拉宁发酵培养基及其扩大培养
2022-05-30郄丽萍姜明星葛鹍鹏随子华赵鹏鹏马婕张雪霞吴达
郄丽萍?姜明星?葛鹍鹏?随子华?赵鹏鹏?马婕?张雪霞?吴达
摘要:目的 通过响应面法,优化替考拉宁发酵培养基,并对发酵工艺参数进行优化,来提高其发酵产量。方法 以游动放线菌TC19-3p-103为试验菌株,采用单因素试验确定发酵培养基考察因素的参考范围;利用最陡爬坡试验确定响应面试验的中心区域;利用Box-Behnken响应面法,确定了发酵培养基中的有机氮源最佳浓度组合;并对起始搅拌转速与通气量这两个发酵工艺参数进行单因素考察;在发酵过程中,采用流加技术控制碳源浓度。结果 经优化的发酵培养基,其摇瓶产量提高了31.6%;50L罐发酵工艺参数优化后,发酵水平达到8558 mg/L。 结论 优化后的发酵工艺,显著提高了替考拉宁的产量,为其工业化生产奠定了基础。
关键词:替考拉宁;响应面法;发酵工艺;
中图分类号:R978.1文献标志码:A
Response surface methodology to optimize the fermentation medium
of teicoplanin and its expanded culture
Qie Li-ping1, Jiang Ming-xing2, Ge Kun-peng1, Sui Zi-hua2, Zhao Peng-peng1, Ma Jie1, Zhang Xue-xia1, and Wu Da2
(1 National Engineering Research Center of Microbial Medicine, Hebei Industry Microbial Metabolic Engineering & Technology Research Center, New Drug Research & Development Company of NCPC , Shijiazhuang 050015;
2 Huasheng Company of NCPC, Shijiazhuang 050015)
Abstract Objective To optimize the fermentation medium of teicoplanin by response surface methodology and optimize the fermentation process parameters to increase its fermentation yield. Methods The Actinoplanes teichomyceticus TC19-3p-103 was used as the test strain. The single factor test was used to determine the reference range of the fermentation medium to investigate factors. The steepest climbing test was used to determine the central area of the response surface test. The Box-Behnken response surface method was used to determine the optimal concentration combination of organic nitrogen sources in the fermentation medium. The two fermentation process parameters, the initial stirring speed and aeration rate, were investigated by a single factor. The fed-batch technology was used to control the concentration of the carbon source in the fermentation process. Results The optimized fermentation medium increased the shake flask yield by 31.6%. After the optimization of the fermentation process parameters in the 50 L tank, the fermentation level reached 8,558 mg/L. Conclusion The optimized fermentation process has significantly increased the production of teicoplanin and laid the foundation for its industrial production.
Key word Teicoplanin; Response surface analysis; Fermentation process
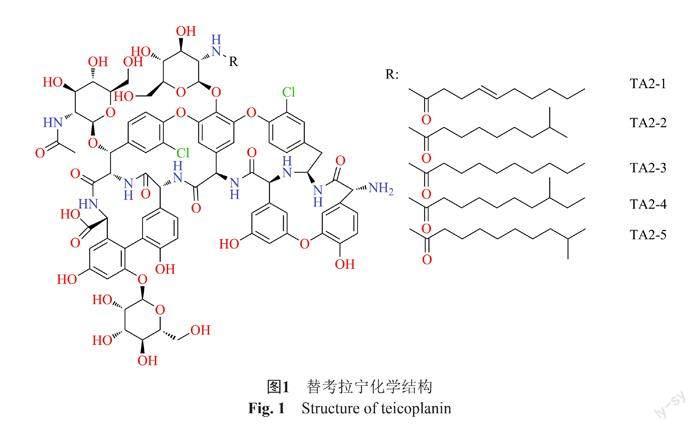
替考拉寧是Parenti等在游动放线菌(Actinoplanes teichomyceticus)的发酵液中发现的发酵产物,是由结构十分相近的5个主要组分(TA2-1,TA2-2,TA2-3,TA2-4,TA2-5),以及另外一个活性组分(TA3-1)组成,主要组分的差异仅在于酰基侧链的不同,都是替考拉宁的有效成分,其化学结构如图1。替考拉宁分子中的部分氨基酸以乙酸盐和酪氨酸为生物合成前体,而5个主要组分所差异的酰基侧链则分别以亚油酸、L-缬氨酸、油酸、异亮氨酸和亮氨酸为前体衍生而来[1-3]。
替考拉宁是继万古霉素、去甲基万古霉素后发现的另一种抗耐药菌的糖肽类抗生素[4],替考拉宁通过与D-丙氨酰D-丙氨酸残基特异性结合,阻断细菌细胞壁中肽聚糖的合成,从而抑制和杀灭细菌。Boast等[5]指出,替考拉宁与万古霉素的抗菌谱相似,但肾毒性风险比较低,其导致红人综合征极为罕见,这些优势也促进了其在儿科的应用。
培养基优化是提高产量的重要手段之一。王德森等[6]采用单因素和正交试验研究发酵培养基组成,探讨了摇瓶发酵的主要影响因子,优化后的发酵水平较原工艺提高40%;邹昆等[7]通过响应面CCD方法优化替考拉宁发酵培养基,产量提高23.3%。本研究是针对本实验室诱变获得的新高产突变菌进行培养基及发酵工艺优化,解决发酵培养基放大中存在的问题,提高发酵水平,降低生产成本,实现放大生产的目的。
1 材料与方法
1.1 菌株
菌株:游动放线菌(Actinoplanestei chomyceticus)TC19-3p-103 本实验室保存
1.2 培养基
1.2.1 斜面培养基(g/L)
可溶性淀粉10,K2HPO4 1, MgSO4·7H2O 1, NaCl 1,(NH4)2SO4 2,CaCO3 2 ,FeSO4·7H2O 0.001,MnCl2.7H2O 0.001,琼脂16,pH 7.2。
1.2.2 种子培养基(g/L)
淀粉20,葡萄糖5,蛋白胨10,玉米浆5,KH2PO4 0.2,CaCO3 3,pH 7.2。
1.2.3 发酵培养基(g/L)
淀粉40,葡萄糖10,棉籽饼粉6,酵母粉10,玉米浆10,缬氨酸0.5,KH2PO4 0.2,CaCO3 3,pH 6.5。
1.3 培养方法
1.3.1 斜面培养
取0.1 mL经过快速解冻的甘油管保藏的孢子悬液于中管斜面上,涂布均匀,28℃培养,8~10 d。
1.3.2 种子瓶培养
从中管斜面上挖取成熟培养物接入250 mL三角瓶中,装料量40 mL;摇床转速220 r/min,培养2 d。
1.3.3 发酵瓶培养
从种子瓶中吸取2~3 mL培养成熟的种子液接入250 mL三角瓶中,装料量40 mL,摇床转速220 r/min,培养7~8 d。
1.3.4 50 L罐发酵培养
50 L发酵罐(上海国强生化工程装备有限公司)。采用二级发酵,中管斜面菌种挖块半支,接种于种子培养基中(150 mL/1000 mL三角瓶),28℃,220 r/min振荡培养48 h。发酵罐装料量为30 L,接种量为5%,培养温度28℃,培养周期8 d。
1.4 分析方法
1.4.1 产物检测采用HPLC分析方法
取5 mL发酵液,加入等体积的无水乙醇摇匀浸泡1 h,3000 r/min离心10 min,取上清,纯化水稀释至适当浓度,进行HPLC分析。
色谱条件:Kromasil C18(4.6 mm×250 mm,5 μm)柱;流动相A为0.02 mol/L乙酸铵;流动相B为纯乙腈;梯度洗脱:流动相A 0~9 min 82%→68%,9~9.5 min 68%~82%,9.5~15 min 82%;检测波长254 nm;柱温40℃;进样量10 μL,进样速度1 mL/min。
1.4.2 菌浓测定
取10 mL发酵液置于离心管中,3000 r/min离心10 min,计算固形物体积占发酵液的比例。
1.4.3 残总糖测定
残总糖测定采用斐林试剂法。
1.4.4 氨氮测定
氨氮测定采用甲醛法。
1.5 培养条件优化方法
1.5.1 单因素试验优化
单因子包括酵母粉、棉籽饼粉和玉米浆。采用单因素试验,考察各因素对发酵水平的影響,以确定各因素适合替考拉宁合成的参考范围。
1.5.2 最陡爬坡法及Box-Behnken设计法优化
在单因素的基础上,对3种有机氮源采用最陡爬坡法进行优化;并应用基于Box-Behnken设计的响应曲面法进行试验,以有效提高配方优化的效率。BBD法优点是应用于因素数在3~7个内的试验;试验次数为15~62次,在因素数相同时比中心复合设计所需的试验次数少。
1.5.3 50 L罐发酵工艺优化方法
采用单因素法对搅拌转速、通气量进行考察。对碳源采用流加的方法,控制其在亚适量范围,提高发酵产量。
2 结果与分析
2.1 发酵培养基优化
2.1.1 单因素考察有机氮源含量对发酵的影响
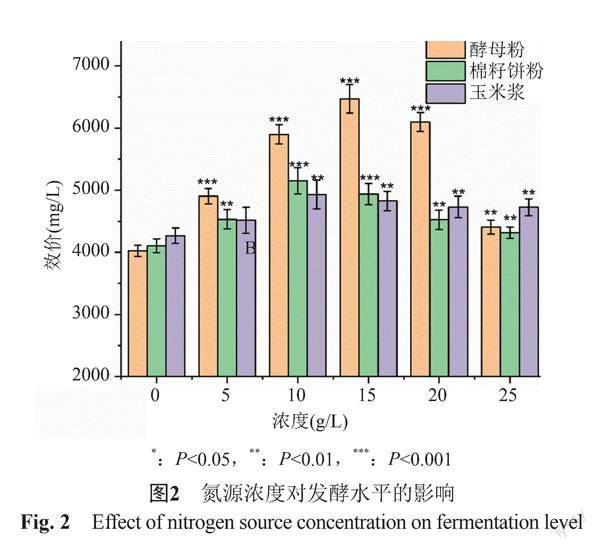
对原基础配方中3种氮源,酵母粉、棉籽饼粉、玉米浆进行单因素摇瓶实验,考查其对替考拉宁发酵的产量的影响。每个实验组设置3个平行,取平均值。结果见图2。
由图2可知,原基础配方中逐步增加酵母粉含量,替考拉宁发酵水平提高最显著;3种氮源对发酵影响显著性的顺序为:酵母粉>棉籽饼粉>玉米浆。酵母粉组菌丝量达到35%;棉籽饼粉组菌丝量达到28%;玉米浆组菌丝量达到26%。摇瓶放瓶菌丝量也是酵母粉组最高。
2.1.2 最陡爬坡试验确定各因子的浓度范围
响应面拟合方程只有在考察的临近区域里才能充分近似真实情况,通过爬坡试验来实现逼近具有最大值的响应区域。根据“2.1.1”单因素考察的结果,确定酵母粉、棉籽饼粉和玉米浆3个因素取值范围和变化步长,做最陡爬坡实验。结果见表1。酵母粉逐渐增大,棉籽饼粉和玉米浆逐渐减少,替考拉宁的产量沿着1到3的路径增加,第3组到达最高点7509 mg/L,然后沿着4至5的路径下降,即较好水平在试验3附近。因此,以第3组各因素水平为中心值作为BBD的中心点进行RSM试验设计。
2.1.3 响应面Box-Behnken实验设计
根据单因素和最陡爬坡试验结果,采用响应面BBD对显著影响产量的3个有机氮源因素(酵母粉,棉籽饼粉,玉米浆)的最佳水平及相互作用进行考察,X1、X2、X3为酵母粉、棉籽饼粉、玉米浆的编码。表2~3为BBD实验设计及其结果。
经Design-Expert12软件拟合,各因素对替考拉宁产量的编码值回归方程如下:
替考拉宁产量=7730+345.75X1+259.25 X2+173.00X3-209.00 X1X2+78X1X3+73.50X2X3-337.75X12-502.75X22-396.75X32。回归方程的校正系数R2为0.9539,说明方程的拟合度良好,可有效预测替考拉宁产量的最优组合。
方差分析表见表4,一次项,二次项的P值<0.05,说明该模型显著;失拟项P值为0.0948,说明模型失拟项不显著,残差是随机误差所引起。
2.1.4 响应面交互作用分析
利用Origin2018软件绘制响应面曲线,通过分析相关变量之间的交互作用,从而确定最优解。酵母粉、棉籽饼粉、玉米浆的三维响应面及对应等高线如图3所示。X1X2、X1X3和X2X3的交互作用的响应面都是开口向下的凸面,说明试验浓度范围内响应值存在最优解。交叉项X1X2等高线呈椭圆形,則说明它们的交互作用对响应值影响显著[8]。交叉项X2X3,X1X3等高线接近圆形,说明其交互作用不明显,这与表4中P>0.05结果一致。
2.1.5 验证试验
通过进一步摇瓶实验对软件预测最优解进行验证。根据模拟方程,软件预测给出的最优解为7844 mg/L。各因素的取值分别为:酵母粉22.833 g/L、棉籽饼粉10.257 g/L、玉米浆10.601 g/L,发酵其他条件不变,共进行3批摇瓶试验。试验结果分别为7792、7880和7613 mg/L,均值为7761 mg/L。误差在1.0%,说明模型可靠,证明用单因素、最陡爬坡、响应面法优化替考拉宁的培养基方法可行。对比优化前后的发酵水平,提高幅度为31.6%。
2.2 发酵罐工艺优化
2.2.1 搅拌转速、通气量对发酵工艺的影响
采用单因素对起始搅拌转速、通气量进行实验考查。本实验分别设置100、150、200和300 r/min作为初始转速,发酵中后期采用控制溶氧达到30%~60%,控制转速;分别设置30、33、36和39 L/min通气量进行单因素试验。实验结果见图4~5。
从图4可以看出,发酵起始搅拌转速对替考拉宁发酵产量影响显著,随着起始搅拌转速的降低,发酵单位显著提高。在初始转速300 r/min时90 h罐上起沫严重。镜检菌丝状态发现,在高转速情况下发酵罐里菌丝状态是分散的菌丝,与摇瓶里的结微球状态不同。在100和150 r/min时菌丝生长为微球,与摇瓶状态一致。本实验表明替考拉宁产生菌在生长初期对搅拌的剪切力敏感,低搅拌转速可以减少剪切力对菌丝生长的影响,菌丝可以生长为微球状态。发酵中期因溶氧的需求提高搅拌转速,菌丝球受剪切力的影响变小,仍能保持自身状态。
由图5可以看出通气量对替考拉宁发酵产量同样影响显著,通气量30 L/min时效果最差,通气量36 L/min时,替考拉宁产量达到最高7284 mg/L,可作为优选条件。通气量也是改善发酵罐内溶氧的有效手段,其对菌丝状态影响小。搅拌和通气两者相辅相成为发酵过程提供一个适宜的溶氧环境。
2.2.2 碳源流加对发酵产量的影响
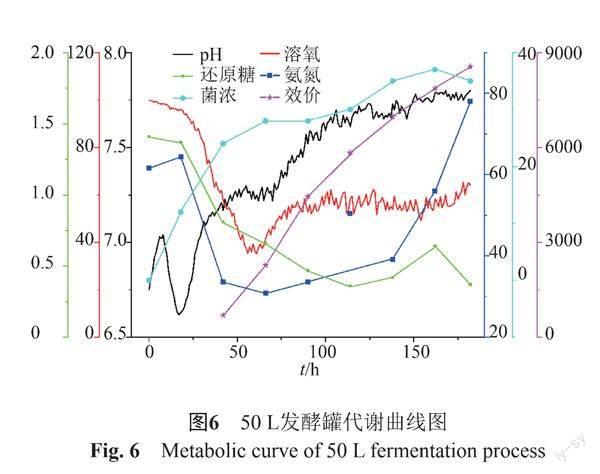
对发酵组分中的碳源采取流加技术,当还原糖的浓度低于12 g/L时,间歇性补入30%葡萄糖,控制还原糖的浓度在5~10 g/L。由图6可以看出,随着菌体生长到对数期后期,替考拉宁开始产生。菌丝生长进入平台初期,溶氧到达底部,替考拉宁已经开始大量合成。流加碳源,维持菌体生长的平台期,也就是维持替考拉宁的高效合成期,达到高产的目的。50 L发酵罐182 h放罐时替考拉宁产量达到8558 mg/L,进一步提高了17.5%。
发酵过程营养成分的浓度,对发酵进入次级代谢有显著地影响。营养成分浓度过高不仅对菌体的生长有一定抑制作用[9],还会延迟发酵进入次级代谢的进程。采用流加技术控制营养成分在亚适量范围,更有效地提高了后期菌体活力不足和产能下降的问题[10-14]。
3 结论
本研究基于摇瓶工艺的发酵培养基,对新菌种发酵放大进行研究。新菌种用原发酵培养基在发酵罐放大培养中表现为发酵中后期菌丝量下降、产抗能力后劲不足。考虑可能是原培养基氮源不足造成的发酵后期营养不足,造成菌体生长受限,菌体活性降低;同时菌球裂解,菌浓降低;从而严重影响到产物合成能力。经用单因素、最陡爬坡、响应面法对发酵培养基进行了优化,新培养基摇瓶产量提高了31.6%。由图6可以看出,新培养基在50 L罐上发酵中后期维持了适度的菌体浓度,分泌期延长,新菌种在生命的后期最大限度的合成和分泌次级代谢产物。
在发酵培养的不同时期,微生物对溶氧要求是不同的。往往在发酵中期,微生物处于旺盛生长时间,对氧的需要量较高;而在发酵初期和发酵后期微生物的需氧量较低。在发酵罐工艺优化中,发现替考拉宁产生菌对发酵罐剪切力敏感,降低初始搅拌转速对菌丝初期生长阶段的结球有利,同时对发酵产能有利。这与金志华[15]报道替考拉宁产生菌Actinoplanes teichomyceticus对剪切力较敏感一致通过对初始搅拌转速及通气量的优化,50 L罐发酵水平达到7284 mg/L。
采用流加技术控制碳源含量在亚适量范围,更有效地提高菌体的生物量和产量,50 L发酵罐的发酵水平达到了8558 mg/L,又提高了17.5%,取得良好的效果。50 L罐工艺开发的成功为替考拉宁进一步放大生产奠定了坚实的基础。
参 考 文 献
Malabarba A, Strazzolini P, Depaoli A, et al. Teicoplanin, antibiotics from Actinoplanes teichomyceticus nov. sp. Ⅵ. chemical degradation: Physicochemical and biological properties of acid hydrolysis products[J]. J Antibiot, 1984, 37(9): 988-999.
Ackermann B L, Regg B T, Colombo L, et al. Rapid analysis of antibiotic-containing mixtures from fermentation broths by using liquid chromatography-electrospray ionizationmass spectrometry anmatrixassisted laser desorption ionization time of fligh massspectrometry[J]. J Am Soc Mass Spectr, 1996, 7: 1227-1237.
Jin Z, Wang M, Cen P. Production of teicoplanin by valin analogue-resisitant mutant strain of Actionplanes teichomyceticus[J]. Appl Microbiol Biot, 2002, 58(1): 63-66.
吴亚铭. 新一代抗生素——替考拉宁[J]. 中国抗生素杂志, 1999, 24(增刊): 51.
Boast A, Gwee A, Gwee A. Teicoplanin should we be doing routine therapeutic drug monitoring in children[J]. Pediatr Infect Dis J, 2017, 36( 11): 1110.
王德森, 张祝兰, 唐文力, 等. 替考拉宁产生菌A .teichomycoticus FIM-37 发酵条件优化[J]. 药物生物技术, 2017, 24(4): 310-314.
邹昆, 张奇, 夏永登. 响应面法优化替考拉宁发酵培养基的研究[J]. 中国抗生素杂志, 2011, 36(9): 671-675.
Bhattacharjee K, Joshi S R. A selective medium for recovery and enumeration of endolithic bacteria[J]. J Microbiol Meth, 2016, 129: 44-54.
熊宗贵.发酵工艺原理[M]. 北京: 中国医药科技出版, 2003: 148-149.
徐瑶, 吴涛, 郭美锦, 等. 氮源对阿维菌素合成的影响及基于二氧化碳释放速率的阿维菌素发酵调控[J]. 生物工程学报, 2020, 36(2): 287-294.
陳凝, 王永红, 储炬, 等. 培养基成分和补料对阿维菌素发酵过程中除虫链霉菌菌丝形态的影响[J]. 华中农业大学学报, 2007, 26(4): 496-501.
李瑜, 李一萌, 杨丽, 等. 5 L发酵罐高密度培养番茄红素工程菌及其发酵调价优化[J]. 现代食品科技, 2020, 36(6): 137-146.
刘景阳, 刘云鹏, 徐庆阳. 谷氨酸全营养流加发酵新工艺[J]. 食品与发酵工业, 2021, 47(7): 14-20.
吴江, 洪文荣, 苏敏, 等. 酿酒酵母XM2-9流加发酵生产甲基硒代半胱氨酸[J]. 食品与生物技术学报, 2021, 40(7): 103-111.
金志华. 抗生素发酵的若干微生物及工程问题研究[D]. 杭州: 浙江大学, 2001.
收稿日期:2021-06-25
基金项目:河北省科技研发平台建设专项(No. 199676154H)
作者简介:郄丽萍,女,生于1974年,高级工程师,从事生物制药研究, E-mail: qieliping1993@163.com
*通讯作者,E-mail: wu-da@126.com
