亚抑菌浓度卡泊芬净对白念珠菌生物膜形成的影响及机制研究
2022-05-30谢珊珊陈烁叶梦思王施施陈华乐
谢珊珊 陈烁 叶梦思 王施施 陈华乐
摘要:目的 初步探讨亚抑菌浓度(sub-MIC)卡泊芬净对白念珠菌生物膜形成的影响,为清除生物膜策略的制定提供理论基础。方法 用微量肉汤稀释法测定卡泊芬净对白念珠菌的活性,并研究sub-MIC卡泊芬净对白念珠菌生长的影响;运用菌落计数、XTT染色和扫描电镜分析sub-MIC卡泊芬净作用下形成的白念珠菌生物膜特点;采用实时荧光定量RT-PCR测定Ece1,Can2,Hip1,GAP1,GCN4和Stp2等白念珠菌生物膜相關基因的mRNA表达水平。结果 12株白念珠菌对卡泊芬净的MIC值范围为0.625~0.875 μg/mL,sub-MIC卡泊芬净对白念珠菌的生长有不同程度的抑制作用。针对白念珠菌生物膜的形成,1/4 MIC和1/8 MIC卡泊芬净皆对生物膜中的菌体数量、菌体代谢活性及生物膜结构有抑制作用,而1/16 MIC卡泊芬净则对生物膜无明显影响。1/4 MIC和1/8 MIC卡泊芬净对白念珠菌生物膜相关基因的表达水平也具有抑制作用,1/16 MIC卡泊芬净则对基因表达水平无影响。结论 sub-MIC卡泊芬净对白念珠菌生物膜的形成有一定抑制作用。但白念珠菌在sub-MIC卡泊芬净作用下仍能形成生物膜,临床上需要谨防出现卡泊芬净处于亚抑菌浓度的情况。
关键词:白念珠菌;卡泊芬净;亚抑菌浓度;生物膜
中图分类号:R978.1 文献标志码:A
Influence and mechanism of caspofungin at sub minimal inhibitory concentration on the biofilm formation of Candida albicans
Xie Shan-shan1, Chen Shuo2, Ye Meng-si2, Wang Shi-shi2, and Chen Hua-le2
(1 Central Hospital of Wenzhou, Wenzhou 325000;
2 The Second Affiliated Hospital and Yuying Childrens Hospital of Wenzhou Medical University, Wenzhou 325000)
Abstract Objective To investigate the influence of sub minimal inhibitory concentration (sub-MIC) of caspofungin on the biofilm formation of Candida albicans, which may provide a theoretical basis for the strategies of removing biofilms in the future. Methods Susceptibility testing of C. albicans to caspofungin was determined using the broth microdilution method. Then we studied the impact of caspofungin at sub-MIC on the growth of C. albicans. In addition, colony counting, XTT staining, and scanning electron microscopy were performed to analyze the characteristics of C. albicans biofilms, which were under the action of caspofungin at sub-MIC. In addition, the expression levels of Ece1, Can2, Hip1, GAP1, GCN4, and Stp2 were analyzed by Real-time PCR. Results The MICs of twelve C. albicans strains to caspofungin were in the range of 0.625~0.875 μg/mL. We found that the growth of C. albicans was inhibited by different sub-MICs of caspofungin at varying degrees. As for the biofilm formation of C. albicans, both 1/4 MIC and 1/8 MIC of caspofungin had inhibitory effects on the number, metabolic activity of C. albicans cells within biofilm, and the structure of biofilm, while the biofilm seemed not to be significantly altered by 1/16 MIC of caspofungin. The expression levels of C. albicans biofilm formation-related genes (Ece1, Can2, Hip1, GAP1, GCN4 and Stp2) were significantly decreased when treated with 1/4 MIC or 1/8 MIC of caspofungin, but stayed the same after the treatment of 1/16 MIC caspofungin. Conclusion Sub-MIC of caspofungin had an inhibitory effect on the biofilm formation of C. albicans. However, the biofilm of C. albicans can still be formed under the action of caspofungin at sub-MIC. It is crucial to beware of the subinhibitory concentration of caspofungin, which may occur in clinical practice.
Key words Candida albicans; Caspofungin; Sub minimal inhibitory concentration; Biofilm
白念珠菌是医源性感染中最常见的真菌,在抗真菌药物使用的情况下,侵袭性念珠菌病病死率仍可高达40%左右[1-2]。白念珠菌的生物膜形成能力可使其耐药性提高100~1000倍,是常规药物治疗医源性感染失败的重要原因[3-4]。卡泊芬净是一种棘白菌素类抗真菌药物,研究显示它对大多数侵袭性念珠菌病的治疗均能取得良好的效果,且相较两性霉素B、氟康唑等,有不良反应轻、生物利用度等优势[5-6]。然而,有研究发现体外膜肺氧合,体内的炎症反应等因素均会降低卡泊芬净有效浓度,导致血药浓度处于亚抑菌浓度(sub-MIC)[7-8]。本文旨在通过提高对sub-MIC抗菌药物对白念珠菌生物膜形成作用的认识,为今后清除生物膜策略的制定提供理论基础。
本研究以临床分析的白念珠菌为研究对象,通过微量肉汤稀释法测定卡泊芬净对白念珠菌的活性,并研究sub-MIC卡泊芬净对白念珠菌的生长曲线及生物膜形成能力的影响。同时通过实时荧光RT-PCR检测Ece1,Can2,Hip1,GAP1,GCN4和Stp2等基因mRNA的表达水平,初步探讨sub-MIC抗菌药物对白念珠菌生物膜的影响。
1 材料和方法
1.1 菌株来源
本研究收集2018年1月—2019年6月温州医科大学附属第二医院临床分离的白念珠菌共11株(分別为B1、B2、B3、B4、B5、B6、B7、B8、V1、V2和V3),剔除了同一患者相同部位分离的重复菌株。所有菌株经Vitek 2 Compact全自动细菌鉴定仪鉴定,确定为白念珠菌。白念珠菌标准株DAY185野生型(WT)为质控菌株。
1.2 仪器和试剂
Vitek全自动细菌鉴定仪(法国梅里埃公司);荧光定量PCR仪(7500 real time PGR system, Applied Biosystems公司);DR100型比浊仪(法国生物梅里埃公司);细胞培养板(美国康宁公司);酶标仪(美国Biotek公司);扫描电镜(德国卡尔蔡司公司);JY96-IIN 超声波细胞破碎仪(上海沪析实业有限公司)。细菌总RNA提取裂解液RNAiso Plus trizol(TaKaRa大连有限公司);逆转录试剂盒(美国 Thermo Scientific RevertAid First Strand cDNA Synthesis Kit);实时荧光定量PCR检测试剂盒(日本Toyobo SYBR Green Realtime PCR Master Mix-Plus-);各种基因检测所用的PCR引物由上海生工生物工程有限公司合成。酵母浸出粉胨葡萄糖(YPD)肉汤培养基,沙保弱氏琼脂培养基,XTT,吩嗪硫酸甲酯和卡泊芬净均购自美谷生物科技(浙江)有限公司。
1.3 药敏试验
白念珠菌对卡泊芬净的药敏试验方法参照CLSI M27 A3中的微量肉汤稀释法,每株菌作3个复孔,24 h后存在肉眼可见的浑浊则结果判读为生长阳性。
1.4 生长曲线测定
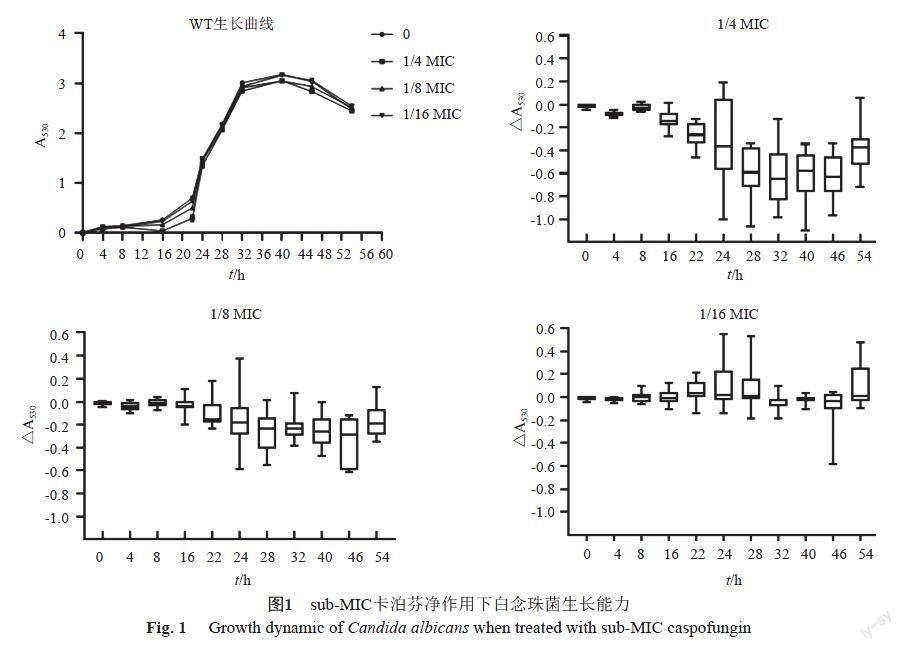
设1/4 MIC、1/8 MIC、1/16 MIC浓度卡泊芬净为实验组,卡泊芬净浓度为0作为对照组。白念珠菌初始接种量为1000 CFU/mL,分别于培养0、4、8、12、16、20、24、28、32、36、40、46和54 h时测取其在530 nm波长处A值,即A530。实验组与对照组白念珠菌的生长差异△A530=A530实验组-A530对照组。
1.5 菌落计数
活化白念珠菌后培养至对数生长期后期(24~30 h),
制成106CFU/mL菌悬液后取100μL分别加入终浓度0、1/4、1/8和1/16 MIC浓度卡泊芬净的细胞培养板中培养6h待其黏附,随后用PBS洗涤祛除未附着细胞。加入YPD培养基再培养48h,培养24 h时更换新鲜培养液,培养过程中保持各组培养体系中的卡泊芬净终浓度分别为0、1/4、1/8和1/16 MIC不变。培养结束后弃去上清并用PBS洗涤除去结合疏松的微生物,戴灭菌手套手动刮取生物膜重悬于含4 mL灭菌水的离心管中进行超声破碎分离生物膜。超声破碎参数为30 s,4次,42 kHz,全程冰浴中操作。最后于沙保弱培养基中培养48 h后进行菌落计数。
1.6 细胞代谢活性检测
如上所述培养各组白念珠菌生物膜,随后加入90 μL 0.75 mg/mL的XTT和10 μL 320 μg/mL的吩嗪硫酸甲酯处理30 min,使用全功能微孔板检测酶标仪测定450 nm处吸光度反映生物膜中细胞的代谢活性。
1.7 扫描电镜定性测定生物膜
将包被Na-EDTA血浆的无菌培养皿盖玻片置于无菌12孔细胞培养板中,加入106 CFU/mL对数生长期后期的白念珠菌菌液于30℃培养60min待其黏附,随后用PBS洗涤祛除未附着细胞。再加入1 mL YPD培养基,37℃,50 r/min培养20 h;培养结束用1 mL 2.5%戊二醛于4℃固定24 h,洗净后用1%四氧化锇在室温处理30 min。乙醇梯度浓度脱水后临界点干燥;镀金后用扫描电镜成像分析。
1.8 实时荧光定量RT-PCR
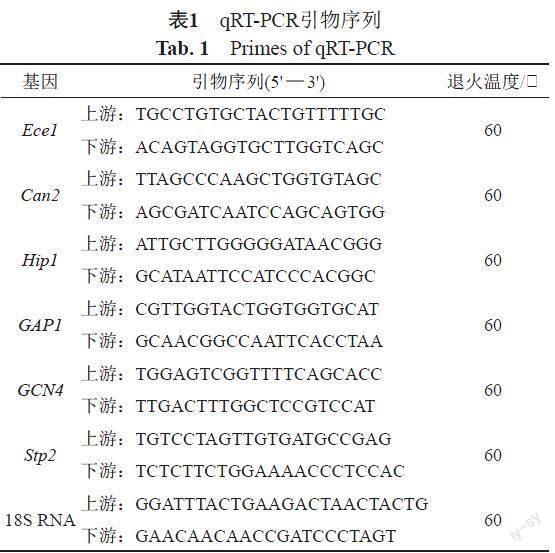
采用RNeasy Minikit提取及纯化各组不同卡泊芬净作用下培养12 h后的白念珠菌的RNA,NanoDrop分光光度仪测定RNA浓度。实时荧光定量RT-PCR反应体系如下:DEPC水4.4 μL,SYBR green realtime PCR Master Mix-Plus- 10 μL,Plus Buffer 2 μL,上下游引物各0.8 μL,cDNA 2 μL。反应条件如下:95℃预变性60 s,95℃变性15 s,60℃退火60 s,40个循环,72℃延伸10 min;最后65℃~95℃熔解曲线分析判断产物的特异性。内参基因为18S RNA,目的基因为Ece1,Can2,Hip1,GAP1,GCN4和Stp2,基因表达量差异计算方法为2-△△CT:以Ece1为例,ΔCt(试验样本) = Ct (sub-MIC处理样本Ece1基因) -Ct (sub-MIC处理样本18S RNA基因),ΔCt (校准样本) = Ct (0 MIC处理样本的Ece1基因)- Ct (0 MIC处理样本的18S RNA基因),-ΔΔCt=ΔCt(校准样本)-ΔCt (试验样本),2-ΔΔCt即为生物膜相关基因在sub-MIC处理组菌株的表达量相较于0 MIC处理组菌株的比值。引物序列见表1。
1.9 统计学分析
本实验数据采用SPSS 23.0统计软件进行分析处理,两样本间比较采用配对样本t检验,双侧P<0.05表示差异具有统计学意义。
2 结果
2.1 白念珠菌对卡泊芬净的MIC值测定
微量肉汤稀释法检测12株白念珠菌对卡泊芬净的MIC值范围为0.625~0.875 μg/mL。其中WT为0.75 μg/mL,5株临床分离株为0.625 μg/mL,4株临床分离株为0.75 μg/mL,2株临床分离株为0.85 μg/mL。
2.2 sub-MIC卡泊芬净对白念珠菌生长影响
从8 h开始,sub-MIC卡泊芬净开始对白念珠菌的生长有影响。当卡泊芬净浓度为1/4 MIC时,12株白念珠菌在8 h后的各个时间点△A530值中位数均为负数,表明白念珠菌的生长受到了抑制。1/8 MIC卡泊芬净影响下,△A530值中位数仍为负数,但相较1/4 MIC作用下,△A530值更接近0。卡泊芬净浓度降至1/16 MIC时,△A530值中位数已几乎为0,表明此浓度的卡泊芬净对白念珠菌已无明显生长抑制,见图1。
2.3 sub-MIC卡泊芬净对白念珠菌生物膜中活菌落量影响
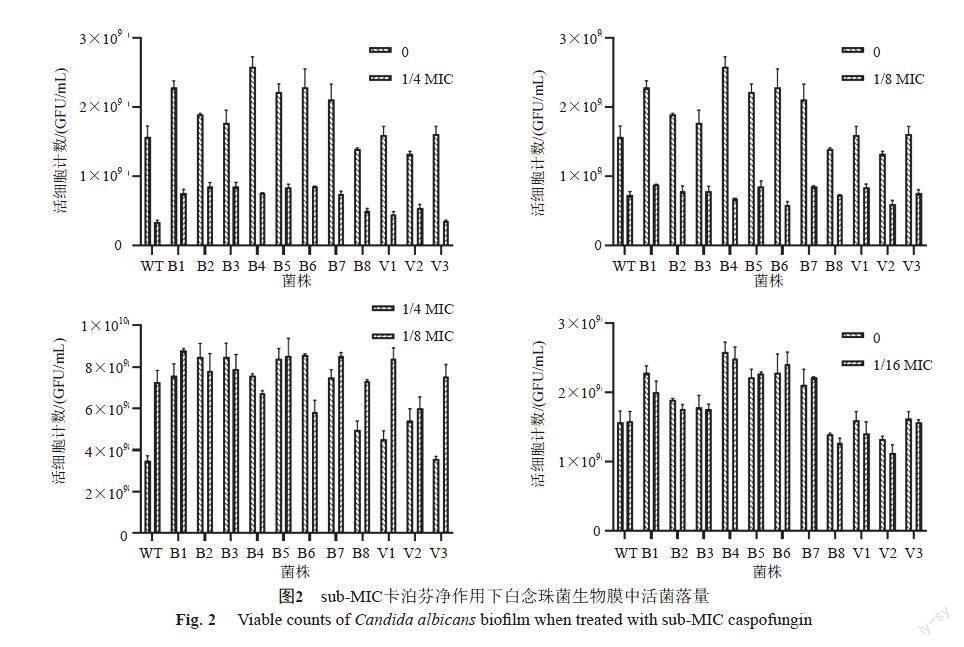
1/4 MIC和1/8 MIC卡泊芬净作用下形成的生物膜中,白念珠菌活菌落数量较无卡泊芬净作用下形成的白念珠菌生物膜中明显减少(P<0.001),但部分菌株的生物膜内活菌落数在这2个不同浓度的卡泊芬净作用下数量相近(P=0.088)。而1/16 MIC卡泊芬凈组中,生物膜中白念珠菌活菌落数量已与无卡泊芬净作用组中接近持平(P=0.300),见图2。
2.4 sub-MIC卡泊芬净对白念珠菌生物膜中活菌代谢影响
1/4 MIC和1/8 MIC卡泊芬净作用下形成的生物膜中,白念珠菌的代谢活性较无卡泊芬净作用下形成的白念珠菌生物膜中明显降低(P<0.001)。而1/16 MIC卡泊芬净组中,生物膜中白念珠菌的代谢活性已与无卡泊芬净作用组中接近持平(P=0.148),见图3。
2.5 sub-MIC卡泊芬净影响下形成的白念珠菌生物膜形态分析
扫描镜下可见,无抗菌药物压力下形成的白念珠菌形成的生物膜数量丰富、结构致密,菌体在生物膜内部纵横交织。而在1/4 MIC和1/8 MIC卡泊芬净作用下形成的白念珠菌生物膜中虽然存在纵横交织的结构,但数量明显减少,且本来致密排列的菌体变得疏松。1/16 MIC卡泊芬净组中的白念珠菌生物膜在镜下则是数量丰富、结构致密,见图4。
2.6 sub-MIC卡泊芬净影响下白念珠菌生物膜相关基因的mRNA表达水平
1/4 MIC和1/8 MIC卡泊芬净作用下,白念珠菌生物膜相关基因的表达水平均明显下降(低于0 MIC组的1/2,P<0.001)。而1/16 MIC卡泊芬净则对白念珠菌生物膜相关基因的表达无抑制作用(P= 0.057),见图5。
3 讨论
白念珠菌是最常见的人类真菌病原体,通常定植于皮肤和黏膜表面,但它也可以通过侵入携带植入性医疗设备的患者体内,特别是免疫受损的患者的血液循环中引起危及生命的全身性感染[9]。有研究发现,同三唑类或两性霉素B组相比,纳入卡泊芬净治疗组的患者具有更好的生存率以及临床治愈率[5]。有观点认为无论疾病的严重程度如何,棘白菌素对大多数真菌感染患者都是首选治疗药物[1]。但关于检出棘白菌素耐药念珠菌的报道越来越多,其中光滑念珠菌最为常见,其他如白色、热带以及克柔念珠菌等也有耐药的报道,而且非血液分离的念珠菌对棘白菌素的耐药情况被严重低估[10-11]。虽然卡泊芬净对白念珠菌血液感染的治疗临床效果优于阿唑类药物,但是其临床经验用药常由于代谢分布、使用剂量不足导致血药浓度处于亚抑菌浓度(sub-MIC)。而白念珠菌几乎能在所有侵入性医疗设备上形成生物膜,一旦形成生物膜,病原菌就处于一种被保护的状态,并具备了对患者免疫防御系统的高度耐受性[3-4]。目前为止,临床上还没有真正有效的针对生物膜的治疗方案,唯一的选择是移除留置的医疗植入物,而对于一些危重患者,例如新生儿ICU中的低出生体重的早产儿,留置医疗植入物是生存的必要条件[12-13]。侵袭性念珠菌病的诊疗现状十分严峻,使白念珠菌生物膜研究成为科研工作者不得不关注的热点。
sub-MIC抗菌药物对病原微生物生物膜的形成具有调控作用,且调控作用可因抗菌药物种类、浓度、作用时间,实验条件或具体菌株的差异,可能会呈现抑制或诱导等不同结果[4]。真菌方面,多种sub-MIC抗菌药物对白念珠菌的表型具有调节作用[14-15]。然而,有关sub-MIC卡泊芬净对白念珠菌生物膜的影响尚缺乏相关研究。本研究中12株白念珠菌的生长均受到各个sub-MIC卡泊芬净不同程度的抑制,抑制作用随着药物浓度的降低而减弱。当卡泊芬净浓度为1/16 MIC时,白念珠菌的生长已几乎不受影响。目前对白念珠菌生物膜形成的研究发现其整个过程始于酵母细胞在医疗植入设备表面的接种和附着[16],生长曲线显示不同浓度卡泊芬净对白念珠菌生长的影响是从8~16 h开始有明显抑制作用。一般白念珠菌的黏附期约为6 h,笔者进一步对亚抑菌浓度卡泊芬净作用下白念珠菌生物膜的形成能力做了测定。结果显示除1/16 MIC外,不同亚抑菌浓度卡泊芬净中形成的成熟白念珠菌生物膜中活细胞数和细胞代谢活性亦有不同程度的减弱,说明卡泊芬净仍能作用于黏附后的白念珠菌生物膜形成过程。此外,不同于sub-MIC氟康唑能促进白念珠菌菌体聚集[17],扫描电镜下笔者发现与无抗菌药物压力下形成的白念珠菌生物膜相比,在亚抑菌浓度卡泊芬净作用下形成的白念珠菌生物膜中虽然仍存在纵横交织的结构,但本来致密排列的菌体已明显变得疏松。笔者在之前的研究中发现sub-MIC药物可以通过抑制生物膜形成相关基因的表达水平抑制生物膜形成[18],所以笔者在念珠菌基因组在线数据库(Candida Genome Database,http://www.candidagenome.org/)中筛选了6个与白念珠菌生物膜形成相关的基因(Ece1,Can2,Hip1,GAP1,GCN4和Stp2)进行分析。通过实时荧光定量RT-PCR测定其在不同亚抑菌浓度卡泊芬净影响下的表达水平,笔者发现除1/16MIC卡泊芬净组外,另外两个浓度的卡泊芬净能显著抑制白念珠菌形成生物膜的重要黏附基因Ece1的表达水平。此外,其他生物膜形成相关基因Can2,Hip1,GAP1,GCN4和Stp2的表达水平也均受到除1/16 MIC外的两个sub-MIC卡泊芬净的抑制。可见sub-MIC卡泊芬净作用下,白念珠菌生物膜形成相关基因表达水平的降低与生物膜形成的减弱的表型相一致。
本研究顯示了sub-MIC卡泊芬净对白念珠菌生物膜的形成具有抑制作用。但白念珠菌在sub-MIC药物作用下仍能形成生物膜,因此仍需谨防sub-MIC的情况出现。研发针对医源性感染的新药投入减少且临床测试的周期过长,因此提高对sub-MIC抗菌药物对白念珠菌生物膜形成作用的认识,为今后清除生物膜策略的制定提供理论基础,从而改善白念珠菌医源性感染患者的预后,可能是一种可行的解决方案。
参 考 文 献
[1]Kullberg B J, Arendrup M C. Invasive candidiasis[J]. N Engl J Med, 2015, 373(15): 1445-1456.
[2]Pappas P G, Lionakis M S, Arendrup M C, et al. Invasive candidiasis[J]. Nat Rev Dis Primers, 2018, 4: 18026.
[3]Pereira R, Dos S F R O, de Brito E H S, et al. Biofilm of Candida albicans: Formation, regulation and resistance[J]. J Appl Microbiol, 2020, 13(1): 11-22
[4]Algburi A, Comito N, Kashtanov D, et al. Control of biofilm formation: Antibiotics and beyond[J]. Appl Environ Microbiol, 2017, 83(3): e02508-e02516
[5]Andes D R, Safdar N, Baddley J W, et al. Impact of treatment strategy on outcomes in patients with candidemia and other forms of invasive candidiasis: A patient-level quantitative review of randomized trials[J]. Clin Infect Dis, 2012, 54(8): 1110-1122.
[6]Li Y, Yang J, Li X, et al. The effect of Ginkgolide B combined with fluconazole against drug-resistant Candida albicans based on common resistance mechanisms[J]. Int J Antimicrob Agents, 2020, 56(2): 106030.
[7]Sutiman N, Koh J C, Watt K, et al. Pharmacokinetics alterations in critically Ill pediatric patients on extracorporeal membrane oxygenation: A systematic review[J]. Front Pediatr, 2020, 8: 260, DOI: 10.3389/fped.2020.00260.
[8]Carcillo J A, Doughty L, Kofos D, et al. Cytochrome P450 mediated-drug metabolism is reduced in children with sepsis-induced multiple organ failure[J]. Intensive Care Med, 2003, 29(6): 980-984.
[9]Riedi A C,Ramseier F. Regression: Different visions, different responses[J]. Krankenpfl Soins Infirm, 1990, 83(3): 47-51.
[10]Fraser M, Borman A M, Thorn R, et al. Resistance to echinocandin antifungal agents in the United Kingdom in clinical isolates of Candida glabrata: Fifteen years of interpretation and assessment[J]. Med Mycol, 2020, 58(2): 219-226.
[11]Arendrup M C and Perlin D S. Echinocandin resistance: An emerging clinical problem?[J]. Curr Opin Infect Dis, 2014, 27(6): 484-492.
[12]Cornely O A, Bassetti M, Calandra T, et al. ESCMID* guideline for the diagnosis and management of Candida diseases 2012: Non-neutropenic adult patients[J]. Clin Microbiol Infect, 2012, 18 (Suppl 7): 19-37.
[13]Mellinghoff S C, Cornely O A, Jung N. Essentials in Candida bloodstream infection[J]. Infection, 2018, 46(6): 897-899.
[14]Asghar F, Yan H, Jiang L. The putative transcription factor CaMaf1 controls the sensitivity to lithium and rapamycin and represses RNA polymerase III transcription in Candida albicans[J]. FEMS Yeast Res, 2018, 18(6), DOI: 10.1093/femsyr/foy068.
[15]Sharma Y, Rastogi S K, Perwez A, et al. Beta-citronellol alters cell surface properties of Candida albicans to influence pathogenicity related traits[J]. Med Mycol, 2020, 58(1): 93-96.
[16]Gulati M, Nobile C J. Candida albicans biofilms: Development, regulation, and molecular mechanisms[J]. Microbes Infect, 2016, 18(5): 310-321.
[17]Mores A U, Souza R D, Cavalca L, et al. Enhancement of secretory aspartyl protease production in biofilms of Candida albicans exposed to sub-inhibitory concentrations of fluconazole[J]. Mycoses, 2011, 54(3): 195-201.
[18]Chen H, Cao J, Zhou C, et al. Biofilm formation restrained by subinhibitory concentrations of tigecyclin in Acinetobacter baumannii is associated with downregulation of efflux pumps[J]. Chemotherapy, 2017, 62(2): 128-133.
