隐丹参酮对肝癌细胞凋亡和内质网应激的影响
2022-05-30王贞丽,王晓雯,付晓菁,张海霞,赵文文,陈雪红
王贞丽,王晓雯,付晓菁,张海霞,赵文文,陈雪红


[摘要]目的 探讨隐丹参酮(CPT)对肝癌细胞凋亡和内质网应激的影响。 方法 HepG2细胞分别用不同浓度的CPT处理48 h,采用MTT法、乳酸脱氢酶释放法和细胞划痕法检测细胞的生长和迁移能力,Annexin V FITC-PI染色后流式细胞分析术检测细胞凋亡率,Western blot法检测caspase3、重链结合蛋白(BIP)和蛋白激酶R样内质网激酶(p-PERK)的表达水平。 结果 与阴性对照组相比,CPT作用后HepG2细胞的生长和迁移能力减弱(F=41.10~126.40,P<0.01),凋亡蛋白caspase3的活化水平升高(F=156.90,P<0.01)。15 μmol/L CPT可以使HepG2细胞中内质网应激蛋白BIP和p-PERK的表达水平明显下降(F=57.20、49.92,P<0.01)。结论 CPT对肝癌细胞的生长和迁移有抑制作用,并且能抑制内质网应激和促进凋亡。
[关键词]隐丹参酮;Hep G2细胞;细胞增殖;细胞运动;细胞凋亡;内质网应激
[中图分类号]R284;R329.25
[文献标志码]A
[文章编号]2096-5532(2022)04-0602-05
doi:10.11712/jms.2096-5532.2022.58.128[HT]
[开放科学(资源服务)标识码(OSID)]
[网络出版]https://kns.cnki.net/kcms/detail/37.1517.R.20220822.1543.002.html;[JY]2022-08-2309:49:42
EFFECT OF CRYPTOTANSHINONE ON APOPTOSIS AND ENDOPLASMIC RETICULUM STRESS IN HEPATOMA CELLS
WANG Zhenli, WANG Xiaowen, FU Xiaojing, ZHANG Haixia, ZHAO Wenwen, CHEN Xuehong
(Quality Management Section of Qingdao Special Service Sanatorium Center of PLA Navy, Qingdao 266071, China)
[ABSTRACT]Objective To investigate the effect of cryptotanshinone (CPT) on apoptosis and endoplasmic reticulum stress in hepatoma cells.
Methods HepG2 cells were treated with different concentrations of CPT for 48 h. MTT assay, lactate dehydrogenase release assay, and wound healing assay were used to measure cell growth and migration abilities; flow cytometry was used to measure cell apoptosis rate after Annexin V FITC-PI staining; Western blot was used to measure the expression levels of caspase3, heavy chain-binding protein (BIP), and protein kinase R-like endoplasmic reticulum kinase (p-PERK).
Results Compared with the negative control group, the CPT treatment group had significant reductions in the growth and migration abilities of HepG2 cells (F=41.10-126.40,P<0.01) and a significant increase in the activation level of the apoptotic protein caspase3 (F=156.90,P<0.01). CPT at a concentration of 15 μmol/L significantly reduced the expression levels of the endoplasmic reticulum stress proteins BIP and p-PERK in HepG2 cells (F=57.20,49.92;P<0.01).
Conclusion CPT can inhibit the growth and migration of HepG2 cells, and it can also inhibit endoplasmic reticulum stress and promote apoptosis.
[KEY WORDS] cryptotanshinone; Hep G2 cells; cell proliferation; cell movement; apoptosis; endoplasmic reticulum stress
肝癌是一种常见的恶性肿瘤[1]。目前常用的肝癌化疗药物5-氟尿嘧啶和铂类(顺铂)经过多年临床应用证实存在大量的副作用和不良反应。目前针对肝癌治疗的化学药物和新的靶向药物的研究层出不穷,但化疗药物耐药性和预后不良的弊端仍然存在。近年来,中医药以其疗效显著、副作用小、原料经济方便等特点,受到世界各国的高度关注[2]。因此,寻求疗效优越、不良反應小的中药是肝癌治疗的潜在方向。丹参作为一种中药,广泛应用于动脉粥样硬化、阿尔茨海默病、高脂血症、肝纤维化、慢性肾衰竭和妇科疾病等多种疾病的治疗,无严重副作用[3]。丹参的水溶性成分具有良好活性,随着研究的深入,发现其脂溶性成分也具有抗结直肠癌、前列腺癌和肺癌等肿瘤的作用[4-5]。隐丹参酮(CPT)是丹参的主要脂溶性提取物。有研究表明,CPT对多种类型的癌细胞有直接的细胞毒性作用[6-8]。本研究旨在探讨CPT对肝癌细胞凋亡和目前报道较多的内质网应激的影响。
1材料与方法
1.1实验材料
CPT(晨光生物,中国陕西);RPMI 1640(基诺,中国江苏);胎牛血清(Biological Industrie,以色列);乳酸脱氢酶(LDH)细胞毒性检测试剂盒(碧云天,中国上海);内质网应激抗体试剂盒、cleaved caspase3、caspase3(CST,美国);MTT细胞增殖及细胞毒性检测试剂盒、PBS缓冲液、衣霉素(索莱宝,中国北京);Annexin V FITC-PI凋亡试剂盒(BD,美国)。
1.2实验方法
1.2.1细胞培养肝癌HepG2细胞(来源于青岛大学基础医学院细胞冻存库)用含体积分数0.10胎牛血清和青霉素/链霉素溶液的RPMI 1640培养液,在37 ℃、含体积分数0.05 CO2的无菌培养箱中培养。
1.2.2MTT法检测细胞活性将HepG2细胞接种于96孔板中,12 h后加CPT处理,加药浓度分别为0、1、5、10、15和30 μmol/L。CPT处理48 h后,加入MTT溶液,继续培养3 h后加入Formazan溶解液,用酶标仪检测570 nm波长处每孔吸光度。
1.2.3LDH释放法检测细胞毒性HepG2细胞加CPT处理(其浓度分别为0、1和15 μmol/L),作用48 h后检测LDH释放量,用酶标仪检测490 nm波长处每孔吸光度。
1.2.4细胞划痕实验将HepG2细胞接种于背面画好横线的6孔板中,培养12 h后用枪头垂直于直线划痕,以PBS清洗,加CPT处理(CPT用无血清培养液稀释,浓度分别为0、1和15 μmol/L)。置于37 ℃、含体积分数0.05 CO2无菌环境中培养,分别于培养0、48 h时取样,拍照。
1.2.5Western blot法检测凋亡和内质网应激相关蛋白表达收集CPT(0、1和(或)15 μmol/L)作用48 h后的HepG2细胞,提取蛋白。取30 μg蛋白,于摇床上用1 g/L脱脂奶粉室温封闭2 h,分别加入cleaved caspase3、重链结合蛋白(BIP)、蛋白激酶R样内质网激酶(p-PERK)一抗(1∶1 000),4 ℃过夜,以PBST清洗3次,加入二抗(1∶10 000),室温摇床孵育2 h,以PBST清洗,滴加ECL化学发光液在显影仪中进行化学发光成像。
1.2.6流式细胞术检测细胞凋亡分别用浓度为1、15 μmol/L的CPT处理HepG2细胞48 h,然后用预冷PBS轻洗细胞2次,消化细胞。取1×104个细胞用Binding Buffer重悬后置于1.5 mL EP管中,每管加入5 μL FITC轻轻混匀,避光孵育15~30 min。加入5 μL PI和400 μL Binding Buffer,上机检测调亡细胞。最后使用Flow Jo软件分析细胞凋亡情况。
1.3统计学分析
采用Prism 5.0软件进行统计学分析。本研究所有实验均进行3次独立实验,取均值。所得数据以[AKx-D]±s形式表示,组间比较采用单因素方差分析。统计学检验均为双侧检验,以P<0.05为差异有统计学意义。
2结果
2.1CPT对HepG2细胞生长和迁移的作用
MTT法檢测结果显示,CPT对HepG2细胞生长的抑制作用是呈梯度的。与阴性对照组相比,10、15、30 μmol/L CPT组HepG2细胞的生存率明显下降,差异有统计学意义(F=126.40,P<0.001)(图1A)。LDH释放法检测结果显示,15 μmol/L CPT组HepG2细胞的LDH释放量明显升高,与阴性对照组相比,差异具有统计学意义(F=41.10,P<0.001)(图1B)。细胞划痕实验结果显示,细胞划痕48 h后,与阴性对照组相比,15 μmol/L CPT组的闭合率显著降低,差异具有统计学意义(F=96.18,P<0.001)(图1C)。
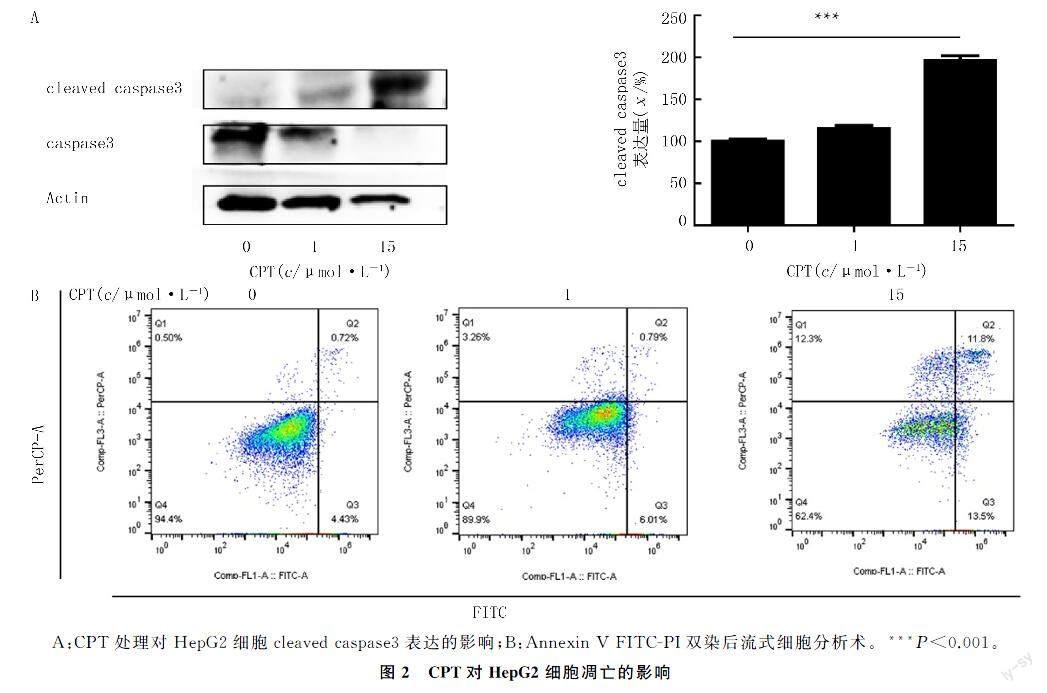
2.2CPT对HepG2细胞凋亡的影响
Western blot检测结果显示,与阴性对照组和1 μmol/L CPT组相比,15 μmol/L CPT组cleaved caspase3的表达水平增高,差异具有统计学意义(F=156.90,P<0.001)(图2A)。流式细胞分析术检测结果显示,与阴性对照组相比,15 μmol/L CPT组细胞凋亡率明显升高,差异具有统计学意义(F=1 090.00,P<0.001)(图2B、表1)。
2.3CPT对HepG2细胞内质网应激的影响
Western blot检测结果显示,与阴性对照组相比,15 μmol/L CPT组细胞中p-PERK和BIP蛋白的表达水平明显降低,差异具有统计学意义(F=57.20、49.92,P<0.001);与1 μmol/L CPT组相比较,15 μmol/L CPT组细胞中BIP蛋白的表达水平明显降低,差异均具有统计学意义(F=49.92,P<0.001)(图3A)。在15 μmol/L CPT作用下,与未经衣霉素预处理组相比,经衣霉素预处理组HepG2细胞中BIP的表达水平明显升高,差异具有统计学意义(F=41.09,P<0.001)(图3B)。
3讨论
研究发现,CPT作为从丹参中提取的脂溶性单体,对肿瘤有很好的疗效[7-9]。本文体外细胞学研究结果表明,CPT可以抑制HepG2细胞的生长,与阴性对照组相比,10、15、30 μmol/L CPT组HepG2细胞的生存率明显下降。15 μmol/L的CPT可以破坏HepG2细胞的细胞膜,引起LDH释放量明显增加。另外,在细胞划痕实验中,相对于阴性对照组,15 μmol/L CPT组HepG2细胞的迁移水平降低,差异具有统计学意义。上述结果证实CPT可以减弱HepG2细胞的生长和迁移能力。
CPT誘导的细胞生长和增殖抑制主要是由于细胞凋亡[10-11]。有研究表明,CPT可以诱导HeLa、DU145和Hep3B细胞凋亡,其机制主要是诱导凋亡蛋白caspase3的活化和抑制抗凋亡蛋白Bcl-xL等的表达[6,12-13]。CPT被普遍认为是一种有效的信号转导和转录激活因子3(STAT3)抑制剂。相关文献报道,CPT可以快速抑制DU145细胞中STAT3 Tyr705的磷酸化,而后与细胞质中的STAT3分子共定位,并通过直接结合到STAT3的SH2域来抑制STAT3二聚体的形成[12]。有文献报道,STAT3可以调节细胞的生长和凋亡[13]。本研究结果表明,CPT可以活化细胞凋亡蛋白caspase3,从而诱导HepG2细胞发生凋亡。
内质网是一种多功能细胞器,可以参与维持细胞稳态和支持细胞存活[14-15]。外界的刺激可以使其内部错误蛋白不断积累,造成内质网应激[16]。当这种积累超过临界阈值时,未折叠蛋白反应(UPR)补救信号转导途径会被激活,该途径主要涉及3个内质网跨膜传感器(IRE1α、PERK和ATF6)介导的通路[17-18]。相关研究表明,肿瘤细胞通过UPR适应低糖环境,促进肿瘤细胞的生存[19-21]。此外,有研究证实,UPR通过抑制炎症和凋亡信号通路进行细胞保护[22-25]。本研究结果表明,CPT可以有效地抑制HepG2细胞中内质网应激的发生。
综上所述,CPT对HepG2细胞的生长和迁移有抑制作用,在促进HepG2细胞凋亡的同时可抑制内质网应激。本研究为CPT作为一种有潜力的抗肝癌药物提供了证据。
[参考文献]
[1]MILLER K D, FIDLER-BENAOUDIA M, KEEGAN T H, et al. Cancer statistics for adolescents and young adults, 2020[J]. CA: A Cancer Journal for Clinicians, 2020,70(6):443-459.
[2]ONG M, PENG J, JIN X L, et al. Chinese herbal medicine for the optimal management of polycystic ovary syndrome[J]. The American Journal of Chinese Medicine, 2017,45(3):405-422.
[3]ZHOU L M, ZUO Z, CHOW M S S. Danshen: an overview of its chemistry, pharmacology, pharmacokinetics, and clinical use[J]. The Journal of Clinical Pharmacology, 2005,45(12):1345-1359.
[4]张蒲容,吕青. 丹参酮ⅡA抗乳腺癌作用机制的实验研究[J]. 四川大学学报(医学版), 2009,40(2):245-249.
[5]CAI Y E, ZHANG W J, CHEN Z R, et al. Recent insights into the biological activities and drug delivery systems of tanshinones[J]. International Journal of Nanomedicine, 2016,11:121-130.
[6]叶因涛,徐文清,仲巍. 隐丹参酮对宫颈癌Hela细胞增殖及细胞凋亡的影响[J]. 中国中药杂志, 2010,35(1):118-121.
[7]XU D F, LIN T H, LI S S, et al. Cryptotanshinone suppresses androgen receptor-mediated growth in androgen dependent and castration resistant prostate cancer cells[J]. Cancer Letters, 2012,316(1):11-22.
[8]CHEN X P, GUO J J, BAO J L, et al. The anticancer properties of Salvia miltiorrhiza Bunge (Danshen): a systematic review[J]. Medicinal Research Reviews, 2014,34(4):768-794.
[9]CAO L, HONG W P, CAI P H, et al. Cryptotanshinone strengthens the effect of gefitinib against non-small cell lung cancer through inhibiting transketolase[J]. European Journal of Pharmacology, 2021,890:173647.
[10]KIM J H, JEONG S J, KWON T R, et al. Cryptotanshinone enhances TNF-α-induced apoptosis in chronic myeloid leukemia KBM-5 cells[J]. Apoptosis: an International Journal on Programmed Cell Death, 2011,16(7):696-707.
[11]PARK I J, KIM M J, PARK O J, et al. Cryptotanshinone induces ER stress-mediated apoptosis in HepG2 and MCF7 cells[J]. Apoptosis: an International Journal on Programmed Cell Death, 2012,17(3):248-257.
[12]SHIN D S, KIM H N, SHIN K D, et al. Cryptotanshinone inhibits constitutive signal transducer and activator of transcription 3 function through blocking the dimerization in DU145 prostate cancer cells[J]. Cancer Research, 2009,69(1):193-202.
[13]LEE W Y, CHEUNG C C, LIU K W, et al. Cytotoxic effects of tanshinones from Salvia miltiorrhiza on doxorubicin-resis-tant human liver cancer cells[J]. Journal of Natural Products, 2010,73(5):854-859.
[14]RON D, WALTER P. Signal integration in the endoplasmic Reticulum unfolded protein response[J]. Nature Reviews Molecular Cell Biology, 2007,8(7):519-529.
[15]LYNES E M, SIMMEN T. Urban planning of the endoplasmic Reticulum (ER): how diverse mechanisms segregate the many functions of the ER[J]. Biochimica et Biophysica Acta (BBA)-Molecular Cell Research, 2011,1813(10):1893-1905.
[16]HETZ C. The unfolded protein response: controlling cell fate decisions under ER stress and beyond[J]. Nature Reviews Molecular Cell Biology, 2012,13(2):89-102.
[17]TABAS I, RON D. Integrating the mechanisms of apoptosis induced by endoplasmic Reticulum stress[J]. Nature Cell Bio-logy, 2011,13(3):184-190.
[18]HOLLIEN J, WEISSMAN J S. Decay of endoplasmic Reticulum-localized mRNAs during the unfolded protein response[J]. Science (New York, N Y), 2006,313(5783):104-107.
[19]CORAZZARI M, GAGLIARDI M, FIMIA G M, et al. Endoplasmic Reticulum stress, unfolded protein response, and cancer cell fate[J]. Frontiers in Oncology, 2017,7:78.
[20]GIAMPIETRI C, PETRUNGARO S, CONTI S, et al. Cancer microenvironment and endoplasmic Reticulum stress response[J]. Mediators of Inflammation, 2015,2015:417281.
[21]RYDER C, MCCOLL K, ZHONG F, et al. Acidosis promotes Bcl-2 family-mediated evasion of apoptosis: involvement of acid-sensing G protein-coupled receptor Gpr65 signaling to Mek/Erk[J]. The Journal of Biological Chemistry, 2012,287(33):27863-27875.
[22]ZHANG J, ZHOU Y, LI N, et al. Curcumol overcomes TRAIL resistance of non-small cell lung cancer by targeting NRH: quinone oxidoreductase 2 (NQO2)[J]. Advanced Science (Weinheim, Baden-Wurttemberg, Germany), 2020,7(22):2002306.
[23]OUTINEN P A, SOOD S K, PFEIFER S I, et al. Homocysteine-induced endoplasmic Reticulum stress and growth arrest leads to specific changes in gene expression in human vascular endothelial cells[J]. Blood, 1999,94(3):959-967.
[24]CUBILLOS-RUIZ J R, BETTIGOLE S E, GLIMCHER L H. Tumorigenic and immunosuppressive effects of endoplasmic Reticulum stress in cancer[J]. Cell, 2017,168(4):692-706.
[25]TIAN J X, MO J M, XU L, et al. Scoulerine promotes cell viability reduction and apoptosis by activating ROS-dependent endoplasmic Reticulum stress in colorectal cancer cells[J]. Chemico-Biological Interactions, 2020,327:109184.
(本文編辑马伟平)
