BRD4对钛颗粒诱导破骨细胞形成和骨吸收功能作用
2022-05-30赵志平,王向宇,贾斌,许应星,王昌耀,王英振
赵志平,王向宇,贾斌,许应星,王昌耀,王英振
[摘要]目的 研究表观遗传信号分子-溴结构域蛋白4(BRD4)在钛(Ti)颗粒体外诱导破骨细胞形成和骨吸收功能中的作用。方法 小鼠RAW264.7巨噬细胞随机分为3组,对照组应用细胞培养液+100 μg/L核因子κB受体活化因子配体(RANKL)+50 μg/L巨噬细胞集落刺激因子(M-CSF)培养,Ti组应用细胞培养液+0.1 g/L Ti+100 μg/L RANKL+50 μg/L M-CSF培养,Ti+JQ1组应用细胞培养液+0.1 g/L Ti+100 μg/L RANKL+50 μg/L M-CSF+200 nmol/L JQ1培养。各组细胞培养48 h后,应用CCK8检测细胞活性,荧光定量聚合酶链式反应法检测[STBX]BRD4基因和破骨细胞相关基因组织蛋白酶K(CK)、抗酒石酸酸性磷酸酶(TRAP)、肿瘤坏死因子受体相关因子6([STBX]TRAF6)、活化T细胞核因子1([STBX]NFATc1)等mRNA表达;培养5 d至破骨细胞形成,用TRAP染色法檢测各组成熟破骨细胞数量,骨吸收培养板(OAP)检测各组破骨细胞骨吸收功能。结果 各组细胞活性差异无显著性(F=1.629,P>0.05);Ti组[STBX]BRD4基因和破骨细胞相关基因mRNA表达均较对照组显著升高,Ti+JQ1组[STBX]BRD4基因和破骨细胞相关基因mRNA表达均较Ti组降低,差异有统计学意义(F=24.575~336.704,P<0.05);Ti组TRAP染色阳性的破骨细胞数目较其他两组明显增多,差异有统计学意义(F=165.941,P<0.05);Ti组骨吸收面积较对照组增加,Ti+JQ1组骨吸收面积与Ti组相比明显减少,差异均有统计学意义(F=49.879,P<0.05)。结论 Ti颗粒通过上调RAW264.7巨噬细胞中BRD4蛋白的表达,促进破骨细胞形成和骨吸收功能。
[关键词]溴结构域蛋白4;钛颗粒;JQ1;破骨细胞;骨吸收;基因检测
[中图分类号]R687.4;R318
[文献标志码]A
[文章编号]2096-5532(2022)04-0489-05
doi:10.11712/jms.2096-5532.2022.58.108
[开放科学(资源服务)标识码(OSID)]
[网络出版]https://kns.cnki.net/kcms/detail/37.1517.R.20220622.1629.013.html;[JY]2022-06-2414:58:40
ROLE OF BROMODOMAIN-CONTAINING PROTEIN 4 IN TITANIUM PARTICLE-INDUCED OSTEOCLASTOGENESIS AND BONE RESORPTION
ZHAO Zhiping, WANG Xiangyu, JIA Bin, XU Yingxing, WANG Changyao, WANG Yingzhen
(Department of Medicine, Qingdao University, Qingdao 266071, China)
[ABSTRACT]Objective[WTBZ] To investigate the role of the epigenetic signaling molecule bromodomain-containing protein 4 (BRD4) in titanium (Ti) particle-induced osteoclastogenesis and bone resorption in vitro.
Methods Mouse RAW264. 7 macrophages were randomly divided into control group, Ti group, and Ti+JQ1 group. The macrophages in the control group were cultured with cell culture medium+100 μg/L receptor activator of nuclear factor-κB ligand (RANKL)+50 μg/L macrophage colony-stimulating factor (M-CSF), those in the Ti group were cultured with cell culture medium+0.1 g/L Ti+100 μg/L RANKL+50 μg/L M-CSF, and those in the Ti+JQ1 group were cultured with cell culture medium+0.1 g/L Ti+100 μg/L RANKL+50 μg/L M-CSF+200 nmol/L JQ1. After culture for 48 h, CCK8 assay was used to measure cell viability, and quantitative real-time PCR was used to measure the mRNA expression of [STBX]BRD4 gene and osteoclast-related genes such as cathepsin K (CK), tartrate-resistant acid phosphatase (TRAP), TNF receptor-associated factor 6 ([STBX]TRAF6), and nuclear factor of activated T-cells 1 ([STBX]NFATc1); after culture for 5 d till the formation of osteoclasts, TRAP staining was used to measure the number of mature os-teoclasts in each group, and osteo assay plate (OAP) was used to evaluate osteoclast-mediated bone resorption in each group.
Results There was no significant difference in cell viability between groups (F=1.629,P>0.05). Compared with the control group, the Ti group had significantly higher mRNA expression levels of [STBX]BRD4 gene and osteoclast-related genes, and compared with the Ti group, the Ti+JQ1 group had significantly lower mRNA expression levels (F=24.575-336.704,P<0.05). The Ti group had a significantly higher number of TRAP-positive osteoclasts than the other two groups (F=165.941,P<0.05). The Ti group had a significantly larger area of bone resorption than the control group, and the Ti+JQ1 group had a significantly smaller area of bone resorption than the Ti group (F=49.879,P<0.05).
Conclusion[WTBZ] Ti particles promote osteoclast formation and bone resorption by upregulating the expression of BRD4 in RAW264. 7 macrophages.
[KEY WORDS]bromodomain-containing protein 4; titanium particles; JQ1; osteoclasts; bone resorption; genetic testing
人工关节置换术(TJA)被广泛用于治疗晚期关节疾病,可显著缓解病人的疼痛并改善关节功能[1]。然而,磨损颗粒引起的假体周围骨溶解引发的无菌性松动是导致假体失败的主要原因[2]。尽管假体周围骨溶解的病理生理机制仍不清楚,但越来越多的证据表明,从假体表面释放的聚乙烯和钛(Ti)等磨损颗粒能诱导破骨细胞形成和过度活化,并增强假体周围的破骨细胞骨吸收功能,从而导致假体周围骨溶解和随后的无菌性松动[3-4]。大量的研究结果发现,表观遗传信号分子-溴结构域蛋白4(BRD4)通过调控破骨细胞的形成,参与破骨细胞相关的溶骨性疾病,如类风湿性关节炎、骨肉瘤和骨质疏松等发生和发展[5-7]。有研究结果表明,BRD4抑制剂JQ1对破骨细胞分化有抑制作用,可防止卵巢切除小鼠骨质疏松[8]。我们先前的研究结果显示,假体周围骨溶解病人的界膜组织中BRD4蛋白的表达明显增加,Ti颗粒处理小鼠RAW264.7巨噬细胞通过上调BRD4表达诱导溶骨性炎性因子的产生[9]。但是,关于BRD4蛋白参与调控磨损颗粒诱导破骨细胞形成、活化和骨吸收功能的确切机制不明。本文对BRD4在磨损颗粒诱导破骨细胞形成和骨吸收功能中的作用进行研究。
1材料和方法
1.1实验材料
小鼠RAW264.7巨噬细胞购自中国科学院(上海)细胞库;DMEM高糖培养液和青霉素/链霉素混合液购自以色列BI公司;胎牛血清购自武汉普诺赛生命科学有限公司;Ti颗粒(平均直径为4 μm)购自美国Alfa Aesa;CCK8试剂盒和TRAP染色试剂盒购自北京索莱宝科技有限公司;Trizol试剂、反转录试剂盒和SYBR Green试剂盒购自日本TaKaRa公司;PCR引物购自生工生物工程(上海)股份有限公司;核因子κB受体活化因子配体(RANKL)和巨噬细胞集落刺激因子(M-CSF)购自美国R&D Systems;JQ1购自北京爱必信生物科技有限公司;骨吸收培养板购自美国康宁公司。
1.2实验方法
1.2.1Ti颗粒的准备Ti颗粒在180 ℃下烘烤6 h后,在体积分数0.75乙醇中洗涤48 h以去除内毒素,然后悬浮在无菌磷酸盐缓冲液(PBS)中,使用高压灭菌器对Ti颗粒悬液进行灭菌,制成0.1 g/L的Ti颗粒悬液4 ℃储存备用。
1.2.2细胞培养和诱导小鼠RAW264.7巨噬细胞以每孔1×104的密度接种于96孔板中,随机分为3组培养:对照组中加入破骨诱导培养液(含有体积分数0.10胎牛血清和体积分数0.01青霉素/链霉素混合液DMEM高糖培养液+100 μg/L RANKL+50 μg/L的M-CSF),Ti组中加入破骨诱导培养液+0.1 g/L Ti颗粒,Ti+JQ1组中加入破骨诱导培养液+0.1 g/L Ti颗粒+200 nmol/L JQ1。3组细胞均培养于含体积分数0.05 CO2、95%湿度和37 ℃的环境中,每2 d更新1次培养液。
1.2.3CCK8方法检测细胞活力小鼠RAW264.7巨噬细胞以每孔1×104的密度接种到96孔板中过夜,根据分组加入相应试剂后培养48 h。然后按照CCK8试剂盒说明书将CCK8添加到96孔板中,每组设5个复孔,培养2 h,酶标仪测定各孔吸光度。
1.2.4荧光定量聚合酶链式反应(Q-PCR)方法检测基因表达Trizol试剂盒提取各组细胞总RNA,参照说明书进行操作。反转录试剂盒将RNA反转为cDNA,将获得的cDNA稀释并用作PCR模板,使用SYBR Green PCR预混液配制反应体系,反应条件为:预变性95 ℃、10 min,变性95 ℃、10 s,退火60 ℃、10 s,延伸72 ℃、15 s,共进行40个循环。以GAPDH为内参照基因,采用2-ΔΔCt法分别计算[STBX]BRD4、组织蛋白酶K(CK)、抗酒石酸酸性磷酸酶(TRAP)、活化T細胞核因子1([STBX]NFATc1)、肿瘤坏死因子受体相关因子6([STBX]TRAF6)等目的基因的mRNA表达。上述每个样本均设置3个复孔,实验重复3次。
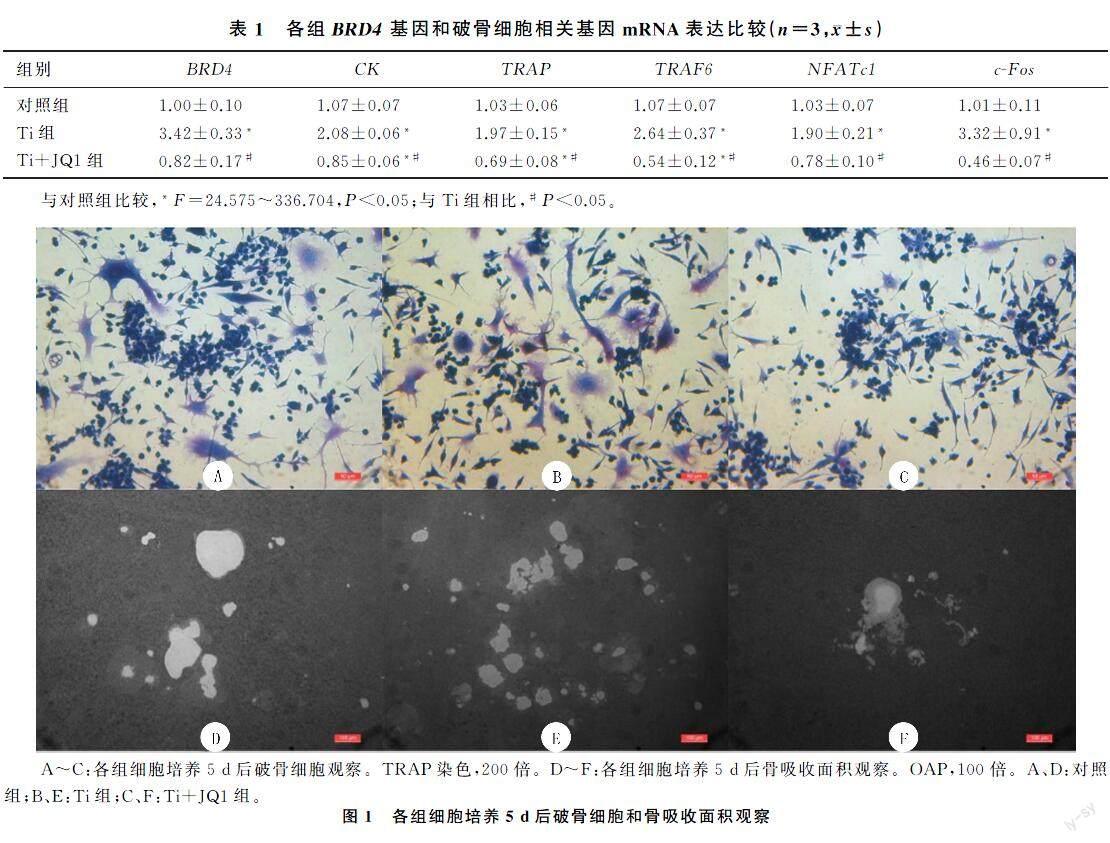
1.2.5TRAP染色法检测破骨细胞形成将小鼠RAW264.7巨噬细胞以每孔1×104的密度接种到96孔板中过夜,根据分组加入相应试剂。每2 d更换1次培养液,直到第5天观察到成熟的破骨细胞。然后将各组细胞用PBS洗涤3次,用40 g/L多聚甲醛固定20 min,并根据TRAP试剂盒说明书进行TRAP染色。具有≥3个核TRAP染色阳性的细胞为破骨细胞,并使用Image Pro-Plus 6.0软件进行计数。
1.2.6骨吸收培养板(OAP)检测破骨细胞骨吸收功能将小鼠RAW264.7巨噬细胞以每孔1×105的密度接种到24孔OAP中,根据分组加入相应试剂。每2 d更换1次培养液培养5 d,然后超声处理直至细胞完全从OAP中移出。使用倒置显微镜拍摄骨吸收凹坑的图像,并使用Image Pro-Plus 6.0软件量化骨吸收的面积。
1.3统计学分析
[CM(20]使用SPSS 21.0软件进行统计分析。计量资料[CM)]
以[AKx-D]±s形式表示,多组比较采用单因素方差分析,组间两两比较采用LSD检验。以P<0.05为差异有统计学意义。
2结果
2.1各组细胞存活率比较
对照组、Ti组和Ti+JQ1组的细胞存活率分别为1.01±0.02、1.04±0.04、0.99±0.05,3组比较差异无统计学意义(F=1.629,P>0.05)。表明加入Ti颗粒、RANKL和M-CSF以及JQ1对细胞生长活性无影响。
2.2各组[STBX]BRD4基因和破骨细胞相关基因mRNA表达比较
Ti组[STBX]BRD4 mRNA表达明显高于对照组,而Ti+JQ1组[STBX]BRD4 mRNA表达与Ti组相比显著降低(F=128.241,P<0.05)。与对照组相比较,Ti组破骨细胞相关基因[STBX]CK、TRAP、TRAF6、NFATc1、c-Fos的mRNA
表达均明显升高;与Ti组相比,Ti+JQ1组破骨细胞相关基因[STBX]CK、NFATc1、TRAF6、TRAP和c-Fos的mRNA表达均明显下降,差异均具有统计学意义(F=24.575~336.704,P<0.05)。见表1。
2.3各組破骨细胞形成比较
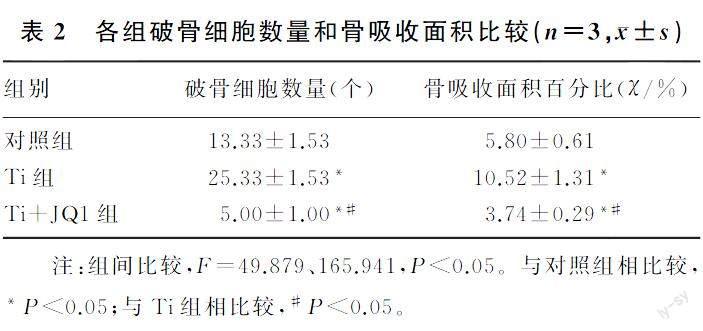
小鼠RAW264.7巨噬细胞可以分化为特征性TRAP阳性多核破骨细胞,与对照组相比,Ti组破骨细胞数增多;与Ti组相比,Ti+JQ1组TRAP阳性破骨细胞数量明显减少,差异有统计学意义(F=165.941,P<0.05)。见图1A~C和表2。
2.4各组破骨细胞骨吸收功能比较
在RANKL和M-CSF诱导下,3组均可观察到骨吸收凹坑。与对照组相比,Ti组的骨吸收面积显著增加;与Ti组相比,Ti+JQ1组的骨吸收面积显著减少,差异均有统计学意义(F=49.879,P<0.05)。见图1D~F和表2。
3讨论
TJA可以明显缓解晚期关节疾病病人的疼痛、改善关节功能、提高生活质量,曾被评为“世纪性的手术”[1]。但是随着TJA手术的广泛开展以及假体使用年限的延长,越来越多的病人需要进行关节翻修手术,这给病人造成了极大的心理压力和经济负担。DOBZYNIAK等[10]对关节翻修手术的原因分析发现,75%的翻修手术是由假体的无菌性松动引起。而磨损颗粒诱导的假体周围骨溶解是假体无菌性松动的病理基础[11]。因此,预防和治疗假体无菌性松动的关键在于对磨损颗粒诱导的假体周围骨溶解进行防治。这就要求我们了解磨损颗粒诱导假体周围骨溶解的发病机制。
随着表观遗传学的兴起,BRD4作为表观遗传信号分子逐渐被人们所熟知。BRD4蛋白主要与乙酰化的组蛋白发生特异性的结合,然后募集其他转录因子,继而形成转录复合体,促进下游基因的转录和表达,进而参与细胞周期、细胞生长、炎症和癌症等调节[12-13]。有研究结果表明,磨损颗粒主要通过激活破骨细胞形成和骨吸收功能诱导假体周围骨溶解[14-17]。大量研究显示,表观遗传信号分子BRD4与破骨细胞相关的溶骨性疾病有关[7,18-19],而抑制BRD4可以显著抑制破骨细胞的形成以及破骨细胞的骨吸收功能[20]。BRD4选择性抑制剂JQ1可通过阻断BRD4蛋白与乙酰化组蛋白之间的相互作用,竞争性地占据溴结构域的识别口袋,并取代染色质的BRD4蛋白,发挥针对靶基因治疗剂的作用。LAMOUREUX等[7]的研究显示,JQ1可抑制成骨细胞和破骨细胞分化,延缓骨肿瘤的发展。KLEIN等[21]研究表明,在类风湿关节炎滑膜组织中可检测到BRD4蛋白,类风湿关节炎滑膜成纤维细胞和巨噬细胞中均有BRD4表达,抑制BRD4可抑制破骨细胞的形成和活化而缓解类风湿关节炎的病理过程。我们之前的研究结果也表明,BRD4在假体周围骨溶解病人界膜组织中的表达上调;当用Ti颗粒处理小鼠RAW264.7巨噬细胞时,BRD4表达上调并且促进溶骨性炎症因子的产生;在JQ1存在时,BRD4和溶骨性炎症因子产生显著减少,表明BRD4可能在Ti颗粒诱导溶骨性炎症因子产生的机制中起作用[9]。本研究旨在进一步探讨BRD4在Ti颗粒体外诱导破骨细胞生成和破骨细胞骨吸收功能中的作用。
本文研究Q-PCR结果显示,在Ti颗粒诱导的RAW264.7巨噬细胞中[STBX]BRD4表达上调,与相关研究结果一致[9];并且伴随着破骨细胞相关基因CK、TRAP、[STBX]TRAF6、NFATc1以及c-Fos mRNA表达升高,而BRD4抑制剂JQ1可以显著降低Ti颗粒诱导的RAW264.7巨噬细胞中破骨细胞相关基因CK、TRAP、[STBX]TRAF6、NFATc1和c-Fos mRNA的表达,说明[STBX]BRD4参与了Ti颗粒诱导破骨细胞相关基因的表达。本文进一步探讨了BRD4对Ti颗粒诱导破骨细胞形成和骨吸收功能的影响,TRAP染色结果显示,Ti颗粒可促进破骨细胞生成和分化,而抑制BRD4则减弱了Ti颗粒诱导的破骨细胞形成和分化;此外,OAP结果表明,Ti颗粒可促进破骨细胞骨吸收功能,而JQ1能显著抑制Ti颗粒体外诱导的破骨细胞骨吸收功能。
綜上所述,Ti颗粒处理RAW264.7巨噬细胞可通过上调BRD4的表达,促进破骨细胞生成和破骨细胞骨吸收功能,抑制BRD4表达可抑制Ti颗粒诱导的破骨细胞的形成和破骨细胞骨吸收的功能,但其具体分子调控机制仍有待研究。应用动物模型进一步研究BRD4在Ti颗粒诱导骨溶解中的作用,从表观遗传学的角度对磨损颗粒诱导假体周围骨溶解的发病机制提供了新的补充,同时也为预防和治疗磨损颗粒诱导假体周围骨溶解和假体无菌性松动找到了新的治疗靶点和理论依据。
[参考文献]
[1]LEARMONTH I D, YOUNG C, RORABECK C. The operation of the century: total hip replacement[J]. Lancet (London, England), 2007,370(9597):1508-1519.
[2]WANG Q, GE G R, LIANG X L, et al. Punicalagin ameliorates wear-particle-induced inflammatory bone destruction by bi-directional regulation of osteoblastic formation and os-teoclastic resorption[J]. Biomaterials Science, 2020,8(18):5157-5171.
[3]LIAO S J, FENG W, LIU Y, et al. Inhibitory effects of biochanin A on titanium particle-induced osteoclast activation and inflammatory bone resorption via NF-κB and MAPK pathways[J]. Journal of Cellular Physiology, 2021,236(2):1432-1444.
[4]HU X Y, PING Z C, GAN M F, et al. Theaflavin-3,3-digallate represses osteoclastogenesis and prevents wear debris-in-duced osteolysis via suppression of ERK pathway[J]. Acta Biomaterialia, 2017,48:479-488.
[5]XIAO Y J, LIANG L Q, HUANG M C, et al. Bromodomain and extra-terminaldomainbromodomaininhibitionprevents synovial inflammation via blocking IκB kinase-dependent NF-κB activation in rheumatoid fibroblast-like synoviocytes[J]. Rheumatology (Oxford, England), 2016,55(1):173-184.
[6]JACQUES C, LAVAUD M, GEORGES S, et al. BET bromodomains functions in bone-related pathologies[J]. Epi-genomics, 2020,12(2):127-144.
[7]LAMOUREUX F, BAUDHUIN M, RODRIGUEZ CALLEJA L, et al. Selective inhibition of BET bromodomain epigenetic signalling interferes with the bone-associated tumour vicious cycle[J]. Nature Communications, 2014,5:3511.
[8]BAUDHUIN M, LAMOUREUX F, JACQUES C, et al. Inhibition of BET proteins and epigenetic signaling as a potential treatment for osteoporosis[J]. Bone, 2017,94:10-21.
[9]REN Y Z, ZHANG Y T, WANG Z, et al. Role of Brd4 in the production of inflammatory cytokines in mouse macrophages treated with titanium particles[J]. Canadian Journal of Phy-siology and Pharmacology, 2019,97(11):1028-1034.
[10]DOBZYNIAK M, FEHRING T K, ODUM S. Early failure in total hip arthroplasty[J]. Clinical Orthopaedics and Related Research, 2006,447:76-78.
[11]KANDAHARI A M, YANG X L, LAROCHE K A, et al. A review of UHMWPE wear-induced osteolysis: the role for early detection of the immune response[J]. Bone Research, 2016,4:16014.
[12]TANIGUCHI Y. The bromodomain and extra-terminal domain (BET) family: functional anatomy of BET paralogous proteins[J]. International Journal of Molecular Sciences, 2016,17(11): E1849.
[13]FILIPPAKOPOULOS P, QI J, PICAUD S, et al. Selective inhibition of BET bromodomains[J]. Nature, 2010,468(7327):1067-1073.
[14]JIANG Y P, JIA T H, WOOLEY P H, et al. Current research in the pathogenesis of aseptic implant loosening asso-ciated with particulate wear debris[J]. Acta Orthopaedica Belgica, 2013,79(1):1-9.
[15]GALLO J, GOODMAN S B, KONTTINEN Y T, et al. Os-teolysis around total knee arthroplasty: a review of pathogenetic mechanisms[J]. Acta Biomaterialia, 2013,9(9):8046-8058.
[16]JIANG Y P, JIA T H, GONG W M, et al. Titanium particle-challenged osteoblasts promote osteoclastogenesis and osteolysis in a murine model of periprosthestic osteolysis[J]. Acta Biomaterialia, 2013,9(7):7564-7572.
[17]LONGHOFER L K, CHONG A, STRONG N M, et al. Specific material effects of wear-particle-induced inflammation and osteolysis at the bone-implant interface: a rat model[J]. Journal of Orthopaedic Translation, 2017,8:5-11.
[18]ZHANG Q G, QIAN J, ZHU Y C. Targeting bromodomain-containing protein 4 (BRD4) benefits rheumatoid arthritis[J]. Immunology Letters, 2015,166(2):103-108.
[19]MENG S, ZHANG L, TANG Y, et al. BET inhibitor JQ1 blocks inflammation and bone destruction[J]. Journal of Den-tal Research, 2014,93(7):657-662.
[20]GUO N H, ZHENG J F, ZI F M, et al. I-BET151 suppresses osteoclast formation and inflammatory cytokines secretion by targetting BRD4 in multiple myeloma[J]. Bioscience Reports, 2019,39(5): BSR20181245.
[21]KLEIN K, KABALA P A, GRABIEC A M, et al. The bromodomain protein inhibitor I-BET151 suppresses expression of inflammatory genes and matrix degrading enzymes in rheumatoid arthritis synovial fibroblasts[J]. Annals of the Rheumatic Diseases, 2016,75(2):422-429.
(本文編辑黄建乡)
