BGN基因在胃癌中的表达及与预后相关性
2022-05-30赵浚江,刘皓,郑自文,刘波,张登云,张坚
赵浚江,刘皓,郑自文,刘波,张登云,张坚

[摘要]目的 探討双糖链蛋白多糖(BGN)基因在胃癌中的表达及与预后的相关性。方法 收集Oncomine数据库中关于BGN的数据信息,对其在胃癌中的差异表达进行统计分析。利用GEPIA2数据库对BGN的表达情况进行验证。对胃癌中BGN参与的通路进行富集分析。利用TCGA数据库分析BGN与胃癌总生存期(OS)、肿瘤特异性生存期(DSS)和无疾病间隔(PFI)的相关性。结果 从Oncomine数据库中纳入不同肿瘤BGN表达的研究共计421项。经过筛选,涉及BGN在胃癌组织和癌旁组织中具有表达差异的研究共5项(包含298例样本),对5项研究进行meta分析显示,与癌旁组织相比,BGN在胃癌组织中均呈高表达(P<0.05)。利用GEPIA2数据库进行分析验证,BGN在胃癌样本中呈现显著高表达。富集分析显示,BGN在胃癌中的表达可能与同种异体排斥、顶端连接、凋亡信号通路密切相关。自TCGA数据库中提取数据分析显示,BGN表达与OS、DSS、PFI呈负相关(P<0.05)。结论 BGN在胃癌组织中高表达,且与胃癌预后显著相关,可能为肿瘤药物的开发提供分子靶点。
[关键词]胃肿瘤;双糖链蛋白多糖;基因表达;预后;计算生物学
[中图分类号]R735.2
[文献标志码]A
[文章编号]2096-5532(2022)04-0500-05
doi:10.11712/jms.2096-5532.2022.58.110[HT]
[开放科学(资源服务)标识码(OSID)]
[网络出版]https://kns.cnki.net/kcms/detail/37.1517.R.20220622.1623.008.html;[JY]2022-06-2410:59:11
EXPRESSION OF THE BGN GENE IN GASTRIC CANCER AND ITS CORRELATION WITH PROGNOSIS
ZHAO Junjiang, LIU Hao, ZHENG Ziwen, LIU Bo, ZHANG Dengyun, ZHANG Jian
(Department of Gastrointestinal Surgery, The Affiliated Hospital of Qingdao University, Qingdao 266003, China)
[ABSTRACT]Objective[WTBZ] To investigate the expression of the biglycan (BGN) gene in gastric cancer and its correlation with prognosis.
Methods The data of BGN in Oncomine database were used for analysis of its differential expression in gastric can-cer. GEPIA2 database was used to verify the expression of BGN. Enrichment analysis was performed for pathways involving BNG in gastric cancer. Data from the TCGA database were used to examine the correlations of BGN with overall survival, disease speci-fic survival, and disease-free interval in gastric cancer.
Results A total of 421 studies on BGN expression in various tumors were retrieved from the Oncomine database. Of these, 5 studies reported the differential expression of BGN between gastric cancer tissues and normal gastric tissues (298 samples). A meta-analysis showed that BGN was highly expressed in gastric cancer tissues (P<0.05). Verification with GEPIA2 database confirmed that BGN was significantly highly expressed in gastric cancer samples. Enrichment analysis showed that the expression of BGN in gastric cancer may be closely related to allograft rejection, apical junction, and apoptotic signaling pathways. Data extracted from TCGA database showed that BGN expression was negatively correlated with overall survival, disease specific survival, and disease-free interval (P<0.05).
Conclusion BGN is highly expressed in gastric cancer tissues and is significantly correlated with the prognosis of gastric cancer, which may provide a molecular target for the development of antitumor drugs.
[KEY WORDS] stomach neoplasms; biglycan; gene expression; prognosis; computational biology
胃癌是全世界最常见的恶性肿瘤之一,由于缺乏有效的治疗方法,其预后较差[1]。中国的胃癌发病率很高[2]。胃癌发生是一个复杂的生物过程,涉及多种因素、基因和分期,具有高度异质性。寻找新的、特异性的生物标志物对胃癌的诊断和治疗具有重要的临床价值,揭示关键基因在胃癌发病过程中的作用机制,可以为抗肿瘤实验奠定基础,为胃癌治疗提供新的选择。双糖链蛋白多糖(BGN)基因是编码富含亮氨酸的小分子蛋白多糖家族的成员[3]。BGN的主要功能包括调节基质装配、细胞迁移、细胞黏附、骨骼矿化、炎症、细胞生长、自噬以及细胞凋亡等[4-6]。因此,BGN参与了多种生理和病理生理过程,包括肿瘤发生[7]。BGN在肿瘤发生中的作用目前尚存在争议。有研究发现,在结直肠癌细胞中,BGN过表达参与了血管内皮生长因子受体信号的激活和细胞外信号激酶途径的调节,促进肿瘤的发生[8]。但是在膀胱癌中,BGN基因沉默导致肿瘤细胞增殖增强,表明BGN在该疾病中起肿瘤抑制作用[9]。目前,BGN对胃癌发生发展作用的相关研究较少。因此,本研究利用相关数据库分析BGN在胃癌中的表达及与预后的相关性,以期更好地理解BGN在胃癌发生发展中的作用,从而促进新治疗方法的开发。
1资料与方法
1.1数据检索及筛选
本研究从Oncomine肿瘤信息数据库(https://www.oncomine.org/)中检索BGN相关数据,根据以下检索条件进行筛选:①基因名称为BGN;②癌症类型为Gastric cancer;③数据类型为mRNA;④分析对照类型为Cancer vs Normal Analysis;⑤临界值设定条件为P value<0.05,fold change(FC)>2,gene rank=top 10%。
1.2BNG基因表达验证
利用GEPIA2数据库(http://gepia2.cancer-pku.cn)的TCGA数据集和GETX数据集对BGN基因在肿瘤组织中的表达进行验证。设置筛选条件如下:①gene为BGN;②methods为ANOVA;③|Log2FC| Cutoff为2;④q value Cutoff为0.01;⑤Matched Normal data为Match TCGA normal data,Match TCGA normal and GTEX data;⑥Tissue为STAD。
1.3基因功能富集分析
收集了408例胃癌组织和36例正常胃组织的基因表达数据,这些数据来自癌症基因组图谱网站TCGA(https://www.cancer.gov/about-nci/orga-nization/ccg/research/structural-genomics/tcga)。
为研究胃癌中BGN表达相关的分子通路,采用基因集富集分析(GSEA)桌面软件进行GSEA,获得相关性排前3位的通路(P value<0.05)。
1.4预后分析
从TCGA官方网站胃癌项目中获得基因表达数据(胃癌组织与正常胃组织)和临床信息,剔除临床信息不够完整的数据。对于最终保留的病人数据,使用sangerbox进行生存曲线绘制。总生存期(OS)定义:诊断日期至死亡日期之间的时间[10]。无疾病间隔(PFI)定义:胃癌手术至检测到复发之间的时间[11]。疾病特异性生存期(DSS)定义:结局指标为癌症相关死亡,它与癌症生物学和治疗效果有更大的关系[12]。
1.5统计学方法
采用SPSS 24.0软件进行统计分析。Kaplan-Meier模型分析用于检验BGN与胃癌预后的相关性。以P<0.05为差异有统计学意义。
2结果
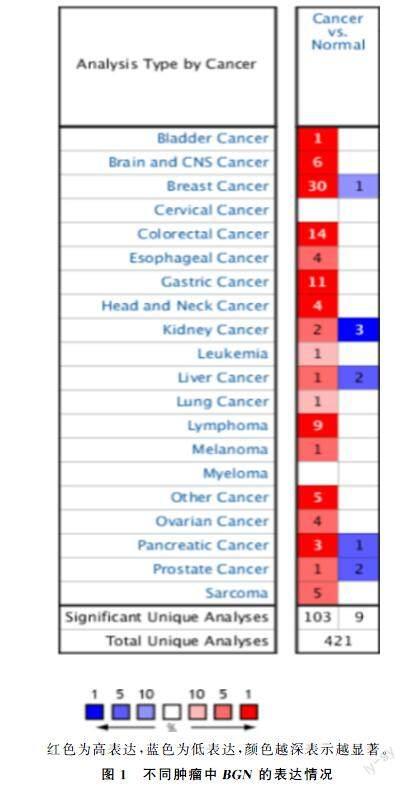
2.1不同肿瘤中BGN的表达情况
对Oncomine数据库进行检索,并分析BGN基因在肿瘤与正常组织中的差异表达情况。共检索到相关研究421项,其中BGN基因在肿瘤组织中呈高表达的研究103项,呈低表达的研究9项。对检索的结果进行筛选,在涉及胃癌的相关研究中,BGN基因在胃癌组织中呈高表达的研究11项,呈低表达的研究0项。见图1。
2.2BGN在胃癌组织中的表达
对Oncomine数据库检索结果分析显示,BGN基因在胃癌组织及癌旁组织中存在表达差异的研究共5项(共有12个芯片数据集,包含298例组织样本)。将此12个数据集相关研究进行meta分析,结果显示,BGN在所有差异表达基因中的中位数值排名为70.5(P<0.001),提示该基因在胃癌组织中显著高表达。见图2。
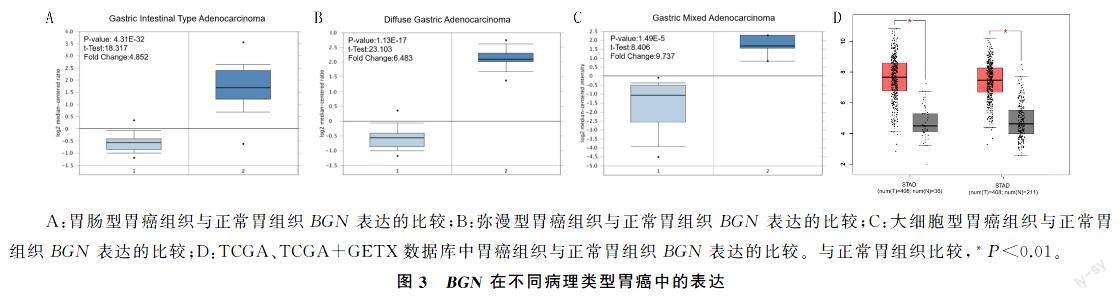
2.3BGN在不同病理类型胃癌中的表达
在Oncomine数据库中检索不同病理类型胃癌BGN表达的研究,对研究结果分析显示,与正常胃组织相比较,BGN基因在胃肠型胃癌(t=18.317,P<0.001)、弥漫型胃癌(t=23.103,P<0.001)和大细胞型胃癌(t=8.406,P<0.001)组织中均呈显著高表达(图3A~C)。利用GEPIA2数据库,对从TCGA和GETX数据库中筛选的胃癌组织与正常組织样本的研究结果(筛选条件为|Log2FC|>1,P<0.01)进行验证,结果显示,与211例正常组织样本比较,BGN在408例胃癌组织样本中也呈现高表达(图3D)。
2.4胃癌中BGN基因功能的富集分析
為了确定胃癌中可能的BGN相关通路,使用TCGA胃癌数据集的数据进行GSEA,结果显示,BGN在胃癌中的表达可能与同种异体排斥、顶端连接、凋亡信号通路密切相关。见图4。
2.5BGN表达与胃癌病人预后的关系
自TCGA数据库中下载胃癌病人相关临床数据进行分析。根据临床结局情况,分别进行筛选。分别对441例病人的OS结局、420例病人的DSS结局及435例病人的PFI结局进行Kaplan-Meier Plotter分析,以比较BGN表达与胃癌病人不同预后结局间相关性。结果显示,BGN表达水平与胃癌病人OS、DSS、PFI均呈显著负相关(P=0.002~0.039),BGN高表达病人的OS、DSS和PFI均明显短于BGN低表达病人。见图5。
3讨论
胃癌是一种常见的恶性肿瘤,是世界范围内因肿瘤死亡的主要原因。目前外科手术是治疗胃癌的主要手段,但手术治疗具有较高的复发率。靶向治疗是治疗癌症的新策略与新方法,但是目前胃癌仍缺乏有效的靶向治疗。所以,寻找潜在的胃癌相关基因有助于胃癌的治疗与预后判断。同时,炎症和肿瘤发展之间的关系被越来越多的证据证实。虽然炎症在组织损伤修复与对抗病原体中有着重要作用,但是如果炎症消退不及时会使得免疫细胞浸润,伴随产生大量的免疫细胞因子、趋化因子等,这些免疫因子会引起组织的再次损伤与炎性反应,改变免疫微环境,从而在一定程度上促进肿瘤的发生发展。
BGN基因与炎症密切相关,可能作为肿瘤发生发展的重要因子参与癌症的进程。有研究显示,BGN在人类胰腺癌、卵巢癌、结肠癌等肿瘤组织中均存在过表达[13-15]。本文结果显示,BGN的表达与同种异体排斥、顶端连接、凋亡信号通路密切相关。细胞凋亡是指为维持内环境稳定,由基因控制的细胞自主的有序的死亡。已有研究表明,BGN与肿瘤细胞凋亡密切相关,BGN的缺失通过细胞凋亡促进细胞死亡,BGN的表达干扰胃癌病人抗凋亡和促凋亡基因的调节,提示BGN参与的细胞凋亡途径可能是治疗胃癌的一个靶点[16-17]。关于同种异体排斥、顶端连接相关的信号通路对癌症作用的研究较少,推测BNG可能通过参与这些通路,直接或间接地参与胃癌的发生发展,但这种猜想需要进一步的研究证明。既往有研究结果显示,BGN可通过TLR2/4-NF-κB和P2X7-NLRP3-caspase-1信号通路直接参与肿瘤的调控,同时可以通过下游递质,如活性氧(ROS)、血管内皮生长因子(VEGF)间接影响肿瘤的发生发展进程[18]。
慢性炎症在胃癌的进展和转移中起着至关重要的作用[19]。慢性胃炎已被证明是胃癌的关键病因,控制胃部炎性反应被认为是临床预防胃癌发生的有效方法,但胃部炎症导致胃癌的机制还需要进一步探索。ROS、VEGF主要参与炎症介导的损伤,多数研究发现胃癌组织中ROS、VEGF的含量增加,表明二者参与了肿瘤的进程[20-21]。炎症反应中公认的细胞内信号通路之一是核因子κB(NF-κB)信号通路。Toll样受体(TLR)基因(特别是[STBX]TLR2、TLR4和TLR10)在宿主防御中起重要作用[22]。目前研究表明,在胃癌组织中,TLR4蛋白基本呈高表达状态,且其表达可能与肿瘤恶性侵袭、转移、TNM分期密切相关[23]。NLRP3炎性小体作为目前研究较为广泛的复杂炎性体,激活后可通过活化半胱天冬酶-1,剪切白细胞介素(IL)-1β或IL-18,引起大量炎症因子的释放,IL-1β及IL-18等炎性因子的过表达在肿瘤的逐步演进过程中起着重要作用[24]。结直肠癌、乳癌等组织中NLRP3的表达水平均明显高于对应的正常组织[25]。有研究结果显示,NF-κB蛋白在胃癌组织中的阳性染色率(71.43%)明显高于癌旁正常切缘(23.81%),NLRP3的阳性染色率(78.57%)也显著高于癌旁正常切缘(16.67%)[26]。BGN基因通过参与调控TLR2/4-NF-κB和P2X7-NLRP3-caspase-1信号通路可能在胃癌的发展中起到重要作用。但胃癌中BGN与下游信号通路的关系机制较为复杂且不十分清楚,仍需通过进一步的实验研究进行探讨。
综上所述,本研究使用生物信息学的方法,基于Oncomine、GEPIA2与TCGA数据库的联合分析显示,BGN基因在胃癌组织中高表达,且与病人的OS、DSS和PFI有关。表明BGN基因参与了胃癌的重要进程,并影响其预后。检测胃癌组织中BGN的表达有助于评估病人的风险状况和预后。BGN有可能成为肿瘤治疗的新靶点,为胃癌的治疗提供新的方向。
[参考文献]
[1]YOUN Y H, BYUN H J, YOON J H, et al. Long noncoding RNA N-BLR upregulates the migration and invasion of gastric adenocarcinoma[J]. Gut and Liver, 2019,13(4):421-429.
[2]LI J J, HU B B, FANG L, et al. Barrier-to-autointegration factor 1: a novel biomarker for gastric cancer[J]. Oncology Letters, 2018,16(5):6488-6494.
[3]MYREN M, KIRBY D J, NOONAN M L, et al. Biglycan potentially regulates angiogenesis during fracture repair by altering expression and function of endostatin[J]. Matrix Biology: Journal of the International Society for Matrix Biology, 2016,52-54:141-150.
[4]RECKTENWALD C V, LEISZ S, STEVEN A, et al. HER-2/neu-mediated down-regulation of biglycan associated with altered growth properties[J]. The Journal of Biological Chemistry, 2012,287(29):24320-24329.
[5]CHEN S J, GUO D D, LEI B B, et al. Biglycan protects human neuroblastoma cells from nitric oxide-induced death by inhibiting AMPK-mTOR mediated autophagy and intracellular ROS level[J]. Biotechnology Letters, 2020,42(4):657-668.
[6]YANG Y F, WANG R, FENG L, et al. LINC00460 promotes cell proliferation, migration, invasion, and epithelial-mesenchymal transition of head and neck squamous cell carcinoma via miR-320a/BGN axis[J]. OncoTargets and Therapy, 2021,14:2279-2291.
[7]SUBBARAYAN K, LEISZ S, WICKENHAUSER C, et al. Biglycan-mediated upregulation of MHC class Ⅰ expression in HER-2/neu-transformed cells[J]. Oncoimmunology, 2018,7(4):e1373233.
[8]XING X J, GU X H, MA T F, et al. Biglycan up-regulated vascular endothelial growth factor (VEGF) expression and promoted angiogenesis in colon cancer[J]. Tumor Biology, 2015,36(3):1773-1780.
[9]NIEDWOROK C, RCK K, KRETSCHMER I, et al. Inhibitory role of the small leucine-rich proteoglycan biglycan in bladder cancer[J]. PLoS One, 2013,8(11):e80084.
[10]WOLANCZYK M J, FAKHRIAN K, ADAMIETZ I A. Radiotherapy, bisphosphonates and surgical stabilization of complete or impending pathologic fractures in patients with metastatic bone disease[J]. Journal of Cancer, 2016,7(1):121-124.
[11]HA J H, HONG K Y, LEE H B, et al. Oncologic outcomes after immediate breast reconstruction following mastectomy: comparison of implant and flap using propensity score matching[J]. BMC Cancer, 2020,20(1):78.
[12]RIVERA M, RICARTE-FILHO J, TUTTLE R M, et al. Molecular, morphologic, and outcome analysis of thyroid carcinomas according to degree of extrathyroid extension[J]. Thyroid: Official Journal of the American Thyroid Association, 2010,20(10):1085-1093.
[13]APRILE G, AVELLINI C, RENI M, et al. Biglycan expression and clinical outcome in patients with pancreatic adenocarcinoma[J]. Tumour Biology, 2013,34(1):131-137.
[14]PAN S, CHENG L H, WHITE J T, et al. Quantitative proteomics analysis integrated with microarray data reveals that extracellular matrix proteins, catenins, and p53 binding protein 1 are important for chemotherapy response in ovarian cancers[J]. Omics: a Journal of Integrative Biology, 2009,13(4):345-354.
[15]MIKULA M, RUBEL T, KARCZMARSKI J, et al. Integrating proteomic and transcriptomic high-throughput surveys for search of new biomarkers of colon tumors[J]. Functional & Integrative Genomics, 2011,11(2):215-224.
[16]PINTO F, SANTOS-FERREIRA L, PINTO M T, et al. The extracellular small leucine-rich proteoglycan biglycan is a key player in gastric cancer aggressiveness[J]. Cancers, 2021,13(6):1330.
[17]XU X B, LAI Y Y, HUA Z C. Apoptosis and apoptotic body: disease message and therapeutic target potentials[J]. Bios-cience Reports, 2019,39(1):BSR20180992.
[18]SCHAEFER L, TREDUP C, GUBBIOTTI M A, et al. Proteoglycan neofunctions: regulation of inflammation and autophagy in cancer biology[J]. The FEBS Journal, 2017,284(1):10-26.
[19]TANG S L, LIN L, CHENG J N, et al. The prognostic value of preoperative fibrinogen-to-prealbumin ratio and a novel FFC score in patients with resectable gastric cancer[J]. BMC Can-cer, 2020,20(1):382.
[20]HOLSHOUSER S, DUNWORTH M, MURRAY-STE-WART T, et al. Dual inhibitors of LSD1 and spermine oxidase[J]. MedChemComm, 2019,10(5):778-790.
[21]YOU X, MA M Z, HOU G X, et al. Gene expression and prognosis of NOX family members in gastric cancer[J]. OncoTargets and Therapy, 2018,11:3065-3074.
[22]TOSCANO J H B, OKINO C H, DOS SANTOS I B, et al. Innate immune responses associated with resistance against Haemonchus contortus in Morada Nova sheep[J]. Journal of Immunology Research, 2019, 2019:3562672.
[23]LIU J M, LIU J N, WEI M T, et al. Effect of [STBX]IL-18 gene promoter polymorphisms on prostate cancer occurrence and prognosis in Han Chinese population[J]. Genetics and Molecular Research: GMR, 2013,12(1):820-829.
[24]CAMPBELL L, RAHEEM I, MALEMUD C J, et al. The relationship between NALP3 and autoinflammatory syndromes[J]. International Journal of Molecular Sciences, 2016,17(5):E725.
[25]DAI G L, JIANG Z T, SUN B T, et al. Caffeic acid phenethyl ester prevents colitis-associated cancer by inhibiting NLRP3 inflammasome[J]. Frontiers in Oncology, 2020,10:721.
[26]曾騫. TLR4、NF-κB、NLRP3在胃癌组织中的表达及意义[D]. 泸州:西南医科大学, 2019.
(本文编辑马伟平)
