沙雷氏Z4 菌株Tn5 转座突变株的群体淬灭活性筛选体系的建立及优化
2022-05-30杨惠婷赵一竹杨瑞雪葛世玫
杨惠婷,刘 栋,赵一竹,杨瑞雪,葛世玫
(温州大学生命与环境科学学院,浙江温州 325035)
群体感应(Quorum Sensing,QS)现象普遍存在于微生物群落中,指微生物在生长过程中根据群体密度变化而调控基因表达的一种生理行为[1-3].研究发现[4],微生物QS 是通过自诱导因子(Autoinducer,AI)的浓度调控基因表达.目前发现的自诱导因子包含N-酰基高丝氨酸内脂(Acyl Homoserine Lactone,AHL)[5]、自诱导因子2(Autoinducer-2,AI-2)[6]、扩散信号因子(Diffusible Signaling Factor,DSF)[7]等.其中,AHL 信号分子主要由高丝氨酸内酯环和酰基侧链组成,侧链依据不同长度可分为C4-C18 等多种类型.细菌通过群体感应系统调控多种生理行为,如生物膜的形成与成熟[8]、生物发光现象[9]、毒力因子产生[10]等.群体感应给环境、农业、医药等行业领域发展带来机遇的同时也带来困难和挑战,因此干扰细菌的群体感应系统是目前研究的热点之一.群体淬灭(Quorum Quenching,QQ)是指在不影响细菌生长的情况下,阻断或干扰群体感应,抑制或者破坏细菌QS 系统,从而阻断细菌信息交流的一种有力手段[11],常被应用于疾病控制和减缓生物膜污染等[12-13]方面.尽管已在Rhodococcussp.[13]、Bacillussp.[14-15]、Serratiasp.[16]等多种属细菌中发现QQ 现象,但对其作用机理仍知之甚少.
我们课题组前期已筛选出一株具有高效群体淬灭能力的沙雷氏Z4 菌(Serratiasp.Z4),本研究采用Tn5 转座子插入突变技术,构建沙雷氏Z4 菌突变体库.通过研究不同供受体混合比例、不同培养时间、不同抗生素选择压力以及不同菌株生长状态对突变的影响,进一步优化Tn5 转座突变条件.在此基础上,研究优化条件后获得的突变株对两种AHL 信号分子——N-己酰基-L-高丝氨酸内酯(C6-HSL)和N-辛酰基-L-高丝氨酸内酯(C8-HSL)的降解能力,筛选具有QQ 能力差异的沙雷氏Z4 突变株,为未来Z4 菌更好地应用提供分子技术及基础理论.
1 实验材料
1.1 菌株与质粒
本实验使用的菌株及质粒见表1.其中,沙雷氏Z4 菌株是本实验室从温州市经济开发区滨海工业区第一污水处理厂采集的污泥中分离获得;大肠杆菌S17-1 作为双亲本接合实验的供体菌;质粒pRL1063a 是经过改造的具有Tn5 转座子的自杀载体;紫色色杆菌CV026 和根癌农杆菌KYC55 购自于北京百欧博伟生物技术有限公司,作为群体感应生物传感器.

表1 菌株及质粒
1.2 培养基
LB 培养基(g/L).胰蛋白胨10、酵母浸出粉5、氯化钠10.调pH 7.4-7.5 之间,121℃高压灭菌30 min.固体培养基加入1.5%的琼脂粉.
AT 培养基(g/L)[17].配置20X AT salt(g/L):硫酸铵40、硫酸镁1.56、七水硫酸铁0.1、一水硫酸锰0.044;配置20X AT buffe(g/L):磷酸二氢钾214,调pH 7.3;配置50%葡萄糖;各组分单独灭菌或过滤除菌.AT 培养基:20X AT salt 50 mL、20 X AT buffe 50 mL、50%葡萄糖10 mL、无菌水896 mL、1.5%琼脂粉.用于检测群体淬灭能力时,需加入相应的抗生素以及5-溴-4-氯-3-吲哚-β-D-半乳糖苷(X-gal).
1.3 实验试剂
试剂母液的配置见表2.
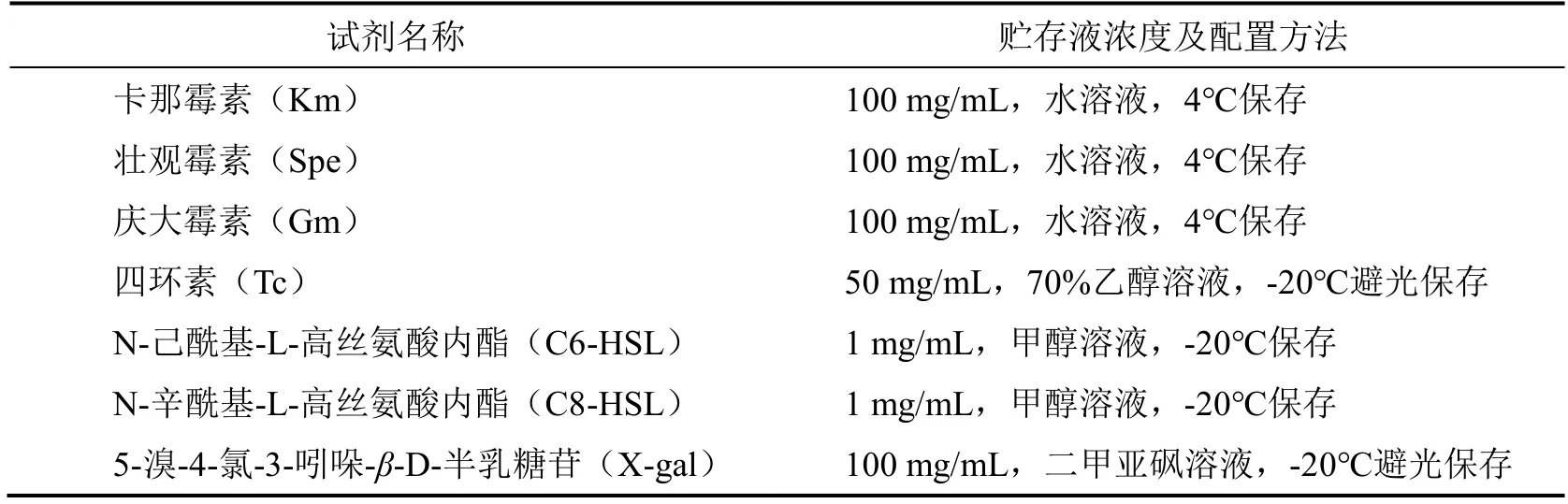
表2 试剂贮液的配置
2 实验方法
2.1 菌株活化
将所需的菌株分别在相应的培养基以及温度下活化,见表3.

表3 菌株培养条件
2.2 双亲本接合
借鉴张茜等[18]所采用的双亲本接合法,挑取供体菌大肠杆菌S17-1(pRL1063a)和受体菌沙雷氏Z4 菌单菌落,分别接于含有100 μg/mL Km 和25 μg/mL Tc 的LB 液体培养基中,振荡培养16 h;至对数生长期(OD600为1.500 左右)分别收集供体菌及受体菌以1∶1 比例混合,12 000 rpm离心2 min,弃上清;加入1 mL LB 液体培养基重悬浮后,30℃振荡培养3 h,使两者充分接合;取50 μL 菌液涂布于含有50 μg/mL Km 和25 μg/mL Tc 的LB 固体培养基,30℃培养24 h.
2.3 Tn5 转座突变株的PCR 验证
挑取双抗筛选固体培养基上的单菌落于新的LB 液体培养基上(含相应抗生素),根据分子克隆实验指南[19],提取突变株基因组DNA;根据pRL1063a 中的luxAB 序列设计合成特异性扩增引物(luxAB P1:5’-TTTGTTCGGCTTGGTATCGC-3’和luxAB P2:5’-ATTGCTTAGGTCCTTCT CA-3’),以突变株基因组DNA 为模板进行聚合酶链式反应(Polymerase Chain Reaction,PCR)验证.PCR 反应体系及反应程序见表4.

表4 PCR 反应体系及反应程序
2.4 转座突变条件优化
采用单因素实验,在其他条件不变的情况下,分别改变Tn5 转座子插入突变中的供体菌和受体菌的混合比例(1∶1、1∶2、1∶3、1∶4、1∶5)、供受体菌混合培养时间(1 h、3 h、5 h)、抗生素选择压力(Km 含量分别为100 μg/mL、75 μg/mL、50 μg/mL 和25 μg/mL、Tc=25 μg/mL)以及沙雷氏Z4 菌的生长状态(OD600分别为0.200、1.500 和4.000),统计长出的突变株数量,获得最佳的转座突变条件.
2.5 群体淬灭差异突变株筛选
在优化的突变条件下进行沙雷氏Z4 菌株Tn5 转座突变,建立沙雷氏Z4 菌株突变体库.具体步骤如下:将2.3 中PCR 验证为阳性的突变株接于同时含有50 μg/mL Km 和25 μg/mL Tc 的LB液体培养基中,30℃振荡培养12-16 h;用无菌LB 液体培养基稀释Z4 突变株OD600至2.600-2.700 之间;取10 mL 菌液,加入信号分子C6-HSL 或C8-HSL 至终浓度为10 μmol/L,30℃振荡培养4 h;取培养液过滤除菌,作为待测液,-20℃保存备用.
紫色色杆菌CV026 报告菌为紫色色杆菌ATCC31532 的mini-Tn5 的突变体[20],自身不能合成AHLs 信号分子,当出现外源AHLs 信号分子时,会产生紫色色素[20].本实验借鉴李晴等[21]群体淬灭活性检测方法,将CV026 接种于含50 μg/mL Km 的LB 液体中,30℃振荡培养至OD600为1.000 左右;加热融化100 mL 的LB 固体培养基,静置冷却至40℃-50℃,加入终浓度为50 μg/mL Km 和10 mL OD600为1.000 左右的CV026 菌液,倒固体培养基冷却凝固,打孔,加入待测液,30℃正置培养24 h,观察紫色圈大小,以C6-HSL 显色圈作为阳性对照.若具有QQ 能力,则待测液中的C6-HSL 会被降解而使得显色圈小于阳性对照;若无QQ 能力,则显色圈会同阳性对照的直径大小一致.
根癌农杆菌KYC55 报告菌在含有外源AHLs 信号分子和X-gal 的培养基中培养时,会产生大量的β-半乳糖苷酶与X-gal 反应呈现蓝色.本实验借鉴盛吉洋[22]的检测方法,将KYC55 接种于含相应抗生素的LB 液体培养基中,30℃振荡培养24 h;加热融化AT 固体培养基,静置冷却至40℃-50℃,加入相应抗生素、终浓度为100 μg/mL 的X-gal 和10 mL KYC55 菌液,打孔,加入待测液,30℃正置培养24 h,观察蓝色圈大小,以C8-HSL 显色圈作为阳性对照.若具有QQ 能力,则待测液中的C8-HSL 会被降解而使得显色圈小于阳性对照;若无QQ 能力,则显色圈会同阳性对照的直径大小一致.
用信号分子C6-HSL 和C8-HSL 作为阳性对照,Z4 野生型菌株降解信号分子作为阳性对照,水作为阴性对照.若观察到突变株降解信号分子的显色圈比Z4 野生型显色圈的直径大,则Tn5插入了编码群体淬灭酶基因中,从而获得群体淬灭缺失突变菌株.
3 结果与分析
3.1 沙雷氏Z4 菌株Tn5 转座突变株的PCR 鉴定
对沙雷氏Z4 菌株进行Tn5 转座突变,通过Km 和Tc 双抗筛选,构建了库容量较多的沙雷氏Z4 菌株突变体库.以随机挑选5 株Z4 突变株基因组DNA、Z4 野生型基因组DNA 以及pRL1063a 质粒DNA 为模板进行PCR 验证(图1),结果都得到了大小约为1.6 kb 的条带,与预期结果相符.说明Tn5 转座子已成功插入了沙雷氏Z4 菌株中,且获得了同时具有Km 以及Tc 抗性的沙雷氏Z4 菌株Tn5 转座突变体.
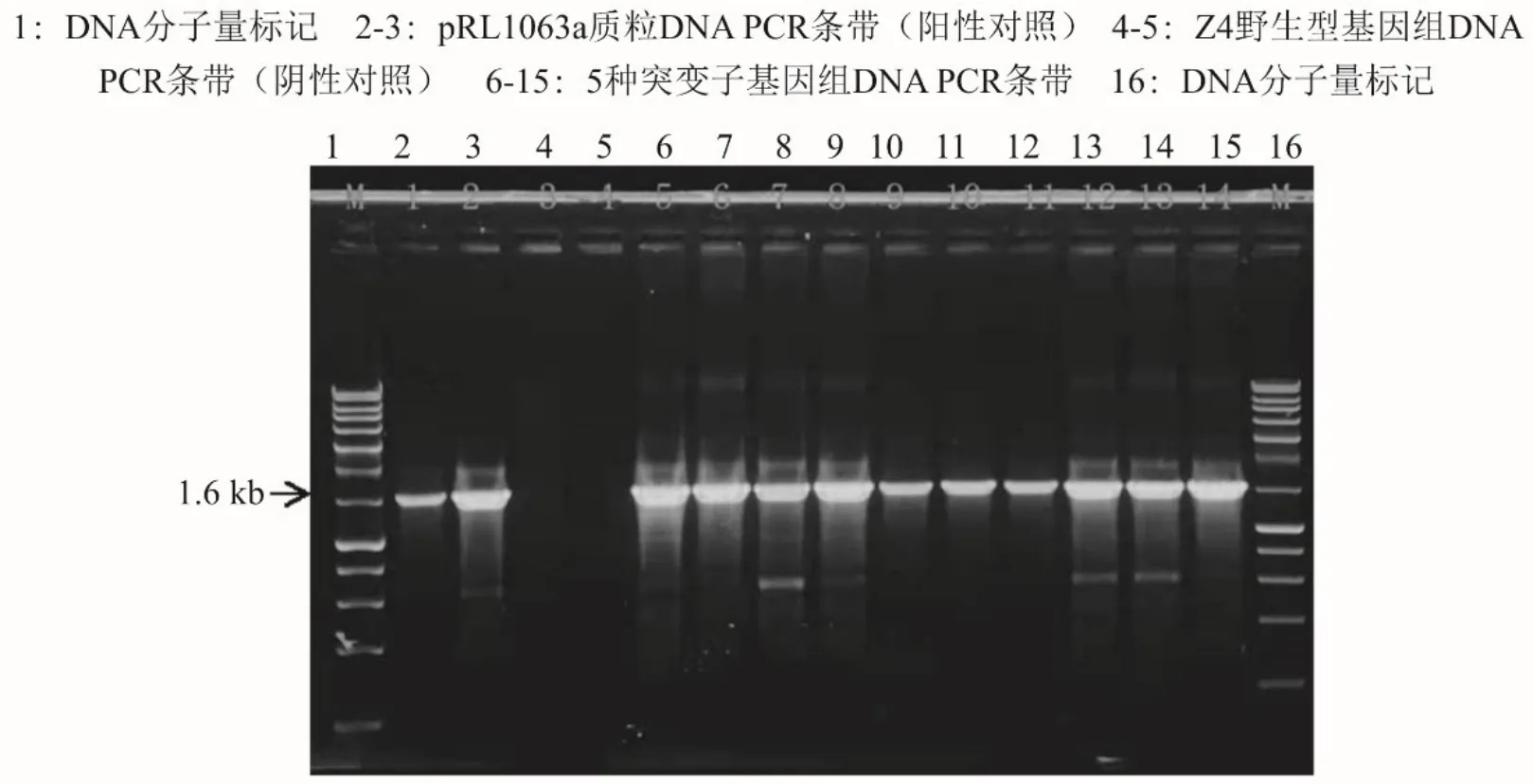
图1 沙雷氏Z4 突变株中Tn5 插入验证的PCR 图谱
3.2 供受体菌混合比例对Tn 转座突变效率的影响
研究表明[23]供体菌和受体菌之间的混合比例对筛选突变株非常关键,只有当受体菌数量适量高于供体菌时才能获得较高的突变株数量.收集菌浓一致的供体菌——大肠杆菌S17-1(pRL1063a)以及受体菌——沙雷氏Z4 菌菌液,将两者分别按照1∶1、1∶2、1∶3、1∶4、1∶5 的比例接种于含有50 μg/mL Km 和25 μg/mL Tc 的LB 固体培养基上,对长出的突变株进行统计(图2、图3).
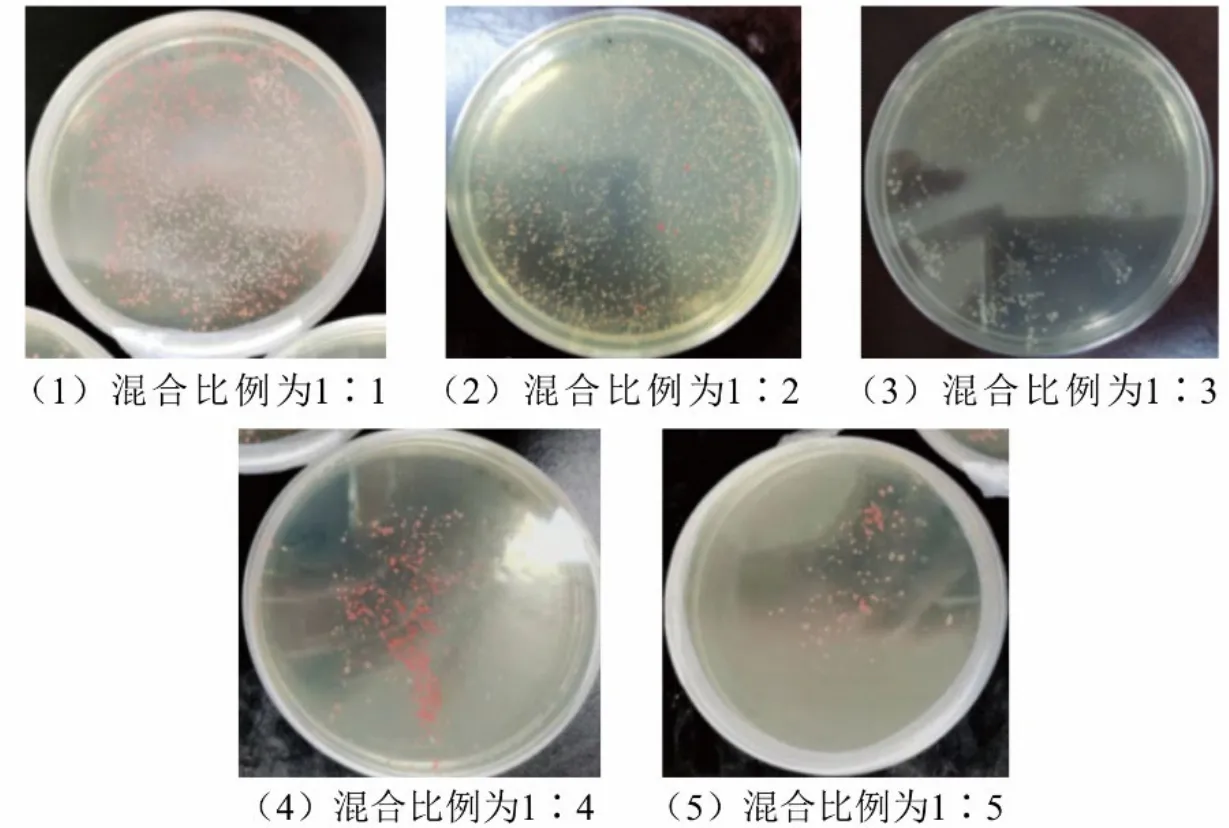
图2 不同比例混合的沙雷氏Z4 菌与大肠杆菌S17-1(pRL1063a)对Tn5 转座突变效率的影响
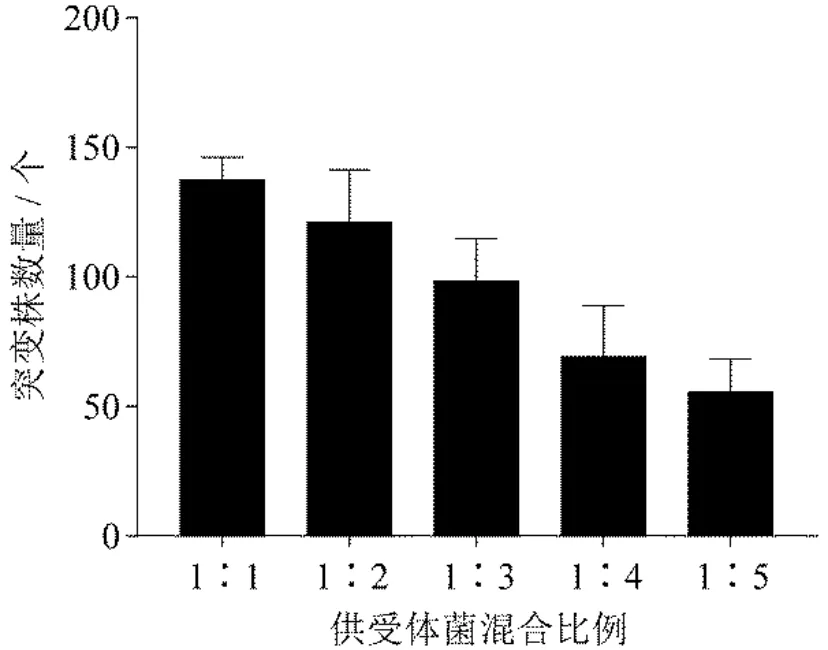
图3 不同比例混合的沙雷氏Z4 菌(受体菌)与大肠杆菌S17-1(pRL1063a)(供体菌)对Tn5 转座突变效率的影响
结果表明,供受体比例在1∶1 至1∶3 之间,Tn5 转座突变能获得较多的突变株,而随着沙雷氏Z4 菌数量逐渐增多,获得的突变株数量逐渐减少.可能是因为在30℃下沙雷氏菌生长速度快于大肠杆菌,当受体沙雷氏Z4 菌数量大大增加时,会抑制大肠杆菌S17-1(pRL1063a)的生长,导致Tn5 转座子只能插入少部分的沙雷氏Z4 菌中,使得突变株数量减少.因此,选择供受体菌混合比例为1∶1.
3.3 混合培养时间对Tn 转座突变效率的影响
以1∶1 比例混合的沙雷氏Z4 菌与大肠杆菌S17-1(pRL1063a),分别于30℃混合震荡培养1 h、3 h 和5 h,观察突变株生长情况(图4).结果表明,不同混合培养时间后,都可以长出很多的沙雷氏Z4 突变菌株,且随着混合培养时间延长,突变株的数量增多.说明,在双亲接合法中,供受体菌接合培养时间越长,接触越充分,Tn5 转座子插入突变的效率就越高.但随着混合培养时间延长,混合菌不断生长,突变株单菌落越来越密集,不利于后续单菌落挑取进行传代培养.因此,选择混合培养时间3 h 进行后续实验.
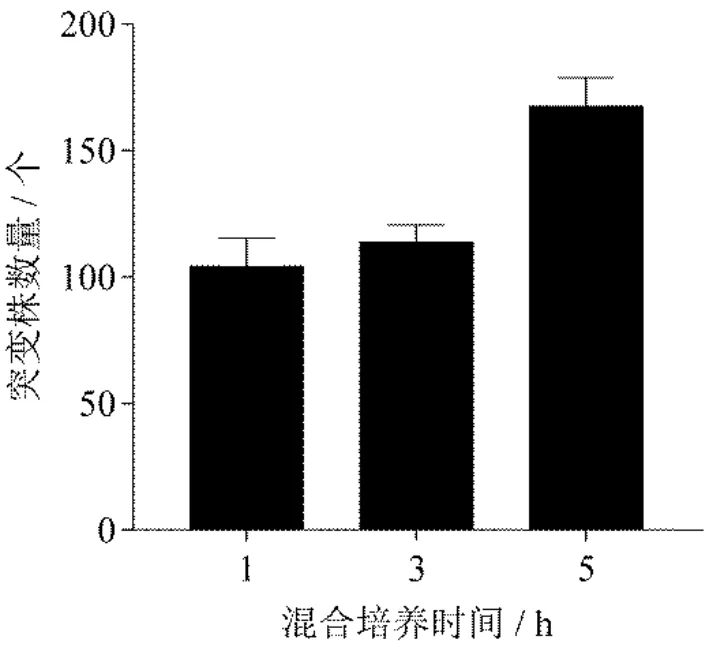
图4 混合培养时间对Tn5 转座突变效率的影响
3.4 抗生素选择压力对Tn 转座突变效率的影响
考虑到抗生素选择压力对沙雷氏Z4 菌转座突变的影响,本实验分别检测了大肠杆菌S17-1(pRL1063a)以及沙雷氏Z4 菌株对Km 和Tc 的敏感性(图5).结果表明,在分别含有100 μg/mL、75 μg/mL、50 μg/mL 和25 μg/mL Km LB 固体培养基上,沙雷氏Z4 菌的生长都受到抑制,而大肠杆菌S17-1(pRL1063a)在含有不同浓度的Km 固体培养基上都正常生长;在分别含有100 μg/mL、75 μg/mL、50 μg/mL 和25 μg/mL Tc 的LB 固体培养基上,大肠杆菌S17-1(pRL1063a)的生长都受到抑制,而沙雷氏Z4 菌在含有浓度分别为25 μg/mL、50 μg/mL 和75 μg/mL 的Tc 固体培养基上生长正常,但在含有100 μg/mL Tc 的固体培养基上则生长相对缓慢.
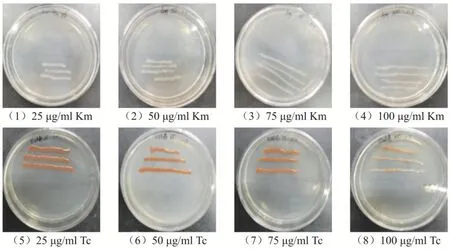
图5 沙雷氏Z4 菌株和大肠杆菌S17-1(pRL1063a)对Km、Tc 的敏感性分析
设定抗生素选择压力,其中Km 浓度分别为100 μg/mL、75 μg/mL、50 μg/mL 和25 μg/mL,Tc 固定不变为25 μg/mL.将50 μL 混合培养后的菌液涂布于对应不同抗生素选择压力的LB 固体培养基上,30℃培养24 h,对长出来的突变株进行统计(图6).结果表明,Km 浓度越高,长出的沙雷氏Z4 突变菌株就越少;在含25 μg/mL Km 和25 μg/mL Tc 的筛选固体培养基上,突变株数量众多,菌落密集难以分开,并且随机挑选突变株再次转接于含Km 和Tc 的LB 固体培养基上,所能长出的突变株很少,说明假阳性突变株多;而在含100 μg/mL Km 和25 μg/mL Tc 的固体培养基上,突变株数量少.因此,后续实验选择在50 μg/mL Km 和25 μg/mL Tc 的抗性LB 固体培养基上进行筛选.
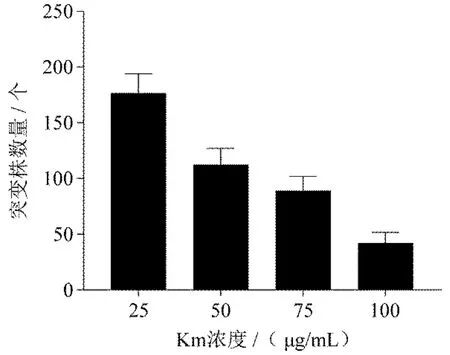
图6 不同抗生素选择压力对突变效率的影响
3.5 沙雷氏菌Z4 生长状态对Tn 转座突变效率的影响
对沙雷氏Z4 菌株的生长情况进行监测,每2 h 测一次OD600值,绘制沙雷氏Z4 菌株的生长曲线(图7).结果表明,0-2 h 内Z4 菌株位于迟缓期内(OD600范围在0-0.278),3-12 h 内位于对数生长期(OD600范围在0.400-3.500),13-14 h 位于平稳期(OD600范围在3.924-4.072).分别选择OD600为0.200、1.500、4.000 时期的沙雷氏Z4 菌株与大肠杆菌S17-1(pRL1063a)同比例混合,30℃培养3 h,涂布于双抗筛选培养基上,对长出的突变株进行统计(图8).结果表明,对处于迟缓期内的沙雷氏Z4 菌株进行转座突变,其突变效率低于对数生长期以及平稳期的沙雷氏Z4 菌株;而对处于对数生长期和平稳期的沙雷氏Z4 菌株进行转座突变,均能获得较多的突变株.平稳期的沙雷氏Z4 菌株的生长活力不如对数生长期[24],故选择对数生长期的沙雷氏Z4 菌株进行转座突变.
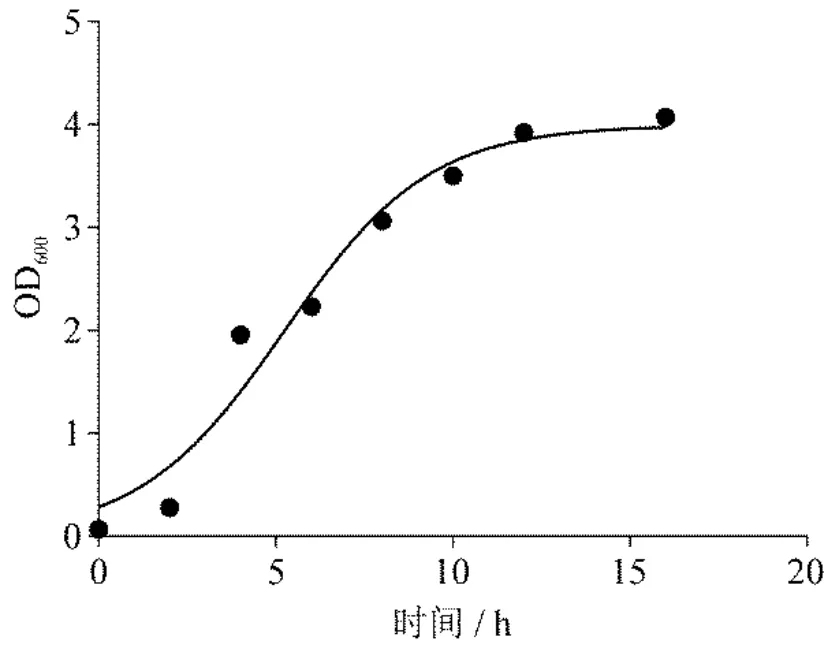
图7 沙雷氏Z4 菌株生长曲线
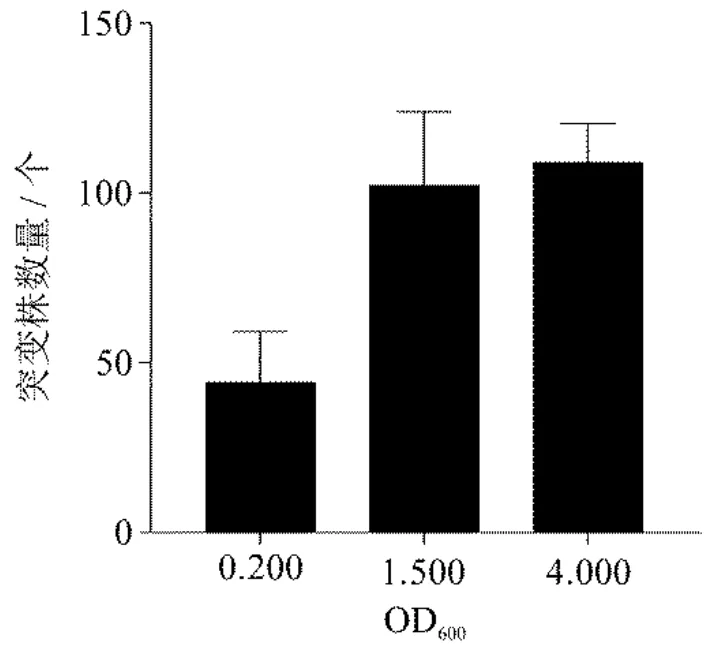
图8 不同沙雷氏Z4 菌株生长状态对突变效率的影响
3.6 群体淬灭差异突变株的筛选
在上述优化培养条件下,对沙雷氏Z4 菌株进行Tn5 转座子插入突变,构建突变体库.利用生物传感器紫色杆菌CV026以及根癌农杆菌KYC55对信号分子C6-HSL和C8-HSL的显色原理,对突变体库进行筛选,筛选出与沙雷氏Z4 野生型QQ 能力有所差异的3 株突变株.其中2 株突变株3 号和5 号降解C6-HSL 和C8-HSL 后它们的显色圈明显比Z4 野生型的大(图9),说明,突变株3 号和5 号对这两种信号分子的降解能力比Z4 野生型的要低.可能在这2 株突变株中,Tn5 转座子插入了与QQ 能力相关的基因中,阻断了基因的表达,使突变株的QQ 能力降低.2号突变株降解C6-HSL 的显色圈比Z4 野生型的明显要小,故它的QQ 能力比Z4 野生型高,可能是转座子插入到淬灭基因的负调控基因上,使得负向调控基因失活,因此QQ 能力上升.

图9 沙雷氏Z4 突变菌株降解C6-HSL 及C8-HSL
4 结 论
结合国内外QQ 研究发展趋势,运用Tn5 转座子插入突变技术,构建沙雷氏Z4 菌株突变体库,采用单因素实验优化了沙雷氏Z4 菌Tn5 转座子插入突变株的最适培养条件,在此基础上筛选群体淬灭突变体,得出以下结论:
1)通过研究供受体菌混合比例、混合培养时间、抗生素选择压力以及沙雷氏Z4 菌株生长状态对Tn5 转座突变效率的影响,结果发现,在沙雷氏Z4 菌株为对数生长期、供受体菌混合比例为1∶1、混合培养时间为3 h、Km 浓度为50 μg/mL、Tc 浓度为25 μg/mL 的培养条件下,获得的沙雷氏Z4 突变体数量最优.
2)在最优培养条件对沙雷氏Z4 菌株进行Tn5 转座突变,构建突变体库,利用生物传感器筛选出了3 株沙雷氏Z4 突变菌株,其QQ 能力都与Z4 野生型有差异.
