QuEChERS结合超高效液相色谱-串联质谱法同时检测苹果中11种农药残留
2022-05-28刘明雨聂继云沈友明韩令喜高小琴
刘明雨 聂继云 沈友明 韩令喜 高小琴
(1.中国农业科学院果树研究所,辽宁兴城 125100;2.青岛农业大学园艺学院,农业农村部果品质量安全风险评估实验室(青岛),青岛市现代农业质量与安全工程重点实验室,山东青岛 266109)
苹果属蔷薇科(Rosaceae)苹果属(Malus),为多年生落叶果树,是世界第二大果树,产量仅次于柑橘[1]。我国是世界上最大的苹果生产国和消费国,苹果产量约占全球的50%[2]。苹果病虫害是影响我国苹果产业可持续健康发展的限制性因素,其防治有农业防治、生物防治、物理防治、化学防治等多种方法,其中化学防治是最常用的防治方法[3~4]。但化学农药如不能科学合理地使用,会导致农药残留增加甚至超标,进而影响苹果品质和安全性,危害消费者健康[5]。制定农药最大残留限量标准,是保障农产品质量安全、促进农业可持续发展和保护消费者健康的基础,并为农产品安全评价与监管执法提供重要依据[6]。
GB 2763-2021《食品安全国家标准 食品中农药最大残留限量》已于2021年9月正式实施并代替此前的版本[7]。该标准规定了苹果中240项农药最大残留限量,其中62项为临时限量。但该标准与国际标准仍有差距,我国苹果中农药残留临时限量范围为0.01~30 mg/kg,欧盟食品安全局(EFSA)对于无具体限量标准且不属于豁免物质的农药残留,都以方法检出限或0.01 mg/kg为限值[8]。鉴于此,加强农药最大残留限量的基础性研究工作,建立快速准确的农药残留检测方法,为制定农药残留限量提供技术支持具有重要意义。本文以苹果中允许使用且只有临时限量的4种杀虫剂(氟苯虫酰胺、氟啶虫胺腈、螺虫乙酯、氯虫苯甲酰胺)和7种杀菌剂(吡噻菌胺、丁香菌酯、多果定、氟吡菌酰胺、氟唑菌酰胺、嗪氨灵、噻霉酮)为检测对象,研究建立快速、准确、简便的多残留同时检测方法,有利于农药残留限量标准的实施和苹果中农药的残留监管。
苹果农药残留检测方法主要有气相色谱法[9]、气相色谱-串联质谱法[10]、高效液相色谱法[11]和高效液相色谱-串联质谱法(HPLC-MS/MS)[12]。与一般HPLC-MS/MS方法相比,超高效液相色谱-串联质谱法(UPLC-MS/MS)检测效率更高[13]。农药残留检测前处理方法多样[14],QuEChERS方法因具有快速、简单、廉价、有效、可靠、安全的优点,而被广泛采用[15~16]。2021年9月施行的GB 23200.121-2021《食品安全国家标准 植物源性食品中331种农药及其代谢物残留量的测定 液相色谱-质谱联用法》[17],采用QuEChERS前处理方法结合液相色谱-三重四极杆串联质谱同时测定331种农药及44种农药代谢物。本文选取的11种农药中,已有8种农药在GB 23200.121-2021中有相应检测方法,但仍有3种农药无配套残留检测方法。目前,关于苹果样品中上述11种农药残留检测的文献报道较少,为了解当前苹果中11种农药的残留情况,提高苹果质量安全管理水平,本文参考GB 23200.121-2021,研究建立QuEChERS结合UPLC-MS/MS同时检测苹果中吡噻菌胺等11种农药的分析方法。
一、材料与方法
(一)仪器、试剂与材料Xevo TQ超高效液相色谱-串联质谱仪 (美国Waters公司);CF16RXII立式大容量高速离心机(日本Hitachi公司):Milli-QDirecet 8全自动超纯水机(美国Millipore公司);ACQUITY UPLC HSS T3色谱柱(2.1 mm×100 mm,1.8μm,美国Waters公司);JYL-C20九阳料理机(中国九阳股份有限公司)。
乙腈、甲醇、乙酸铵、甲酸和乙酸乙酯(色谱纯,美国Thermo Fisher Scientific公司);乙二胺-N-丙基硅烷(PSA)、石墨化碳黑(GCB)、多壁碳纳米管(MWCNTs)、十八烷基硅烷(C18)、佛罗里硅土(Florisil)(美国Varian公司);无水MgSO4(优级纯,天津市津科精细化工研究所);NaCl(优级纯,天津市丰川化学试剂技术有限公司);0.22μm尼龙有机滤膜(Nylon,美国Fine Scientific公司);农药标准品:吡噻菌胺、丁香菌酯、多果定、氟苯虫酰胺、氟吡菌酰胺、氟啶虫胺腈、氟唑菌酰胺、螺虫乙酯、氯虫苯甲酰胺、嗪氨灵和噻霉酮(纯度≥99.4%,德国Dr.Ehrenstorfer GmbH公司)。
富士苹果样品采于我国两大苹果主产区,即渤海湾产区(样品数为山东n=28、辽宁n=10、河北n=21)、黄土高原产区(样品数为陕西n=24、甘肃n=16、山西n=21、河南n=10),共计采集130份样品;嘎啦苹果样品采于黄土高原产区(样品数为陕西n=16、河南n=8),共计采集24份样品。
(二)标准溶液的配制
1.标准储备液。11种农药标准品,分别用甲醇稀释配制成100.0 mg/L的标准储备液。准确吸取11种农药标准储备液各适量,以甲醇定容,得到10 mg/L的混合标准储备液,-20℃冷冻保存。
2.标准工作液。准确移取一定体积的混合标准储备液,分别用甲醇逐级稀释成1、2、5、10、20、50、100、200和500μg/L的混合标准工作液。
3.基质空白标准工作溶液。用空白基质溶液将混合标准储备液按相同比例稀释成1、2、5、10、20、50、100、200和500μg/L的基质空白标准工作溶液。
(三)样品前处理准确称取10.00 g(精确至0.01 g)已匀浆的苹果样品于50 mL离心管中,加入20 mL乙腈,振荡涡旋5 min。再加入NaCl 2 g和无水MgSO44 g,再次振荡涡旋5 min,以9 000 r/min离心5 min。吸取2 mL上清液于15 mL离心管,加入100 mg PSA,涡旋1 min,以4 500 r/min离心5 min,取适量上清液过0.22μm有机滤膜,待测。
(四)仪器条件
1.色谱条件。ACQUITY UPLC HSS T3(2.1 mm×100 mm,1.8μm)色谱柱;柱温为40℃。流动相A为甲醇,B为含0.1%甲酸的5 mmol/L乙酸铵溶液。梯度洗脱程序为:0.0~2.0 min,10%A~90%A;2.0~4.0 min,90%A;4.0~4.01 min,90%A~10%A;4.01~5.5 min,10%A。流速为0.4 mL/min;进样体积为5μL;样品室温度为10℃。
2.质谱条件。电喷雾离子源(ESI);扫描方式为正负同时扫描;毛细管电压为3.0 kV;检测方式为多反应监测(MRM);离子源温度为150℃;脱溶剂气温度为500℃;去溶剂气为氮气,流量为800 L/h;锥孔气为氮气,流量为50 L/h。其他参数见表1。
二、结果与分析
(一)质谱及色谱条件优化将11种农药的1 mg/L的单个标准品由注射泵直接注入质谱,以优化MRM离子对。在全扫描模式下(m/z50~1 000)进行母离子扫描。针对每个目标分析物的母离子,测试并优化了每种农药的锥孔电压。选择优化后的母离子在MRM模式下扫描产物离子,为每个目标分析物选择了两个子离子,同时优化子离子的碰撞电压(见表1)。
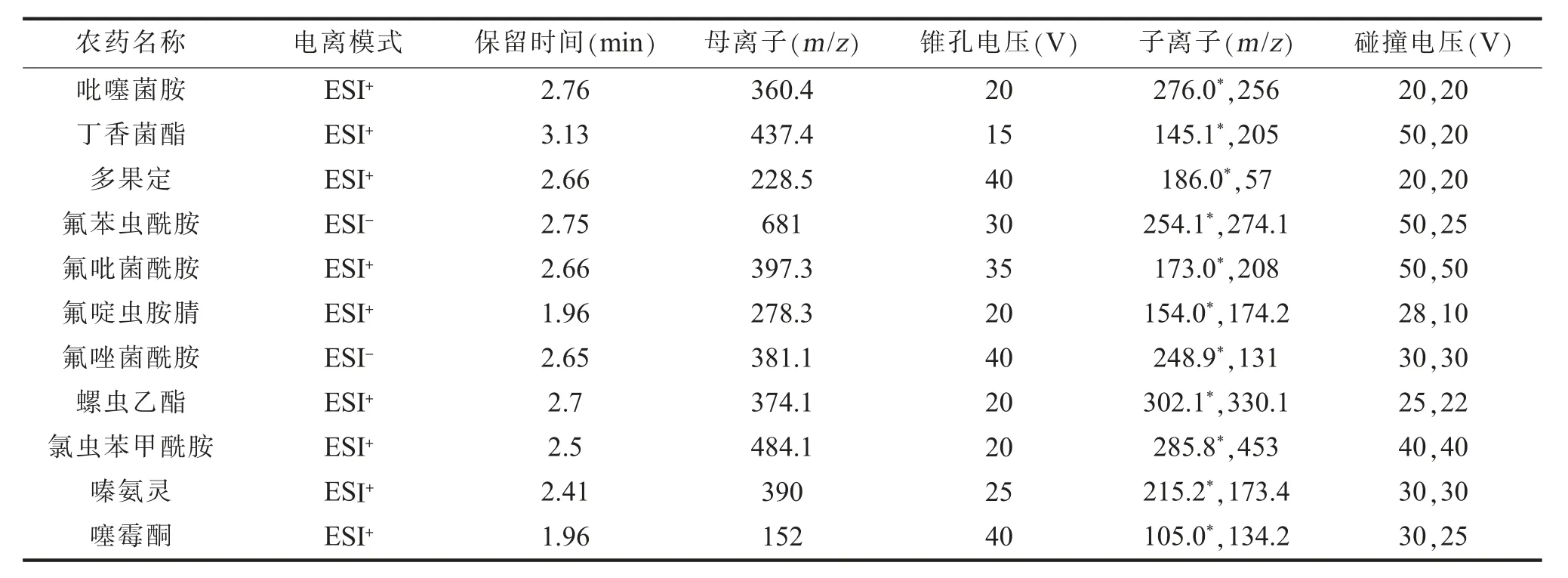
表1 11种农药的质谱参数及液相保留时间
色谱条件优化的主要目的是增大目标物之间或目标物与杂质之间的分离度,提高检测的灵敏度与准确度[18]。本文选择了反相色谱常用的流动相体系甲醇-0.1%甲酸水溶液、甲醇-5 mmol/L乙酸铵水溶液和甲醇-含0.1%甲酸的5 mmol/L乙酸铵水溶液进行测试和比较,以获得最佳分辨率和峰形响应强度。乙酸铵能促进化合物的离子化效率,同时加入甲酸后,目标化合物响应增强,峰形变尖锐,灵敏度变高。结果表明,在甲醇-含0.1%甲酸的5 mmol/L乙酸铵水溶液流动相组成下,11种农药的峰形得到了有效的改善,峰形更加尖锐和对称,并且响应值最高。因此,选择甲醇-含0.1%甲酸的5 mmol/L乙酸铵水溶液作为梯度洗脱的流动相。
(二)提取方法的优化鉴于11种农药的分子极性差异,本研究考察了乙腈、乙酸乙酯和0.1%甲酸-乙腈溶液3种试剂的提取效果,对11种农药在空白苹果基质中加标回收率进行比对,加标量为200μg/kg,结果见图1。可以看出,使用乙腈作为提取剂时,各组分的回收率较高,均达到80%以上并且低于120%,提取出的杂质较少;使用乙酸乙酯提取时无法提取出多果定和噻霉酮两种农药。同时,试验还考察了乙腈中添加甲酸时对11种农药的提取效果,结果发现,11种农药的总体回收率在71%~112%之间,说明在提取剂中加入甲酸并不能提高提取率。此外,选择乙腈作为提取剂比其他提取剂的提取效果好,证实了前人研究中所提出的,与其他溶剂相比,乙腈对大多数化合物具有适当的极性,提取剂选择乙腈能产生更好的回收率和相容性[19],因此最终确定乙腈作为提取剂。
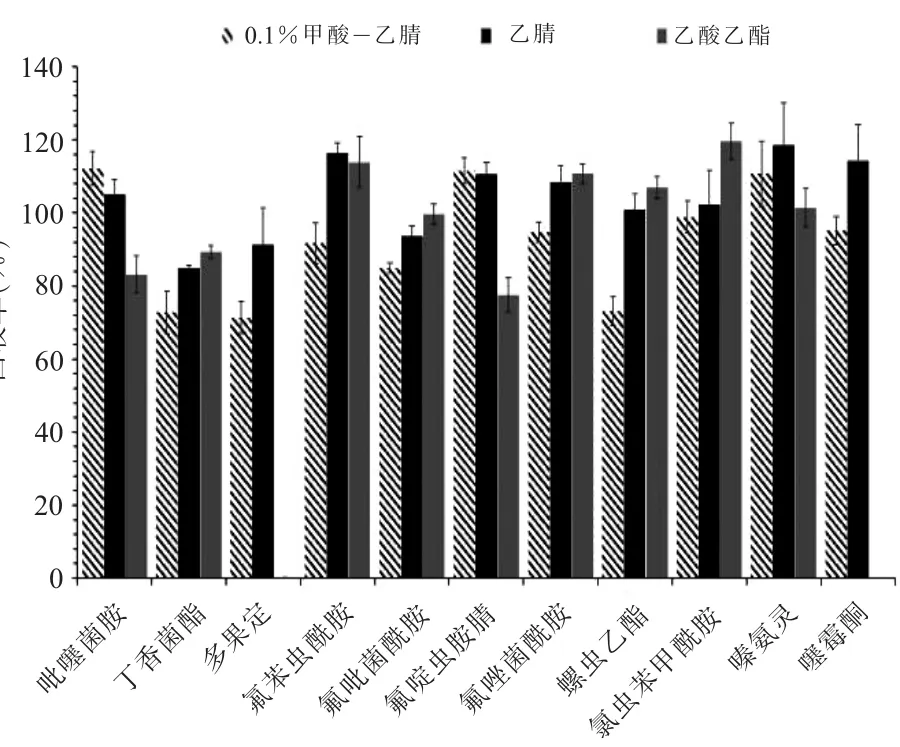
图1 不同提取剂对11种农药回收率的影响
(三)吸附剂的选择及优化QuEChERS方法常用的吸附剂有PSA、C18、GCB、MWCNTs、Florisil[20],其中PSA主要用于去除样品提取物中的脂肪酸、有机酸、色素和糖类;C18被证实可以有效去除提取物中的许多非极性或中等极性的干扰物,如脂肪、甾醇和挥发性油;GCB和MWCNTs用于去除色素,如类胡萝卜素和叶绿素,但它们二者对含苯官能团的化合物有较强吸附作用,会降低其回收率[21]。因此,本试验采用空白基质加标回收法进行比较,加标量为200μg/kg,分别考察了PSA(200 mg)、C18(200 mg)、GCB(100 mg)、MWCNTs(20 mg)、Florisil(200 mg)5种吸附剂单独使用对待测农药回收率的影响,结果见图2。如图2所示,当使用200 mg Florisil作为吸附剂时,多果定的回收率仅为6%。MWCNTs和GCB具有高纵横比和表面积,对有机分子表现出很强的保留能力。在本试验中,使用MWCNTs和GCB单独作为吸附剂时,11种农药的添加回收率分别为11%~110%和6%~126%,部分目标农药的回收率偏低。当200 mg PSA和200 mg C18分别作为吸附剂用于2 mL苹果提取液时,11种农药的回收率分别为61%~119%和78%~114%,表明它们对农药的吸附效果较小。

图2 不同吸附剂对11种农药回收率的影响
进一步对C18和PSA的用量进行探究,目的是使每一种农药获得满意的回收率。考察并比较了不同使用量的PSA(50、100、150和200 mg)和C18(50、100、150和200 mg)对11种农药回收率的影响,结果见表2,随着PSA、C18用量的增加,苹果乙腈提取液的脱色效果逐渐增强。当使用50~200 mg C18时,11种农药的平均回收率在59.6%~125.0%之间;使用50~200 mg PSA时,11种农药的平均回收率在60.6%~121.8%之间。只有在100 mg PSA用量下每种农药的平均回收率都大于90%,显著优于其他的用量条件,最终选择100 mg PSA为本试验的吸附剂。

表2 苹果基质中不同PSA和C18用量下11种农药的回收率 (n=3,%)
(四)11种农药的线性方程、检出限、定量限及基质效应评价基于已优化的分析条件,分别采用乙腈和苹果空白基质提取液作为标准溶液的稀释液,配制11种农药的基质匹配标准溶液,设置9个浓度梯度 (1、2、5、10、20、50、100、200、500μg/L),以化合物浓度为横坐标,各目标化合物对应峰面积为纵坐标,获得线性方程以评估方法线性范围,结果见表3。以满足添加回收率在70%~120%范围内且RSD<20%要求的最低加标水平为定量限(LOQ);以在规定的试验条件下,在苹果基质中能检测到11种农药的最低浓度为检出限(LOD)[22]。从表3可以看出,苹果基质中吡噻菌胺、丁香菌酯、多果定、氟苯虫酰胺、氟吡菌酰胺、氟啶虫胺腈、氟唑菌酰胺、螺虫乙酯、氯虫苯甲酰胺、嗪氨灵和噻霉酮在浓度范围内线性关系良好,R2≥0.9 9,11种农药的LOD为0.1~4.0μg/kg,LOQ为2~10μg/kg。同时,相较于GB 23200.121-2021中已有水果基质中农药的检测方法,5种农药(吡噻菌胺、丁香菌酯、氟吡菌酰胺、氟啶虫胺腈和螺虫乙酯)的定量限均低于标准中的定量限,3种农药(氟苯虫酰胺、氟唑菌酰胺和氯虫苯甲酰胺)的定量限与标准中的定量限相同。
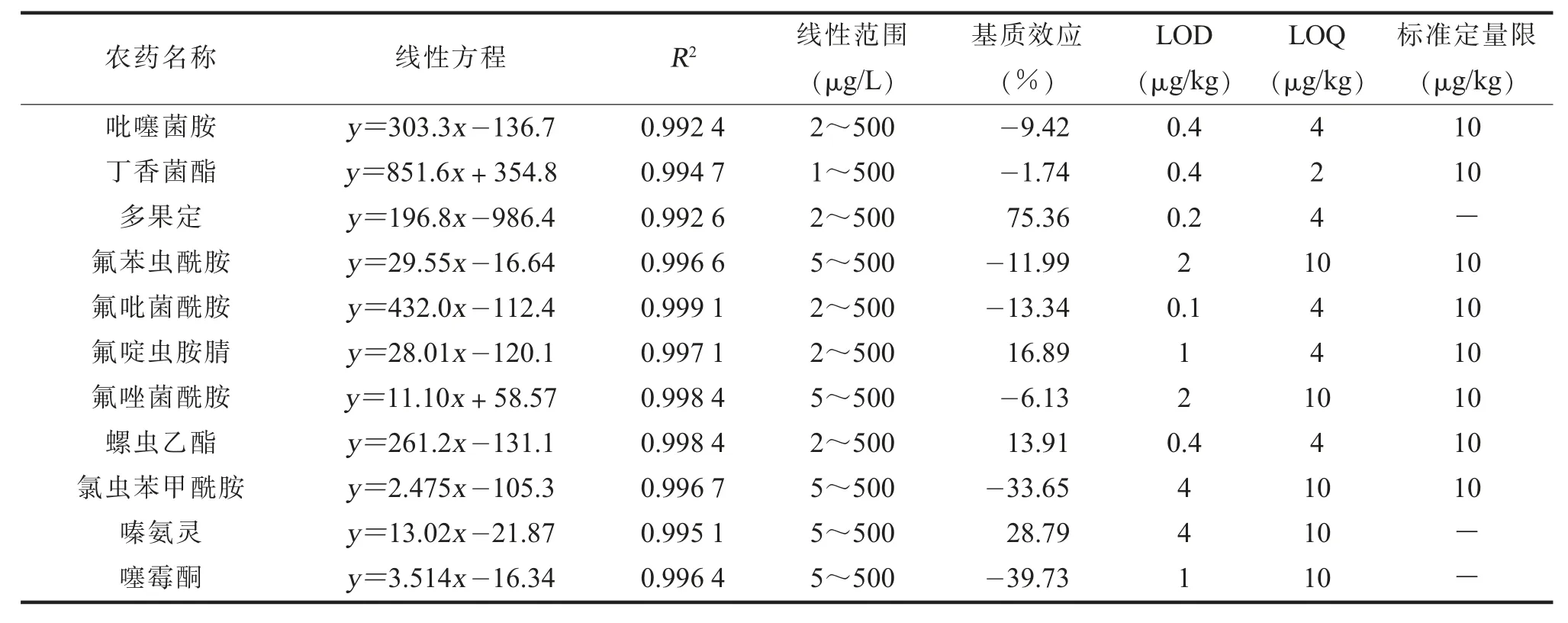
表3 11种农药在苹果基质中的线性方程、相关系数、基质效应、检出限和定量限
植物源性食品中色素、有机酸和脂肪等杂质易引起基质增强或抑制效应,研究表明,基质种类、基质数量和目标物化学性质对基质效应有一定影响[23]。基质效应(ME)根据公式“ME=(基质匹配标准曲线的斜率/溶剂标准曲线的斜率-1)×100%”进行评估,当ME>0时,表现为基质增强效应;当ME<0时,为基质抑制效应。此外,若|ME|≤20%,表示弱基质效应;若|ME|在20%~50%之间,则表示中等基质效应;若|ME|>50%,表示强基质效应[24]。结果显示,在苹果基质中多果定表现出强基质效应,其余农药表现出弱或中等基质效应。空白苹果基质TIC色谱图见图3。为降低基质效应对苹果中农药分析的影响,本文采用苹果基质匹配标准溶液绘制的标准校正曲线对苹果中11种农药定量,提高分析可靠性[25]。

图3 空白苹果基质TIC色谱图
(五)方法的回收率和精密度在空白苹果样品中添加11种目标农药的混合标准溶液,在2、4、10、20、100、200μg/kg加标水平下进行回收率试验,每个水平重复5次,结果见表4。11种农药的平均回收率为82.2%~118.1%,相对标准偏差范围为0.3%~17.4%,方法回收率和精密度均满足农药残留检测要求。
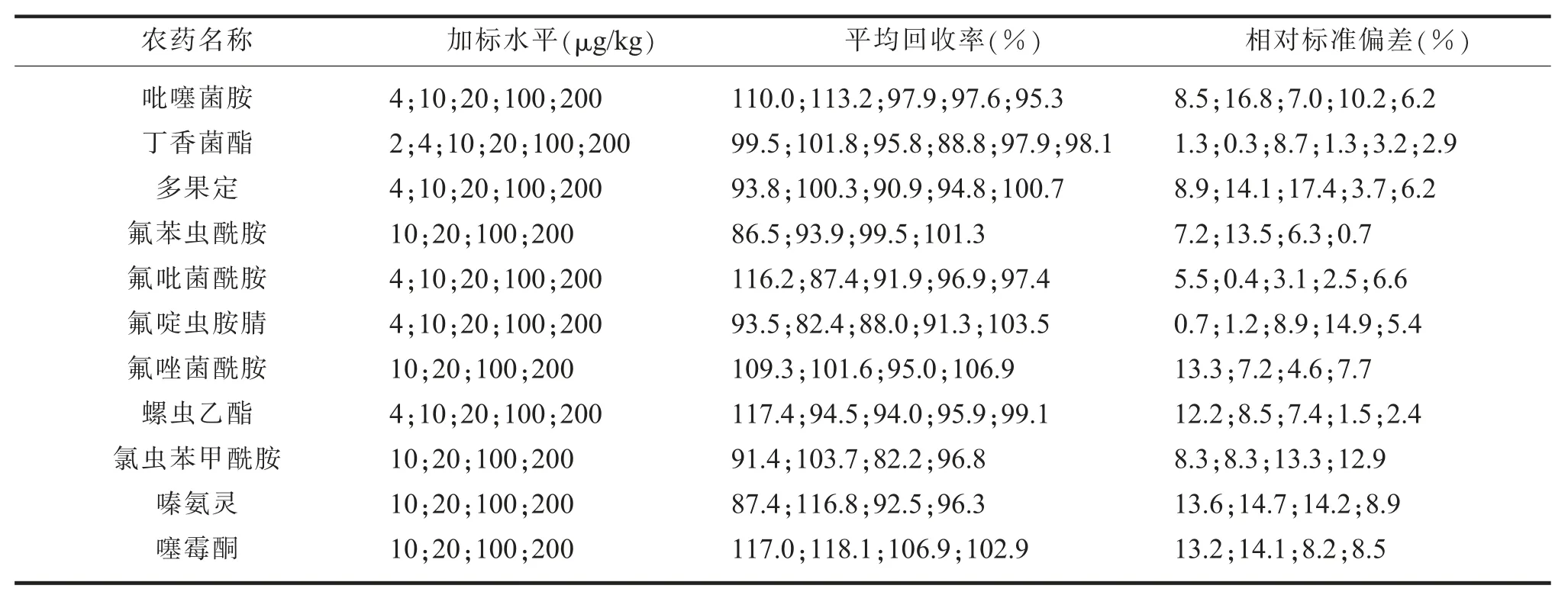
表4 苹果基质中11种农药的加标回收率及相对标准偏差 (n=5)
(六)实际样品检测应用建立的方法对采自全国苹果主产区(渤海湾产区、黄土高原产区)7个省份的154份苹果样品进行检测。苹果中11种农药的残留水平如表5所示,共检测出7种农药,残留水平均远低于我国临时最大残留限量。在氯虫苯甲酰胺阳性样品中,仅有1个样品残留水平略高于欧盟最大残留限量;在噻霉酮阳性样品中,7个样品残留值超过欧盟最大残留限量,其余阳性检出样品残留值均远低于欧盟最大残留限量。

表5 苹果样品中的农药检出情况
三、结论
本文采用QuEChERS前处理法,结合超高效液相色谱-串联质谱测定,建立了苹果中11种农药(吡噻菌胺、丁香菌酯、多果定、氟苯虫酰胺、氟吡菌酰胺、氟啶虫胺腈、氟唑菌酰胺、螺虫乙酯、氯虫苯甲酰胺、嗪氨灵和噻霉酮)残留的同时检测方法。方法学考察结果显示,11种农药的LOD为0.1~4.0μg/kg,LOQ为2~10μg/kg,标准曲线R2≥0.99,平均回收率为82.2%~118.1%,RSD为0.3%~17.4%;部分农药定量限低于我国现行国家标准,能够满足苹果中11种农药残留的快速检测需要。采用所建立的方法对154份苹果样品进行检测,结果显示,检出的7种农药其残留水平远低于我国临时最大残留限量。本文所建立的检测方法操作简便、高效灵敏、准确度好,可为苹果中相关农药的残留监测提供技术支撑。
