哌嗪类曼尼希碱壳聚糖缓蚀剂的制备及缓蚀性能研究
2022-05-28李俐枝彭云超李丰渟王志坤孙霜青胡松青
李俐枝,彭云超,李丰渟,王志坤,孙霜青,胡松青
哌嗪类曼尼希碱壳聚糖缓蚀剂的制备及缓蚀性能研究
李俐枝,彭云超,李丰渟,王志坤,孙霜青,胡松青
(中国石油大学(华东),山东 青岛 266580)
解决海底采油设备酸化腐蚀问题,合成一种绿色的哌嗪类曼尼希碱壳聚糖衍生物缓蚀剂CS-N- MB,并研究其在15%(质量分数)盐酸溶液中对N80钢的缓蚀性能,计算研究其在金属表面的作用机理。以曲酸和N–甲基哌嗪为原料,经过曼尼希反应,合成曼尼希碱(MB),再将该曼尼希碱接枝到壳聚糖分子上。采用红外光谱表征所合成产物,利用电化学法和静态失重法评价CS-N-MB在该强酸环境中对N80钢的缓蚀能力。基于密度泛函理论,研究壳聚糖(CS)和CS-N-MB的反应活性,明确活性位点,并通过分子动力学计算缓蚀剂的吸附能以及体系中水分子的均方位移。在15%盐酸环境中,CS-N-MB对N80钢具有良好的缓蚀作用,且当缓蚀剂添加量小于200 mg/L时,随着浓度的增加,N80钢的腐蚀速率逐渐减小。当缓蚀剂添加量大于200 mg/L时,短时间内,随着浓度的增加,N80钢的腐蚀速率又略微增大,而72 h后N80钢的腐蚀速率略微减小并趋于稳定。电化学研究表明,CS-N-MB能够同时抑制腐蚀的阴极反应和阳极反应,是混合型缓蚀剂。分子模拟结果表明,CS-N-MB的主要活性位点集中在N、O以及环状结构处,且加入缓蚀剂后,体系中水分子的运动减缓,抑制了金属腐蚀的发生。CS-N-MB是一种在强酸环境中仍有良好缓蚀效果的绿色缓蚀剂,多个活性中心可在金属表面形成致密的保护膜,从而有效抑制了金属的腐蚀。
壳聚糖;曼尼希碱;缓蚀剂;分子模拟;酸化环境;海底管道
随着近代海底石油的勘探和开采技术的发展,海上原油产量日益增加,日产量占世界原油总日产量的25%。我国已在不同海域中建立了80多个油气田开采平台,在石油开采过程中,常采用酸化压裂技术来提高油气采收率,增大了井下溶液的酸性,造成了一系列的金属腐蚀问题,且由于海底环境复杂,海底钻采设备与管道的施工和维护工作难度较大,因此解决海底采油设备与管道的酸化腐蚀问题是目前研究热点。添加缓蚀剂是目前各类油气田采用的最便捷有效的防腐蚀方法之一。国内使用的缓蚀剂主要以有机缓蚀剂为主,但已报道的大多数有机缓蚀剂毒性较大,易对环境造成污染。壳聚糖(CS)是一种结构简单,且容易从自然界中直接提取的生物多糖化合物,对环境无害,可降解,被认为是潜在的天然绿色缓蚀剂[1]。CS分子中含有大量的羟基和氨基等活泼基团,能够与金属原子之间产生较强结合力,形成保护膜,减少金属表面的活性腐蚀位点[2-3]。
然而,单纯的CS缓蚀剂在酸性条件下成膜性差,缓蚀效果不佳。为进一步增强CS缓蚀剂的缓蚀效率,可以在分子的氨基与伯羟基和仲羟基位上引入功能基团来增强CS与金属的结合力[4-7]。曼尼希碱(MB)缓蚀剂是常用的油气田酸化缓蚀剂,具有酸溶性强、耐温性好等特点[8-11]。利用MB缓蚀剂对CS缓蚀剂进行化学修饰,能够向CS分子引入大量p区原子和带π电子云的芳香环,大大增强CS缓蚀剂与金属之间的配位螯合作用,作为油气田高温酸化缓蚀剂,具有较大的开发价值和应用前景。因此,本文通过将合成的MB接枝到CS分子上,得到新型曼尼希碱壳聚糖衍生物类绿色酸化缓蚀剂。
1 试验
1.1 材料与仪器
试验所用材料有:壳聚糖(CS,脱乙酰度80%~ 95%),生物试剂,国药化学试剂有限公司;曲酸,分析纯,浙江金壳生化有限公司;氯化亚砜、甲醇、吡啶、浓盐酸(质量分数为37%)、无水乙醇、甲醛标准溶液,六次甲基四胺,分析纯,国药化学试剂有限公司;N–甲基哌嗪、二甲基甲酰胺、苯甲醛,分析纯,上海沃凯生物技术有限公司;试验用钢片为N80钢片,尺寸为50 mm×10 mm×2 mm;合成试验用水为去离子水,自制;酸洗液,自制,1 000 mL酸洗液中含100 mL浓盐酸和3.5 g六次甲基四胺。
试验所用仪器有:DF-101S型油浴锅,巩义泰洪升仪器厂;CPA225D型准微量分析天平,德国赛多利斯公司;DZF-6020AB型真空干燥箱,上海坤天实验室仪器;NEXUS FTIR型红外光谱仪,美国尼高力公司;Reference 600型电化学工作站,美国Gamry公司;HETACHIS-4800型扫描电子显微镜,日本HETACHI。
1.2 试验合成
CS-N-MB的合成路线如图1所示。将曲酸(KA)与氯化亚砜按物质的量之比1∶4反应生成氯代曲酸(KA-Cl),用石油醚洗涤,在沸水中重结晶得到纯化氯代曲酸。将一定量的氯代曲酸和N–甲基哌嗪溶解在150 mL甲醇和10 mL甲醛水溶液中,室温下快速搅拌,大约20 min反应完成,生成褐色沉淀。过滤收集沉淀,用无水甲醇洗涤,得到氯代曲酸曼尼希碱(MB)。将制备得到的MB和CS以1.5∶1的物质的量之比分别溶于50 mL二甲基甲酰胺中。将CS溶液缓慢滴加在MB溶液中,然后加入一定量的吡啶,持续搅拌反应4 h。加入过量二甲基酮终止反应,抽滤,得固体沉淀。以二甲基酮作为提取液索氏提取24 h,除去DMF,最后在真空中干燥,得到CS-N-MB产品[12]。
1.3 电化学测试
电化学测试采用三电极体系,包括N80钢样品(工作电极)、铂片(辅助电极)和饱和甘汞电极(参比电极)。在进行测试之前,连续测量1 h工作电极电位,获得稳定的开路电位(OCP)。电化学阻抗谱测量激励信号为幅值10 mV的正弦波,测试频率为0.1 Hz~1 000 kHz。动电位极化曲线测量扫描电位为–0.15~0.15 V(vs. OCP),扫描速度为0.2 mV/s。所有试验至少重复测量3次。根据阻抗谱与极化曲线测试,计算缓蚀效率,见式(1)、(2)[13-15]:
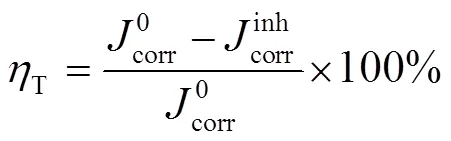
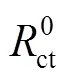
1.4 质量损失测试
用无水乙醇和丙酮清洗金属挂片,烘干后称取其质量,分别置于未添加和添加不同浓度缓蚀剂的15%(质量分数)盐酸溶液中,在室温下分别放置24、72 h。取出挂片后,用酸洗液洗去腐蚀产物,再用无水乙醇和丙酮清洗,干燥,称量,记录试验前后钢片的质量变化,重复试验3次,用质量变化平均值按式(3)和(4)计算缓蚀剂的缓蚀效率。
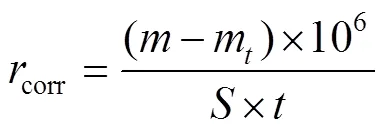
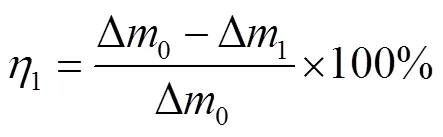
式中:corr为腐蚀速率,g/(m2·h);、m为试验前后钢片的质量,g;1为钢片总面积,m2;为试验时间,h;1为缓蚀效率;Δ0、Δ1为未添加和添加缓蚀剂试验后钢片的质量损失,g。
1.5 扫描电镜测试
将N80钢片置于15%盐酸溶液中72 h后,用去离子水清洗钢片表面,利用冷空气鼓风机干燥。使用HETACHIS-4800型扫描电子显微镜观测钢片表面形貌。
1.6 量子化学计算
基于密度泛函理论(DFT)的量子化学计算方法,对CS-N-MB单体单元的分子结构进行优化。选用GGA-PBE函数,热拖尾效应值为0.005 Ha,实空间截断半径值为0.37 nm,所有计算均考虑自旋非限制性,得到CS-N-MB的优化构型和相应的量子化学参数。所有量子化学计算采用Materials Studio软件中的DMol3模块完成。
1.7 分子动力学模拟
采用分子动力学模拟研究CS-N-MB在N80钢表面的吸附过程。首先用Fe(0 0 1)面构建周期为9×9的超晶胞基底[16],在该基底上构建一个包含500个水分子和1个CS-N-MB分子的溶液相,并在溶液相上方添加一个厚2 nm的真空层。然后固定基底Fe原子,对该模型进行几何优化,在298 K用NVT系综和COMPASS力场进行分子动力学模拟,模拟计算的截断半径值为1.25 nm,模拟总时长为2 ns,时间步长为1 fs。所有分子动力学计算采用Materials Studio软件中的Forcite模块完成。
2 结果与讨论
2.1 结构表征
CS和CS-N-MB分子的红外光谱如图2所示。3 400 cm–1左右的宽峰为O—H伸缩震动以及分子内和分子间氢键的特征吸收峰。1 659、1 592、1 324 cm–1为CS的3个典型酰胺谱带,表明该CS的脱乙酰度超过70%[17]。1 155 cm–1为C—O—C不对称伸缩峰。CS-N-MB红外光谱中1 213 cm–1处的特征峰代表分子含有曲酸中的5–羟基吡喃酮基的C==O,表明氯代曲酸–曼尼希碱通过共价键连接到了CS分子上。与CS分子相比,合成产物在1 592 cm–1处的峰消失,而1 078、996 cm–1处的峰表明C—O存在,3 000 cm–1以上的N—H和O—H吸收小于CS分子,1431 cm–1处C—N加强。890 cm–1对应的β–吡喃型糖苷键的吸收峰变化不大,说明合成后CS分子的基本骨架结构没有改变。
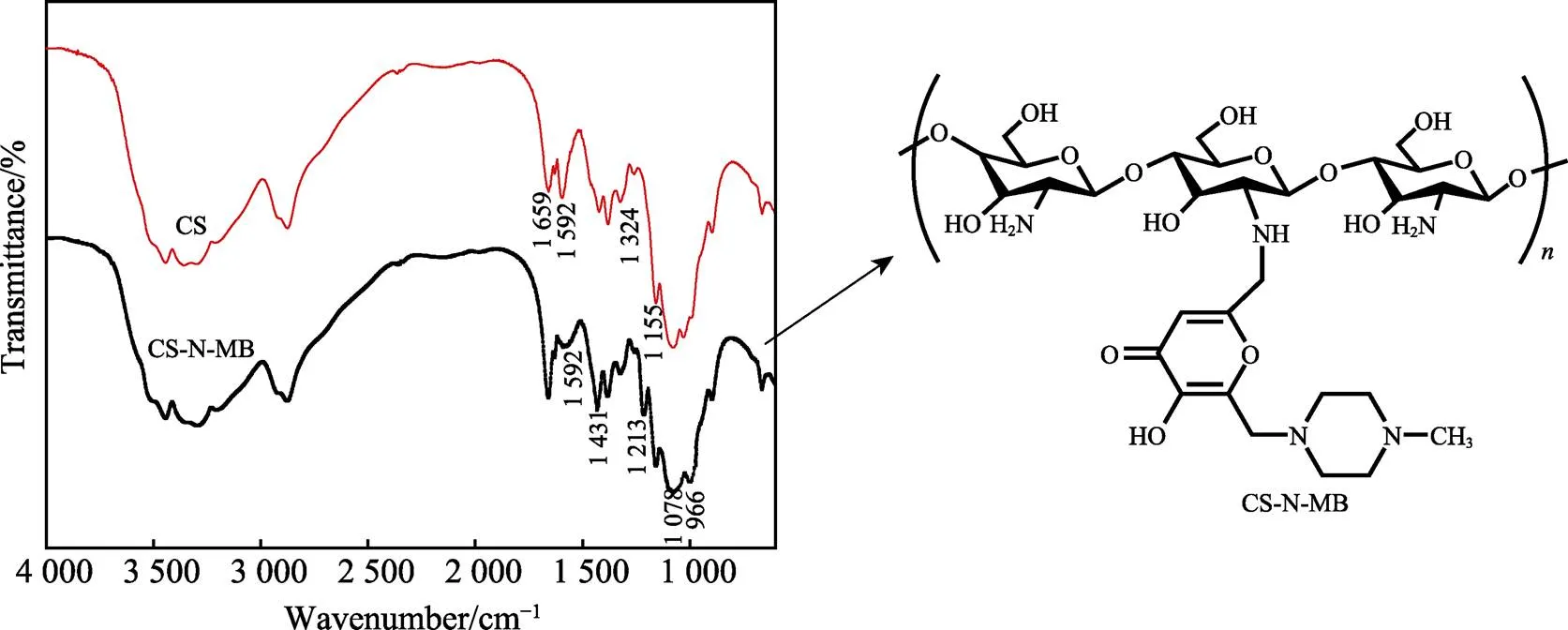
图2 CS分子和CS-N-MB分子的红外光谱
2.2 壳聚糖曼尼希碱缓蚀剂性能评价
2.2.1 极化曲线法
N80钢在CS-N-MB用量分别为0、50、100、200、300、400 mg/L的腐蚀溶液中的极化曲线如图3所示,相应参数见表1。结果显示,加入缓蚀剂后,阴极电流和阳极电流均减小,说明CS-N-MB抑制了金属阴极析氢反应和阳极溶解反应。同时,corr均向负方向移动,其中最大偏移量为添加200 mg/L CS-N-MB时,其corr为–458 mV,较空白的corr降低了32 mV,偏移值小于85 mV,表明该缓蚀剂为混合型缓蚀剂[18]。与空白样品相比,添加缓蚀剂后,体系的腐蚀电流大幅减小。由此可以推测CS-N-MB分子在金属表面形成了保护膜,减少了腐蚀介质与金属的接触,阻碍了金属的腐蚀。
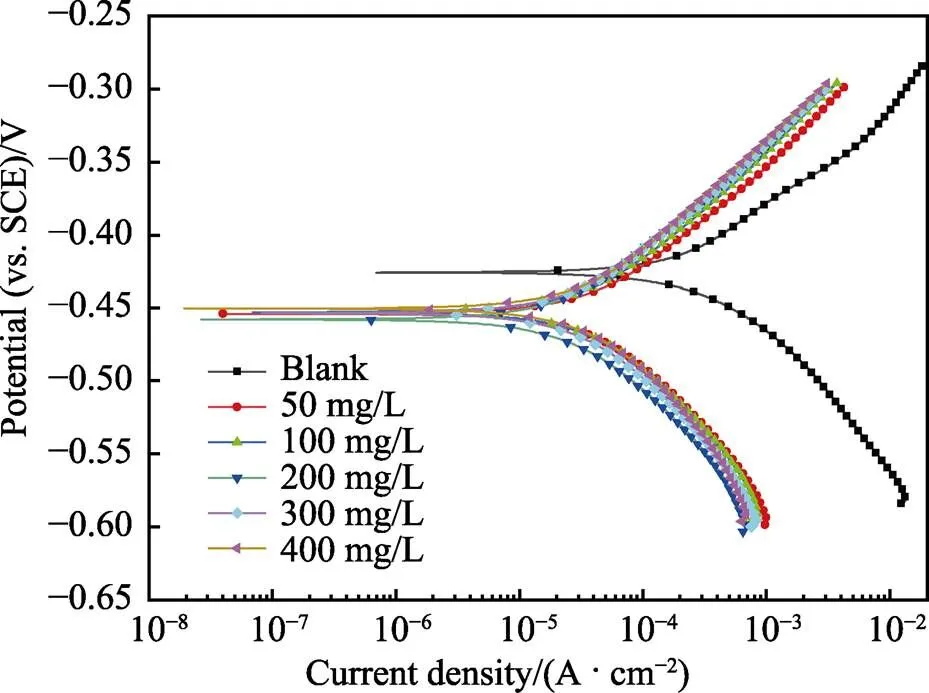
图3 N80钢在添加不同浓度缓蚀剂腐蚀溶液中的极化曲线
2.2.2 电化学阻抗谱法
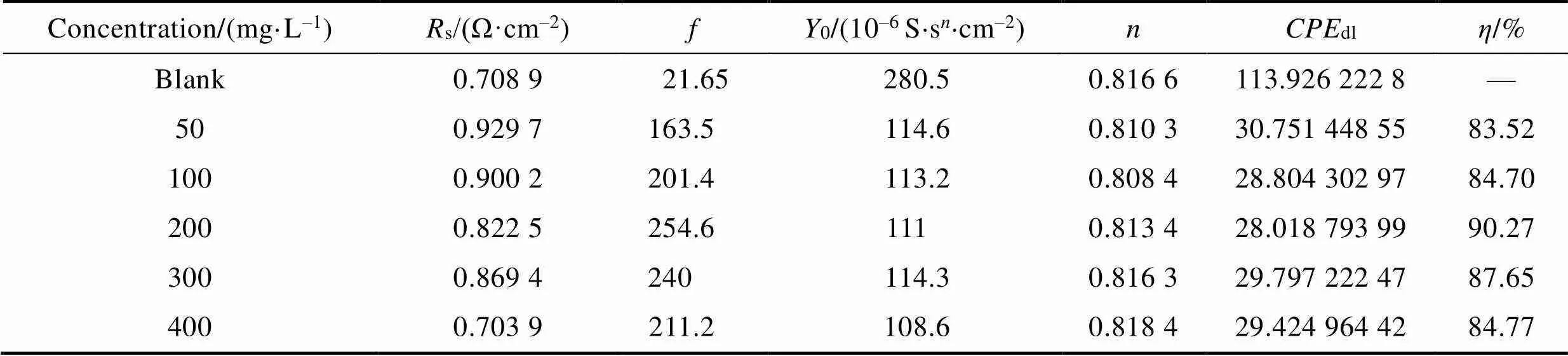
N80钢在不同CS-N-MB用量的15% HCl溶液中的电化学阻抗图谱如图4所示。添加缓蚀剂前后,Nyqiust和Bode图形状相似,表明缓蚀剂的存在没有改变钢片的腐蚀机理。在整个频率范围内只有1个峰,表明N80钢片表面只存在1种腐蚀形式。与空白对照组相比,添加缓蚀剂后,相位角向负方向移动,说明缓蚀剂在金属表面形成了一层缓蚀剂分子膜来抑制金属的腐蚀。在缓蚀剂加量为200 mg/L以下时,随着缓蚀剂添加量的增加,阻抗谱逐渐增大。这是由于CS-N-MB分子中的N、O原子含有大量未公用电子对,它们通过与Fe原子结合,增大了吸附膜的稳定性,且缓蚀剂加量越大,保护膜越完整。在缓蚀剂加量超过200 mg/L时,阻抗谱随着缓蚀剂添加量的增加而减小。这是由于较大的CS-N-MB分子结构导致分子之间存在位阻效应,过量的缓蚀剂分子阻碍了其在金属表面的吸附。
表1 N80钢电极在不同浓度缓蚀剂CS-N-MB的15%盐酸溶液中极化曲线参数
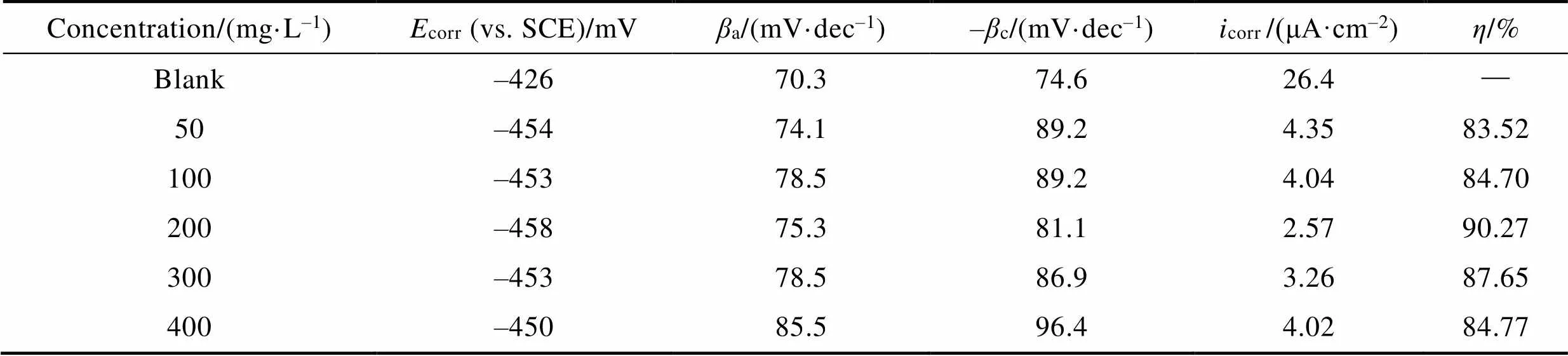
Tab.1 Polarization curve parameters of N80 steel electrode in 15% hydrochloric acid solution with different concentration of CS-N-MB corrosion inhibitor
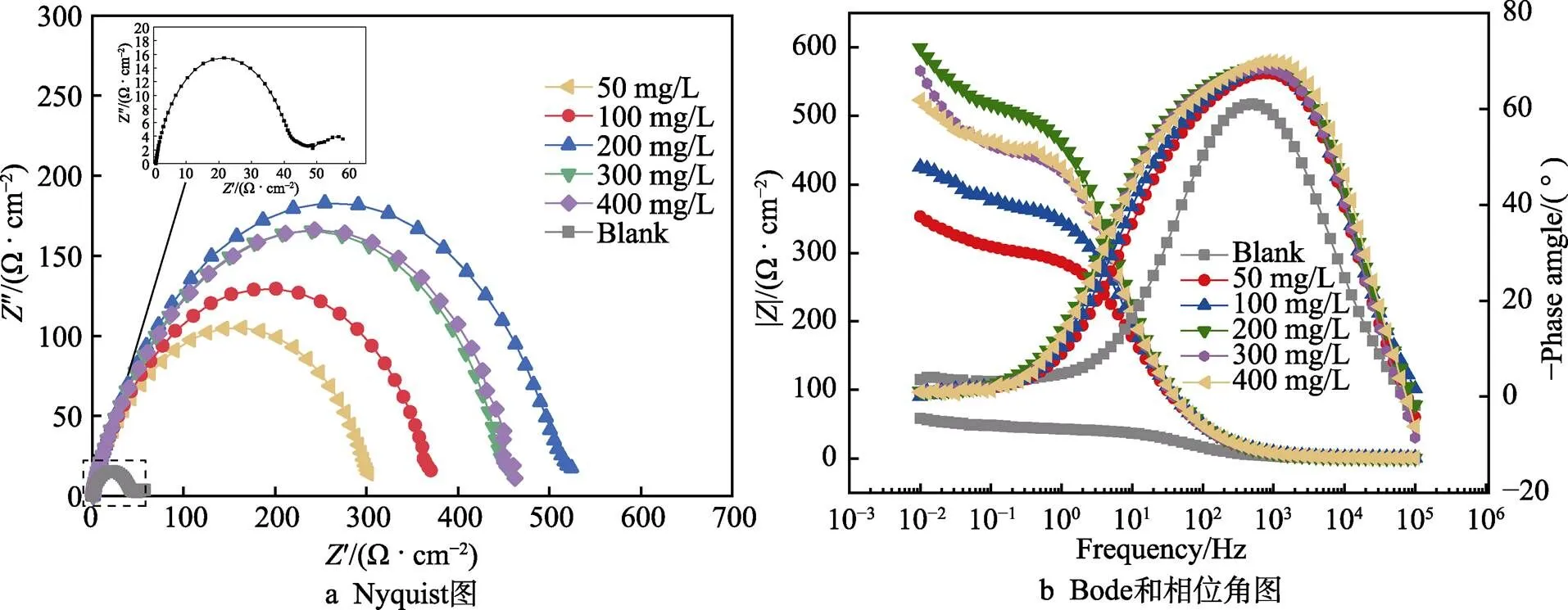
图4 N80钢在不同浓度缓蚀剂溶液中的Nyquist、Bode和相位角图
如图5所示,利用等效电路图来拟合电化学阻抗谱,可以得到溶液电阻s、电荷转移电阻ct、双层电容dl和缓蚀效率等动力学参数。其中dl可由式(5)计算。
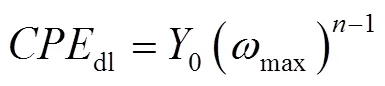
由表2数据可以看出,加入CS-N-MB缓蚀剂后,双电容层电容减小,这是因为缓蚀剂分子的介电常数小于水分子的介电常数,缓蚀剂分子在金属表面形成了保护膜。
2.2.3 失重法
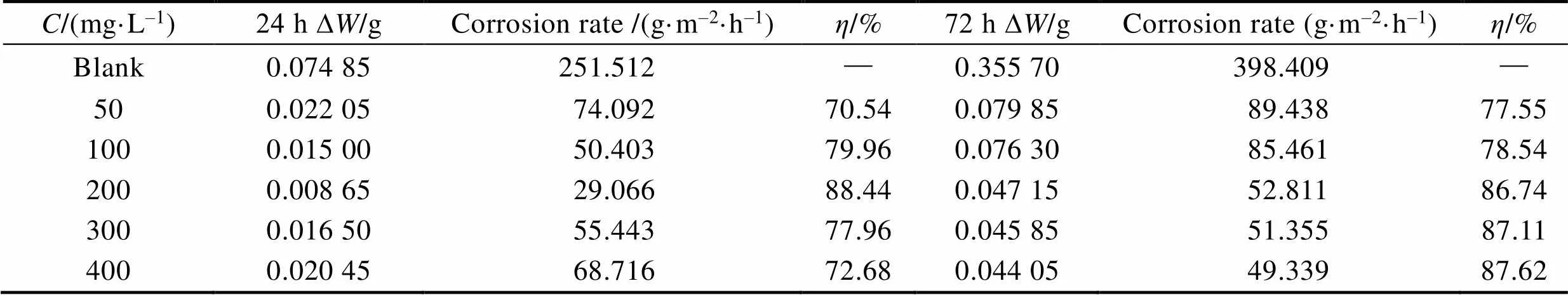
N80钢在不同CS-N-MB用量的15% HCl溶液中的常压腐蚀质量损失情况见表3。当浸泡时间为24 h时,随着CS-N-MB浓度的增大,挂片腐蚀速率先减小、后增大,即缓蚀效率先增加、后减小。这可能是因为在较低浓度时,缓蚀剂分子未能完整覆盖金属表面,随着缓蚀剂加量的不断增加,缓蚀剂膜逐渐完全覆盖金属表面,缓蚀效率增加。当缓蚀剂用量超过200 mg/L时,CS-N-MB分子间的位阻效应阻碍了其在金属表面的吸附,因此缓蚀效率下降。当缓蚀剂加量为200 mg/L时,缓蚀效率最佳,可达88.44%。其规律与短时间的电化学测试结果相符。当浸泡时间为72 h时,随着CS-N-MB浓度的增大,挂片的腐蚀速率逐渐减小,并趋于稳定,及缓蚀效率先增加、后趋于稳定。这可能是因为在长时间的浸泡中,金属表面因位阻效应掉落的缓蚀剂分子又逐渐稳定吸附在金属表面,趋于形成完整的缓蚀剂分子保护膜。
表2 不同浓度CS-N-MB在15%盐酸溶液中腐蚀的电化学阻抗参数
Tab.2 Electrochemical impendence spectroscopy parameters of CS-N-MB corrosion in 15% hydrochloric acid solution with different concentrations.
表3 挂片在含不同浓度缓蚀剂的15%盐酸溶液中的质量损失情况
Tab.3 Weight loss of hanging tablets in 15% hydrochloric acid solutions containing different concentrations of corrosion inhibitors
2.2.4 表面形貌分析
N80钢片在添加以及未添加缓蚀剂的15%盐酸溶液中浸泡72 h前后的表面形貌如图6所示。从图6a中可以看出,在未进行腐蚀前,N80钢片表面平滑均匀,仅有金属切割痕迹;而未添加缓蚀剂的钢片表面存在大量的腐蚀坑,侵蚀严重(见图6b)。图6c、d分别表示为在15%盐酸溶液中添加200、400 mg/L缓蚀剂后N80钢的表面腐蚀形貌,可以看出,钢片表面腐蚀坑较少,变得稍平滑。这表明CS-N-MB缓蚀剂的添加减缓了N80钢腐蚀程度,其结果与质量损失数据相符。
2.3 量子化学计算
2.3.1 前线轨道分布
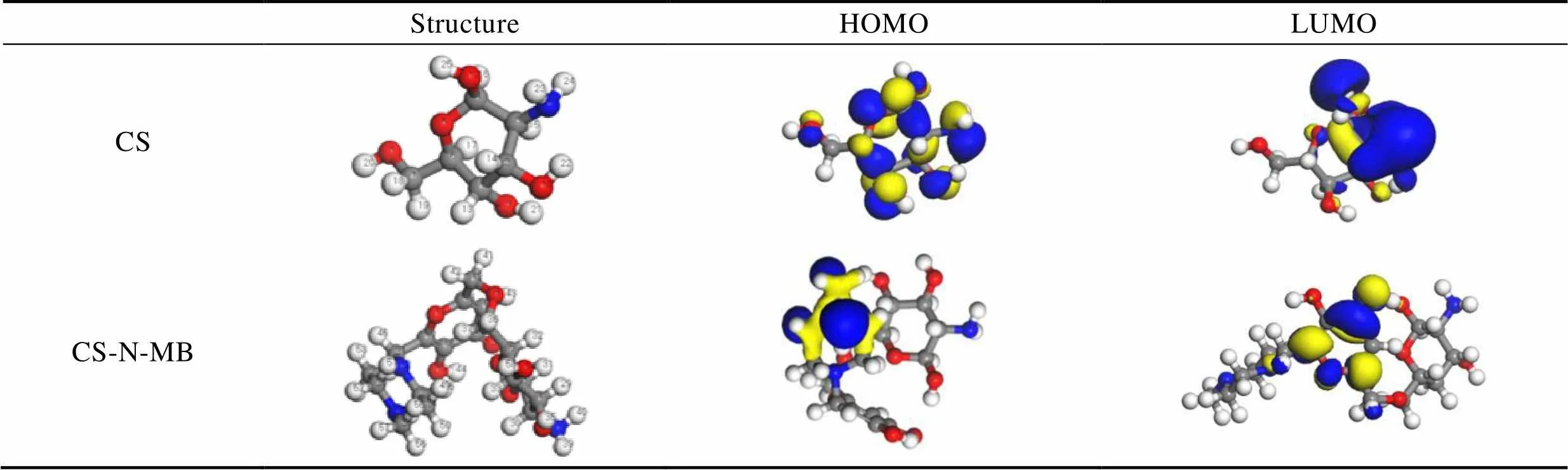
CS与CS-N-MB分子的几何优化结构以及前线轨道分布见表4。CS分子的HOMO和LUMO轨道主要集中在六元环结构和氧原子上。CS-N-MB分子的HOMO轨道主要分布在哌嗪环上,LUMO轨道分布在哌嗪环与CS结构环上。可以看出,CS与CS-N-MB分子的前线分子轨道主要分布在环状结构上。这可能是因为环上的非氢原子几乎在同一平面上,且存在肩并肩的π电子,所以环上原子易形成sp2杂化,即形成共轭π键增强了分子的反应活性。
能量带隙(∆=LUMO–HOMO)是评价缓蚀剂分子缓蚀性能的重要参数,其中HOMO和LUMO分别为分子的最高和最低未占据轨道能量。∆反映了分子的稳定性,可用于分析缓蚀剂与金属发生结合的难易程度。同类缓蚀剂中,∆值越小,缓蚀性能越好[19]。由计算可得,CS和CS-N-MB分子的能量带隙分别为∆CS=6.100 eV而∆CS-N-MB=2.859 eV,表明接枝MB以后,CS衍生物的能量带隙变小,更易与金属作用,从而增强缓蚀效果。

图6 N80钢片腐蚀前后形貌照片
表4 几何优化结构与前线分子轨道密度分布
Tab.4 Geometrically optimized structure diagram and frontier molecular orbital density distribution
2.3.2 局部反应活性
CS和CS-N-MB分子结构中典型原子的Fukui指数、密立根电荷分布和分子前线轨道在整个分子中的占比见表5。CS分子中O5、O9和O10的亲电Fukui指数较大,这3个原子的给电子能力较强,亲电性较强。O9和O10的亲核Fukui指数也比较大,夺电子能力较强,亲核性较强。同时,O9和O10原子带有较多的负电荷,且O9原子的HOMO轨道在整个CS分子的HOMO轨道中占比较大,这表明O9原子在亲电反应和亲核反应中活性较大,是CS分子的反应活性中心。在CS-N-MB分子中,N25和N11的亲电Fukui指数较大,O20、C15和C13的亲核Fukui指数较大。在这些活性原子中,N11的轨道占比较小,因此N11不是CS-N-MB分子中的亲电活性位点。
2.3.3 分子静电势
通过计算分子静电势,分析缓蚀剂亲核反应和亲电反应位点,如图7所示。分子静电势中红色到绿色区域静电势为正值,该区域电子密度较高,表现为负电性,即倾向于发生亲核反应。绿色到蓝色区域静电势为负值,该区域电子密度较低,表现正电性,即倾向于发生亲电反应。CS在N、O原子处的静电势较大,表明N、O原子处易发生亲核反应。CS-N-MB分子中除N、O原子外,含双键、O原子的六元环处的静电势较大,并且CS-N-MB分子整体的静电势比CS分子大,这表明CS-N-MB分子的反应活性要强于CS分子。
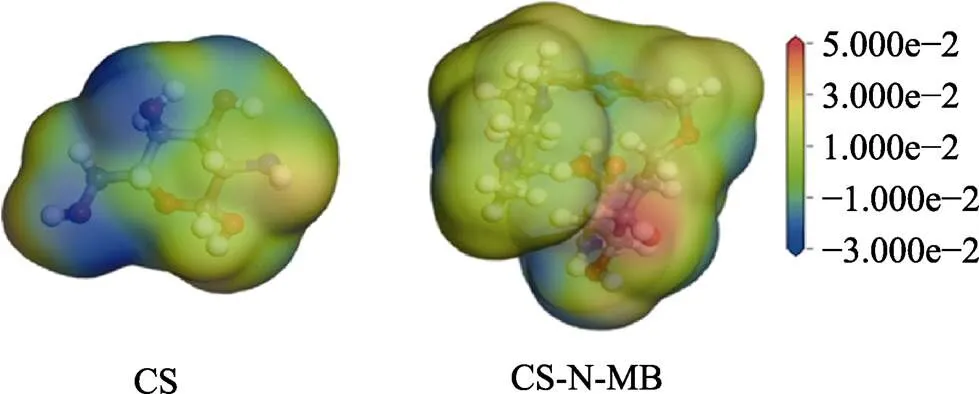
图7 壳聚糖分子与CS-N-MB分子的分子静电势
表5 缓蚀剂分子的Fukui指数、Mulliken电荷分布以及前线轨道系数
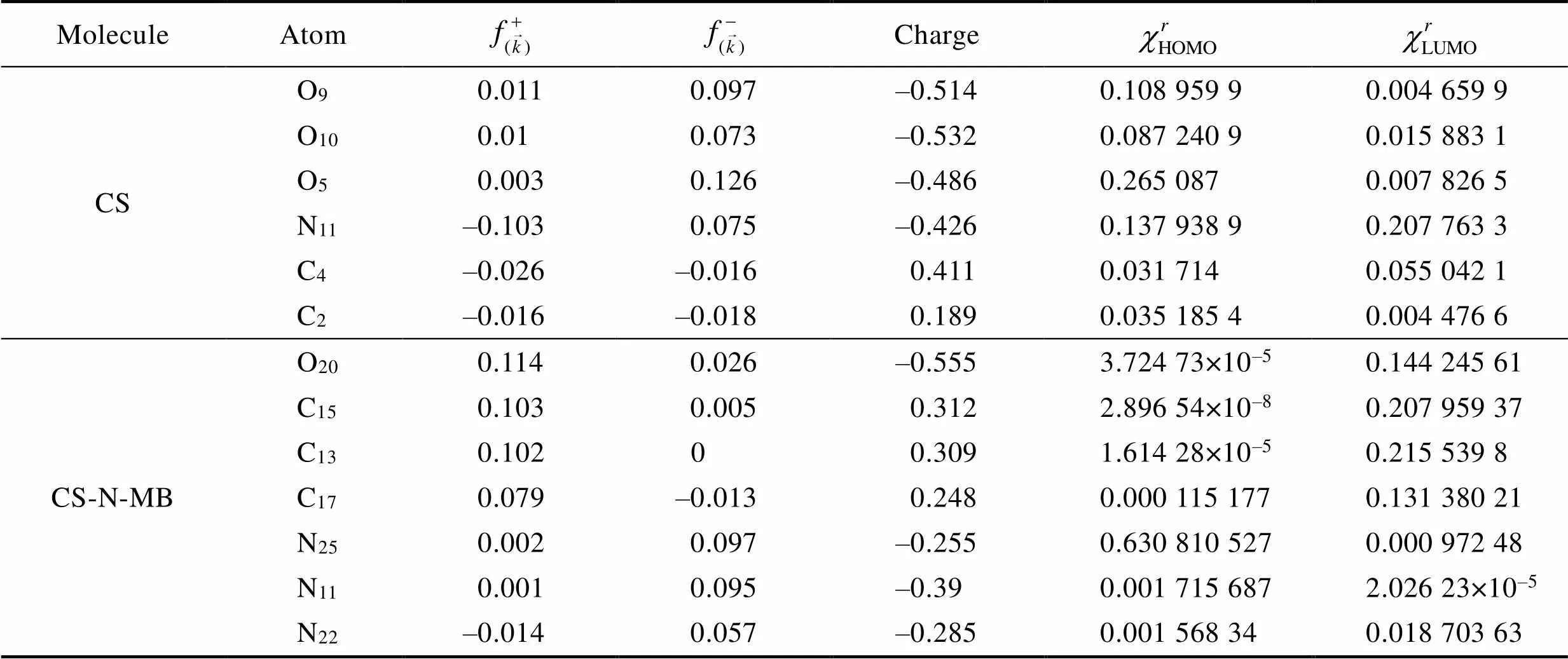
Tab.5 Fukui index, Mulliken charge distribution and frontier orbital coefficient of corrosion inhibitor molecule
2.4 分子动力学模拟
2.4.1 缓蚀剂分子的吸附能
通过计算非共价键吸附能来判断缓蚀剂分子在金属表面的吸附稳定性。CS和CS-N-MB分子在金属表面运动达到平衡时,其吸附构型和非键相互作用能变化(1 800~2 000 ps)如图8和图9所示。此时的非键相互作用能代表平衡状态时缓蚀剂与金属表面的物理吸附能。经过计算得CS的平均物理吸附能为–9.051 3 eV,CS-N-MB的平均物理吸附能为–65.833 3 eV,表明CS-N-MB在金属表面的成膜稳定性明显优于CS分子。

图8 CS分子和CS-N-MB分子在水中的吸附构型
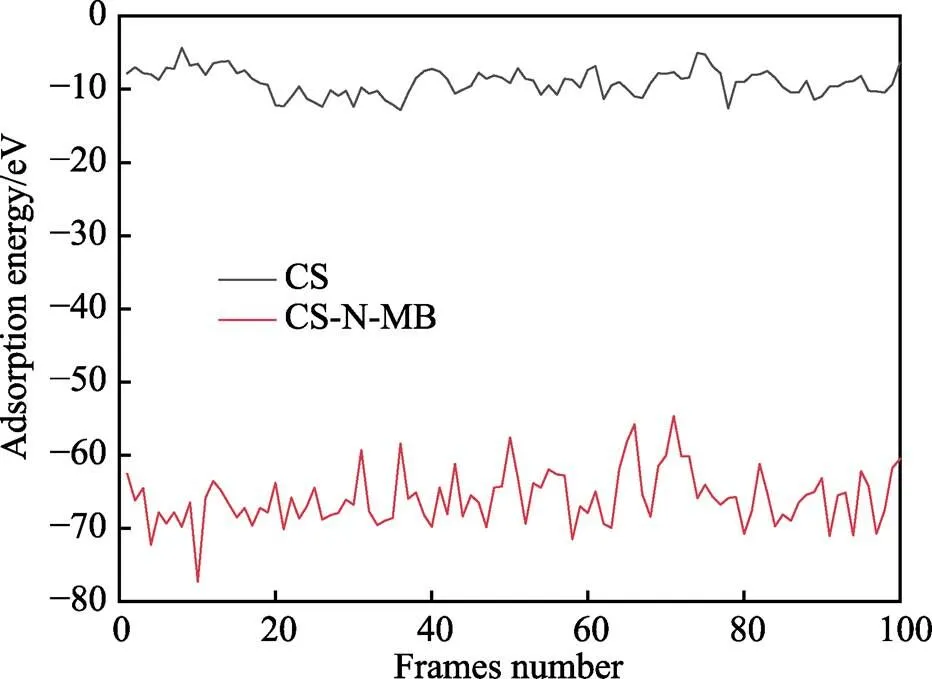
图9 CS和CS-N-MB分子的吸附能
2.4.2 水分子均方位移
通过计算含有CS和CS-N-MB体系中水分子的均方位移来判断腐蚀粒子的扩散速率。平衡状态下水分子的均方位移曲线及线性拟合如图10所示。当体系中不含缓蚀剂时,MSD曲线斜率为3.33,此时水分子的扩散不受任何限制。当CS分子存在于体系中,MSD曲线斜率为2.05,表明CS分子的存在阻碍了水分子的位移,一定程度上抑制了金属腐蚀。当体系中含有CS-N-MB时,MSD曲线斜率为1.15,此时体系中水分子的扩散速度最小,证明该情况下缓蚀效果最好。
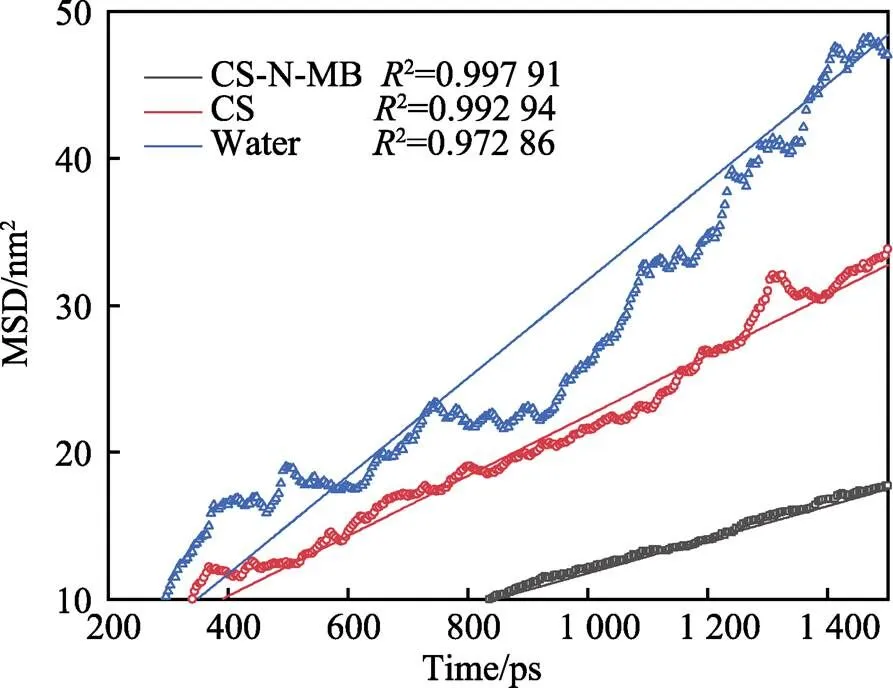
图10 含有CS分子、CS-N-MB分子体系中水分子的均方位移
3 结论
本文通过曲酸与N–甲基哌嗪合成曼尼希碱,再将合成的曼尼希碱接枝在壳聚糖上,合成了新型的哌嗪类曼尼希碱壳聚糖缓蚀剂。通过失重法和电化学法评价了其缓蚀性能,并运用分子模拟中的量化计算和分子动力学模拟研究了CS和CS-N-MB分子的活性位点、吸附能以及缓蚀机理。主要结论如下:
1)在15%盐酸酸化环境下,当CS-N-MB缓蚀剂添加质量浓度小于200 mg/L时,随着缓蚀剂添加量的增加,对N80钢的腐蚀抑制能力逐渐增加。当缓蚀剂加量超过200 mg/L,浸泡时间小于24 h时,缓蚀剂对N80钢的腐蚀抑制能力略微减弱;当浸泡时间为72 h时,缓蚀剂对N80钢腐蚀的抑制能力逐渐趋于稳定,缓蚀效率最高可达87.62%。
2)电化学阻抗谱分析表明,CS-N-MB分子在N80钢表面形成了吸附膜,抑制了腐蚀过程中的电荷转移。极化曲线分析表明,CS-N-MB分子为混合型缓蚀剂。
3)通过分子模拟量化计算可知,CS-N-MB分子的主要吸附活性位点在N、O原子以及环状结构处。分子动力学模拟表明,CS-N-MB分子在金属表面的吸附能大于CS分子,改性提高了缓蚀效率。体系中含有CS-N-MB分子时,腐蚀粒子的位移能力减弱,抑制了金属的腐蚀。
[1] JIA Zhi-shen, SHEN Dong-feng, XU Wei-liang. Synthesis and Antibacterial Activities of Quaternary Ammonium Salt of Chitosan[J]. Carbohydrate Research, 2001, 333(1): 1-6.
[2] EDUOK U M, KHALED M M. RETRACTED ARTICLE: Corrosion Protection of Steel Sheets by Chitosan from Shrimp Shells at Acid pH[J]. Cellulose, 2014, 21(5): 3139-3143.
[3] RABIZADEH T, KHAMENEH ASL S. Chitosan as a Green Inhibitor for Mild Steel Corrosion: Thermodynamic and Electrochemical Evaluations[J]. Materials and Corrosion, 2019, 70(4): 738-748.
[4] CHEN N L, KONG P P, FENG H X, et al. Corrosion Mitigation of Chitosan Schiff Base for Q235 Steel in 1.0M HCl[J]. Journal of Bio- and Tribo-Corrosion, 2019, 5(1): 1-8.
[5] ELSAEED S M, EL TAMANY E S H, ASHOUR H, et al. Corrosion and Hydrogen Evolution Rate Control for X-65 Carbon Steel Based on Chitosan Polymeric Ionic Liquids: Experimental and Quantum Chemical Studies[J]. RSC Advances, 2018, 8(66): 37891-37904.
[6] SRIVASTAVA V, CHAUHAN D S, JOSHI P G, et al. PEG-Functionalized Chitosan: A Biological Macromolecule as a Novel Corrosion Inhibitor[J]. Chemistry Select, 2018, 3(7): 1990-1998.
[7] CHAUHAN D S, SRIVASTAVA V, JOSHI P G, et al. PEG Cross-Linked Chitosan: A Biomacromolecule as Corrosion Inhibitor for Sugar Industry[J]. International Journal of Industrial Chemistry, 2018, 9(4): 363-377.
[8] 吕祥鸿, 张晔, 闫亚丽, 等. 两种新型曼尼希碱缓蚀剂的性能及吸附行为研究[J]. 中国腐蚀与防护学报, 2020, 40(1): 31-37.
LV Xiang-hong, ZHANG Ye, YAN Ya-li, et al. Performance Evaluation and Adsorption Behavior of Two New Mannich Base Corrosion Inhibitors[J]. Journal of Chinese Society for Corrosion and Protection, 2020, 40(1): 31-37.
[9] 鄢明雄. 一种杂环类曼尼希碱在次氯酸根溶液中对碳钢的缓蚀性能[J]. 精细石油化工, 2019, 36(3): 65-68.
YAN Ming-xiong. Inhibition Performance of a Heterocyclic Mannich Base on Carbon Steel in Hypochlorite Solution[J]. Speciality Petrochemicals, 2019, 36(3): 65-68.
[10] 郭文姝, 丛玉凤, 黄玮, 等. 曼尼希碱型缓蚀剂的合成及缓蚀作用的评价[J]. 石油炼制与化工, 2018, 49(12): 97-102.
GUO Wen-shu, CONG Yu-feng, HUANG Wei, et al. Synthesis of Mannich Base Inhibitor and Their Effectiveness Against Corrosion[J]. Petroleum Processing and Petrochemicals, 2018, 49(12): 97-102.
[11] JEEVA M, PRABHU G V, BOOBALAN M S, et al. Interactions and Inhibition Effect of Urea-Derived Mannich Bases on a Mild Steel Surface in HCl[J]. The Journal of Physical Chemistry C, 2015, 119(38): 22025-22043.
[12] LIU Xiao-li, XIA Wen-shui, JIANG Qi-xing, et al. Chitosan Oligosaccharide-N-Chlorokojic Acid Mannich Base Polymer as a Potential Antibacterial Material[J]. Carbohydrate Polymers, 2018, 182: 225-234.
[13] CHAUHAN D S, ANSARI K R, SOROUR A A, et al. Thiosemicarbazide and Thiocarbohydrazide Functionalized Chitosan as Ecofriendly Corrosion Inhibitors for Carbon Steel in Hydrochloric Acid Solution[J]. International Journal of Biological Macromolecules, 2018, 107: 1747-1757.
[14] SOLMAZ R. Investigation of the Inhibition Effect of 5- ((E)-4-Phenylbuta-1, 3-Dienylideneamino)-1, 3, 4-Thiadiazole-2-Thiol Schiff Base on Mild Steel Corrosion in Hydrochloric Acid[J]. Corrosion Science, 2010, 52(10): 3321- 3330.
[15] SOLMAZ R, KARDAŞ G, ÇULHA M, et al. Investigation of Adsorption and Inhibitive Effect of 2-Mercaptothiazoline on Corrosion of Mild Steel in Hydrochloric Acid Media[J]. Electrochimica Acta, 2008, 53(20): 5941-5952.
[16] SAHA S K, DUTTA A, GHOSH P, et al. Adsorption and Corrosion Inhibition Effect of Schiff Base Molecules on the Mild Steel Surface in 1 M HCl Medium: A Combined Experimental and Theoretical Approach[J]. Physical Chemistry Chemical Physics, 2015, 17(8): 5679-5690.
[17] 董炎明, 王勉, 吴玉松, 等. 壳聚糖衍生物的红外光谱分析[J]. 纤维素科学与技术, 2001, 9(2): 42-56.
DONG Yan-ming, WANG Mian, WU Yu-song, et al. FTIR Spectroscopic Determinations of Chitosan Derivatives[J]. Journal of Cellulose Science and Technology, 2001, 9(2): 42-56.
[18] KHAN G, BASIRUN W J, KAZI S N, et al. Electrochemical Investigation on the Corrosion Inhibition of Mild Steel by Quinazoline Schiff Base Compounds in Hydrochloric Acid Solution[J]. Journal of Colloid and Interface Science, 2017, 502: 134-145.
[19] ARSLAN T, KANDEMIRLI F, EBENSO E E, et al. Quantum Chemical Studies on the Corrosion Inhibition of some Sulphonamides on Mild Steel in Acidic Medium[J]. Corrosion Science, 2009, 51(1): 35-47.
Preparation and Corrosion Inhibition of Piperazine Mannich Base Chitosan Corrosion Inhibitors
,,,,,
(China University of Petroleum (East China), Shandong Qingdao 266580, China)
In order to solve the problem of acidification and corrosion of subsea oil production equipment, a green piperazine Mannich base chitosan derivative corrosion inhibitor CS-N-MB was synthesized in this paper, and its corrosion inhibition performance on N80 steel in 15wt.% hydrochloric acid solution was studied, and its mechanism of action on the metal surface was calculated. Using kojic acid and N-methylpiperazine as raw materials, Mannich base (MB) was synthesized through Mannich reaction, and then the Mannich base was grafted onto chitosan molecules. The synthesized products were characterized by infrared spectroscopy, and the corrosion inhibition ability of CS-N-MB on N80 steel in this strong acid environment was evaluated by electrochemical method and static weight loss method. The reactivity of chitosan (CS) and CS-N-MB was studied based on density functional theory, the active sites were clarified, and the adsorption energy of the corrosion inhibitor and the mean square displacement of water molecules in the system were calculated by molecular dynamics. The corrosion inhibition effect of N80 steel was good in the environment of 15 wt% hydrochloric acid, and when the corrosion inhibitor dosagewas less than 200 mg/L, the corrosion rate of N80 steel decreases gradually with the increase of concentration. When the addition of corrosion inhibitor was more than 200 mg/L, the corrosion rate of N80 steel increases slightly with the increase of concentration in a short time, but after 72 h, the corrosion rate of N80 steel decreases slightly and tends to be stable. Electrochemical studies showed that CS-N-MB can inhibit both cathodic and anodic reactions of corrosion simultaneously, and was a mixed inhibitor. Molecular simulation results show that the main active sites of CS-N-MB were concentrated in N, O and ring structures, and the movement of water molecules in the system was slowed down after adding CS-N-MB, which inhibits the occurrence of metal corrosion. CS-N-MB was a green corrosion inhibitor with good corrosion inhibition effect in strong acid environment. Multiple active centers can form a dense protective film on the metal surface, thereby effectively inhibiting the corrosion of metal.
chitosan; mannich base; corrosion inhibitor; molecular simulation; acidic condition; submarine pipeline
TG174.42
A
1001-3660(2022)05-0139-09
10.16490/j.cnki.issn.1001-3660.2022.05.015
2022–02–28;
2022–04–24
2022-02-28;
2022-04-24
国家自然科学基金面上项目(51974345);山东省自然科学基金面上项目(ZR2019MEM054)
The General Project of National Natural Science Foundation of China (51974345); The General Project of Natural Science Foundation of Shandong Province (ZR2019MEM054)
李俐枝(1998—),女,硕士研究生,主要研究方向为材料腐蚀与防护。
LI Li-zhi (1998-), Female, Postgraduate, Research focus: corrosion and protection.
胡松青(1967—),男,博士,教授,主要研究方向为材料腐蚀与防护。
HU Song-qing (1967-), Male, Doctor, Professor, Research focus: corrosion and protection.
李俐枝, 彭云超, 李丰渟, 等. 哌嗪类曼尼希碱壳聚糖缓蚀剂的制备及缓蚀性能研究[J]. 表面技术, 2022, 51(5): 139-147.
LI Li-zhi, PENG Yun-chao, LI Feng-ting, et al. Preparation and Corrosion Inhibition of Piperazine Mannich Base Chitosan Corrosion Inhibitors[J]. Surface Technology, 2022, 51(5): 139-147.
责任编辑:刘世忠
