新型冠状病毒疫苗接种对ELISA检测HIV抗体的影响
2022-05-26王克成潘诗茜
王克成,潘诗茜,丛 琳
江苏省南通市中心血站检验科,江苏南通 226014
新型冠状病毒肺炎(COVID-19)对全社会经济与生活造成巨大影响,新型冠状病毒(SARS-CoV-2)疫苗接种是有效预防COVID-19的重要手段。截至2021年4月24日24时,南通市已累计接种92.46万人、102.37万针,完成全程免疫9.91万人[1]。根据血站COVID-19疫情常态化防控工作指引,SARS-CoV-2灭活疫苗接种48 h后可献血,其他类型SARS-CoV-2疫苗(不包括减毒活疫苗)接种14 d后可以献血[2]。但SARS-CoV-2抗体是否对酶联免疫吸附试验(ELISA)检测人类免疫缺陷病毒(HIV)抗体的结果产生影响,尚不明确。本研究对SARS-CoV-2疫苗接种满28 d的献血者按HIV抗体检测反应性不同分组比较SARS-CoV-2总抗体检测情况,为实验室准确检测HIV抗体提供参考,现报道如下。
1 资料与方法
1.1一般资料 数据来源于本站血液信息管理系统(BIS)和实验室信息管理系统(LIS),收集2021年3月16日至2021年4月9日本站献血者HIV抗体检测单试剂反应性标本15份和非反应性标本30份,共45份标本。对应的45例献血者均接受SARS-CoV-2疫苗接种满28 d。献血者经健康征询,符合《献血者健康检查要求》(GB18467-2011),无类风湿性关节炎、系统性红斑狼疮、皮肌炎、特发性血小板减少性紫癜、单核细胞增多症等病史,28 d内无发热或呼吸道症状,与发热或呼吸道症状人员无密切接触史,与SARS-CoV-2感染者或聚集性发病人群无接触或流行病学关联史,无境外或高风险区居住史[2]。同时对本站2017年1月至2020年12月献血者的355 575份HIV ELISA检测结果进行回顾性分析,年龄18~60岁,均符合献血要求。
1.2仪器与试剂 抗体检测仪器包括TECAN freedom evo clinical全自动混样仪,HAMILTON Microlab F.A.M.E24/20全自动酶标仪,SIEMENS BEPⅢ全自动酶标仪,TECAN M8/2CH洗板机,TECAN SUNRISE酶标仪。真空采血管脱盖机(DC-1,阳普医疗),冷冻离心机(MULTIFUGE X3FR,赛默飞世尔科技),恒温培养箱(DNP-9082BS-Ⅲ,上海新苗),生物安全柜(HR50-11A2,海尔生物)。抗体检测试剂盒分别来自A和B公司,包括HIV抗体诊断试剂盒[酶联免疫吸附试验(ELISA),A1]、HIV抗原抗体诊断试剂盒(ELISA,B1)、SARS-CoV-2抗体检测试剂盒(ELISA,A2)和HIV抗体诊断试剂盒(胶体金法,B2)。室内质控品均来自北京康彻思坦。
1.3方法 使用A1和B1 2种ELISA试剂盒进行HIV抗体检测,单试剂检测结果呈反应性时使用原试剂进行双孔复试,双孔复试任意一孔呈反应性或双试剂反应性时判为阳性,并送南通市疾病预防控制中心(CDC)采用蛋白质印迹(WB)法确认,除双试剂反应性外的标本进行核酸检测。血清学检测HIV抗体(或抗原)、SARS-CoV-2总抗体,以及核酸检测HIV RNA的检测步骤参照仪器设备和各试剂盒说明书。HIV ELISA检测结果以S/CO≥0.7为反应性,0.7≤S/CO<1.0为灰区。SARS-CoV-2总抗体的判读按试剂盒说明书要求进行。
1.4统计学处理 采用Microsoft excel 2010整理数据,应用SPSS22.0软件进行数据统计分析,计数资料以率表示,比较采用χ2检验或Fisher确切概率法,HIV抗体和SARS-CoV-2抗体检测结果的相关性采用Spearman相关分析。以P<0.05为差异有统计学意义。以ELISA检测结果的S/CO值作为统计变量,CDC确证结果作为状态变量,绘制受试者工作特征(ROC)曲线并计算曲线下面积(AUC),选择最大约登指数对应的S/CO值作为试剂最适临界值。
2 结 果
2.12020年与2021年检测情况比较 2021年3月16日至2021年4月9日共检测献血者标本8 920份,A1试剂检测HIV抗体反应性标本15份(S/CO值:0.75~7.56),反应性比例0.17%(15/8 920);2020年1月1日至2020年12月31日共检测献血者标本93 399份,反应性标本24份,反应性比例[0.03%(24/93 399)],CDC确证7份;2020年与2021年检测情况相比,差异有统计学意义(χ2=43.374,P<0.01)。B1、B2试剂与核酸检测均为非反应性,CDC WB法确证为阴性。2021年HIV抗体假阳性率[0.17%(15/8 920)]是2020年[0.02%(17/93 399)]的8.5倍,差异有统计学意义(χ2=58.566,P<0.01)。
2.22021年SARS-CoV-2总抗体检测情况 2021年3月16日至2021年4月9日HIV抗体反应性标本15份与随机抽取的30份非反应性标本同步进行SARS-CoV-2总抗体检测。对应45例献血者中,男40例,女5例,年龄21~57岁。在A1试剂HIV 抗体反应组和非反应组中,SARS-CoV-2 总抗体反应性结果差异有统计学意义(χ2=12.851,P<0.01),SARS-CoV-2总抗体反应性结果与HIV抗体反应性(假阳性)结果呈正相关(r=0.515,P<0.01)。见表1。

表1 SARS-CoV-2总抗体检测情况
2.32017-2020年2种HIV抗体ELISA试剂ROC曲线分析结果 对2017-2020年355 575份HIV ELISA检测结果进行分析,HIV抗体反应性295份,其中A1试剂单反应性136份,B1试剂单反应性104份,双试剂反应性55份,经CDC确证阳性38份。根据ROC曲线确定HIV抗体ELISA检测的临界值。见表2。
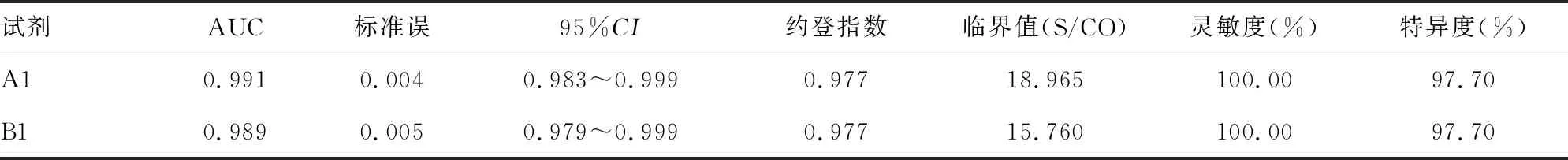
表2 2017-2020年2种HIV抗体ELISA试剂ROC曲线分析结果
3 讨 论
血液是HIV传播的重要途径,为最大限度保证血液安全,血液筛查实验室应选用能够检测出最弱反应性标本的高灵敏度试剂,尽可能防止漏检,但高灵敏度常意味着非特异性反应增多[3],易造成假阳性结果。本研究显示,2021年3月16日至2021年4月9日本实验室ELISA 检测HIV抗体受SARS-CoV-2抗体的影响产生假阳性,提示实验室关注低S/CO值反应性结果对保证检测结果的准确性有一定参考意义。
ELISA是献血者HIV筛查的常用方法,有研究证明ELISA检测S/CO值与确证结果具有相关性,随着S/CO值的上升,确证阳性率明显增加[4]。回顾本实验室2017-2020年HIV ELISA检测结果,灰区标本无确证阳性,与胡文佳等[5]结果一致,确证HIV阳性的均为双试剂反应性,单试剂反应性标本无确证阳性,双试剂或单试剂非反应性标本核酸检测均为阴性,与南昌等地区ELISA单试剂阳性标本假阳性比例较高[6]的情况相同。本研究中,A1试剂HIV检测15份反应性结果的S/CO值(0.75~7.56)远小于临界值18.965(2017-2020年),且均为单试剂反应性,结合核酸检测与确证结果均判定为假阳性。
HIV检测结果的假阳性将会造成血液资源的浪费,增加重复检测、疾控中心确认、献血者归队等工作量,降低实验室威信等。造成HIV抗体ELISA检测假阳性的原因可能有:(1)自身抗体、异嗜性抗体、人抗动物抗体及结合蛋白等内源性因素;(2)标本溶血、凝固不全或者保存时间过长[7];(3)脂血、免疫交叉反应及基质效应甚至检测设备不同[8]。本实验室所有标本按照《血站技术操作规程》(2019版)要求采用乙二胺四乙酸二钾(EDTA-K2)真空管,采集、留样过程操作规范无异常,2~8 ℃冷藏,72 h内完成全部检测,检测设备运行正常,近期未发生故障、未进行重大维护校准,工作人员无新进或转岗,严格按试剂说明书操作,可排除人员、设备、试剂、质控品、水电、环境等外源性因素。献血者经过严格的健康征询,无类风湿性关节炎、系统性红斑狼疮、银屑病、特发性血小板减少性紫癜、单核细胞增多症等病史,标本外观检查排除溶血、脂血、纤维蛋白析出、细菌污染等,乙型肝炎病毒表面抗原(HBsAg)、丙型肝炎病毒(HCV)抗体和梅毒螺旋体(TP)抗体检测结果均为阴性,丙氨酸氨基转移酶(ALT)均合格,基本排除常见自身抗体所致的交叉反应,以及血脂、溶血、黄疸、类风湿因子等内源性因素。本研究中HIV抗体假阳性比例为0.17%(15/8 920),是2020年0.02%(17/93 399)的8.5倍(P<0.01),由于异嗜性抗体所致的可能性较小。
机体在感染病毒后会发生免疫反应并产生IgM、IgG、IgA等特异性抗体,一般情况下,IgM抗体在病毒感染早期,约在感染病毒后1周出现,但浓度相当较低、维持时间短、亲和性较低。IgG抗体在感染病毒后3周出现,在血液循环中较长时间存在,且抗体初期会有一个持续增高的过程[9]。SARS-CoV-2疫苗接种后产生抗体的原理与此类似,在10 项研究中,受试者接种疫苗28 d内中和抗体几何平均滴度明显增加,血清转化率超过80%[10]。2020年12月15日中国正式开展重点人群接种工作,本研究对象来自南通首批SARS-CoV-2灭活疫苗(Vero细胞)接种人群,参加无偿献血时接种间隔已超过28 d,SARS-CoV-2总抗体反应性比例为46.67%(21/45)。HIV抗体反应组和非反应组SARS-CoV-2总抗体反应性比例分别为86.67%(13/15)和30.00%(9/30),SARS-CoV-2抗体反应性检测结果与A1试剂检测HIV抗体假阳性结果之间存在相关性(r=0.515,P<0.01)。
自身抗体可以由于交叉反应与包被在固相载体上的抗原形成非特异性的结合[11],或者非特异性地吸附在反应孔上,在洗涤不彻底的情况下使底物显色导致假阳性的出现。SARS-CoV-2是一种通过与血管紧张素转换酶Ⅱ(ACE2)受体结合感染细胞,产生细胞死亡和ACE2下调的呼吸道病毒,与失调的免疫反应一起,协调一种促炎、促血栓状态,导致呼吸道和多器官功能衰竭[12]。有研究表明,SARS-CoV-2可侵犯造血细胞,通过生成自身抗体或免疫复合物等造成细胞损坏,血小板和其他具有相似抗原的血细胞也可能被抗血小板抗体和免疫复合物结合,引发免疫损伤[13]。谢毓滨等[14]研究显示,15名COVID-19康复者血小板抗体筛查实验全部呈强阳性。LEI等[15]研究表明,SARS-CoV-2表面刺突蛋白(S蛋白)本身就会破坏血管内皮细胞,使血管内皮细胞死亡,造成血管内膜炎。因此,SARS-CoV-2疫苗接种后可能产生自身抗体,由于交叉反应导致本研究中HIV抗体的假阳性。本研究中A1试剂为ELISA 3代试剂,采用双抗原夹心法,酶标志物为特异性HIV抗体,可以同时检测IgG、IgM抗体,B1试剂为4代试剂,在3代试剂基础上还包被了P24抗原,可以同时检测抗原和抗体,试剂稳定性强且产生的假阳性反应更少[3],这可能造成了本研究中A1试剂反应性而B1试剂非反应性结果的差异。
本研究存在一定的局限性,为单中心研究,样本量较小,仅对SARS-CoV-2总抗体情况进行抽样检测,未对IgG、IgM进行鉴别和核酸确认,可能存在偏差,以后可以进一步完善包含多中心、大样本、更多检测项目的研究,为实验室提供借鉴。
综上所述,SARS-CoV-2总抗体检测结果与A1试剂HIV抗体反应性结果之间存在相关性,SARS-CoV-2疫苗接种后产生的抗体对部分ELISA试剂检测HIV抗体带来影响,造成假阳性结果。采供血机构需要加强献血者健康征询,区分无症状感染者与疫苗接种者,排除高危人群,妥善选择检测方法与试剂,合理调整检测策略,尽早进行WB确证或核酸检测,在确保安全的前提下减少假阳性,避免血液浪费和对献血者的不良影响。今后可以进一步研究疫苗接种是否对其他检测项目带来影响,并探索其发生的机制。
