外周血NLR、PLR、SCC、CA125和CYFRA21-1在早期宫颈鳞癌诊断中的价值*
2022-05-26李小琴宋楠昊石永军侯玉磊
李小琴,宋楠昊,石永军,侯玉磊
1.重庆医科大学附属第一医院检验科,重庆 400016;2.重庆医科大学检验医学院,重庆 400016
宫颈癌是影响女性健康的一个主要公共卫生问题,其发病率居女性常见恶性肿瘤第4位,仅次于乳腺癌、结肠直肠癌和肺癌[1]。近期研究显示,宫颈癌病理类型仍以鳞癌为主,分期以早期居多[2],加强早期筛查对宫颈癌的早期诊治具有重要意义。肿瘤的发生往往伴随炎症进展,中性粒细胞与淋巴细胞比值(NLR)和血小板与淋巴细胞比值(PLR)为全身炎性反应的非特异性标志物,近年来在多个领域中已有研究,有报道其对宫颈癌的临床分期和预后判断具有一定的价值[3]。鳞状上皮细胞癌抗原(SCC)、糖类抗原125(CA125)和细胞角蛋白19片段(CYFRA21-1)是宫颈癌治疗监测和预后判断常用的血清标志物[4],但关于NLR、PLR、SCC、CA125、CYFRA21-1联合检测在早期宫颈鳞癌的辅助诊断中的研究较少。本研究分析外周血炎症标志物NLR、PLR与肿瘤标志物SCC、CA125、CYFRA21-1在早期宫颈鳞癌患者中的水平,以及这5项指标联合检测对早期宫颈鳞癌的诊断效能,分析不同病理特征的宫颈鳞癌患者NLR、PLR、SCC、CA125和CYFRA21-1水平变化,以期为早期宫颈鳞癌的筛查和诊断提供参考。
1 资料与方法
1.1一般资料 选择2017年1月至2020年12月就诊于重庆医科大学附属第一医院(下称本院)并行手术治疗的163例早期宫颈鳞癌患者作为试验组,同期本院体检中心171例女性体检健康者作为对照组。试验组纳入标准:(1)术后结果证实国际妇产科联盟(FIGO)分期为ⅠA、ⅠB1、ⅠB2、ⅡA1期宫颈鳞癌;(2)近期内无急、慢性感染,未使用抗菌药物。排除标准:(1)近期接受过影响血常规结果的治疗,如放化疗、激素治疗等;(2)合并血液病或其他恶性肿瘤;(3)合并感染性或免疫性疾病;(4)合并其他部位鳞状细胞癌,如肺、口腔、食管、直肠、结肠、皮肤等。试验组年龄27~79岁,平均(50.94±9.92)岁;临床分期:ⅠA期23例(14.1%),ⅠB1期19例(11.7%),ⅠB2期52例(31.9%),ⅡA1期69例(42.3%)。对照组年龄26~79岁,平均(50.00±10.78)岁。两组年龄比较,差异无统计学意义(P>0.05)。本研究通过本院伦理委员会审批,所有研究对象签署研究知情同意书。
1.2方法 血常规指标检测:采用BD公司乙二胺四乙酸二钾(EDTA-K2)抗凝管采血,采用SYSMEX XE-5000全自动血细胞分析仪和配套试剂进行检测。根据检测结果计算NLR、PLR。SCC、CA125和CYFRA21-1水平检测:均采用成都瑞琦公司促凝管采血,分离血清后,采用罗氏Cobas e 602电化学发光分析仪和配套试剂进行检测。

2 结 果
2.1试验组与对照组NLR、PLR、SCC、CA125和CYFRA21-1水平比较 试验组NLR、PLR、SCC、CA125和CYFRA21-1均高于对照组,差异有统计学意义(P<0.05)。见表1。
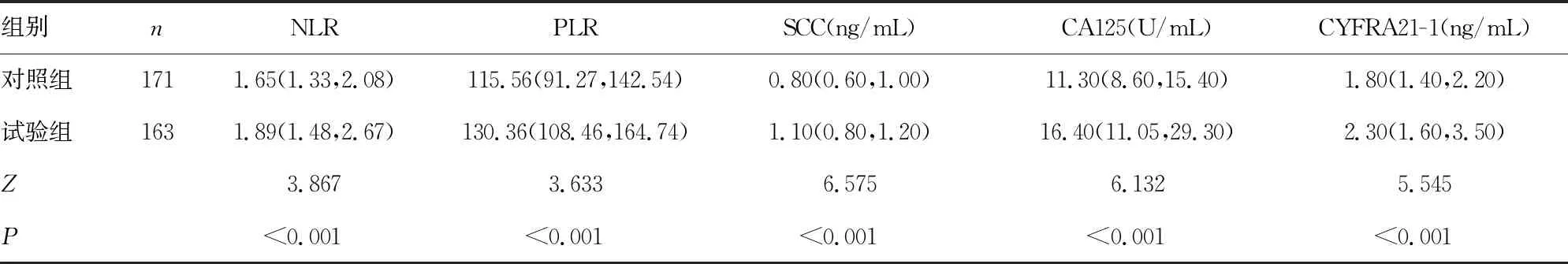
表1 试验组与对照组NLR、PLR、SCC、CA125和CYFRA21-1水平比较[M(P25,P75)]
2.2NLR、PLR、SCC、CA125和CYFRA21-1在早期宫颈鳞癌诊断中的效能 NLR、PLR、SCC、CA125、CYFRA21-1及5项联合检测诊断早期宫颈鳞癌的ROC曲线下面积(AUC)分别为0.622、0.618、0.710、0.691、0.675、0.832。见表2。
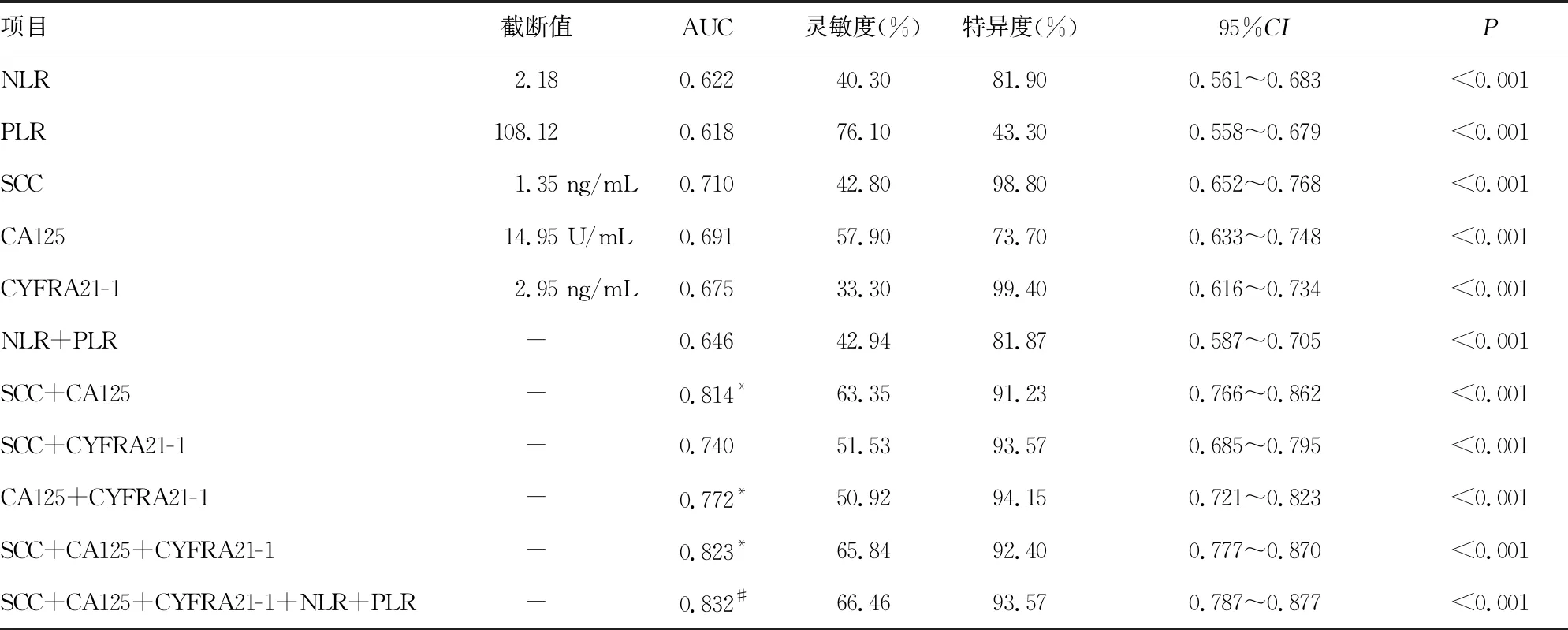
表2 NLR、PLR、SCC、CA125和CYFRA21-1诊断早期宫颈鳞癌的ROC曲线相关参数
2.3不同病理特征早期宫颈鳞癌外周血NLR、PLR、SCC、CA125和CYFRA21-1水平比较 NLR和PLR在肿瘤最大径<2 cm和≥2 cm组,以及肿瘤是否超越子宫组间差异均无统计学意义(P>0.05);SCC在肿瘤最大径≥2 cm组明显高于肿瘤最大径<2 cm组(P<0.05),肿瘤超越子宫组明显高于肿瘤未超越子宫组(P<0.05);CA125在肿瘤最大径≥2 cm组明显高于肿瘤最大径<2 cm组(P<0.05),在肿瘤是否超越子宫组间差异无统计学意义(P>0.05);CYFRA21-1在肿瘤超越子宫组高于肿瘤未超越子宫组(P<0.05);肿瘤最大径<2 cm和≥2 cm组间差异无统计学意义(P>0.05)。见表3。
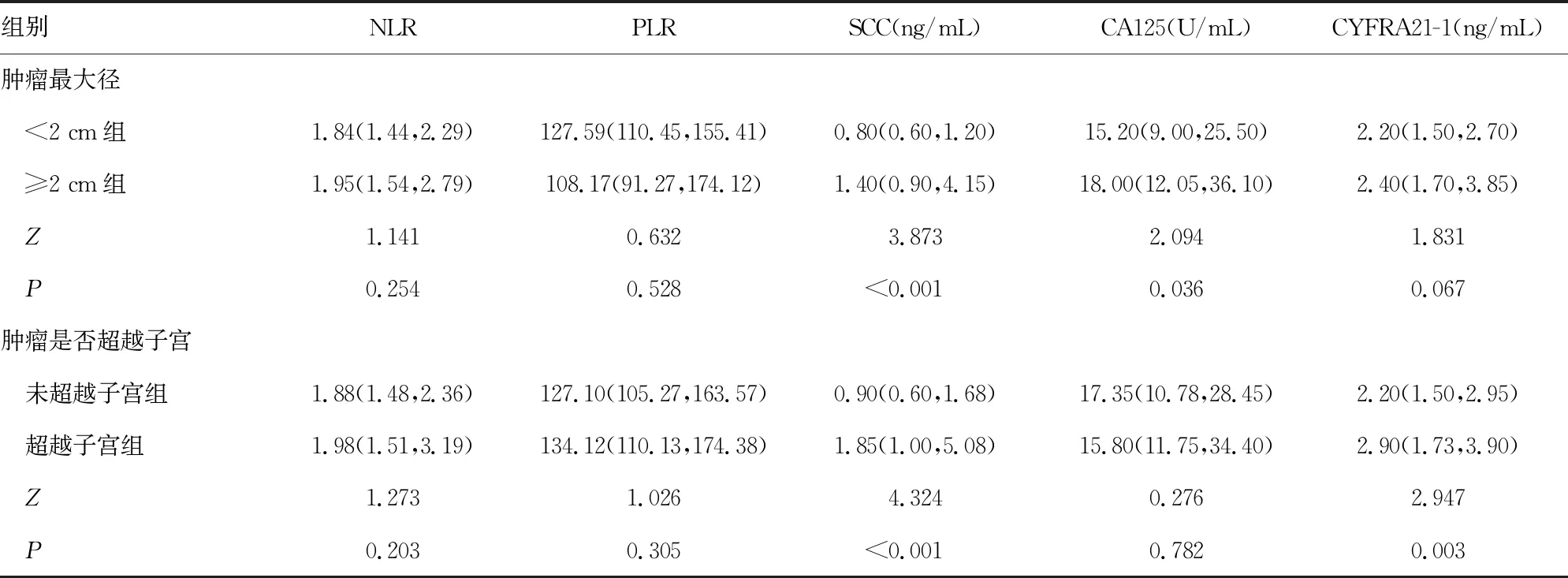
表3 不同病理特征早期宫颈鳞癌患者NLR、PLR、SCC、CA125和CYFRA21-1比较[M(P25,P75)]
3 讨 论
宫颈癌是女性常见恶性肿瘤之一,在肿瘤的发生、发展过程中,血液中的某些肿瘤标志物,包括炎症标志物和肿瘤标志物等,可出现不同程度升高,在宫颈癌早期发生变化的标志物有助于临床医生对宫颈癌进行早期诊断,预测临床疗效和病情监测[5],探索可用于早期宫颈鳞癌的辅助诊断指标尤为重要。
NLR和PLR作为常见的全身炎性反应标志物,对肿瘤的诊断、预后判断及疗效监测有重要意义。有研究报道,宫颈癌组NLR高于健康对照组(P<0.05),与癌前病变组比较差异无统计学意义(P>0.05),宫颈癌组PLR高于健康对照组和癌前病变组(P<0.05),且PLR诊断宫颈癌的效能高于NLR[6]。赵雅文等[7]研究表明,早期宫颈癌患者NLR和PLR在年龄>50岁或肿块最大径≥4 cm组高于年龄≤50岁或肿块最大径<4 cm组,NLR和PLR还与5年生存率相关,高NLR和PLR常提示预后不良,且NLR对预后的判断更有意义。
SCC主要存在于宫颈、肺和口腔等鳞状上皮细胞的细胞质中,是宫颈鳞癌的首选肿瘤标志物,其增高的程度与肿瘤的恶性程度相关。CYFRA21-1为细胞角蛋白19的可溶性片段,对肺癌的诊断有重要意义,有研究表明,CYFRA21-1在宫颈癌中的水平升高[8]。CA125常用于卵巢癌的诊断,与肿瘤大小和分期相关,宫颈癌患者CA125水平也可能升高[9]。有研究显示,宫颈癌患者SCC、CA125和CYFRA21-1水平高于宫颈上皮内瘤变患者和健康者,宫颈鳞癌中SCC和CYFRA21-1水平明显高于腺癌、腺鳞癌,CA125在腺癌中的水平高于鳞癌、腺鳞癌[4]。进一步的研究表明,在高临床分期、有脉管浸润、有淋巴结转移、肿瘤浸润深度大于1/2肌层的宫颈癌患者中血清SCC和CYFRA21-1水平均更高,高水平的SCC和CYFRA21-1是宫颈癌患者不良预后的危险因素[10]。万惠敏等[9]研究显示,宫颈癌组NLR、SCC和CA125高于对照组,Ⅲ~Ⅳ期患者高于Ⅰ~Ⅱ期患者;这3项联合检测可提高子宫颈癌的诊断效能;SCC和CA125还可用于宫颈癌放化疗的疗效评估,其水平在放化疗后降低。
本研究结果显示,试验组NLR、PLR、SCC、CA125和CYFRA21-1均高于对照组(P<0.05);ROC曲线分析显示,SCC作为宫颈癌的特异诊断标志物,其诊断效能在5项指标中最大,AUC为0.710;NLR和PLR作为非特异性炎症标志物,在早期宫颈鳞癌中二者联合检测与单独检测相比,诊断效能无明显增加;肿瘤标志物SCC、CA125和CYFRA21-1联合检测的诊断效能高于单独检测。非特异炎症标志物(NLR和PLR)与肿瘤标志物(SCC、CA125和CYFRA21-1)联合检测可提高诊断效能。有研究显示,早期宫颈癌患者的肿瘤大小和宫颈间质浸润深度与低危早期患者的判断有关,肿瘤间质浸润深度≥1/2全层且肿瘤最大径≥2 cm者,存在更高的影响预后高危因素的发生率[11]。FIGO 2018年癌症报告表明,早期宫颈癌肿瘤最大径<2 cm者其复发率明显低于肿瘤最大径>2 cm者,在最新的2018年分期中增加了早期宫颈癌肿瘤最大径2 cm为新的临界点[12]。本研究以肿瘤最大径2 cm为临界点,发现早期宫颈鳞癌患者SCC水平在肿瘤最大径≥2 cm组高于最大径<2 cm组,且肿瘤超越子宫组高于未超越子宫组(P<0.05);CA125在肿瘤最大径≥2 cm组明显高于肿瘤最大径<2 cm组(P<0.05);CYFRA21-1在肿瘤超越子宫组明显高于肿瘤未超越子宫组(P<0.05);表明SCC和CA125水平与早期宫颈鳞癌的肿瘤最大径相关,SCC和CYFRA21-1水平与肿瘤界限相关。NLR和PLR在不同肿瘤最大径及肿瘤是否超越子宫间比较,差异无统计学意义(P>0.05)。
综上所述,早期宫颈鳞癌患者NLR、PLR、SCC、CA125和CYFRA21-1明显升高,这5项指标均可作为宫颈癌辅助诊断指标,联合检测可提高诊断效能。肿瘤标志物SCC和CA125有助于早期宫颈鳞癌肿瘤大小的鉴别,SCC和CYFRA21-1有助于肿瘤界限的鉴别。本研究不足之处在于的样本量较小,可能使结果出现偏倚,后续研究有待于更大样本量和更全面的研究以阐明NLR、PLR、SCC、CA125和CYFRA21-1在早期宫颈鳞癌中的价值。
